文章信息
- 李宁, 阚艳敏, 王艺桦, 李晓松, 李劼, 石超会, 张树华, 於爽
- Li Ning, Kan Yanmin, Wang Yihua, Li Xiaosong, Li Jie, Shi Chaohui, Zhang Shuhua, Yu Shuang
- 基于判别分析的甲状腺乳头状癌多模态超声诊断模型的建立与分析
- Establishment and analysis of multimodal ultrasound diagnosis model of thyroid papillary carcinoma based on discriminant analysis
- 实用肿瘤杂志, 2022, 37(6): 522-529
- Journal of Practical Oncology, 2022, 37(6): 522-529
基金项目
- 河北省医学科学研究课题计划(20210629)
-
通信作者
- 阚艳敏,E-mail:wuxiny_2009@163.com
-
文章历史
- 收稿日期:2021-09-08
甲状腺癌作为临床常见的恶性肿瘤,发病率呈现逐渐上升趋势,防治形势较为严峻,因此对甲状腺结节良恶性的准确评估及诊断仍然是目前非常重要的问题[1-2]。研究报道,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)在甲状腺恶性结节中所占比例高达90%,为最常见的病理类型;其恶性程度较低,如果治疗及时,预后较好;因此及时为临床提供诊断依据,提示临床早期干预有重要意义[3]。目前常规超声、实时剪切波弹性成像(shear wave elastography,SWE)及超声造影(contrast-enhanced ultrasound,CEUS)技术广泛应用于甲状腺结节的检查,可通过观察结节的结构、回声、钙化、血流分布、弹性成像定量参数及微循环灌注等从定性及定量方面为甲状腺结节良恶性的鉴别诊断提供客观依据。本研究旨在建立基于超声影像组学特征的PTC诊断模型,为临床对PTC的精准诊断及治疗提供影像学客观依据。
1 资料与方法 1.1 研究对象回顾性选取2018年9月至2020年3月于本院住院行甲状腺结节切除术的患者79例,其中男性27例,女性52例;年龄25~70岁,中位年龄44岁。结节共85个,良性结节44个(其中结节性甲状腺肿23个,桥本氏甲状腺炎9个,甲状腺腺瘤7个,亚急性甲状腺炎3个,滤泡乳头状增生2个),恶性结节41个(均为PTC)。依据术后病理检查结果分为PTC组和非PTC组。
纳入标准:(1)常规超声检查示2017年美国放射学会甲状腺影像报告和数据系统(American College of Radiology Thyroid Imaging Reporting and Data System,ACR TI-RADS)分类≥3类拟行手术切除的患者[4];(2)经超声引导下穿刺证实为恶性并行结节手术切除的患者;(3)常规超声、SWE及CEUS检查资料完整者。排除标准:(1)结节位置较深和颈部肌层较厚等干扰弹性成像者;(2)有手术禁忌证,无法获得术后病理检查结果者;(3)对鸡蛋和牛奶等过敏无法完成超声造影检查者。
此研究通过华北理工大学附属医院伦理委员会审批,且在检查前向受检者告知检查方法及目的,受检者均签署知情同意书。
1.2 检查仪器常规超声及SWE检查使用法国声科超声诊断仪(SuperSonic Imagine Aixplorer),线阵探头L15-4,频率为4~15 MHz;CEUS检查使用德国西门子S2000超声诊断仪,线阵探头L9-4,频率4~9 MHz,造影剂选用声诺维(SonoVue)。
1.3 检查方法 1.3.1 常规超声检查常规超声确认目标病灶,并记录甲状腺结节的位置、大小、结构(实性、实性为主、囊性为主和囊性)、回声(等回声或高回声、低回声和极低回声)、纵横比(≥1和 < 1)、边缘(光滑、分叶状或不规则和向甲状腺被膜侵犯)、结节内局灶强回声(无、粗大钙化或周边钙化和点状强回声)及血流分布(采用Adler分级标准[5]:0级为肿块内未发现血流信号;Ⅰ级为肿块内有少量血流,可见1或2个点状或细短棒状血管;Ⅱ级为肿块内有中量血流,可见3或4个点状或1支较长血管,血管长度接近或超过肿块半径;Ⅲ级为肿块内有多量血流,可见≥5个点状或2支较长血管)。
1.3.2 SWE检查确认目标结节后,切换至SWE模式,上方图像为基于常规超声的弹性成像模式图,可观察结节及周边组织的硬度,并测得感兴趣区域的杨氏模量值,下方图像则为常规超声图像,可双幅对比观察。在检查过程中,选取大小合适的取样框,嘱患者屏气以使图像趋于稳定,后静置3 s,定帧存图。采用Q-Box测量软件测量相关的SWE参数弹性最大值(maximum elasticity,Emax)、弹性最小值(minimum elasticity,Emin)、弹性均值(mean elasticity,Emean)、弹性标准差(standard deviation of elasticity,Esd)以及甲状腺结节与周围正常组织的弹性比值(elasticity ratio of thyroid nodules to surrounding tissue,Eradio)。测量时取样框选用2 mm,于结节最硬处和同水平甲状腺正常组织处各采集3次弹性图像,取其平均值。
1.3.3 CEUS检查通过常规超声选定目标结节,选择结节最佳血供的切面切换到超声造影条件,保持探头稳定。用5 mL生理盐水将造影剂SonoVue配成六氟化硫微泡混悬液,连续震荡一定时间后,抽取2.5 mL经肘正中静脉团注,而后快速注入5 mL生理盐水进行冲管,动态观察超声造影情况并记录3 min,并将动态图像记录存盘。动态观察并记录甲状腺结节的增强程度(无增强、低增强、等增强和高增强)、增强特点(无规律、向心性增强和环状增强)、造影剂分布(均匀和不均匀)、与周边甲状腺实质增强进入及消退时间比较(早于、等于和晚于)等征象;分析造影时间-强度曲线,记录甲状腺结节的达峰浓度(peak concentration,Peak)、达峰时间(time to peak,TP)、时间-强度曲线下面积(area under time-strength curve,AUCt)以及平均渡越时间(mean transit time,MTT)。超声检查结果所记录信息均由2位高年资医师(副主任医师及以上职称)进行解读,并记录。
1.4 统计学分析采用SPSS 22.0统计学软件进行数据分析。计量资料符合正态分布的采用均数±标准差(x±s)表示,不符合正态分布的以中位数(四分位间距)[M(Q1~Q3)]表示,组间比较采用独立样本t检验或秩和检验。计数资料以频数(百分比)表示,组间比较采用χ2检验及Fisher精确检验。以超声特征为自变量,以是否为PTC为因变量,采用线性回归分析,对PTC组与非PTC组差异具有统计学意义(P < 0.05)的超声指标进行多重共线性的诊断,筛选出可以入组的变量,进一步采用Fisher逐步判别分析法,剔除不能入组的变量,建立基于多模态超声的PTC的综合诊断模型,并采用自身检验法和留一交叉验证进行检验,最后构建受试者工作特征(receiver operating characteristic,ROC)曲线对诊断模型效能进行评价。以P < 0.05为差异具有统计学意义。
2 结果 2.1 PTC组与非PTC组超声特征比较 2.1.1 常规超声特征比较PTC组与非PTC组结节的结构、回声、纵横比、边缘和局灶强回声比较,差异均具有统计学意义(均P < 0.05);结节最大径、位置和血流分布比较,差异均无统计学意义(均P > 0.05,表 1)。
| 超声参数 | PTC组(n=41) | 非PTC组(n=44) | Z/χ2值 | P值 |
| 最大径[mm,M(Q1~Q3)] | 0.62(0.42~1.12) | 0.76(0.50~1.28) | 699.000 | 0.074 |
| 位置 | - | 0.076* | ||
| 左叶 | 15(36.6) | 22(50.0) | ||
| 右叶 | 22(53.7) | 22(50.0) | ||
| 峡部 | 4(9.7) | 0(0.0) | ||
| 结构 | 17.627 | < 0.01 | ||
| 实性 | 30(73.2) | 13(29.5) | ||
| 实性为主 | 10(24.4) | 22(50.0) | ||
| 囊性为主 | 1(2.4) | 9(20.5) | ||
| 囊性 | 0(0.0) | 0(0.0) | ||
| 回声 | 23.420 | < 0.01 | ||
| 等回声或高回声 | 0(0.0) | 17(38.6) | ||
| 低回声 | 34(82.9) | 24(54.5) | ||
| 极低回声 | 7(17.1) | 3(6.8) | ||
| 纵横比 | 6.308 | 0.014 | ||
| ≥1 | 20(48.8) | 10(22.7) | ||
| < 1 | 21(51.2) | 34(77.3) | ||
| 边缘 | 17.763 | < 0.01 | ||
| 光滑 | 7(17.1) | 27(61.4) | ||
| 分叶状或不规则 | 31(75.6) | 16(36.4) | ||
| 向甲状腺被膜侵犯 | 3(7.3) | 1(2.2) | ||
| 局灶强回声 | 10.119 | 0.006 | ||
| 无 | 15(36.6) | 26(59.1) | ||
| 粗大钙化或周边钙化 | 3(7.3) | 8(18.2) | ||
| 点状强回声 | 23(56.1) | 10(22.7) | ||
| 血流分布 | 6.791 | 0.145 | ||
| 0级 | 4(9.7) | 12(27.3) | ||
| Ⅰ级 | 10(24.4) | 12(27.3) | ||
| Ⅱ级 | 22(53.7) | 19(43.2) | ||
| Ⅲ级 | 5(12.2) | 1(2.2) | ||
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma);*Fisher精确检验 | ||||
PTC组与非PTC组Emax、Emin、Emean、Esd和Eratio比较差异均具有统计学意义(均P < 0.05,表 2)。
| 组别 | Emax(kPa,x±s) | Emin(kPa,x±s) | Emean(kPa,x±s) | Esd[kPa,M(Q1~Q3)] | Eratio[M(Q1~Q3)] |
| PTC组(n=41) | 54.08±18.59 | 36.95±13.14 | 47.31±16.67 | 3.60(2.50~6.35) | 3.00(1.95~4.40) |
| 非PTC组(n=44) | 27.67±16.62 | 17.38±12.68 | 22.61±15.01 | 2.80(2.10~4.45) | 2.10(1.40~3.25) |
| Z/t值 | 7.177 | 6.986 | 7.186 | -4.299 | -4.574# |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma);SWE:实时剪切波弹性成像(shear wave elastography);Emax:弹性最大值(maximum elasticity);Emin:弹性最小值(minimum elasticity);Emean:弹性均值(mean elasticity);Esd:弹性标准差(standard deviation of elasticity);Eratio:甲状腺结节与周围正常组织的弹性比值(elasticity ratio of thyroid nodules to surrounding tissue);#代表Z值,其余为t值 | |||||
PTC组和非PTC组在增强程度、增强特点、造影剂分布以及与周边甲状腺组织增强进入和消退时间方面比较,差异均具有统计学意义(均P < 0.05,表 3)。两组Peak和AUCt比较,差异均具有统计学意义(均P < 0.05,表 4)。两组TP和MTT比较,差异均无统计学意义(均P > 0.05)。
| CEUS特征 | PTC组(n=41) | 非PTC组(n=44) | χ2值 | P值 |
| 增强程度 | 25.321 | < 0.01 | ||
| 无增强 | 0(0.0) | 0(0.0) | ||
| 低增强 | 38(92.7) | 18(40.9) | ||
| 等增强 | 2(4.9) | 16(36.4) | ||
| 高增强 | 1(2.4) | 10(22.7) | ||
| 增强特点 | 15.547 | < 0.01 | ||
| 无规律 | 19(46.3) | 4(9.1) | ||
| 向心性增强 | 7(17.1) | 17(38.6) | ||
| 环状增强 | 15(36.6) | 23(52.3) | ||
| 造影剂分布 | 19.274 | < 0.01 | ||
| 均匀 | 4(9.8) | 24(54.5) | ||
| 不均匀 | 37(90.2) | 20(45.5) | ||
| 与周边甲状腺实质增强进入时间比较 | 9.018 | 0.011 | ||
| 早于 | 6(14.6) | 10(22.7) | ||
| 等于 | 7(17.1) | 18(40.9) | ||
| 晚于 | 28(68.3) | 16(36.4) | ||
| 与周边甲状腺实质消退时间比较 | 6.832 | 0.033 | ||
| 早于 | 13(31.7) | 4(9.1) | ||
| 等于 | 23(56.1) | 32(72.7) | ||
| 晚于 | 5(12.2) | 8(18.2) | ||
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma);CEUS:超声造影(contrast-enhanced ultrasound) | ||||
| 组别 | Peak(%,x±s) | TP(s) | MTT(s) | AUCt(%s) |
| PTC组(n=41) | 22.69±9.01 | 28.50(15.83~42.29) | 44.97(21.15~59.13) | 1 036.60(528.35~1 656.10) |
| 非PTC组(n=44) | 30.37±10.88 | 27.44(21.79~35.83) | 62.09(34.18~75.99) | 1 489.65(1 011.70~2 868.27) |
| Z/t值 | -3.530 | -0.730# | -1.930# | -3.324# |
| P值 | 0.001 | 0.465 | 0.054 | 0.001 |
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma);CEUS:超声造影(contrast-enhanced ultrasound);Peak:达峰浓度(peak concentration);TP:达峰时间(time to peak);MTT:平均渡越时间(mean transit time);AUCt:时间-强度曲线下面积(area under time-strength curve);#代表Z值, 其余为t值 | ||||
以是否为PTC为因变量,以差异具有统计学意义(P < 0.05)的多模态超声定量及定性特征为自变量,分别进行赋值(表 5);为了避免筛选变量之间存在强线性关系,使Fisher判别方程的参数估计不准确,构建诊断模型前进行共线性诊断,其中结节结构、回声、纵横比、边缘、局灶强回声、Eratio、增强程度、增强特点、造影剂分布、与周边甲状腺实质增强进入时间比较、与周边甲状腺实质消退时间比较、Peak和AUCt的容差值均 > 0.1,方差膨胀因子(variance inflation factor,VIF)均 < 5,因此,认为上述变量间不存在多重共线性,可采用Fisher判别分析进行研究(表 6);进而采用Fisher逐步判别分析法进行分析,逐步输入可以使总体威尔克Lambda最小化的变量,其中要输入的最小偏F值为3.84,要除去的最大偏F值为2.71,最终结节回声、边缘、Eratio、增强特点、造影剂分布和AUCt进入诊断方程,此时威尔克Lambda值最小,为0.326,且P < 0.01,提示采用上述变量得到的判别结果是有效的。依据其分类函数系数建立判别方程:PTC=-24.856+7.360X2+6.348X4+1.502X10+2.771X12+9.486X13+0.001X17,非PTC=-17.143+5.007X2+4.538X4+0.819X10+3.792X12+6.551X13+0.002X17,其中X2、X4、X10、X12、X13和X17分别代表结节回声、边缘、Eratio、增强特点、造影剂分布和AUCt(表 7)。
| 变量 | 赋值 |
| 是否PTC(Y) | 0=非PTC,1=PTC |
| 结构(X1) | 1=实性,2=实性为主,3=囊性为主,4=囊性 |
| 回声(X2) | 1=等回声或高回声,2=低回声,3=极低回声 |
| 纵横比(X3) | 1=纵横比≥1,2=纵横比 < 1 |
| 边缘(X4) | 1=光滑,2=分叶状或不规则,3=向甲状腺被膜侵犯 |
| 局灶强回声(X5) | 1=无,2=粗大钙化或周边钙化,3=点状强回声 |
| Emax(X6) | 连续变量 |
| Emin(X7) | 连续变量 |
| Emean(X8) | 连续变量 |
| Esd(X9) | 连续变量 |
| Eratio(X10) | 连续变量 |
| 增强程度(X11) | 1=无增强,2=低增强,3=等增强,4=高增强 |
| 增强特点(X12) | 1=向心性增强,2=环状增强,3=无规律 |
| 造影剂分布(X13) | 1=均匀,2=不均匀 |
| 与周边甲状腺实质增强进入时间比较(X14) | 1=早于,2=等于,3=晚于 |
| 与周边甲状腺实质消退时间比较(X15) | 1=早于,2=等于,3=晚于 |
| Peak(X16) | 连续变量 |
| AUCt(X17) | 连续变量 |
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma);Emax:弹性最大值(maximum elasticity);Emin:弹性最小值(minimum elasticity);Emean:弹性均值(mean elasticity);Esd:弹性标准差(standard deviation of elasticity);Eratio:甲状腺结节与周围正常组织的弹性比值(elasticity ratio of thyroid nodules to surrounding tissue);Peak:达峰浓度(peak concentration);AUCt:时间-强度曲线下面积(area under time-strength curve) | |
| 项目 | β | 标准误 | β’ | t值 | P值 | 共线性分析 | |
| 容差 | VIF | ||||||
| 常量 | 1.838 | 0.309 | - | 5.942 | < 0.01 | - | - |
| 结构(X1) | 0.348 | 0.049 | 0.480 | 7.075 | < 0.01 | 0.685 | 1.460 |
| 回声(X2) | -0.374 | 0.066 | -0.418 | -5.642 | < 0.01 | 0.574 | 1.741 |
| 纵横比(X3) | 0.043 | 0.075 | 0.042 | 0.582 | 0.563 | 0.619 | 1.617 |
| 边缘(X4) | -0.127 | 0.060 | -0.144 | -2.134 | 0.036 | 0.688 | 1.454 |
| 局灶强回声(X5) | -0.082 | 0.037 | -0.153 | -2.235 | 0.029 | 0.669 | 1.494 |
| Emax(X6) | -0.021 | 0.027 | -0.922 | -0.759 | 0.451 | 0.002 | 469.718 |
| Emin(X7) | 0.012 | 0.026 | 0.489 | 0.478 | 0.634 | 0.003 | 332.270 |
| Emean(X8) | 0.006 | 0.015 | 0.183 | 0.372 | 0.711 | 0.013 | 76.881 |
| Esd(X9) | 0.003 | 0.062 | 0.013 | 0.053 | 0.958 | 0.052 | 19.302 |
| Eratio(X10) | 0.031 | 0.029 | 0.104 | 1.069 | 0.289 | 0.329 | 3.036 |
| 增强程度(X11) | -0.144 | 0.087 | -0.136 | -1.656 | 0.102 | 0.468 | 2.135 |
| 增强特点(X12) | 0.017 | 0.056 | 0.024 | 0.297 | 0.767 | 0.490 | 2.039 |
| 造影剂分布(X13) | 0.069 | 0.038 | 0.115 | 1.812 | 0.074 | 0.778 | 1.285 |
| 与周边甲状腺实质增强进入时间比较(X14) | -0.023 | 0.038 | 0.040 | 0.601 | 0.550 | 0.709 | 1.410 |
| 与周边甲状腺实质消退时间比较(X15) | -0.009 | 0.040 | -0.013 | -0.219 | 0.827 | 0.877 | 1.140 |
| Peak(X16) | 0.006 | 0.004 | 0.127 | 1.629 | 0.108 | 0.516 | 1.936 |
| AUCt(X17) | 0.000 | 0.000 | 0.046 | 0.628 | 0.532 | 0.577 | 1.734 |
| 注 Emax:弹性最大值(maximum elasticity);Emin:弹性最小值(minimum elasticity);Emean:弹性均值(mean elasticity);Esd:弹性标准差(standard deviation of elasticity);Eratio:甲状腺结节与周围正常组织的弹性比值(elasticity ratio of thyroid nodules to surrounding tissue);Peak:达峰浓度(peak concentration);AUCt:时间-强度曲线下面积(area under time-strength curve);VIF:方差膨胀因子(variance inflation factor) | |||||||
| 组别 | 回声(X2) | 边缘(X4) | Eratio(X10) | 增强特点(X12) | 造影剂分布(X13) | AUCt(X17) | 常量 |
| PTC组 | 7.360 | 6.348 | 1.502 | 2.771 | 9.486 | 0.001 | -24.856 |
| 非PTC组 | 5.007 | 4.538 | 0.819 | 3.792 | 6.551 | 0.002 | -17.143 |
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma);Eratio:甲状腺结节与周围正常组织的弹性比值(elasticity ratio of thyroid nodules to surrounding tissue);AUCt:时间-强度曲线下面积(area under time-strength curve) | |||||||
分别采用自身验证法及留一交叉验证对诊断模型进行验证,结果显示均具有较高的正确率,其正确率分别为88.2%和84.7%,误判率分别为11.8%和15.3%(表 8~9)。
| 判别分析模型预测结果 | 病理检查结果(个) | 合计(个) | |
| PTC | 非PTC | ||
| PTC | 38 | 7 | 45 |
| 非PTC | 3 | 37 | 40 |
| 合计 | 41 | 44 | 85 |
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma) | |||
| 判别分析模型预测结果 | 病理检查结果(个) | 合计(个) | |
| PTC | 非PTC | ||
| PTC | 37 | 9 | 46 |
| 非PTC | 4 | 35 | 39 |
| 合计 | 41 | 44 | 85 |
| 注 PTC:甲状腺乳头状癌(papillary thyroid carcinoma) | |||
构建ROC曲线对诊断模型的诊断效能进行评价,结果显示,曲线下面积为0.907,95%CI为0.835~0.978,敏感度(92.7%)和特异度(88.6%)均较高(图 1)。
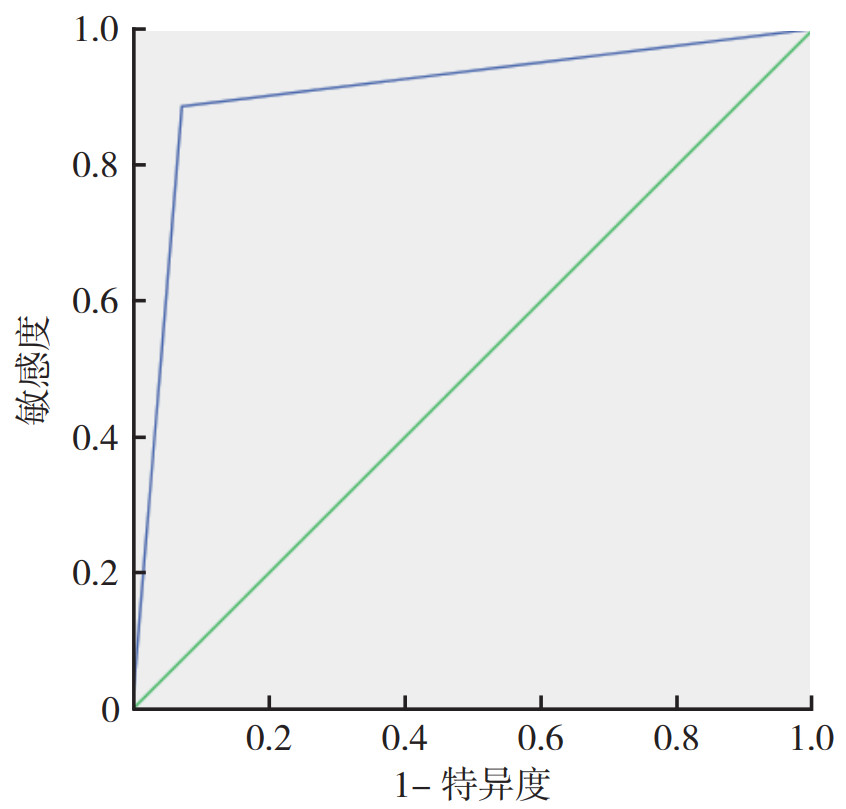
|
| 图 1 甲状腺乳头状癌诊断模型效能评价 Fig.1 Evaluation of the effectiveness of thyroid papillary carcinoma diagnostic model |
随着人们生活水平的提高,保健意识的增强及医疗水平的提升,甲状腺结节的发病率一直保持增高的趋势,直至近年来才逐渐趋于稳定[6-7]。研究报道,约15%的甲状腺结节为恶性结节,而不同病理类型的甲状腺癌,其诊疗方式、预后和远期生存率不完全相同,因此为临床医师提供准确的术前依据和指导其对不同病理类型甲状腺癌患者实施精准化个体治疗显得尤为重要。既往较多学者研究不同基因表达水平与PTC的临床进展及侵袭性的关系,以期提高术前PTC的诊断准确率,指导临床干预,并取得一系列成果,但这些研究检查均为有创性,且价格昂贵,难以在临床广泛开展[8-9]。超声检查作为甲状腺结节检查及诊断的首选影像学方法,安全、廉价且可重复性高,在临床诊疗决策中有重要价值[10-11]。
常规超声检查可以发现甲状腺内直径 > 2 mm的病灶,是甲状腺结节患者常规检查、定期复查及随访的重要手段。本研究结果显示,PTC组与非PTC组之间结节的结构、回声、纵横比、边缘和局灶强回声比较,差异均具有统计学意义(均P < 0.05),而在血流分布方面比较,差异无统计学意义(P > 0.05),与之前的研究结果一致[12-13],进一步证实了常规超声可以为甲状腺乳头状癌患者图像的快速分析及鉴别提供重要依据。SWE通过测量组织弹性参数即杨氏模量值反映组织硬度,杨氏模量值越大,代表组织硬度越大。本研究中PTC组Emax、Emin、Emean、Esd和Eratio均较非PTC组增加,主要是由于大部分甲状腺乳头状癌组织内含有较多的纤维组织和钙化小体等,组织硬度较高,而良性病变如结节性甲状腺肿等结节主要由滤泡细胞组成,组织硬度较小[14]。研究表明,甲状腺癌细胞的增殖主要是由于大量血管内皮生长因子的生成,诱导新生血管的形成,并为肿瘤细胞提供的能量与养分,故新生血管形成被认为是甲状腺癌的重要生物学行为之一[15]。CEUS通过静脉注入超声造影剂,在甲状腺结节内产生大量液-气界面,病灶后散射强度得到增强,血管多普勒信号增加,微血管血流灌注得到显示,从而实现实时动态观察病灶血管分布情况目的。本研究中PTC组结节呈现不均匀的低增强,Peak与AUCt均较非PTC组减小,与国内部分研究结果一致[16-17],主要原因为虽然癌组织中有大量新生血管形成,但在生长过程中造成的血管破坏使其绝对数量变少,且分布不均,因此同一结节内可同时出现局部血供丰富和局部血供缺乏2种情况。
在临床诊疗工作中,经常会遇到需要将问题的结果用类别表示的情况,其中最常用的方法是线性判别分析与logistic回归,其中线性判别分析模型比逻辑回归模型更稳定,尤其是当样本量较小时,线性判别分析的优势较为明显,但随着样本量的增大,二者效果逐渐类似,当样本量足够大时,logistic回归的效果反而更好[18]。基于此,本研究选择应用判别分析方法对PTC的诊断进行研究。Fisher判别分析是在分类确定的条件下,根据某一研究对象的各种特征值判别其类型归属问题的一种多变量统计分析方法。其基本的原理是已知A和B两类观察对象,A类有a例,B类有b例,分别记录X1、X2......Xm观察指标,称为判别指标或变量;Fisher判别法就是找出一个线性组合Z=C1X1+C2X2+......+CmXm,使得综合指标Z在A类的均数Z与在B类的均数ZB的差异|ZA − ZB|尽可能大,而2类的类内综合指标的变异S2A+S2B尽可能小,当
在自身验证及交叉验证中分别存在10例和13例误判患者,表明诊断模型仍然存在难以将部分PTC与非PTC患者超声特征进行鉴别的情况,可能的原因:(1)本研究样本量有限,会对诊断模型参数的纳入产生影响,从而影响诊断结果;(2)多数PTC内部可见大量纤维组织增生,结节多表现为低回声或极低回声,而部分非PTC结节在其退行性变过程中可产生纤维化玻璃样变和出血等现象,亦可呈现出低回声[22];(3)PTC结节内由于纤维组织成分多,所以其硬度较高,少量非PTC结节也可能存在纤维化成分及滤泡细胞被破坏、胶质浓缩、机化和炎性反应等,导致结节硬度增加[14];(4)多数PTC结节表现不均匀增强和低增强,部分非PTC结节生长迅速,伴有大量纤维化及囊性变时也会呈现微灌注特点不明显现象,从而表现为不均匀增强和低增强的超声特征[23]。因此在实际工作中需将判别结果与超声特征结合起来,对病例进行综合分析,减少误判病例的发生。
本研究的不足之处:本研究将反映PTC特征的多种超声技术及超声参数结合起来,建立诊断模型,参数较多,可能会导致临床医师工作量增加,诊疗时间延长, 在今后的工作中将加大样本量的研究,进一步筛选出可以充分反映PTC特征的超声参数,以提高临床医师的诊疗效率。
综上所述,本研究应用Fisher逐步判别分析法建立PTC的诊断模型,可以综合反映PTC结节常规超声、SWE及CEUS定量及定性特征的表现,为临床诊断提供依据。
| [1] |
Shi LL, DeSantis C, Jemal A, et al. Changes in thyroid cancer incidence, post-2009 American Thyroid Association guidelines[J]. Laryngoscope, 2017, 127(10): 2437-2441. DOI:10.1002/lary.26473 |
| [2] |
Durante C, Grani G, Lamartina L, et al. The diagnosis and management of thyroid nodules: a review[J]. JAMA, 2018, 319(9): 914-924. DOI:10.1001/jama.2018.0898 |
| [3] |
Haugen BR, Alexander EK, Bible KC, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133. DOI:10.1089/thy.2015.0020 |
| [4] |
Tessler FN, Middleton WD, Grant EG, et al. ACR Thyroid Imaging, Reporting and Data System (TI-RADS): White paper of the ACR TI-RADS Committee[J]. J Am Coll Radiol, 2017, 14(5): 587-595. DOI:10.1016/j.jacr.2017.01.046 |
| [5] |
Adler DD, Carson PL, Rubin JM, et al. Doppler ultrasound color flow imaging in the study of breast cancer: preliminary findings[J]. Ultrasound Med Biol, 1990, 16(6): 553-559. DOI:10.1016/0301-5629(90)90020-D |
| [6] |
Lim H, Devesa SS, Sosa JA, et al. Trends in thyroid cancer incidence and mortality in the United States, 1974-2013[J]. JAMA, 2017, 317(13): 1338-1348. DOI:10.1001/jama.2017.2719 |
| [7] |
Torre LA, Trabert B, DeSantis CE, et al. Ovarian cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(4): 284-296. DOI:10.3322/caac.21456 |
| [8] |
李书飞, 武伦, 付海峰, 等. microRNA-126和microRNA-613在甲状腺乳头状癌中的表达及临床意义[J]. 实用肿瘤杂志, 2020, 35(5): 430-435. DOI:10.13267/j.cnki.syzlzz.2020.05.009 |
| [9] |
郑海红, 谢伯剑, 朱优优, 等. BRAFV600E基因检测在术前辅助细针穿刺细胞学诊断甲状腺微小乳头状癌中的意义[J]. 实用肿瘤杂志, 2020, 35(3): 228-230. |
| [10] |
Alexander EK, Pearce EN, Brent GA, et al. 2017 Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum[J]. Thyroid, 2017, 27(3): 315-389. DOI:10.1089/thy.2016.0457 |
| [11] |
宋立稳, 王小龙, 程丽霞. 甲状腺结节的规范化诊疗[J]. 中华临床医师杂志: 电子版, 2017, 11(17): 2189-2192. DOI:10.3877/cma.j.issn.1674-0785.2017.17.005 |
| [12] |
张隽, 陈辽, 胡伟, 等. 二维超声、超声造影及细针穿刺针感赋值评分在TI-RADS 3~4级甲状腺微小结节鉴别诊断中的应用[J]. 临床超声医学杂志, 2018, 20(3): 161-164. |
| [13] |
Chen BD, Zhang Z, Wang KK, et al. Association of BRAFV600E mutation with ultrasonographic features and clinicopathologic characteristics of papillary thyroid microcarcinoma: a retrospective study of 116 cases[J]. Clin Hemorheol Microcirc, 2019, 73(4): 545-552. |
| [14] |
李忠举, 张植兰, 辛敏慧, 等. 实时剪切波弹性成像对甲状腺结节超声诊断的价值研究[J]. 中国实验诊断学, 2020, 24(8): 1275-1277. DOI:10.3969/j.issn.1007-4287.2020.08.014 |
| [15] |
王翡, 刘雪梅. 分化型甲状腺癌组织XRCC1和血管内皮细胞生长因子C(VEGF-C)的表达及临床意义[J]. 细胞与分子免疫学杂志, 2017, 33(11): 1550-1553. |
| [16] |
霍晓明, 张红, 冯海洋, 等. 弹性成像与超声造影联合应用诊断甲状腺微小乳头状癌的价值[J]. 现代肿瘤医学, 2016, 24(15): 2462-2465. DOI:10.3969/j.issn.1672-4992.2016.15.034 |
| [17] |
何燕莲, 余岳芬, 徐小兰, 等. 超声造影联合声辐射力脉冲成像技术在甲状腺微小乳头状癌诊断中的研究[J]. 中国临床医学影像杂志, 2018, 29(4): 250-253, 262. |
| [18] |
董小刚, 刘新蕊. 二分类响应变量下判别分析与Logistic回归比较[J]. 长春工业大学学报, 2019, 40(5): 441-445. |
| [19] |
Wang YF, Nie F, Liu T, et al. Revised value of contrast-enhanced ultrasound for solid hypo-echoic thyroid nodules graded with the thyroid imaging reporting and data system[J]. Ultrasound Med Biol, 2018, 44(5): 930-940. |
| [20] |
Zhao RN, Zhang B, Jiang YX, et al. Ultrasonographic multimodality diagnostic model of thyroid nodules[J]. Ultrason Imaging, 2019, 41(2): 63-77. |
| [21] |
Huang ST, Zhang B, Yin HL, et al. Incremental diagnostic value of shear wave elastography combined with contrast-enhanced ultrasound in TI-RADS category 4a and 4b nodules[J]. J Med Ultrason (2001), 2020, 47(3): 453-462. |
| [22] |
陈晶. 超声误诊为甲状腺癌的良性病变超声与病理对照分析[D]. 太原: 山西医科大学医学影像系, 2015: 12.
|
| [23] |
王明辉, 马英路, 崔广和, 等. 细针穿刺细胞学检查和超声弹性成像及超声造影对甲状腺癌的诊断价值[J]. 中国超声医学杂志, 2018, 34(1): 9-13. |
 2022, Vol. 37
2022, Vol. 37


