文章信息
- 刘雪, 胡涵光
- Liu Xue, Hu Hanguang
- 原发性大唾液腺鳞状细胞癌预后因素分析
- Prognostic factors of primary major salivary gland squamous cell carcinoma
- 实用肿瘤杂志, 2020, 35(2): 173-180
- Journal of Practical Oncology, 2020, 35(2): 173-180
-
通信作者
- 胡涵光, E-mail:huhanguang@zju.edu.cn
-
文章历史
- 收稿日期:2019-12-17
大唾液腺恶性肿瘤是一组呈多样性且高度异质性的罕见肿瘤[1-3], 在头颈部肿瘤中占比约3%~6%[4-5]; 其中最常见的病理类型为腺样囊腺癌及黏液表皮样癌[6]。鳞状细胞癌(squamous cell carcinoma, SCC)是大唾液腺恶性肿瘤中较为特殊且发病率较低的一种病理类型。由于大唾液腺SCC多来源于原发性皮肤恶性肿瘤转移, 其诊断必须排除头颈部其他部位的转移性病变和高级别黏液表皮样癌[7], 原发性大唾液腺SCC的发病率约占唾液腺肿瘤的0.1%~10%[2, 5, 8]。由于其罕见性, 原发性大唾液SCC研究较少, 但患者预后较差, 5年生存率 < 50%[2, 9-10]。
作为一种罕见疾病, 相关研究极少, 诊疗策略多基于临床经验, 存在不少争议。手术是大唾液腺恶性肿瘤的重要治疗手段。在腮腺恶性肿瘤中, 隐匿性转移的发生率约为12%~60%[8, 11-12]。对于cN0患者, 现有研究关于选择性区域淋巴结清扫是否带来生存获益结论不一[11-13]。放疗是否带来生存获益也尚存争议。研究发现, 对于高级别及局部晚期大唾液腺恶性肿瘤患者行辅助放疗可以带来生存获益[14], 但也有研究显示, 单纯放疗较无治疗并不能改善患者的长期生存, 且手术联合放疗与单纯手术带来的生存获益相似[15]。化疗可作为一种全身治疗手段。研究发现, 辅助化疗可以改善晚期鳞状细胞癌患者预后[3]; 但也有研究表明, 辅助化疗不但不能带来生存获益, 反而增加不良反应发生率[16-17]。
目前原发性大唾液腺SCC研究多局限于腮腺, 关于下颌下腺及舌下腺SCC的人口统计学特征、临床病理特征及预后因素的研究有限。笔者利用美国国立癌症研究所监测、流行病学和结果数据库(Surveillance, Epidemiology, and End Results, SEER)对原发性大唾液腺SCC作进一步探究。
1 资料与方法 1.1 数据来源本研究基于SEER数据, 筛选2004年至2016年病理诊断为原发性大唾液腺SCC的患者。由国际肿瘤疾病分类(International Classification of Diseases for Oncology, ICD-O)第3版代码定义大唾液腺[18]: C07.9(腮腺)、C08.0(颌下腺)和C08.1(舌下腺); 用组织学代码定义原发性鳞状细胞癌:8070/3、8071/3、8072/3、8073/3、8074/3、8075/3、8076/3和8078/3。
1.2 数据提取及方法研究设计流程见图 1。纳入标准:(1)病理确诊为原发性大唾液腺SCC; (2)年龄≥ 18岁; (3)确诊年份为2004年至2016年。排除标准:(1)诊断为大唾液腺SCC, 但原发灶具体部位不详或多部位; (2)肿瘤分级、分期及TNM分期数据等缺乏的患者。患者筛选流程见图 1。从SEER数据中提取的变量包括:诊断年龄(≥ 18岁)、诊断年份(2004年至2016年)、性别、种族(白人、黑人和其他)、婚姻状况、TNM分期、肿瘤分级及分期、肿瘤大小、边侧性、是否放疗(是或否/未知)、是否化疗(是或否/未知)、原发灶手术(是或否)、区域淋巴结手术(是或否/未知)、生存时间和生存状态。
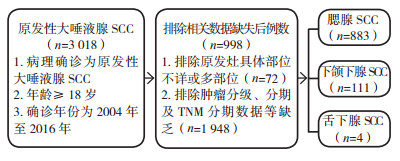
|
| 图 1 研究设计 Fig.1 Study design |
采用SPSS 22.0软件进行数据分析。KaplanMeier法绘制生存曲线, Log-rank检验用于验证与生存预后相关的因素。χ2检验或Fisher精确检验用于分类变量组间比较。Z检验用于5年生存率分析。采用逐步Cox回归模型进行单因素及多因素分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 人口统计学特征共998例患者纳入研究, 其中腮腺883例(88.5%)、下颌下腺111例(11.1%)及舌下腺4例(0.4%)。年龄18~104岁, (72.4±13.5)岁, 中位年龄74岁。随着年龄的增长其发病率呈上升趋势, 最高发病率年龄段为65~90岁(图 2)。多数原发性大唾液腺SCC临床特征为白人(93.1%)、≥ 72岁(56.0%)、已婚(56.0%)和男性(79.8%)。腮腺SCC较下颌下腺SCC在白人(93.8% vs 87.4%)、≥ 72岁(57.9% vs 43.2%)和男性(81.9% vs 64.0%)患者中占比更高(均P < 0.05, 表 1)。
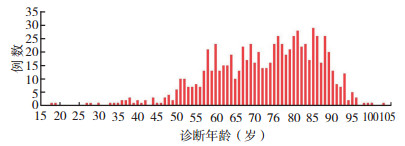
|
| 图 2 原发性大唾液腺SCC患者诊断年龄分布 Fig.2 Distribution of ages at diagnosis of patients with primary major salivary gland SCC |
| 临床病理特征 | 总例数 | 腮腺SCC | 下颌下腺SCC | P值 |
| 总例数 | 998(100.0) | 883(88.5) | 111(11.1) | |
| 年龄 | 0.004 | |||
| < 72岁 | 439(44.0) | 372(42.1) | 63(56.8) | |
| ≥72岁 | 559(56.0) | 511(57.9) | 48(43.2) | |
| 性别 | < 0.01 | |||
| 男性 | 796(79.8) | 723(81.9) | 71(64.0) | |
| 女性 | 202(20.2) | 160(18.1) | 40(36.0) | |
| 种族 | 0.026 | |||
| 白人 | 929(93.1) | 828(93.8) | 97(87.4) | |
| 黑人 | 32(3.2) | 27(3.1) | 5(4.5) | |
| 其他 | 33(3.3) | 24(2.7) | 9(8.1) | |
| 不详 | 4(0.4) | 4(0.5) | 0(0.0) | |
| 婚姻状况 | 0.143 | |||
| 未婚 | 382(38.3) | 329(37.3) | 52(46.8) | |
| 已婚 | 559(56.0) | 504(57.1) | 53(47.7) | |
| 不详 | 57(5.7) | 50(5.7) | 6(5.4) | |
| 边侧性 | 0.018 | |||
| 左侧 | 513(51.4) | 461(52.2) | 51(45.9) | |
| 右侧 | 481(48.2) | 420(47.6) | 58(52.3) | |
| 双侧 | 2(0.2) | 0(0.0) | 2(1.8) | |
| 不详 | 2(0.2) | 2(0.2) | 0(0.0) | |
| 肿瘤大小 | 0.135 | |||
| < 2 cm | 144(14.4) | 135(15.3) | 9(8.1) | |
| 2 ~4 cm | 477(47.8) | 419(47.5) | 55(49.5) | |
| >4 cm | 317(31.8) | 274(31.0) | 42(37.8) | |
| 不详 | 60(6.0) | 55(6.2) | 5(4.5) | |
| T分期 | 0.008 | |||
| T0~2 | 360(36.1) | 331(37.5) | 27(24.3) | |
| T3~4 | 638(63.9) | 552(62.5) | 84(75.7) | |
| N分期 | 0.070 | |||
| N0 | 497(49.8) | 450(51.0) | 46(41.4) | |
| N1~3 | 501(50.2) | 433(49.0) | 65(58.6) | |
| M分期 | 0.002 | |||
| M0 | 936(93.8) | 837(94.8) | 96(86.5) | |
| M1 | 62(6.2) | 46(5.2) | 15(13.5) | |
| 肿瘤分期 | 0.017 | |||
| Ⅰ + Ⅱ | 202(20.2) | 189(21.4) | 13(11.7) | |
| Ⅲ + Ⅳ | 796(79.8) | 694(78.6) | 98(88.3) | |
| 肿瘤分级 | 0.361 | |||
| Ⅰ + Ⅱ | 430(43.1) | 384(43.5) | 43(38.7) | |
| Ⅲ + Ⅳ | 568(56.9) | 499(56.5) | 68(61.3) |
56.9%的患者在确诊时为高分级(Ⅲ或Ⅳ)。79.6%的患者肿瘤大小≥ 2 cm, 且31.8%的患者肿瘤大小>4 cm。63.9%的患者为较高T分期(T3或T4), 且下颌下腺比例高于腮腺(75.7% vs 62.5%, P=0.008)。79.8%的患者确诊时为Ⅲ或Ⅳ期, 且下颌下腺比例高于腮腺(88.3% vs 78.6%, P=0.017)。区域淋巴结转移与否比例相似(50.2%, N1~3), 下颌下腺区域淋巴结转移发生率高于腮腺(58.6% vs 49.0%, P=0.070)。有6.2%的患者发生远处转移(M1), 下颌下腺SCC患者M1发生率高于腮腺SCC患者(13.5% vs 5.2%, P=0.002)。
在Ⅰ和Ⅱ期大唾液腺SCC患者中, 手术联合放疗是最常用的治疗方案(9.8%, 其中腮腺及下颌下腺SCC患者中分别为10.3%和6.3%), 单纯手术是第二常见的治疗方案(7.8%), 0.9%的患者接受手术联合放化疗(表 2)。对于Ⅲ和Ⅳ期大唾液腺SCC患者, 31.8%的患者接受手术联合放疗(腮腺及下颌下腺SCC患者中分别为33.2%和29.7%), 18.9%的患者接受单纯手术, 18.3%的患者接受手术联合放化疗。腮腺SCC患者接受原发灶手术比例高于下颌下腺SCC患者(90.1% vs 81.1%, P=0.006), 但在放疗和化疗方面两者比较, 差异均无统计学意义(均P>0.05)。
| 治疗特征 | 总例数 | 腮腺SCC | 下颌下腺SCC | P值 |
| 总例数 | 998(100.0) | 883(88.5) | 111(11.1) | |
| 原发灶手术 | 0.006 | |||
| 是 | 888(89.0) | 796(90.1) | 90(81.1) | |
| 无 | 110(11.0) | 87(9.9) | 21(18.9) | |
| 放疗 | 0.914 | |||
| 是 | 681(68.2) | 603(68.3) | 75(67.6) | |
| 无/不详 | 317(31.8) | 280(31.7) | 36(32.4) | |
| 化疗 | 0.299 | |||
| 是 | 256(25.7) | 221(25.0) | 33(29.7) | |
| 无/不详 | 742(74.3) | 662(75.0) | 78(70.3) | |
| 区域淋巴结手术 | 0.078 | |||
| 是 | 761(76.3) | 683(77.3) | 76(68.5) | |
| 无 | 232(23.2) | 195(22.1) | 35(31.5) | |
| 不详 | 5(0.5) | 5(0.6) | 0(0.0) | |
| 治疗(Ⅰ+ Ⅱ期) | 0.322 | |||
| 无治疗 | 6(0.6) | 5(0.6) | 1(0.9) | |
| 仅手术 | 78(7.8) | 75(8.5) | 3(2.7) | |
| 仅放疗 | 7(0.7) | 6(0.7) | 1(0.9) | |
| 仅化疗 | 0(0.0) | 0(0.0) | 0(0.0) | |
| 手术+放疗 | 98(9.8) | 91(10.3) | 7(6.3) | |
| 手术+化疗 | 0(0.0) | 0(0.0) | 0(0.0) | |
| 放化疗 | 4(0.4) | 4(0.5) | 0(0.0) | |
| 手术+放化疗 | 9(0.9) | 8(0.9) | 1(0.9) | |
| 治疗(Ⅲ + Ⅳ期) | 0.070 | |||
| 无治疗 | 24(2.4) | 18(2.0) | 5(4.5) | |
| 仅手术 | 189(18.9) | 167(18.9) | 22(19.8) | |
| 仅放疗 | 23(2.3) | 17(1.9) | 6(5.4) | |
| 仅化疗 | 6(0.6) | 5(0.6) | 1(0.9) | |
| 手术+放疗 | 317(31.8) | 283(32.0) | 33(29.7) | |
| 手术+化疗 | 14(1.4) | 10(1.1) | 4(3.6) | |
| 放化疗 | 40(4.0) | 32(3.6) | 7(6.3) | |
| 手术+放化疗 | 183(18.3) | 162(18.3) | 20(18.0) |
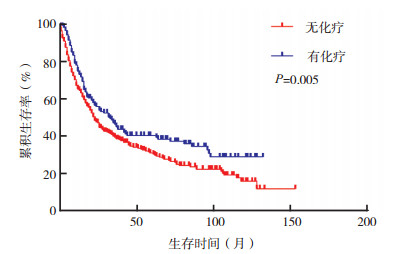
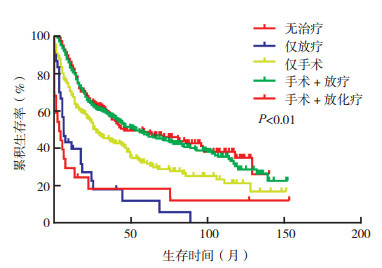
在原发性大唾液腺SCC患者中, M1患者中位OS短于M0患者[10.0个月(95% CI:6.6~13.4) vs 41.0个月(95% CI:34.6~47.4), P < 0.01, 图 3]。cN0患者中选择性区域淋巴结清扫患者的中位OS长于无清扫者[62.0个月(95% CI:39.2~84.8) vs 17.0个月(95% CI:10.8~23.2), P < 0.01, 图 4]。在Ⅳ期患者中, 化疗患者中位OS较未化疗者改善[33.0个月(95% CI:23.6~42.4)vs 22.0个月(95% CI:17.9~26.1), P=0.005, 图 5]。不同治疗方案生存曲线见图 6。
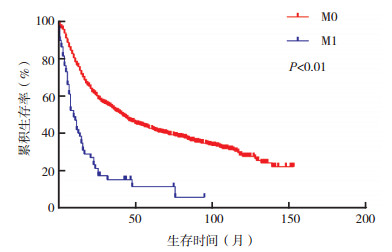
|
| 图 3 远处转移对原发性大唾液腺SCC患者生存曲线的影响 Fig.3 Effect of distant metastasis on the survival of patients with primary major salivary gland SCC |
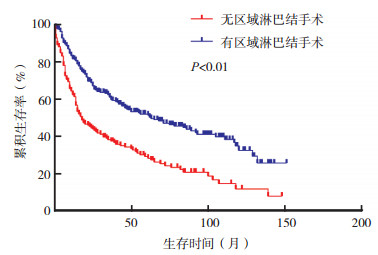
|
| 图 4 选择性区域淋巴结清扫对cN0原发性大唾液腺SCC患者生存曲线的影响 Fig.4 Effect of selective regional lymph node dissection on the survival of cN0 patients with primary major salivary gland SCC |
|
| 图 5 化疗对Ⅳ期原发性大唾液腺SCC患者生存曲线的影响 Fig.5 Effect of chemotherapy on the survival of stage Ⅳ patients with primary major salivary gland SCC |
|
| 图 6 不同治疗模式对原发性大唾液腺SCC患者生存曲线的影响 Fig.6 Effect of different treatment modality on the survival of patients with primary major salivary gland SCC |
所有患者5年OS率为40.4%, 腮腺和下颌下腺SCC患者5年OS率分别为41.1%及34.5%(表 3)。大唾液腺SCC患者5年生存率在年龄、婚姻状况、肿瘤大小、N分期、M分期、肿瘤分期、放疗、原发灶手术及区域淋巴结手术方面比较, 差异均具有统计学意义(均P < 0.05)。在腮腺SCC患者中, 预后相关因素与整个研究人群相似。但在下颌下腺SCC患者中, 5年OS率仅在种族和肿瘤分期方面比较, 差异具有统计学意义(均P < 0.05)。
| 变量 | 腮腺SCC | 下颌下腺SCC | 所有SCC患者 | |||||
| 5年生存率 | P值 | 5年生存率 | P值 | 5年生存率 | P值 | |||
| 所有患者 | 41.1 | 34.5 | 40.4 | |||||
| 性别 | 0.315 | 0.265 | 0.236 | |||||
| 男性 | 40.2 | 29.7 | 39.3 | |||||
| 女性 | 45.1 | 42.1 | 44.5 | |||||
| 年龄 | < 0.01 | 0.210 | < 0.01 | |||||
| < 72岁 | 56.3 | 29.1 | 52.2 | |||||
| ≥72岁 | 29.5 | 43.0 | 30.6 | |||||
| 种族 | ||||||||
| 白人(A) | 40.2 | 0.489(A vs B) | 37.1 | < 0.01(A vs B) | 39.8 | 0.983(A vs B) | ||
| 黑人(B) | 47.4 | 0.383(B vs C) | 0.0 | 0.022(B vs C) | 39.6 | 0.296(B vs C) | ||
| 其他(C) | 61.2 | 0.087(A vs C) | 40.0 | 0.875(A vs C) | 53.9 | 0.174(A vs C) | ||
| 婚姻状况 | < 0.01 | 0.419 | < 0.01 | |||||
| 未婚 | 31.6 | 27.0 | 31.3 | |||||
| 已婚 | 47.3 | 36.1 | 46.2 | |||||
| 边侧性 | 0.773 | 0.471 | 0.678 | |||||
| 左侧 | 41.6 | 37.9 | 41.1 | |||||
| 右侧 | 40.5 | 30.0 | 39.6 | |||||
| 肿瘤大小 | ||||||||
| < 2 cm (A) | 63.7 | < 0.01(A vs B) | 60.0 | 0.414(A vs B) | 63.5 | < 0.01(A vs B) | ||
| 2 ~ 4 cm (B) | 42.0 | 0.003(B vs C) | 41.0 | 0.207(B vs C) | 41.7 | 0.001(B vs C) | ||
| > 4 cm (C) | 29.0 | < 0.01(A vs C) | 26.8 | 0.155(A vs C) | 28.8 | < 0.01(A vs C) | ||
| T分期 | < 0.01 | 0.075 | < 0.01 | |||||
| T0~2 | 52.5 | 52.3 | 52.4 | |||||
| T3~4 | 34.5 | 29.2 | 33.9 | |||||
| N分期 | 0.109 | 0.169 | 0.048 | |||||
| N0 | 44.0 | 43.1 | 43.8 | |||||
| N1~3 | 38.0 | 28.0 | 36.8 | |||||
| M分期 | < 0.01 | < 0.01 | ||||||
| M0 | 42.7 | 39.7 | 42.4 | |||||
| M1 | 14.5 | - | 11.0 | |||||
| 肿瘤分期 | < 0.01 | 0.014 | < 0.01 | |||||
| Ⅰ + Ⅱ | 56.4 | 69.9 | 57.4 | |||||
| Ⅲ + Ⅳ | 37.0 | 29.4 | 36.1 | |||||
| 肿瘤分级 | 0.530 | 0.837 | 0.599 | |||||
| Ⅰ + Ⅱ | 39.8 | 33.6 | 39.3 | |||||
| Ⅲ + Ⅳ | 42.2 | 35.8 | 41.2 | |||||
| 原发灶手术 | < 0.01 | 0.776 | < 0.01 | |||||
| 是 | 43.7 | 35.2 | 42.8 | |||||
| 无 | 18.1 | 31.2 | 21.2 | |||||
| 放疗 | < 0.01 | 0.858 | < 0.01 | |||||
| 是 | 46.7 | 33.7 | 45.5 | |||||
| 无/不详 | 28.6 | 35.7 | 29.2 | |||||
| 化疗 | 0.158 | 0.229 | 0.391 | |||||
| 是 | 45.8 | 25.9 | 43.0 | |||||
| 无/不详 | 39.6 | 39.1 | 39.5 | |||||
| 区域淋巴结手术 | < 0.01 | 0.664 | < 0.01 | |||||
| 是 | 45.5 | 36.1 | 44.5 | |||||
| 无 | 26.5 | 31.3 | 27.4 | |||||
单因素分析表明, 在所有SCC患者及腮腺SCC患者中, 年龄≥ 72岁、晚期、肿瘤大小≥ 2 cm、较高T分期(T3~4)和远处转移与预后较差相关, 但已婚、放疗、原发灶及区域淋巴结手术患者预后较好(均P < 0.05)。下颌下腺SCC患者中, 较高T分期(T3~4)和远处转移是患者预后不良因素(均P < 0.05, 表 4)。
| 变量 | 腮腺SCC | 下颌下腺SCC | 所有患者SCC | ||||||
| HR (95% CI) | P值 | HR (95% CI) | P值 | HR (95% CI) | P值 | ||||
| 年龄(≥72岁vs < 72岁) | 2.25(1.85 ~2.73) | < 0.01 | 0.87(0.54 ~1.43) | 0.590 | 1.96(1.64~ 2.33) | < 0.01 | |||
| 性别(女性vs男性) | 1.02(0.81 ~1.28) | 0.879 | 0.97(0.59 ~1.59) | 0.899 | 1.05(0.85~1.28) | 0.674 | |||
| 种族(黑人vs白人) | 0.86(0.52 ~1.41) | 0.543 | 2.27(0.90 ~5.70) | 0.083 | 1.00(0.64~ 1.54) | 0.987 | |||
| 种族(其他vs白人) | 0.52(0.26 ~1.05) | 0.066 | 0.87(0.37 ~2.03) | 0.749 | 0.64(0.38~ 1.10) | 0.102 | |||
| 婚姻状况(已婚vs未婚) | 0.63(0.53 ~0.76) | < 0.01 | 0.75(0.46 ~1.23) | 0.256 | 0.65(0.55~ 0.77) | < 0.01 | |||
| 边侧性(左侧vs右侧) | 0.94(0.79 ~1.13) | 0.513 | 0.81(0.50 ~1.33) | 0.413 | 1.14(0.16~8.12) | 0.896 | |||
| 肿瘤大小(2 ~ 4 cm vs < 2 cm) | 1.78(1.32 ~2.39) | < 0.01 | 1.58(0.48 ~5.23) | 0.450 | 1.78(1.33~ 2.37) | < 0.01 | |||
| 肿瘤大小(>4 cm vs < 2 cm) | 2.65(1.95 ~3.61) | < 0.01 | 2.48(0.74 ~8.30) | 0.142 | 2.65(1.97~ 3.56) | < 0.01 | |||
| T分期(T3 ~ 4 vs T0 ~ 2) | 1.76(1.45 ~2.14) | < 0.01 | 1.96(1.06 ~3.62) | 0.032 | 1.78(1.48~ 2.14) | < 0.01 | |||
| N分期(N1 ~3 vs N0) | 1.06(0.89 ~1.27) | 0.500 | 1.12(0.69 ~1.82) | 0.637 | 1.08(0.91~1.28) | 0.373 | |||
| M分期(M1 vs M0) | 2.97(2.13 ~4.15) | < 0.01 | 2.55(1.38 ~4.74) | 0.003 | 2.97(2.23~ 3.97) | < 0.01 | |||
| 分期(Ⅲ + Ⅳ vs Ⅰ + Ⅱ) | 1.63(1.29 ~2.07) | < 0.01 | 2.22(0.96 ~5.17) | 0.064 | 1.68(1.34~ 2.12) | < 0.01 | |||
| 分级(Ⅲ + Ⅳ vs Ⅰ + Ⅱ) | 0.88(0.73 ~1.05) | 0.157 | 1.07(0.65 ~1.77) | 0.788 | 0.89(0.75~ 1.05) | 0.162 | |||
| 原发灶手术(是vs否) | 0.37(0.28 ~0.48) | < 0.01 | 0.85(0.46 ~1.57) | 0.598 | 0.42(0.33~ 0.53) | < 0.01 | |||
| 区域淋巴结手术(是vs否) | 0.53(0.43 ~0.64) | < 0.01 | 0.62(0.38 ~1.02) | 0.059 | 0.53(0.44~ 0.63) | < 0.01 | |||
| 放疗(是vs无/不详) | 0.60(0.49 ~0.72) | < 0.01 | 0.90(0.53 ~1.51) | 0.680 | 0.62(0.52~ 0.74) | < 0.01 | |||
| 化疗(是vs无/不详) | 0.81(0.65 ~1.00) | 0.051 | 1.40(0.85 ~2.31) | 0.184 | 0.88(0.72~ 1.07) | 0.192 | |||
多因素分析表明, 所有SCC患者及腮腺SCC患者中, 年龄≥ 72岁、肿瘤大小≥ 2 cm、较高T分期(T3~4)及远处转移是OS阴性预测因素, 已婚、放疗、原发灶及区域淋巴结手术是OS预后较好的预测因素(均P < 0.05)。此外, 区域淋巴结转移(N1~3)也是腮腺SCC患者预后较差的因素之一(P < 0.05)。下颌下腺SCC患者中, 较高T分期(T3~4)和远处转移是患者预后较差的因素(表 5)。
| 变量 | 腮腺SCC | 下颌下腺SCC | 所有患者SCC | |||||
| HR (95% CI) | P值 | HR (95% CI) | P值 | HR (95% CI) | P值 | |||
| 年龄(≥72岁vs < 72岁) | 2.50(2.04~3.07) | < 0.01 | - | - | 2.13(1.77~2.56) | < 0.01 | ||
| 婚姻状况(已婚vs未婚) | 0.75(0.62~0.90) | 0.003 | - | - | 0.75(0.63~0.89) | 0.001 | ||
| 肿瘤大小(2 ~ 4 cm vs < 2 cm) | 1.63(1.20~2.23) | 0.002 | - | - | 1.62(1.21~2.19) | 0.001 | ||
| 肿瘤大小(>4 cm vs < 2 cm) | 2.17(1.51~3.11) | < 0.01 | - | - | 2.12(1.51~2.99) | < 0.01 | ||
| T分期(T3~4 vs T0 ~ 2) | 1.33(1.04~1.69) | 0.022 | 1.84(0.99~3.41) | 0.053 | 1.35(1.08~1.69) | 0.009 | ||
| N分期(N1 ~ 3 vs N0) | 1.23(1.01~1.50) | 0.044 | - | - | - | - | ||
| M分期(M1 vs M0) | 2.02(1.40~2.92) | < 0.01 | 2.37(1.28~4.41) | 0.006 | 2.27(1.67~3.06) | < 0.01 | ||
| 原发灶手术(是vs否) | 0.57(0.40~0.81) | 0.002 | - | - | 0.63(0.47~0.84) | 0.002 | ||
| 区域淋巴结手术(是vs否) | 0.68(0.53~0.87) | 0.003 | - | - | 0.76(0.61~0.94) | 0.011 | ||
| 放疗(是vs无/不详) | 0.64(0.53~0.78) | < 0.01 | - | - | 0.68(0.56~0.81) | < 0.01 | ||
原发性大唾液SCC是一种预后较差的罕见肿瘤。在本研究中, 其5年OS率为40.4%, 在腮腺和下颌下腺SCC患者中分别为41.1%和34.5%。本研究发现, 下颌下腺SCC预后较腮腺SCC差, 可能与下颌下腺SCC在确诊时晚期比例、发生区域淋巴结转移及远处转移比例均高于腮腺SCC有关, 也可能与腮腺SCC接受原发灶手术比例高于下颌下腺SCC(90.1% vs 81.1%, P=0.006)有关, 由于回顾性研究的局限性, 其机制需研究。本研究利用SEER数据库现有数据进一步探索大唾液腺SCC的人口统计学特征、临床病理特征及预后因素。与其他病理类型相似, 腮腺仍是主要的发病部位, 其次是下颌下腺, 舌下腺最少见。除多数下颌下腺SCC年龄 < 72岁, 而多数腮腺SCC年龄≥ 72岁外, 大部分大唾液腺SCC为女性、白种人及已婚患者。这与之前的大型数据库研究相似[3, 11, 13]。本研究表明, 年龄≥ 72岁是患者的预后不良因素, 较Chen等[2]研究中年龄≥ 85岁患者年轻, 这可能与原发性大唾液腺SCC为排除性诊断, 近年来随着诊疗水平的提高, 原发性大唾液腺SCC诊断率提高有关。Chen等[2]发现在腮腺SCC患者中, 黑人较白人预后差(HR=2.08, 95% CI:1.52~2.86, P < 0.01)。但本研究发现, 种族与预后并无相关。Russell等[19]发现, 黑人较白人生存率低主要是由于两组之间的治疗方案不同, 黑人接受手术治疗比例低于白人(57.3% vs 76.9%, P < 0.01)。
本研究中50.2%的大唾液腺SCC患者发生区域淋巴结转移, 在cN0患者中分析发现, 选择性区域淋巴结清扫患者中位OS较未清扫者改善(62.0个月vs 17.0个月, P < 0.01), 这与研究报道的大唾液腺恶性肿瘤中隐匿性淋巴结转移最高达60%相关[20-21]。但有研究指出, 在低分级恶性肿瘤中, 选择性区域淋巴结清扫并不能给患者带来益处[22]。进一步研究发现, 唾液腺恶性肿瘤的组织学类型、分级、肿瘤分期和大小是隐匿性淋巴结转移的重要预测因素[1, 13, 23]。因此对存在隐匿性淋巴结转移高危因素患者推荐进行选择性颈部淋巴结清扫。
在大唾液腺SCC中, 手术联合放疗及单纯手术是常见的治疗方案。本研究显示, 手术联合辅助放化疗较单纯手术可以给患者带来更大的生存获益, 但手术联合辅助放化疗较手术联合放疗并不能带来额外的生存获益, 仅放疗较无治疗无生存获益。Hosni等[15]的一项单中心回顾性研究表明, 辅助放疗可以改善患者的长期预后。Wang等[24]对34例原发性大唾液腺SCC的回顾性分析发现, 术后辅助放疗可改善局部控制率和无瘤生存期。研究发现, 在晚期或高分级大唾液腺恶性肿瘤患者中, 辅助放疗可改善患者预后[14]。由于M1患者生存时间大为减少, 因此进一步在M1患者中分析化疗的疗效, 遗憾的是化疗并不能改善M1患者的预后。本研究进一步在Ⅳ期患者中分析发现, 接受化疗者预后较未化疗者改善。相似的是, 一项研究利用美国国家癌症数据库(National Comprehensive Cancer Network, NCDB)数据库在2 285例晚期唾液腺SCC中研究辅助化疗对患者预后时发现, 在晚期唾液腺SCC患者中增加辅助化疗可能会改善长期生存[3]。
SEER数据库作为一个大型的国家数据库, 依据该数据库得以对罕见肿瘤进行分析研究, 但是也存在一些局限性。这是一个回顾性数据库, 患者注册登记信息可能存在错误, 同时存在数据的缺失, 如化疗方案和放疗剂量等详细的治疗信息及患者相关并发症等信息, 无法进一步得出相关结论。因此相关结论需要进一步研究验证。
原发性大唾液腺SCC是一种罕见且预后较差的恶性肿瘤, 多数患者在确诊时即为晚期, 且下颌下腺SCC在确诊时晚期比例、区域淋巴结转移及远处转移发生率高于腮腺SCC, 其预后较腮腺差。对于存在高T分期及分级等高危因素的cN0患者, 选择性颈部淋巴结清扫可以带来生存获益。对于Ⅳ期患者, 化疗可以改善长期预后。但是由于回顾性研究的局限性, 相关结论需进一步验证。
| [1] |
Israel Y, Rachmiel A, Gourevich K, et al. Kaplan-Meier analysis of salivary gland tumors:prognosis and longterm survival[J]. J Cancer Res Clin Oncol, 2019, 145(8): 2123-2130. DOI:10.1007/s00432-019-02953-9 |
| [2] |
Chen MM, Roman SA, Sosa JA, et al. Prognostic factors for squamous cell cancer of the parotid gland:an analysis of 2104 patients[J]. Head Neck, 2015, 37(1): 1-7. |
| [3] |
Cheraghlou S, Schettino A, Zogg CK, et al. Adjuvant chemotherapy is associated with improved survival for latestage salivary squamous cell carcinoma[J]. Laryngoscope, 2019, 129(4): 883-889. DOI:10.1002/lary.27444 |
| [4] |
Lee RJ, Tan AP, Tong EL, et al. Epidemiology, prognostic factors, and treatment of malignant submandibular gland tumors[J]. JAMA Otolaryngol Head Neck Surg, 2015, 141(10): 905-912. |
| [5] |
Witt RL. Major salivary gland cancer[J]. Surg Oncol Clin N Am, 2004, 13(1): 113-127. |
| [6] |
Aro K, Tarkkanen J, Saat R, et al. Submandibular gland cancer:Specific features and treatment considerations[J]. Head Neck, 2018, 40(1): 154-162. DOI:10.1002/hed.24981 |
| [7] |
Lee S, Kim GE, Park CS, et al. Primary squamous cell carcinoma of the parotid gland[J]. Am J Otolaryngol, 2001, 22(6): 400-406. |
| [8] |
Fang Q, Wu J, Liu F. Oncologic outcome and potential prognostic factors in primary squamous cell carcinoma of the parotid gland[J]. BMC Cancer, 2019, 19(1): 752. DOI:10.1186/s12885-019-5969-6 |
| [9] |
Shemen LJ, Huvos AG, Spiro RH. Squamous cell carcinoma of salivary gland origin[J]. Head Neck Surg, 1987, 9(4): 235-240. DOI:10.1002/hed.2890090407 |
| [10] |
张建丽, 谷峰, 田燕晓. DCLK1基因启动子甲基化与口腔鳞癌临床病理特征及预后的关系[J]. 实用肿瘤杂志, 2019, 34(4): 337-342. |
| [11] |
Pfisterer MJ, Vazquez A, Mady LJ, et al. Squamous cell carcinoma of the parotid gland:A population-based analysis of 2545 cases[J]. Am J Otolaryng, 2014, 35(4): 469-475. DOI:10.1016/j.amjoto.2014.03.003 |
| [12] |
Korkmaz H, Yoo GH, Du W, et al. Predictors of nodal metastasis in salivary gland cancer[J]. J Surg Oncol, 2002, 80(4): 186-189. DOI:10.1002/jso.10125 |
| [13] |
Schrank TP, Zhan KY, Lentsch EJ. Predictors of outcomes in large cell undifferentiated carcinoma of the major salivary glands[J]. Laryngoscope, 2017, 127(2): 372-376. |
| [14] |
Mahmood U, Koshy M, Goloubeva O, et al. Adjuvant radiation therapy for high-grade and/or locally advanced major salivary gland tumors[J]. Arch Otolaryngol Head Neck Surg, 2011, 137(10): 1025-1030. DOI:10.1001/archoto.2011.158 |
| [15] |
Hosni A, Huang SH, Goldstein D, et al. Outcomes and prognostic factors for major salivary gland carcinoma following postoperative radiotherapy[J]. Oral Oncol, 2016, 54: 75-80. DOI:10.1016/j.oraloncology.2015.11.023 |
| [16] |
Mifsud MJ, Tanvetyanon T, Mccaffrey JC, et al. Adjuvant radiotherapy versus concurrent chemoradiotherapy for the management of high-risk salivary gland carcinomas[J]. Head Neck, 2016, 38(11): 1628-1633. DOI:10.1002/hed.24484 |
| [17] |
Amini A, Waxweiler TV, Brower JV, et al. Association of adjuvant chemoradiotherapy vs radiotherapy alone with survival in patients with resected major salivary gland carcinoma:data from the National Cancer Data Base[J]. JAMA Otolaryngol Head Neck Surg, 2016, 142(11): 1100-1110. DOI:10.1001/jamaoto.2016.2168 |
| [18] |
Olarte LS, Megwalu UC. The impact of demographic and socioeconomic factors on major salivary gland cancer survival[J]. Otolaryngol Head Neck Surg, 2014, 150(6): 991-998. DOI:10.1177/0194599814526556 |
| [19] |
Russell JL, Chen N, Ortiz SJ, et al. Racial and ethnic disparities in salivary gland cancer survival[J]. JAMA Otolaryngol Head Neck Surg, 2014, 140(6): 504. DOI:10.1001/jamaoto.2014.406 |
| [20] |
Armstrong JG, Harrison LB, Thaler HT, et al. The indications for elective treatment of the neck in cancer of the major salivary glands[J]. Cancer, 1992, 69(3): 615-619. |
| [21] |
Ying YL, Johnson JT, Myers EN. Squamous cell carcinoma of the parotid gland[J]. Head Neck, 2006, 28(7): 626-632. DOI:10.1002/hed.20360 |
| [22] |
Kruse AL, Gratz KW, Obwegeser JA, et al. Malignant minor salivary gland tumors:a retrospective study of 27 cases[J]. Oral Maxillofac Surg, 2010, 14(4): 203-209. |
| [23] |
Xiao CC, Zhan KY, White-Gilbertson SJ, et al. Predictors of nodal metastasis in parotid malignancies:A National Cancer Data Base study of 22, 653 patients[J]. Otolaryngol Head Neck Surg, 2016, 154(1): 121-130. |
| [24] |
Wang LM, Li HMP, Yang ZM, et al. Outcomes of primary squamous cell carcinoma of major salivary glands treated by surgery with or sithout postoperative radiotherapy[J]. J Oral Maxil Surg, 2015, 73(9): 1860-1864. DOI:10.1016/j.joms.2015.03.016 |
 2020, Vol. 35
2020, Vol. 35


