文章信息
- 高楚伊, 聂俊, 朱颖, 江波
- Gao Chuyi, Nie Jun, Zhu Ying, Jiang Bo
- EGFR突变对云南省晚期肺腺癌疗效及预后影响的真实世界研究
- A real-world study of effect of EGFR mutation on efficacy and prognosis of advanced lung adenocarcinoma in Yunnan Province
- 实用肿瘤杂志, 2021, 36(1): 37-42
- Journal of Practical Oncology, 2021, 36(1): 37-42
基金项目
- 云南省应用基础研究(昆医联合专项)[2017FE467(-186),2018FE001(-069)];云南省教育厅科学研究基金(2018JS226)
-
通信作者
- 江波,E-mail: jiangruonin1973@163.com
-
文章历史
- 收稿日期:2019-11-25
2014年云南省肿瘤登记地区数据统计显示,肺癌居于发病率及死亡率第1位[1]。云南省宣威市位居云南省肺癌发病率之首,宣威等地采煤密集,室内燃煤且通风不畅造成空气污染等因素,可能与肺癌发病率高有关。随着临床研究的深入,非小细胞肺癌(non-small-cell lung cancer, NSCLC)的治疗从广谱的化疗逐渐转化为精准治疗。对于表皮生长因子受体(epidermal growth factor receptor, EGFR)敏感突变的晚期NSCLC患者,NCCN指南推荐一线应用表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor, EGFR-TKI)[2]。虽然此类药物在我国上市十余年,但EGFR基因突变检测及药物并未同期纳入医保报销范畴,需自行负担检测及治疗费用,临床治疗中仍有部分患者EGFR基因突变检测阳性而首选化疗或者未行基因检测而首选EGFR-TKI治疗,从而影响患者的疗效及预后。云南省为肺癌高发地区,经济发展较为落后,临床诊疗欠规范。本研究为回顾性研究,旨在观察云南省真实世界中肺癌患者EGFR突变检测情况、EGFR-TKI使用情况以及EGFR突变对晚期肺癌疗效及预后的影响。
1 资料与方法 1.1 一般资料收集2014年5月至2018年5月在云南省肿瘤医院初治并行病理检查确诊的ⅢB~Ⅳ期肺腺癌患者资料。患者年龄≥18岁,均为云南籍,经手术、电子纤维支气管镜、CT引导下经皮肺穿刺、超声内镜引导下的经支气管针吸活检术(endobronchail ultrasound guilded transbronchial needle aspiration, EBUS-TBNA)、胸腔积液细胞学、痰细胞学、胸腔镜取材活检、浅表转移淋巴结取材活检或其他确诊方式取材并经病理检查确诊为NSCLC。所有患者入院前未行任何包括手术、化疗、放疗、靶向治疗和免疫治疗等抗肿瘤治疗。进行EGFR基因检测阳性的患者,需为EGFR常见突变,如19外显子缺失突变或21外显子L858R错义突变。所有患者要求病例资料以及影像学资料完整,可以进行疗效评估。
1.2 观察指标 1.2.1 一般指标年龄、性别、籍贯、有无吸烟史、转移部位[淋巴结和(或)远处转移及具体转移部位]、确诊方式、分期和基因检测实施情况等。
1.2.2 治疗模式一线应用EGFR-TKI/二线化疗,一线应用化疗/二线EGFR-TKI。
1.2.3 T细胞亚群外周血CD4+T细胞水平、CD8+T细胞水平和CD4+/CD8+水平。
1.2.4 疗效根据实体瘤疗效评价1.1版(Response Evaluation Criteria in Solid Tumors Version 1.1, RECIST1.1)标准评估患者疗效[3],分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD),客观缓解率(objective response rate, ORR)为CR+PR,疾病控制率(disease control rate, DCR)为CR+PR+SD。化疗患者每2个周期评价疗效,EGFR-TKI治疗患者首次疗效评价时间为开始治疗满1个月时,之后每2个月评价疗效。
1.2.5 无进展生存期(progression-free survival, PFS)指从接受治疗开始,到疾病进展的时间。
1.2.6 随访方式化疗及EGFR-TKI治疗患者均按时返院评价疗效及随访,未返院评价疗效及随访的患者被排除在本研究之外,总生存数据尚不成熟,随访截止时间2018年5月。
1.3 统计学分析采用SPSS 23.0软件进行数据分析。EGFR突变情况与患者临床特征分析采用χ2检验。治疗前后外周血T细胞亚群的变化采用配对t检验。多因素生存分析采用Cox比例风险回归模型。采用Kaplan-Meier法绘制生存曲线,采用Log-rank作生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 患者特征及EGFR突变情况共纳入300例云南省初治且病理确诊的晚期NSCLC患者,其中肺腺癌195例。195例肺腺癌患者中,男性105例,女性90例;年龄33~82岁,中位年龄54岁。127例行EGFR基因检测,检测率为65.1%;65例EGFR突变阳性,应用EGFR-TKI治疗61例(93.8%)。患者EGFR突变率比较,女性患者高于男性患者(P=0.003),不吸烟患者高于吸烟患者(P=0.001)。
2.2 EGFR突变阳性肺腺癌患者PFS及疗效 2.2.1 EGFR-TKI应用情况及PFS65例EGFR突变阳性的肺腺癌患者中61例(93.8%)曾接受EGFR-TKI治疗。其中41例一线应用EGFR-TKI二线应用化疗;20例一线应用化疗,二线应用EGFR-TKI。一线应用EGFR-TKI治疗的患者中位PFS为10.7个月(95%CI:8.8~12.7个月),一线应用化疗的患者中位PFS为7.3个月(95%CI:4.9~9.6个月),两者比较,差异具有统计学意义(P=0.038,图 1)。
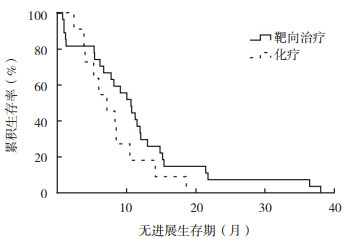
|
| 图 1 EGFR-TKI靶向治疗和化疗治疗的EGFR突变阳性肺腺癌患者无进展生存曲线比较 Fig.1 Comparison of progression-free survival curves of EGFR mutation-positive lung adenocarcinoma patients treated with EGFR-TKI and chemotherapy |
一线进行EGFR-TKI治疗的41例患者治疗期间,CR 0例,30例达到PR,6例SD,ORR为73.2%,DCR为87.8%。一线进行化疗的20例患者治疗期间,1例达到CR,7例PR,5例SD,ORR为40.0%,DCR为65.0%;两组ORR和DCR比较,差异均具有统计学意义(均P < 0.01)。
2.2.3 EGFR突变阳性且伴脑转移患者PFS11例初诊时发生脑转移的患者EGFR基因检测结果为阳性,其中7例一线应用EGFR-TKI治疗,4例一线应用化疗。一线应用EGFR-TKI治疗的中位PFS为8.3个月(95%CI:3.1~13.4个月),一线应用化疗的中位PFS为6.1个月(95%CI:4.6~7.6个月),两者比较,差异无统计学意义(P=0.165,图 2)。
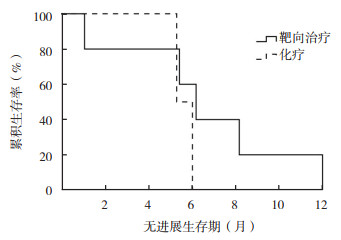
|
| 图 2 应用EGFR-TKI靶向治疗和化疗的EGFR阳性脑转移肺腺癌患者无进展生存曲线比较 Fig.2 Comparison of progression-free survival curves of EGFR mutation-positive lung adenocarcinoma patients with brain metastasis treated with EGFR-TKI and chemotherapy |
62例患者经检测为EGFR阴性,其中6例一线应用EGFR-TKI治疗,其余56例应用化疗。一线应用EGFR-TKI治疗的患者中位PFS为1.3个月(95%CI:0~4.5个月),应用化疗的患者中位PFS为5.1个月(95%CI:4.5~5.8个月),两者比较,差异具有统计学意义(P=0.004,图 3)。
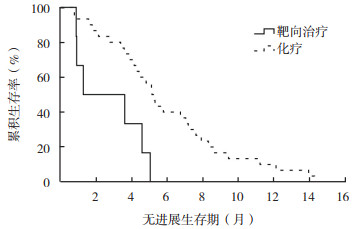
|
| 图 3 EGFR-TKI靶向治疗和化疗治疗的EGFR突变阴性肺腺癌患者无进展生存曲线比较 Fig.3 Comparison of progression-free survival curves between EGFR-TKI and chemotherapy treated lung adenocarcinoma patients without EGFR mutation |
68例肺腺癌患者未进行EGFR突变检测,其中24例一线应用EGFR-TKI治疗,44例一线应用化疗。一线应用EGFR-TKI治疗的患者中位PFS为7.5个月(95%CI:3.5~11.4个月),一线应用化疗的患者中位PFS为7.1个月(95%CI:3.6~10.6个月),两者比较,差异无统计学意义(P=0.783,图 4)。
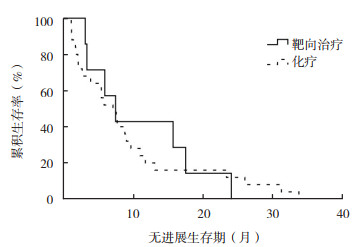
|
| 图 4 应用EGFR-TKI靶向治疗和化疗的不明EGFR突变状态肺腺癌患者无进展生存曲线比较 Fig.4 Comparison of progression-free survival curves of lung adenocarcinoma patients with unknown EGFR mutation status treated with EGFR-TKI and chemotherapy |
单因素分析显示,127例行EGFR基因检测患者的PFS在EGFR突变状态及有无脑转移方面比较,差异均具有统计学意义(P=0.009,P=0.014,表 1)。
| 临床特征 | mPFS(月,95%CI) | P值 |
| EGFR状态 | 0.009 | |
| 突变型 | 7.9(6.17~9.57) | |
| 野生型 | 5.0(4.18~5.88) | |
| 性别 | 0.528 | |
| 男性 | 6.1(3.68~8.53) | |
| 女性 | 7.0(5.82~8.34) | |
| 年龄 | 0.406 | |
| ≤60岁 | 6.9(5.43~8.37) | |
| > 60岁 | 6.3(3.40~9.14) | |
| 吸烟 | 0.454 | |
| 是 | 4.1(2.25~6.01) | |
| 否 | 7.0(6.36~7.70) | |
| 籍贯 | 0.515 | |
| 宣威 | 10.8(4.46~17.20) | |
| 其他 | 6.7(5.43~8.03) | |
| 脑转移 | 0.014 | |
| 无 | 7.2(5.99~8.36) | |
| 有 | 5.4(5.00~5.77) | |
| TNM分期 | 0.765 | |
| ⅢB~ⅢC | 4.1(0.22~8.04) | |
| Ⅳ | 5.1(3.06~7.14) | |
| 注 EGFR:表皮生长因子受体(epidermal growth factor receptor);mPFS:中位无进展生存期(median progression-free survival) | ||
将PFS单因素分析中有统计学意义的变量纳入多因素分析显示,EGFR突变状态及有无脑转移均为PFS预后因素(P=0.005,P=0.007,表 2)。
| 因素 | B | SE | Wald | df | P值 | Exp(B) | 95.0% CI |
| EGFR状态 | 0.631 | 0.223 | 8.033 | 1 | 0.005 | 1.879 | 1.215~2.907 |
| 脑转移 | 0.796 | 0.293 | 7.354 | 1 | 0.007 | 2.216 | 1.247~3.938 |
| 注 EGFR:表皮生长因子受体(epidermal growth factor receptor) | |||||||
71例患者治疗前及治疗后行外周血T细胞亚群检测。收集这些患者治疗前外周血CD4+T细胞占T细胞百分比、CD8+T细胞占T细胞百分比和CD4+/CD8+比值以及进行2个周期化疗后或行EGFR-TKI治疗1个月后患者外周血对应的T细胞亚群水平。化疗可影响外周血CD4+T细胞水平(P=0.031)。靶向治疗前和治疗后CD4+T细胞水平比较,靶向治疗或化疗前、后CD8+T细胞水平及CD4+/CD8+比值比较,差异均无统计学意义(均P > 0.05,表 3)。
| 淋巴细胞亚群 | 化疗 | EGFR-TKI | |||||
| 治疗前 | 治疗后 | P值 | 治疗前 | 治疗后 | P值 | ||
| CD4+(%) | 32.98±9.17 | 36.22±10.84 | 0.031 | 37.47±8.44 | 36.22±11.70 | 0.587 | |
| CD8+(%) | 19.44±7.15 | 20.45±7.04 | 0.467 | 19.55±7.28 | 20.03±9.05 | 0.802 | |
| CD4+/CD8+ | 1.94±0.85 | 2.05±0.90 | 0.503 | 2.18±0.99 | 2.31±1.82 | 0.655 | |
| 注 EGFR-TKI:表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor) | |||||||
既往研究均认为,亚裔、不吸烟和女性肺腺癌患者EGFR突变率较高[4-5]。本回顾性研究也证实,EGFR突变率与患者性别及有无吸烟史有关,女性和无吸烟史患者更易发生EGFR突变。尽管进行EGFR基因检测早已被写入国际及国内NSCLC诊疗指南[6-7],但在本研究中所观察的195例肺腺癌患者,仅有65.1%的检测率。云南省EGFR检测率低,一方面可能与当时基因检测及靶向药物未进入医保且价格昂贵有关,另一方面也与医师对基因检测及靶向治疗的认识不够深入有关。基于IPASS[8]、NEJ002[9]和WJTOG3405[10]等研究的结果,国内外指南均将EGFR-TKI列为EGFR突变的晚期NSCLC患者的一线治疗[11-12]。与既往研究相似[8-10],本研究中,EGFR突变阳性的晚期肺腺癌患者,一线靶向治疗PFS达到10.7个月,ORR达到73.2%,均优于一线化疗,提示EGFR-TKI靶向治疗是云南省EGFR敏感突变的晚期肺腺癌的首选治疗方法。NSCLC极易发生脑转移,由于化疗药物难以透过血-脑脊液屏障而作用于脑转移病灶,脑转移患者往往预后不佳[13]。既往大量研究证实,对于EGFR突变阳性脑转移的患者,靶向治疗优于化疗[14-16]。本研究中,EGFR突变阳性脑转移患者,靶向与化疗治疗患者的PFS曲线后期明显分离,但差异无统计学意义(P=0.165),可能与病例数较少有关。
TORCH研究显示,对于EGFR突变状态未知的患者,一线使用EGFR-TKI,死亡风险增加24%[17]。IPASS研究中[8],EGFR野生型患者一线使用EGFR-TKI的疾病进展风险增加185%,死亡风险增加18%。同样在本研究中,EGFR突变未知组一线使用EGFR-TKI未较化疗有优势。而EGFR野生型组,一线化疗优于一线靶向治疗。可见,对于云南晚期肺腺癌EGFR野生型或未知型患者,化疗仍为标准一线治疗,使用EGFR-TKI前须明确EGFR基因状态。本研究预后分析显示,EGFR突变状态及有无脑转移为预后因素(均P < 0.05),这也与既往大量研究相似[10-16]。
CD4+T细胞为辅助性T细胞,可以通过γ-干扰素(interferon-γ, INF-γ)介导的机制直接杀伤肿瘤细胞[18-19],对细胞免疫起正调节作用。CD8+T细胞为抑制性T细胞,抑制机体免疫应答,也对靶细胞有一定杀伤作用,起负调节作用。CD4+/CD8+比值可以反映机体细胞免疫功能状态,比值降低表明机体细胞免疫功能降低,抗肿瘤能力减弱。有研究认为,化疗或靶向治疗治疗会影响细胞免疫调节功能[20-22]。本研究71例可获得治疗前后外周血T细胞亚群的患者,接受化疗或靶向治疗对CD4+T细胞水平、CD8+T细胞水平和CD4+/CD8+比值均无影响。可能与样本量不足及治疗周期数有关,后期也可进一步行相关研究。
综上所述,对于云南晚期肺腺癌EGFR敏感突变患者,EGFR-TKI是首选治疗。对于EGFR野生型或未知型患者,一线首选化疗,使用EGFR-TKI前须明确EGFR基因状态。EGFR突变状态及有无脑转移是云南晚期肺腺癌患者的独立预后因素。
| [1] |
文洪梅, 秦明芳, 陈杨, 等. 2014年云南省肿瘤登记地区恶性肿瘤发病与死亡分析[J]. 中国肿瘤, 2018, 27(11): 813-823. DOI:10.11735/j.issn.1004-0242.2018.11.A001 |
| [2] |
National Comprehensive Cancer Network. (NCCN) Clinical Practice Guidelines in Oncology. Non-Small Cell Lung Cancer, Version 1.2019[EB/OL]. (2018-06-11)[2019-11-20] https://www.nccn.org/professionals/physician_gls/f_guidelines.asp.
|
| [3] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [4] |
杨婉玲, 顾岩, 付秀华. 贝伐珠单抗胸腔灌注治疗肺腺癌伴恶性胸腔积液疗效与血清VEGF水平的关系[J]. 实用肿瘤杂志, 2020, 35(1): 62-64. |
| [5] |
Lee HJ, Kim YT, Kang CH, et al. Epidermal growth factor receptor mutation in lung adenocarcinomas: relationship with CT characteristics and histologic subtypes[J]. Radiology, 2013, 268(1): 254-264. DOI:10.1148/radiol.13112553 |
| [6] |
中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家组. 中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家共识[J]. 中华病理学杂志, 2011, 40(10): 700-702. DOI:10.3760/cma.j.issn.0529-5807.2011.10.014 |
| [7] |
Leighl NB, Rekhtman N, Biermann WA, et al. Molecular testing for selection of patients with lung cancer for epidermal growth factor receptor and anaplastic lymphoma kinase tyrosine kinase inhibitors: American Society of Clinical Oncology endorsement of the College of American Pathologists/International Association for the study of lung cancer/association for molecular pathology guideline[J]. J Clin Oncol, 2014, 32(32): 3673-3679. DOI:10.1200/JCO.2014.57.3055 |
| [8] |
Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-957. DOI:10.1056/NEJMoa0810699 |
| [9] |
Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380-2388. DOI:10.1056/NEJMoa0909530 |
| [10] |
Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(2): 121-128. DOI:10.1016/S1470-2045(09)70364-X |
| [11] |
National Comprehensive Cancer Network. NCCN guidelines for patients. Version 1. 2015. Non-small cell lung cancer[EB/OL]. (2014-10-21)[2019-11-20]. http://www.nccn.org/patients/guidelines/nscl/index.Html
|
| [12] |
石远凯, 孙燕, 于金明, 等. 中国晚期原发性肺癌诊治专家共识(2016年版)[J]. 中国肺癌杂志, 2016, 19(1): 1-15. |
| [13] |
Bhatt VR, Dsouza SP, Smith LM, et al. Epidermal growth factor receptor mutational status and brain metastases in non-small-cell lung cancer[J]. J Glob Oncol, 2016, 3(3): 208-217. |
| [14] |
Park SJ, Kim HT, Lee DH, et al. Efficacy of epidermal growth factor receptor tyrosine kinase inhibitors for brain metastasis in non-small cell lung cancer patients harboring either exon 19 or 21 mutation[J]. Lung Cancer, 2012, 77(3): 556-560. DOI:10.1016/j.lungcan.2012.05.092 |
| [15] |
Heon S, Yeap BY, Lindeman NI, et al. The impact of initial gefitinib or erlotinib versus chemotherapy on central nervous system progression in advanced non-small cell lung cancer with EGFR mutations[J]. Clin Cancer Res, 2012, 18(16): 4406-4414. DOI:10.1158/1078-0432.CCR-12-0357 |
| [16] |
Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer[J]. N Engl J Med, 2018, 378(2): 113-125. DOI:10.1056/NEJMoa1713137 |
| [17] |
Gridelli C, Ciardiello F, Gallo C, et al. First-line erlotinib followed by second-line cisplatin-gemcitabine chemotherapy in advanced non-small-cell lung cancer: the TORCH randomized trial[J]. J Clin Oncol, 2012, 30(24): 3002-3011. DOI:10.1200/JCO.2011.41.2056 |
| [18] |
Zhang S, Bernard D, Khan WI, et al. CD4+ T-cell-mediated anti-tumor immunity can be uncoupled from autoimmunity via the STAT4/STAT6 signaling axis[J]. Eur J Immunol, 2009, 39(5): 1252-1259. DOI:10.1002/eji.200839152 |
| [19] |
H u, Z. Overexpression of osteopontin is associated with more aggressive phenotypes in human non-small cell lung cancer[J]. Clin Cancer Res, 2005, 11(13): 4646-4652. DOI:10.1158/1078-0432.CCR-04-2013 |
| [20] |
许钰杰, 崔瑶, 朱琰琰, 等. 化疗对晚期胆道系统肿瘤患者TAP及T细胞亚群的影响[J]. 医药论坛杂志, 2018, 39(11): 9-12. |
| [21] |
呙月. 恩度联合NP化疗治疗中晚期非小细胞肺癌疗效及对T细胞亚群、VEGF的影响[J]. 中国现代药物应用, 2018, 12(6): 97-99. |
| [22] |
张金标, 郑航, 尤长宣, 等. 靶向治疗后肺癌患者外周血T淋巴细胞亚群的表达变化及意义[J]. 山东医药, 2011, 51(18): 55-56. DOI:10.3969/j.issn.1002-266X.2011.18.032 |
 2021, Vol. 36
2021, Vol. 36


