文章信息
- 任明艳, 袁中琴, 周永红, 余顺玲, 廖冶丹, 谢琳
- Ren Mingyan, Yuan Zhongqin, Zhou Yonghong, Yu Shunling, Liao Yedan, Xie Lin
- 169例初诊肺癌骨转移患者临床特征及预后分析
- Clinical characteristics and prognosis of 169 patients with newly diagnosed lung cancer with bone metastases
- 实用肿瘤杂志, 2020, 35(4): 322-327
- Journal of Practical Oncology, 2020, 35(4): 322-327
基金项目
- 国家自然科学基金(81560471)
-
作者简介
- 任明艳(1991-), 女, 河南焦作人, 住院医师, 硕士, 从事胸部肿瘤诊断学临床研究.
-
通信作者
- 谢琳, E-mail:xielinyanghan@163.com
-
文章历史
- 收稿日期:2018-10-28
2. 云南省肿瘤医院, 昆明医科大学第三附属医院云南省癌症中心办公室, 云南 昆明 650118;
3. 云南省肿瘤医院, 昆明医科大学第三附属医院消化肿瘤内科, 云南 昆明 650118;
4. 临沧市第二人民医院肿瘤科, 云南 临沧 677000
2. Yunnan Cancer Center Office, Yunnan Cancer Hospital, The Third Affiliated Hospital of Kunming Medical University, Kunming 650118, China;
3. Department of Gastroenterology and Oncology, Yunnan Provincial Cancer Hospital, The Third Affiliated Hospital of Kunming Medical University, Kunming 650118, China;
4. Department of Oncology, Lincang Second People's Hospital, Lincang 677000, China
肺癌的发病率及死亡率极高[1-2],我国肺癌的发病率居恶性肿瘤第1位,云南省肺癌的发病率约为我国肺癌发病率的2倍。约60%以上的肺癌患者在首诊时即出现转移,骨转移是肺癌远处转移的常见部位之一[2-3]。肺癌患者出现骨转移后,容易出现骨相关事件(skeletal related events, SREs)[4],如病理性骨折、脊髓压迫、高钙血症和疼痛等症状,严重影响患者的生活质量,预后极差。对云南省肿瘤医院169例原发性肺癌初诊时已出现骨转移患者的临床特点包括病理类型、转移部位、骨相关事件的发生、治疗及总生存进行回顾性分析,探讨影响肺癌骨转移的临床预后因素。
1 资料与方法 1.1 一般资料收集2014年1月1日至2014年12月31日收治于云南省肿瘤医院的初诊原发性肺癌骨转移患者169例。其中男性102例,女性67例; 男女比例为1.5:1。年龄36~82岁,中位年龄58岁。病理类型:腺癌117例,鳞癌22例,小细胞肺癌14例,腺鳞癌2例,恶性但病理类型未明确14例。单发骨转移37例,多发骨转移132例。其中首诊时即出现骨相关事件94例,骨相关事件包括疼痛(90例)、病理性骨折(10例)和脊髓压迫(3例)。
1.2 诊断方法肺癌骨转移的诊断应满足以下2个条件之一:(1)临床或病理诊断为肺癌,骨病变活检符合肺癌转移; (2)肺癌病理诊断明确,具有典型的骨转移影像学(ECT/PET-CT/CT/MRI)表现[3-4]。
1.3 治疗肺癌骨转移患者的临床治疗是以化疗为主的综合治疗。其中,接受化疗111例(65.7%),放疗15例(8.9%),靶向治疗34例(20.1%),靶向治疗患者中仅12例进行基因检测,放射性核素治疗22例(13.0%),双磷酸盐治疗83例(49.1%),肺部病灶手术切除24例(14.2%); 骨转移灶外科手术治疗13例(13.6%),未行抗肿瘤治疗仅对症支持治疗37例(21.9%)。其中78例(46.2%)患者接受 > 2种治疗方案的联合治疗。
1.4 随访采用电话方式随访,最后随访时间为2018年9月30日。截止随访时间3例生存,最长生存时间57个月。生存期自确诊肺癌骨转移的日期开始计算,至死亡日期或最后随访日期终止。
1.5 统计学分析应用SPSS20.0软件作统计学分析。采用Kaplan-Meier法计算患者的总体生存情况,采用Log-rank比较生存情况。采用Cox回归对患者预后因素进行多因素分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 肺癌骨转移患者临床特征针对骨转移部位,SPECT、CT和MRI检查提示,溶骨性骨质破坏149例(88.2%),成骨性骨质破坏12例(7.1%),混合性骨质破坏8例(4.7%)。单发骨转移37例(21.9%),多发骨转移132例(78.1%)。肺癌患者易发生骨转移,肺癌骨转移的发生率及骨转移部位与疾病病理类型有关。腺癌发生率最高占69.2%(117/169),其次是鳞癌占13.0%(22/169),小细胞肺癌及其他较少。169例患者中碱性磷酸酶高于参考范围上限52例(30.8%),其中腺癌36例,鳞癌7例,小细胞肺癌2例,其他病理类型7例。T分期中,1期32例(18.9%),2期75例(44.4%),3期18例(10.7%),4期23例(13.6%),分期不详21例(12.4%); N分期中,0期8例(4.7%),1期3例(1.8%),2期72例(42.6%),3期63例(37.3%),分期不详23例(13.6%)。本研究中骨转移最常见的部位是脊椎,其次是胸肋骨,临床症状以骨转移灶处疼痛最常见。不同病理类型肺癌骨转移部位见表 1。
| 病理类型 | 胸椎 | 胸肋骨 | 腰骶椎 | 骨盆 | 四肢骨 | 肩胛骨 | 颅骨 |
| 腺癌 | 70 | 78 | 67 | 7 | 53 | 37 | 30 |
| 鳞癌 | 7 | 13 | 8 | 64 | 8 | 3 | 2 |
| 小细胞癌 | 5 | 8 | 7 | 4 | 7 | 4 | 3 |
| 其他 | 10 | 12 | 7 | 9 | 5 | 6 | 2 |
| 合计 | 92 | 111 | 89 | 84 | 73 | 50 | 37 |
采用Log-rank法比较性别、年龄、体质量指数(body mass index,BMI)、吸烟史、合并其他部位转移、肺癌类型、骨转移灶、血钙、肺部病灶手术治疗、骨相关事件、化疗、靶向治疗、锶89治疗、双磷酸盐治疗和血清碱性磷酸酶(alkaline phosphatase,ALP)是否升高对患者生存率的影响(表 2)。所有肺癌骨转移患者中位生存期为10个月,最短生存时间 < 1个月,最长生存57个月,2018年9月随访截止时仍带瘤生存(图 1)。原发性肺癌骨转移患者中位总生存期在性别、年龄、原发性肺癌类型、吸烟史、骨相关事件、骨转移多发情况、血钙浓度和血清ALP水平方面比较,差异均无统计学意义(均P < 0.05,表 2)。
| 临床特征 | 例数(%) | 中位生存时间(月) | χ2值 | P值 |
| 性别 | 0.002 | 0.967 | ||
| 男性 | 102(60.4) | 11 | ||
| 女性 | 67(39.6) | 12 | ||
| 年龄 | 0.044 | 0.834 | ||
| ≥60岁 | 76(45.0) | 13 | ||
| < 60岁 | 93(55.0) | 11 | ||
| BMI | 4.722 | 0.030 | ||
| < 18.5 kg/m2 | 16(10.3) | 5 | ||
| ≥18.5 kg/m2 | 139(89.7) | 13 | ||
| 吸烟史 | 0.109 | 0.742 | ||
| 有 | 58(34.3) | 11 | ||
| 无 | 111(65.7) | 13 | ||
| 病理类型 | 19.158 | < 0.01 | ||
| 腺癌 | 117(69.2) | 16 | ||
| 鳞癌 | 22(13.0) | 7 | ||
| 其他 | 30(17.8) | 7 | ||
| 其他部位转移 | 4.639 | 0.031 | ||
| 有 | 85(50.3) | 11 | ||
| 无 | 84(49.7) | 14 | ||
| 肺癌类型 | 1.951 | 0.163 | ||
| 中央型 | 64(37.9) | 12 | ||
| 周围型 | 105(62.1) | 12 | ||
| 骨转移灶 | 1.863 | 0.172 | ||
| 单发 | 37(21.9) | 9 | ||
| 多发 | 132(78.1) | 13 | ||
| 血钙浓度 | 2.516 | 0.113 | ||
| < 2.1 mmol/L | 15(9.0) | 8 | ||
| 2.1~2.6 mmol/L | 151(91.0) | 13 | ||
| 肺部病灶手术治疗 | 5.997 | 0.014 | ||
| 有 | 24(14.2) | 20 | ||
| 无 | 145(85.8) | 11 | ||
| 骨相关事件 | 0.598 | 0.439 | ||
| 有 | 75(44.4) | 12 | ||
| 无 | 94(55.6) | 14 | ||
| 化疗 | 14.924 | < 0.01 | ||
| 有 | 111(65.7) | 16 | ||
| 无 | 58(34.3) | 6 | ||
| 靶向治疗 | 14.198 | < 0.01 | ||
| 有 | 34(20.1) | 24 | ||
| 无 | 135(79.9) | 10 | ||
| 锶89治疗 | 7.711 | 0.005 | ||
| 有 | 22(13.0) | 26 | ||
| 无 | 147(87.0) | 11 | ||
| 双磷酸盐治疗 | 9.747 | 0.002 | ||
| 有 | 83(49.1) | 16 | ||
| 无 | 86(50.9) | 9 | ||
| ALP | 0.602 | 0.438 | ||
| ≤135 U/L | 118(69.8) | 12 | ||
| > 135 U/L | 51(30.2) | 12 | ||
| 注 BMI:体质量指数(body mass index); ALP:碱性磷酸酶(alkaline phosphatase) | ||||
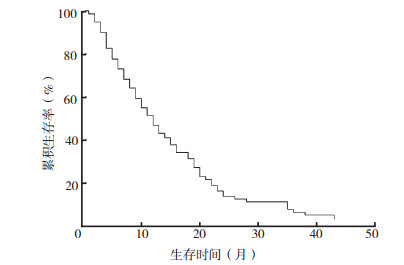
|
| 图 1 肺癌骨转移患者总生存曲线 Fig.1 Overall survival curve of lung cancer patients with bone metastases |
原发性肺癌骨转移患者中,中位生存期比较,腺癌患者长于其他病理类型患者,BMI过重及正常的患者长于BMI较轻患者,只出现骨转移患者长于同时合并其他部位转移的患者,经肺部病灶手术治疗、化疗、靶向治疗、锶89治疗或双磷酸盐治疗的患者中位生存期较长,差异均具有统计学意义(均P < 0.01,表 2,图 2)。

|
| 注 A:病理类型; B:BMI; C:其他部位转移与否; D:原发灶有无手术; E:有无化疗; F:有无靶向治疗; G:有无锶89治疗; H:有无双磷酸盐治疗 图 2 不同临床特征对肺癌骨转移患者总生存情况的影响 Fig.2 Effect of different clinical characteristics on the overall survival of lung cancer patients with bone metastases |
将上述单因素分析中P < 0.05的指标,包括病理类型、BMI、合并其他部位转移、肺部病灶手术治疗、化疗、靶向治疗、锶89治疗及双磷酸盐治疗进行Cox比例风险模型多因素分析显示,化疗和靶向治疗是原发性肺癌骨转移患者预后的独立预后因素(均P < 0.05,表 3)。
| 临床特征 | B | SE | Wald | P值 | Exp(B) | 95%CI |
| 病理类型 | 0.212 | 0.203 | 1.089 | 0.297 | 1.236 | 0.830~1.839 |
| 其他部位转移 | -.221 | 0.211 | 1.099 | 0.295 | 0.802 | 0.531~1.212 |
| 肺部病灶手术 | 0.461 | 0.341 | 1.834 | 0.176 | 1.586 | 0.814~3.093 |
| 化疗 | 0.770 | 0.230 | 11.243 | 0.001 | 2.159 | 1.377~3.386 |
| 靶向治疗 | 1.058 | 0.287 | 13.632 | < 0.01 | 2.881 | 1.643~5.053 |
| 锶89治疗 | -.318 | 0.345 | 0.852 | 0.356 | 0.727 | 0.370~1.430 |
| 双磷酸盐治疗 | 0.230 | 0.218 | 1.112 | 0.292 | 1.259 | 0.821~1.931 |
肺癌的发病率高居全球癌症首位。美国国立流行病学的数据显示肺癌占所有新发恶性肿瘤的13.3%,而占所有癌症所致患者死亡的26.5%[2, 5]。在我国,肺癌的死亡率增加趋势明显,是死亡率上升最快的癌症,已成为第1位的癌症死因。至2012年,肺癌所致患者死亡占男性恶性肿瘤的29%,占女性的26%[6]。云南省作为肺癌的高发病率地区,肺癌的发病率约为全国肺癌发病率的2倍。肺癌分为非小细胞肺癌和小细胞肺癌,非小细胞肺癌患者在初诊时多为Ⅲ/Ⅳ期,而小细胞肺癌初诊即有66.7%的患者已出现转移[7-8]。
2016年美国肺癌患者诊断的中位年龄为70岁[5]。本研究肺癌患者诊断的中位年龄是58岁,其中患者的最小年龄为36岁,可能与肺癌患者年轻化有关。本研究中非小细胞肺癌141例(83.4%),小细胞肺癌14例(8.3%),与既往报道的数据一致[5, 7-8]。肺癌患者出现转移后严重影响患者生活质量,导致患者生存期缩短。本研究中肺癌骨转移患者中位生存时间仅为10个月,最短生存时间 < 1个月。
> 50%的肺癌患者会出现转移[5, 7],肺癌可转移到全身各部位,较常见的转移部位有肺、肝、脑、骨、肾上腺和软组织等[9-12]。肺癌骨转移的发生率约为30%~40%[13-15],好发部位为脊椎、骨盆、胸骨和颅骨等。多数骨转移灶为溶骨性破坏。肺癌骨转移患者骨相关事件发生率高,主要表现为疼痛、脊髓压迫和病理性骨折等[16],影响肺癌骨转移患者的生活质量。研究显示,肺腺癌骨转移率最高,其次为鳞状细胞癌和小细胞肺癌等,常表现为多发骨转移[17]。本研究169例初诊肺癌骨转移患者中,病理学类型主要为腺癌,多数患者表现为多发骨转移。骨转移灶以胸腰椎和骨盆等承重骨为主,骨转移灶以溶骨性骨质破坏为主,半数肺癌骨转移患者存在骨相关事件,主要表现为骨转移灶部位的疼痛,与既往研究结果一致。有研究显示,非小细胞肺癌患者的血钙浓度降低易出现骨转移,是其预后的独立影响因子[18]。本研究中初诊肺癌骨转移患者其血钙浓度降低也使其生存期缩短,与患者的预后相关,但并不是肺癌骨转移患者的独立预后因素,可能因为患者出现低血钙后,临床常常会干预。
含铂双药化疗是晚期肺癌的标准一线治疗,化疗后患者的生存时间长于非化疗组[19]。肺癌骨转移患者的治疗以化疗、手术治疗、放疗、靶向治疗及双磷酸盐治疗等综合治疗为主。唑来膦酸是第三代双膦酸盐类药物,唑来膦酸可减少肺癌骨转移患者骨相关事件的发生[14],联合化疗可延长肺癌骨转移患者的总生存期及无进展生存期[20]。本研究结果提示,化疗和靶向治疗是肺癌骨转移的独立预后因素,双磷酸盐治疗和锶89治疗的肺癌骨转移患者较未行上述治疗的患者生存时间长,与肺癌骨转移患者的预后相关。既往的研究也得出相同的结论[16, 21-22]。这就提示临床医师对于肺癌骨转移患者,如可耐受化疗和靶向治疗,应尽早行化疗和靶向治疗控制病情,同时还需行双磷酸盐治疗和锶89治疗等辅助治疗来提高患者的生存期,如骨转移灶已出现严重的骨相关事件或有出现骨相关事件的风险高,需及时外科干预。
综上所述,肺癌骨转移患者中腺癌及多发骨转移常见,肺癌骨转移患者有无化疗和有无靶向治疗是其独立预后因素。
| [1] |
Siegel R, Miller D, Jemal A. Cancer Statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7. DOI:10.3322/caac.21551 |
| [2] |
Zhang C, Mao M, Guo X, et al. Nomogram based on homogeneous and heterogeneous associated factors for predicting bone metastases in patients with different histological types of lung cancer[J]. BMC Cancer, 2019, 19(1): 238. DOI:10.1186/s12885-019-5445-3 |
| [3] |
Yu S, Jiang Z, Zhang L, et al. Chinese expert consensus statement on clinical diagnosis and treatment of malignant tumor bone metastasis and bone related diseases[J]. Chinese-German J Clin Oncol, 2010, 9(1): 187. |
| [4] |
王爱芬, 王亚娟, 张伟强, 等. 肺癌骨转移的全身骨扫描表现分析[J]. 实用肿瘤杂志, 2012, 27(1): 86-87. |
| [5] |
Smith RA, Andrews KS, Brooks D, et al. Cancer screening in the United States, 2017:A review of current American Cancer Society guidelines and current issues in cancer screening[J]. CA Cancer J Clin, 2017, 67(2): 100. DOI:10.3322/caac.21392 |
| [6] |
Mehta MP, Paleologos NA, Mikkelsen T, et al. The role of chemotherapy in the management of newly diagnosed brain metastases:a systematic review and evidence-based clinical practice guideline[J]. J Neurooncol, 2010, 96(1): 71-83. DOI:10.1007/s11060-009-0062-7 |
| [7] |
Doronzo S, Coleman R, Brown J, et al. Metastatic bone disease:Pathogenesis and therapeutic options:Up-date on bone metastasis management[J]. J Bone Oncol, 2019, 15: 004-4. |
| [8] |
林凌, 陈振岗, 史学军. 预后营养指数对接受靶向治疗的晚期肺腺癌患者的预后评估研究[J]. 实用肿瘤杂志, 2019, 34(5): 444-448. |
| [9] |
Chamberlain MC. Targetable lung cancer brain metastases:Improved outcome[J]. J Clin Oncol, 2016, 34(19): 2315-2316. DOI:10.1200/JCO.2016.66.9465 |
| [10] |
Yushak ML, Chiang VL, Kluger HM. Clinical trials in melanoma patients with brain metastases[J]. Pigment Cell Melanoma Res, 2015, 28: 741-743. DOI:10.1111/pcmr.12401 |
| [11] |
Kuiper JL, Smit EF. High-dose, pulsatile erlotinib in two NSCLC patients with leptomeningeal metastases-one with a remarkable thoracic response as well[J]. Lung Cancer, 2013, 80(1): 102-105. |
| [12] |
Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer[J]. New Engl J Med, 2017, 376(7): 629-640. DOI:10.1056/NEJMoa1612674 |
| [13] |
Ruppert AM, Stankoff B, Lavole A, et al. Miliary brain metastases in lung cancer[J]. J Clin Oncol, 2010, 28(34): e714-716. DOI:10.1200/JCO.2009.27.0140 |
| [14] |
Solomon BJ, Cappuzzo F, Felip E, et al. Intracranial efficacy of crizotinib versus chemotherapy in patients with advanced ALK-positive nonsmall-cell lung cancer:results from PROFILE 1014[J]. J Clin Oncol, 2016, 34(24): 2858-2865. DOI:10.1200/JCO.2015.63.5888 |
| [15] |
Landi L, Dlnca F, Gelibter A, et al. Bone metastases and immunotherapy in patients with advanced non-small-cell lung cancer[J]. J Immuno Ther Cancer, 2019, 7(1): 316. |
| [16] |
Johung KL, Yeh N, Desai NB, et al. Extended survival and prognostic factors for patients with ALK-rearranged nonsmall-cell lung cancer and brain metastasis[J]. J Clin Oncol, 2016, 34: 123-129. |
| [17] |
Langer CJ. Emerging immunotherapies in the treatment of non-small cell lung cancer (NSCLC):the role of immune checkpoint inhibitors[J]. Am J Clin Oncol, 2015, 38(4): 422-30. DOI:10.1097/COC.0000000000000059 |
| [18] |
Johnson DB, Rioth MJ, Horn L. Immune checkpoint inhibitors in NSCLC[J]. Curr Treat Options Oncol, 2014, 15(4): 658-69. DOI:10.1007/s11864-014-0305-5 |
| [19] |
Lee DH, Han JY, Kim HT, et al. Primary chemotherapy for newly diagnosed nonsmall cell lung cancer patients with synchronous brain metastases compared with wholebrain radiotherapy administered first:result of a randomized pilot study[J]. Cancer, 2008, 113: 143-149. DOI:10.1002/cncr.23526 |
| [20] |
Garon EB, Rizvi NA, Hui R, et al. Pembrolizumab for the treatment of non-small-cell lung cancer[J]. N Engl J Med, 2015, 372(21): 2018-28. DOI:10.1056/NEJMoa1501824 |
| [21] |
Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373: 1627-1639. DOI:10.1056/NEJMoa1507643 |
| [22] |
Goldberg SB, Gettinger SN, Mahajan A, et al. Pembrolizumab for patients with melanoma or non-small-cell lung cancer and untreated brain metastases:early analysis of a non-randomised, open-label, phase 2 trial[J]. Lancet Oncol, 2016, 17(7): 976-83. DOI:10.1016/S1470-2045(16)30053-5 |
 2020, Vol. 35
2020, Vol. 35


