文章信息
- 中华医学会肿瘤学分会胃癌学组, 中国医师协会结直肠肿瘤专业委员会, 中国抗癌协会大肠癌专业委员会, 中国抗癌协会胃癌专业委员会, 中国抗癌协会消化道息肉及癌前病变专业委员会
- Gastric Cancer Group, Oncology Branch, Chinese Medical Association, Colorectal Cancer Professional Committee, Chinese Medical Doctor Association, Colorectal Cancer Professional Committee, China Anti-Cancer Association, Gastric Cancer Professional Committee, China Anti-Cancer Association, Digestive Tract Polyp and Precancerous Lesion Professional Committee, China Anti-Cancer Association
- 循环肿瘤细胞检测在胃肠道肿瘤诊疗中的应用中国专家共识(2023版)
- Chinese expert consensus on application of circulating tumor cell detection in diagnosis and treatment of gastrointestinal neoplasms (2023 edition)
- 实用肿瘤杂志, 2023, 38(6): 497-504
- Journal of Practical Oncology, 2023, 38(6): 497-504
基金项目
- 国家高新技术研究发展计划(863计划)课题(2012AA02A506,2012AA02A502);国家自然科学基金面上项目(81572874,81872376,82173330);国家自然科学基金青年基金(81702411,82103463)
-
文章历史
- 收稿日期:2023-10-08
胃肠道恶性肿瘤是最常见的恶性肿瘤之一。我国胃癌的发病率和死亡率均居恶性肿瘤第3位;结直肠癌发病率居第2位,死亡率居第5位[1]。复发和转移是导致患者死亡的首要原因,接受根治性手术的胃肠道恶性肿瘤患者仍有5%~55%的概率在5年内出现复发转移[2-4]。因此,如何有效监测疾病进展并准确判断预后是胃肠道恶性肿瘤诊治的难点。
循环肿瘤细胞(circulating tumor cell,CTC)作为液体活检的主要代表,早在1869年就已被发现存在于肿瘤患者的血液中,是肿瘤转移的重要原因[5-6]。CTC作为实体肿瘤脱落进入血液的游离癌细胞,携带有肿瘤细胞完整的基因组信息,更具有完整的肿瘤细胞形态及细胞膜标志。与传统组织学活检比较,CTC具有创伤小和可重复检测等优势,可提供关于胃肠道恶性肿瘤患者疾病状态的实时信息。2019年,中国研究型医院学会微创外科学专业委员会发表了《循环肿瘤细胞检测在结直肠癌中的应用专家共识(2018)》[7];2022年,《中华医学会胃癌临床诊疗指南(2021版)》首次将CTC纳入胃癌检查推荐[8]。这表明,业内专家对CTC的临床价值的认可度越来越高。为了使CTC在胃肠道肿瘤的诊疗中规范使用,中华医学会肿瘤学分会胃癌学组、中国医师协会结直肠肿瘤专业委员会、中国抗癌协会大肠癌专业委员会、中国抗癌协会胃癌专业委员会和中国抗癌协会消化道息肉及癌前病变专业委员会共同发起并召集国内部分专家,讨论制定了《循环肿瘤细胞检测在胃肠道肿瘤诊疗中的应用中国专家共识(2023版)》,围绕CTC检测在胃肠道肿瘤诊疗中的检测技术和临床应用(包括预后判断、复发转移监测、疗效监测和辅助诊断)撰写了共识意见,以期为临床应用提供指导。
本共识依据循证医学证据质量和推荐强度,按照推荐意见分级的评估、制定及评价(Grade of Recommendations Assessment,Development and Evaluation,GRADE)对证据强度和推荐强度进行分级[9]。证据强度等级(简称证据等级)分为高级证据(A)、中级证据(B)、低级证据(C)和极低级证据(D)4级,推荐强度等级(简称推荐级别)分为强推荐和弱推荐(表 1)[9]。
| 分级 | 具体描述 |
| 证据强度等级 | |
| 高级证据(A) | 非常确信真实的效应值接近效应估计值 |
| 中级证据(B) | 对效应估计值有中等程度的信心:真实值有可能接近估计值,但仍存在两者大不相同的可能性 |
| 低级证据(C) | 对效应估计值的确信程度有限:真实值可能与估计值大不相同 |
| 极低级证据(D) | 对效应估计值几乎没有信心:真实值很可能与估计值大不相同 |
| 推荐强度等级 | |
| 强推荐 | 明确显示干预措施利大于弊或者弊大于利 |
| 弱推荐 | 利弊不确定,或无论质量高低的证据均显示利弊相当 |
| 注 GRADE:推荐意见分级的评估、制定及评价(Grade of Recommendations Assessment,Development and Evaluation) | |
推荐意见1:CTC可作为MRD的检测指标对肿瘤残留微病灶进行监测。CTC和循环肿瘤DNA(circulating tumor DNA,ctDNA)联合检测可有效提高MRD检测敏感度。(证据等级:B,推荐级别:强)
MRD是指肿瘤经过治疗之后,传统影像学或实验室检测不能发现,但可通过液体活检手段发现的肿瘤微小残留,能更早地提示肿瘤持续存在和疾病进展。MRD检测对象包括CTC和ctDNA等。其临床应用逐步从血液肿瘤延伸至实体肿瘤范畴,目前在乳腺癌和肺癌中的临床应用已达成部分共识。MRD检测可提示早期非小细胞肺癌术后复发风险高低,且有助于晚期肺癌的预后判断[10];早期乳腺癌CTC计数≥1个/7.5 mL血液即代表有MRD的存在或提示较差的预后[11]。在实际临床应用中,基于少量CTC和ctDNA检测可在各种恶性肿瘤中进行MRD监测,两者联合检测可有效提升MRD检测敏感度[12]。
2 CTC检测技术推荐意见2:CTC检测技术主要包括依赖特定标志物的生物学特性分离和不依赖于特定标志物的物理特性分离两大类。不同的分离富集技术各有优缺点。实验室应综合考虑技术特点和下游应用目的,选择合适的方法并建立完善的质量管理体系。(证据等级:B,推荐级别:强)
CTC在血液中有多种存在形式,包括不同的分子分型[上皮型CTC(epithelial CTC,E-CTC)、间质型CTC(mesenchymal CTC,M-CTC)和混合型CTC]和细胞分型[单个CTC、循环肿瘤微栓(circulating tumor microemboli,CTM)和中性粒细胞CTM(CTC-neutrophil clusters)]。CTC的稀有性和高度异质性是CTC分离富集需要克服的技术难题[13]。CTC与血液中其他细胞在物理特性、免疫学特性和基因表达等方面有显著差异。这些构成CTC分离富集的理论基础[14]。
2.1 物理学捕获方法[15]物理学捕获方法利用CTC和正常血液细胞在大小、形态和流体力学等物理学方面的差异进行CTC分离,根据肿瘤细胞特有的核型特征进行CTC鉴定。其优势是能保证CTC形态完好,可以兼容下游各种细胞分析和鉴定技术。其中ISET系统和CTC-BIOPSY系统是纳米微孔膜滤过装置,根据细胞大小的差异通过滤孔分离CTC[16]。ClearCell® FX系统和Parsortix系统采用微流控技术,结合细胞大小及其形变能力对CTC进行分离和富集。OncoQuick系统利用CTC与白细胞的密度差异进行分离,密度梯度离心后白细胞经过多孔滤膜去除,CTC被富集于介质层中可洗脱获得。
2.2 免疫学捕获方法大部分CTC表达细胞角蛋白(cytokeratin,CK)和上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)等上皮细胞标志物,因此可通过这些特异标志物进行免疫识别,在此核心原理的基础上结合纳米、微流和磁珠等技术,实现CTC的阳性或阴性分离。CellSearch系统和CTC-Chip分别利用磁珠法和微流控芯片进行阳性分离,表面标志均为EpCAM。两种方法捕获的CTC纯度较高,但是会遗漏部分上皮间质转化或EpCAM缺失表达亚型。阴性分离通常是直接靶向白细胞表面的特异性抗原(如CD45),优先去除血液中的白细胞从而实现CTC的富集;这类方法操作步骤较多,富集的CTC纯度偏低[17]。
3 CTC的临床应用 3.1 肿瘤预后的判断推荐意见3:CTC状态与临床因素如肿瘤浸润和肿瘤TNM分期等具有相关性。胃肠道肿瘤患者中CTC阳性者较CTC阴性者预后更差,其中单个CTC、CTM和中性粒细胞CTM的存在分别代表依次递增的风险级别。CTC检测有助于临床判断预后和制定进一步的治疗策略。(证据等级:A,推荐级别:强)
3.1.1 胃癌CTC和CTM作为预测肿瘤预后的潜在生物标志物,与胃癌患者的疾病进展和预后显著相关。CTC和CTM是胃癌患者无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)的独立预测因子[18-19]。CTC阳性与胃癌患者无瘤生存期(disease-free survival,DFS)也显著相关;CTC阳性患者的疾病控制率(disease control rate,DCR)更低[20]。中性粒细胞CTM较单纯CTC具有更差的预后[21]。
3.1.2 结直肠癌结直肠癌CTC阳性与淋巴或静脉浸润、肿瘤浸润深度、淋巴结转移和肿瘤TNM分期等因素相关[22-25]。结直肠癌患者基线和化疗期间CTC阳性患者PFS和OS均更短[23, 26-28]。CTC细胞分型和分子分型对结直肠癌患者预后具有预测作用。CTM阳性比单纯CTC阳性患者的OS率更低(P=0.022 8),检出M-CTC或CTM的患者比检出E-CTC的患者的中位PFS(6个月vs 11个月,P=0.031 4)和中位OS(11个月vs 20个月,P=0.014 7)更差[23]。
3.2 肿瘤复发转移的监测推荐意见4:接受根治性手术治疗的胃肠道肿瘤患者术前或术后CTC阳性较CTC阴性提示更高的复发转移风险,需对其进行密切随访管理,建议每3~6个月进行1次CTC检测。(证据等级:A,推荐级别:强)
3.2.1 胃癌复发和转移是胃癌患者死亡的主要原因,即使接受根治性切除术,仍有5%~39%的患者出现复发或转移[4, 29-30]。CTC与胃癌患者术后5年无复发生存(relapse-free survival,RFS)率相关(P=0.003 4);CTC≤5个/7.5 mL血液的患者较CTC > 5个/7.5 mL血液的患者具有更高的5年RFS率[31];CTC与多指标联合检测能更好地预测患者的术后复发状况[32]。
3.2.2 结直肠癌CTC检出率和CTC计数与结直肠癌进展和远处转移显著相关[24, 33]。与CTC阴性患者比较,术前和(或)术后CTC阳性的结直肠癌患者具有更差的RFS[22, 34]。CTC分子分型也与结直肠癌复发相关。术前和术后持续M-CTC阳性的患者较其他分子分型CTC动态变化的患者具有更差的RFS(P=0.025)[35]。
3.3 早期肿瘤的疗效监测推荐意见5:接受新辅助治疗和术后辅助治疗的胃肠道肿瘤患者可通过新辅助治疗和辅助治疗前后CTC的状态分析治疗效果。CTC水平明显降低提示疗效较好;反之提示疗效未达预期,应及时考虑调整治疗方案。CTC阳性提示更高的疾病进展风险,需对其进行密切随访管理,建议每2个治疗周期进行1次CTC检测。(证据等级:A,推荐级别:强)
3.3.1 胃癌多项研究证实新辅助治疗和辅助治疗在胃癌中的价值[36-37]。但由于肿瘤发展的复杂性和异质性,哪些患者可能受益于新辅助治疗、哪些患者接受手术治疗后更适合定期随访或予以辅助治疗及哪些患者可能受益于术后多模式治疗难以精准确定[38-39]。CTC研究进展显示,CTC对于新辅助治疗和辅助治疗具有较高的评估潜力[40-41]。胃癌术后接受辅助化疗6个周期治疗(XELOX方案:奥沙利铂+卡培他滨)后出现疾病进展的患者M-CTC数量增加,而对辅助治疗有反应的患者CTC计数减少和(或)M-CTC比例下降[42]。另一项局部晚期胃癌新辅助治疗的研究显示,DOF方案(多西他赛+奥沙利铂+5-氟尿嘧啶)联合贝伐珠单抗较单纯DOF方案能提高手术切除率和R0切除率(均P < 0.05),且经新辅助治疗后患者CTC计数降低(P=0.033 5)[43]。
3.3.2 结直肠癌临床和病理因素对于结直肠癌患者术前和术后治疗方案的选择非常重要,但并不能使所有患者由此决策。CTC可实时监测肿瘤治疗疗效,有助于临床医师制定更全面的治疗决策。Ⅲ期结直肠癌患者中术后辅助治疗后检测到CTC持续阳性的患者较CTC持续阴性的患者显示出更高的肿瘤复发率及更短的PFS和OS[44]。Ⅱ期结直肠癌患者中术前CTC≥4个/7.5 mL血液的患者获益于辅助治疗(P=0.006 4),而CTC < 4个/7.5 mL血液的患者未获益[34]。CTC计数与新辅助治疗反应之间存在相关性[45]。新辅助放疗后CTC计数减少可用于预测局部晚期直肠癌患者的病理完全缓解(pathological complete response,pCR)和临床完全缓解(clinical complete response,cCR),敏感度为60%,特异度为71.4%[46]。新辅助治疗期间CTC计数增加的直肠癌患者较CTC计数减少者中位DFS(9.11个月vs 33.85个月,P=0.000 25)和中位OS(35.57个月vs 47.74个月,P=0.003 6)更差[47]。
3.4 转移性肿瘤的疗效监测推荐意见6:转移性胃肠道肿瘤患者在接受放化疗、靶向治疗或免疫治疗等全身综合治疗过程中,监测CTC计数动态变化可及时提示肿瘤进展状态,有效评估治疗疗效。CTC计数增加说明治疗无效,需要变更治疗方案;若CTC计数明显降低,说明治疗有效。对患者动态监测CTC计数时,建议在治疗前可先行1次CTC检测,治疗1个周期后再次进行CTC检测。(证据等级:A,推荐级别:强)
3.4.1 胃癌胃癌异质性强,患者个体化差异等均会影响治疗疗效,对患者治疗反应进行即时评估非常必要。CTC和CTM的动态变化可即时监测肿瘤患者的治疗疗效,有助于快速识别无效治疗和不良预后。一项包含136例胃癌患者的前瞻性研究显示,患者化疗后CTC阳性组(CTC≥3个/7.5 mL血液)的客观缓解率(objective response rate,ORR;P=0.016)和DCR(P=0.013)均低于CTC阴性组(CTC < 3个/7.5 mL血液);治疗后CTC转阴患者PFS和OS改善,而CTC持续阳性或者治疗后CTC计数升高的患者PFS和OS较差[48]。Yue等[49]发现,程序性死亡受体配体-1(programmed death ligand-1,PD-L1)阳性CTC计数的减少可反映胃癌患者对程序性死亡受体-1(programmed death-1,PD-1)抑制剂的获益应答。
3.4.2 结直肠癌CTC可作为转移性结直肠癌的生物标志物,用于动态评估治疗反应,提示疾病进展和临床结局[50-51]。研究显示,转移性结直肠癌患者在化疗后CTC阳性患者的疾病进展率明显更高[26]。化疗后CTC计数增加 > 5.5个/7.5 mL血液提示患者中位PFS更差[51]。
3.5 肿瘤的辅助诊断推荐意见7:CTC联合影像学、病理学和血清肿瘤标志物检查可对胃肠道肿瘤患者进行更精准的辅助诊断。随访期间建议每6~12个月进行1次CTC检测,实时监测肿瘤进展风险。(证据等级:B,推荐级别:强)
3.5.1 胃癌病理评估有创,影像学存在滞后性,而CTC具有较高的肿瘤特异性,与多种临床因素相关,无创且适合多次检测,可作为肿瘤辅助诊断的补充。CTC计数与肿瘤浸润、淋巴结转移和肿瘤TNM分期等临床病理特征相关,且CTC计数与全身免疫炎性指数(systemic immune inflammatory index,SII)存在相关性[52-53];CTC和CTM阳性与肿瘤分化程度、血清癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原125(carbohydrate antigen 125,CA125)相关[18-19]。
3.5.2 结直肠癌与胃癌相似,结直肠癌CTC阳性也与临床病理特征(淋巴或静脉浸润、肿瘤浸润深度、淋巴结转移、TNM分期、血清CEA、淋巴计数和中性粒细胞与淋巴细胞计数比值等)相关[23-24, 44]。CTC计数与结直肠癌分期相关[25]。CTC的拷贝数变异(copy number variation,CNV)分析可能为早期诊断提供新的途径[54-55]。
附:CTC检测流程
1 样本采集
外周血采集需由专业医护人员进行。使用BDVacutainer K2 (EDTA)的6 mL抗凝真空采血管采集5 mL外周血,上下轻柔混匀8次,1 h内上机检测。若需远途运输,将其竖直保存于4~8℃环境,避免剧烈摇晃,上机前需置于室温复温20 min。
2 CTC分离
样本上机处理参照CTC-BIOPSY系统(武汉友芝友医疗科技股份有限公司)标准上机步骤,样本分离后可用于后续检测。
3 染色阅片
样本分离完成后用甲醇固定,然后进行瑞氏吉姆萨染液染色,接着将染色完成的样本进行封固。使用普通光学显微镜,通过细胞病理形态阅片来鉴定不同CTC细胞类型。
4 CTC鉴定
CTC鉴定的6条标准:(1)细胞核异型性,非中性粒细胞(杆状或分叶)形态,非单核细胞(马蹄形、肾形或卵圆形)形态;(2)核质比 > 0.8;(3)细胞直径 > 15 μm;(4)核深染且着色不均匀;(5)核膜增厚出现凹陷或皱褶,核膜呈锯齿状;(6)细胞核染色质边移、巨大核仁或异常分裂。符合≥4个以上评判标准,或满足评判标准(6)外加符合其他2个条件可判读为CTC。≥3个CTC形成的细胞团鉴定为CTM;≥3个CTC形成的细胞团中包含有中性粒细胞则鉴定为中性粒细胞CTM。临床报告结果包括CTC总计数和3种不同CTC细胞分型(单个CTC、CTM及中性粒细胞CTM,图 1)。
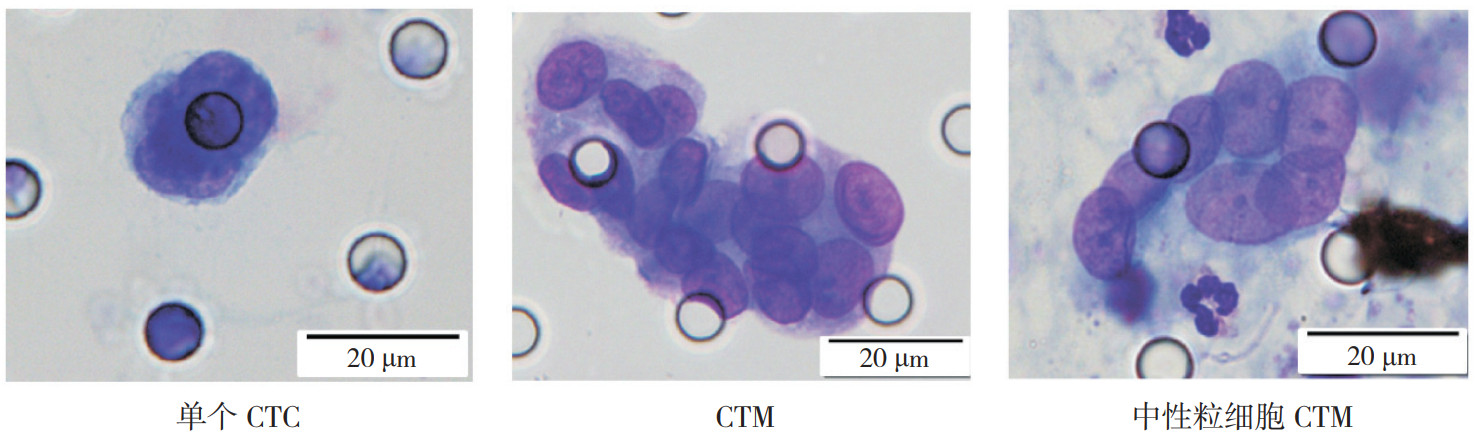
|
| 注 CTC:循环肿瘤细胞(circulating tumor cell);CTM:循环肿瘤微栓(circulating tumor microemboli) 图 1 CTC-BIOPSY系统检测循环肿瘤细胞的不同细胞分型(Wright-Giemsa×100) Fig.1 Different cell types of circulating tumor cells detected by CTC-BIOPSY system (Wright-Giemsa×100) |
编审委员会成员名单
编写组长(按贡献大小排序) 熊斌、王锡山、王振宁、王贵英、梁寒、张涛
执笔(按姓名汉语拼音字母排序) 王舒艺、熊斌、杨朝纲
编审委员会成员(按姓名汉语拼音字母排序) 卜建红(中华胃肠外科杂志社)、邓云特(湖北省肿瘤医院)、方文峰(中山大学附属肿瘤医院)、韩方海(中山大学孙逸仙纪念医院)、计勇(中山大学附属佛山医院)、江波(山西省肿瘤医院)、赖仁胜(江苏省中医院)、李一荣(武汉大学中南医院)、梁寒(天津医科大学肿瘤医院)、孟斌(天津医科大学肿瘤医院)、施海(西安大兴医院)、陶凯雄(华中科技大学同济医学院附属协和医院)、田素芳(武汉大学中南医院)、王贵英(河北医科大学第二医院)、王舒艺(武汉大学中南医院)、王锡山(中国医学科学院肿瘤医院)、王振宁(中国医科大学附属第一医院)、王征(北京医院)、武爱文(北京大学肿瘤医院)、熊斌(武汉大学中南医院)、徐烨(复旦大学附属肿瘤医院)、徐智高(武汉大学中南医院)、杨朝纲(武汉大学中南医院)、印明柱(重庆大学附属三峡医院)、余佩武(陆军军医大学西南医院)、袁瑛(浙江大学医学院附属第二医院)、张成武(青海大学附属医院)、张涛(华中科技大学同济医学院附属协和医院)、周福祥(武汉大学中南医院)、庄競(河南省肿瘤医院)
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Osterman E, Hammarström K, Imam I, et al. Recurrence risk after radical colorectal cancer surgery-less than before, but how high is it?[J]. Cancers, 2020, 12(11): 3308. DOI:10.3390/cancers12113308 |
| [3] |
Furuke H, Arita T, Kuriu Y, et al. The survival after recurrence of colorectal cancer: a retrospective study focused on time to recurrence after curative resection[J]. Surg Today, 2022, 52(2): 239-250. DOI:10.1007/s00595-021-02336-z |
| [4] |
Yago A, Haruta S, Ueno M, et al. Correction to: Adequate period of surveillance in each stage for curatively resected gastric cancer: analyzing the time and rates of recurrence[J]. Gastric Cancer, 2021, 24(3): 762-763. DOI:10.1007/s10120-021-01166-9 |
| [5] |
Castro-Giner F, Aceto N. Tracking cancer progression: from circulating tumor cells to metastasis[J]. Genome Med, 2020, 12(1): 31. DOI:10.1186/s13073-020-00728-3 |
| [6] |
Kim MY, Oskarsson T, Acharyya S, et al. Tumor self-seeding by circulating cancer cells[J]. Cell, 2009, 139(7): 1315-1326. DOI:10.1016/j.cell.2009.11.025 |
| [7] |
中国研究型医院学会微创外科学专业委员会, 《腹腔镜外科杂志》. 循环肿瘤细胞检测在结直肠癌中的应用专家共识(2018)[J]. 腹腔镜外科杂志, 2019, 24(1): 74-80. DOI:10.13499/j.cnki.fqjwkzz.2019.01.074 |
| [8] |
中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会胃癌临床诊疗指南(2021版)[J]. 中华医学杂志, 2022, 102(16): 1169-1189. |
| [9] |
Balshem H, Helfand M, Schünemann HJ, et al. GRADE guidelines: 3. Rating the quality of evidence[J]. J Clin Epidemiol, 2011, 64(4): 401-406. DOI:10.1016/j.jclinepi.2010.07.015 |
| [10] |
吴一龙, 陆舜, 程颖, 等. 非小细胞肺癌分子残留病灶专家共识[J]. 循证医学, 2021, 21(3): 129-135. |
| [11] |
中国抗癌协会肿瘤标志专业委员会乳腺癌标志物协作组. 基于靶标指导乳腺癌精准治疗标志物临床应用专家共识(2022版)[J]. 中国癌症防治杂志, 2022, 14(4): 346-362. |
| [12] |
Zhao LN, Jiang LP, Liu YH, et al. Integrated analysis of circulating tumour cells and circulating tumour DNA to detect minimal residual disease in hepatocellular carcinoma[J]. Clin Transl Med, 2022, 12(4): e793. DOI:10.1002/ctm2.793 |
| [13] |
中华医学会检验医学分会分子诊断学组. 循环肿瘤细胞临床应用与实验室检测专家共识[J]. 中华检验医学杂志, 2021, 44(11): 1008-1020. DOI:10.3760/cma.j.cn114452-20210721-00445 |
| [14] |
Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions[J]. Cancer Lett, 2007, 253(2): 180-204. DOI:10.1016/j.canlet.2006.12.014 |
| [15] |
Yang CG, Chen FF, Wang SY, et al. Circulating tumor cells in gastrointestinal cancers: current status and future perspectives[J]. Front Oncol, 2019, 9: 1427. DOI:10.3389/fonc.2019.01427 |
| [16] |
Hong B, Zu Y. Detecting circulating tumor cells: current challenges and new trends[J]. Theranostics, 2013, 3(6): 377-394. DOI:10.7150/thno.5195 |
| [17] |
Bankó P, Lee SY, Nagygyörgy V, et al. Technologies for circulating tumor cell separation from whole blood[J]. J Hematol Oncol, 2019, 12(1): 48. DOI:10.1186/s13045-019-0735-4 |
| [18] |
Ning DW, Cui K, Liu M, et al. Comparison of CellSearch and circulating tumor cells (CTC)-biopsy systems in detecting peripheral blood circulating tumor cells in patients with gastric cancer[J]. Med Sci Monit, 2021, 27: e926565. |
| [19] |
Zheng XM, Fan L, Zhou PF, et al. Detection of circulating tumor cells and circulating tumor microemboli in gastric cancer[J]. Transl Oncol, 2017, 10(3): 431-441. DOI:10.1016/j.tranon.2017.02.007 |
| [20] |
Li YD, Wu GL, Yang WL, et al. Circulating tumour cells (CTCs) as potential biomarkers of clinicopathological and prognostic significance in gastric cancer patients: a systematic review and meta-analysis[DB/OL]. (2020-08-07)[2023-09-07]. https://www.researchsquare.com/article/rs-50130/v1
|
| [21] |
Szczerba BM, Castro-Giner F, Vetter M, et al. Neutrophils escort circulating tumour cells to enable cell cycle progression[J]. Nature, 2019, 566(7745): 553-557. DOI:10.1038/s41586-019-0915-y |
| [22] |
Yang CG, Shi DD, Wang SY, et al. Prognostic value of pre- and post-operative circulating tumor cells detection in colorectal cancer patients treated with curative resection: a prospective cohort study based on ISET device[J]. Cancer Manag Res, 2018, 10: 4135-4144. DOI:10.2147/CMAR.S176575 |
| [23] |
Zhang DJ, Zhao L, Zhou PF, et al. Circulating tumor microemboli (CTM) and vimentin+ circulating tumor cells (CTCs) detected by a size-based platform predict worse prognosis in advanced colorectal cancer patients during chemotherapy[J]. Cancer Cell Int, 2017, 17: 6. DOI:10.1186/s12935-016-0373-7 |
| [24] |
Chen FF, Wang SY, Fang YA, et al. Feasibility of a novel one-stop ISET device to capture CTCs and its clinical application[J]. Oncotarget, 2017, 8(2): 3029-3041. DOI:10.18632/oncotarget.13823 |
| [25] |
Tsai WS, You JF, Hung HY, et al. Novel circulating tumor cell assay for detection of colorectal adenomas and cancer[J]. Clin Transl Gastroenterol, 2019, 10(10): e00088. DOI:10.14309/ctg.0000000000000088 |
| [26] |
Cohen SJ, Punt CJ, Iannotti N, et al. Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer[J]. J Clin Oncol, 2008, 26(19): 3213-3221. DOI:10.1200/JCO.2007.15.8923 |
| [27] |
Tol J, Koopman M, Miller MC, et al. Circulating tumour cells early predict progression-free and overall survival in advanced colorectal cancer patients treated with chemotherapy and targeted agents[J]. Ann Oncol, 2010, 21(5): 1006-1012. DOI:10.1093/annonc/mdp463 |
| [28] |
Groot Koerkamp B, Rahbari NN, Büchler MW, et al. Circulating tumor cells and prognosis of patients with resectable colorectal liver metastases or widespread metastatic colorectal cancer: a meta-analysis[J]. Ann Surg Oncol, 2013, 20(7): 2156-2165. DOI:10.1245/s10434-013-2907-8 |
| [29] |
Shin CH, Lee WY, Hong SW, et al. Characteristics of gastric cancer recurrence five or more years after curative gastrectomy[J]. Chin J Cancer Res, 2016, 28(5): 503-510. DOI:10.21147/j.issn.1000-9604.2016.05.05 |
| [30] |
Xu J, Shen L, Shui YJ, et al. Patterns of recurrence after curative D2 resection for gastric cancer: implications for postoperative radiotherapy[J]. Cancer Med, 2020, 9(13): 4724-4735. DOI:10.1002/cam4.3085 |
| [31] |
Ito H, Sato J, Tsujino Y, et al. Long-term prognostic impact of circulating tumour cells in gastric cancer patients[J]. World J Gastroenterol, 2016, 22(46): 10232-10241. DOI:10.3748/wjg.v22.i46.10232 |
| [32] |
Zhang GL, Fang XC, Liu CL, et al. Circulating tumor cell count and serum CEA mRNA level predict postoperative recurrence of digestive tract cancer[J]. Am J Transl Res, 2021, 13(8): 9514-9521. |
| [33] |
Tsai WS, Chen JS, Shao HJ, et al. Circulating tumor cell count correlates with colorectal neoplasm progression and is a prognostic marker for distant metastasis in non-metastatic patients[J]. Sci Rep, 2016, 6: 24517. DOI:10.1038/srep24517 |
| [34] |
Chen LL, Zhou WP, Ye ZY, et al. Predictive value of circulating tumor cells based on subtraction enrichment for recurrence risk in stage Ⅱ colorectal cancer[J]. ACS Appl Mater Interfaces, 2022, 14(31): 35389-35399. DOI:10.1021/acsami.2c08560 |
| [35] |
Shi DD, Yang CG, Han S, et al. Dynamic evaluation of mesenchymal circulating tumor cells in patients with colorectal cancer: clinical associations and prognostic value[J]. Oncol Rep, 2020, 44(2): 757-767. DOI:10.3892/or.2020.7629 |
| [36] |
Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial[J]. Lancet, 2012, 379(9813): 315-321. DOI:10.1016/S0140-6736(11)61873-4 |
| [37] |
Coccolini F, Nardi M, Montori G, et al. Neoadjuvant chemotherapy in advanced gastric and esophago-gastric cancer. Meta-analysis of randomized trials[J]. Int J Surg, 2018, 51: 120-127. DOI:10.1016/j.ijsu.2018.01.008 |
| [38] |
Smyth EC, Nilsson M, Grabsch HI, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648. DOI:10.1016/S0140-6736(20)31288-5 |
| [39] |
Fong C, Johnston E, Starling N. Neoadjuvant and adjuvant therapy approaches to gastric cancer[J]. Curr Treat Options Oncol, 2022, 23(9): 1247-1268. DOI:10.1007/s11864-022-01004-9 |
| [40] |
Matikas A, Kotsakis A, Apostolaki S, et al. Detection of circulating tumour cells before and following adjuvant chemotherapy and long-term prognosis of early breast cancer[J]. Br J Cancer, 2022, 126(11): 1563-1569. DOI:10.1038/s41416-022-01699-5 |
| [41] |
Chong MH, Zhao Y, Wang J, et al. The dynamic change of circulating tumour cells in patients with operable breast cancer before and after chemotherapy based on a multimarker QPCR platform[J]. Br J Cancer, 2012, 106(10): 1605-1610. DOI:10.1038/bjc.2012.157 |
| [42] |
Li TT, Liu H, Li FP, et al. Evaluation of epithelial-mesenchymal transitioned circulating tumor cells in patients with resectable gastric cancer: relevance to therapy response[J]. World J Gastroenterol, 2015, 21(47): 13259-13267. DOI:10.3748/wjg.v21.i47.13259 |
| [43] |
Ma JX, Yao S, Li XS, et al. Neoadjuvant therapy of DOF regimen plus bevacizumab can increase surgical resection ratein locally advanced gastric cancer[J]. Medicine, 2015, 94(42): e1489. DOI:10.1097/MD.0000000000001489 |
| [44] |
Lu CY, Tsai HL, Uen YH, et al. Circulating tumor cells as a surrogate marker for determining clinical outcome to mFOLFOX chemotherapy in patients with stage Ⅲ colon cancer[J]. Br J Cancer, 2013, 108(4): 791-797. DOI:10.1038/bjc.2012.595 |
| [45] |
Sun WJ, Li GC, Wan JF, et al. Circulating tumor cells: a promising marker of predicting tumor response in rectal cancer patients receiving neoadjuvant chemo-radiation therapy[J]. Oncotarget, 2016, 7(43): 69507-69517. DOI:10.18632/oncotarget.10875 |
| [46] |
Liu WY, Zhang W, Tang Y, et al. Metastasis risk stratification and response prediction through dynamic viable circulating tumor cell counts for rectal cancer in a neoadjuvant setting[J]. Cancer Med, 2023, 12(10): 11438-11450. DOI:10.1002/cam4.5860 |
| [47] |
Silva VSE, Abdallah EA, Flores BCT, et al. Molecular and dynamic evaluation of proteins related to resistance to neoadjuvant treatment with chemoradiotherapy in circulating tumor cells of patients with locally advanced rectal cancer[J]. Cells, 2021, 10(6): 1539. DOI:10.3390/cells10061539 |
| [48] |
Li YL, Gong JF, Zhang QY, et al. Dynamic monitoring of circulating tumour cells to evaluate therapeutic efficacy in advanced gastric cancer[J]. Br J Cancer, 2016, 114(2): 138-145. DOI:10.1038/bjc.2015.417 |
| [49] |
Yue C, Jiang Y, Li P, et al. Dynamic change of PD-L1 expression on circulating tumor cells in advanced solid tumor patients undergoing PD-1 blockade therapy[J]. Oncoimmunology, 2018, 7(7): e1438111. DOI:10.1080/2162402X.2018.1438111 |
| [50] |
Netterberg I, Karlsson MO, Terstappen LWMM, et al. Comparing circulating tumor cell counts with dynamic tumor size changes as predictor of overall survival: a quantitative modeling framework[J]. Clin Cancer Res, 2020, 26(18): 4892-4900. DOI:10.1158/1078-0432.CCR-19-2570 |
| [51] |
Silva VSE, Abdallah EA, Brito ABC, et al. Baseline and kinetic circulating tumor cell counts are prognostic factors in a prospective study of metastatic colorectal cancer[J]. Diagnostics, 2021, 11(3): 502. DOI:10.3390/diagnostics11030502 |
| [52] |
Zheng L, Zou K, Yang C, et al. Inflammation-based indexes and clinicopathologic features are strong predictive values of preoperative circulating tumor cell detection in gastric cancer patients[J]. Clin Transl Oncol, 2017, 19(9): 1125-1132. DOI:10.1007/s12094-017-1649-7 |
| [53] |
Yang C, Zhang N, Wang S, et al. Wedge-shaped microfluidic chip for circulating tumor cells isolation and its clinical significance in gastric cancer[J]. J Transl Med, 2018, 16(1): 139. DOI:10.1186/s12967-018-1521-8 |
| [54] |
Gao Y, Ni XH, Guo HA, et al. Single-cell sequencing deciphers a convergent evolution of copy number alterations from primary to circulating tumor cells[J]. Genome Res, 2017, 27(8): 1312-1322. DOI:10.1101/gr.216788.116 |
| [55] |
Ni XH, Zhuo ML, Su Z, et al. Reproducible copy number variation patterns among single circulating tumor cells of lung cancer patients[J]. Proc Natl Acad Sci U S A, 2013, 110(52): 21083-21088. DOI:10.1073/pnas.1320659110 |
 2023, Vol. 38
2023, Vol. 38
