文章信息
- 林跃玮, 刘文渤, 胡志锋, 梁超伦, 高明, 黄永明, 陈耿鑫
- Lin Yuewei, Liu Wenbo, Hu Zhifeng, Liang Chaolun, Gao Ming, Huang Yongming, Chen Gengxin
- 基于SEER数据库使用支持向量机和列线图对骨肉瘤诊断时肺转移风险预测模型的建立与验证
- Development and validation of a predictive model of pulmonary metastasis risk in diagnosis of osteosarcoma by support vector machine and nomogram based on SEER database
- 实用肿瘤杂志, 2023, 38(3): 251-257
- Journal of Practical Oncology, 2023, 38(3): 251-257
基金项目
- 广东省自然科学基金面上项目(2018A030313643)
-
通信作者
- 陈耿鑫, E-mail: 389207217@qq.com
-
文章历史
- 收稿日期:2021-08-05
2. 广州中医药大学第二附属医院骨伤科,广东 广州 510006
2. Department of Orthopaedics, the Second Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou 510006, China
骨肉瘤是骨中最常见的恶性肿瘤之一,多见于儿童和青壮年[1]。尽管骨肉瘤的治疗方式有了进步,如手术切除原发肿瘤和辅助化疗应用,但出现转移的患者预后仍然不容乐观[2]。有研究显示,有12%~30%的骨肉瘤患者在就诊时有可检测到的肺转移[3-5]。出现转移的骨肉瘤患者5年总生存率约为30%,而复发的骨肉瘤患者则下降至15%,极大地影响了患者的预后[6]。目前骨肉瘤主要治疗方式为手术切除,肺转移会极大地增加手术切除难度,同时,放化疗对骨肉瘤的治疗效果极为有限[7]。因此,能预测和筛查出高风险肺转移的骨肉瘤患者,对于其预防和治疗有深远意义。
多项研究已经报道,年龄、肿瘤部位和肿瘤大小会增加骨肉瘤转移的风险并且恶化生存结果[8-10]。目前,关注骨肉瘤肺转移的相关研究主要是关注基因表达和信号通路的研究[5, 11-12]。但是,到目前还没有基于人口学和临床数据的相关研究分析预测骨肉瘤的肺转移的风险。对于基因和信号通路等因素,在临床工作中获取是有点难度的。因此,基于临床和人口学数据等临床容易获得的资源分析骨肉瘤肺转移的危险因素并开发容易使用的模型对特定患者的肺转移风险进行预测是非常有价值的。
骨肉瘤发病率较低,单中心的研究是十分困难的[13]。美国国家癌症研究所“监测, 流行病学和结果”(Surveillance,Epidemiology and End Results,SEER)数据库是人群癌症发病率和生存率信息的综合性数据库,包含约27.8%的美国人口。SEER数据库已被广泛用作分析罕见癌症的有效工具[14-16]。本研究利用SEER数据库2010年以来的有关转移性肿瘤特定部位的相关数据,收集骨肉瘤人口统计学和临床特征的相关信息,以调查在骨肉瘤肺转移危险因素,并建立模型预测患者出现肺转移的风险。
准确预测骨肉瘤肺转移风险具有挑战性,因为这些相关因素和肿瘤肺转移之间存在复杂的联系。目前,列线图(nomogram)和支持向量机是应用最广泛的模型[16-17]。列线图是一种可靠的统计模型,可以综合多种危险因素,建立可视化的预测工具,提供个性化、循证和高度准确的风险评估[18-21]。支持向量机作为一种很有发展前景的机器学习技术,能够从观测数据中学习,设计复杂的模型来捕捉输入和输出变量之间的内在关系,并做出数据驱动的预测或决策,已经成功地应用于多种生物医学领域,并显示出良好的性能[22-23]。
本研究利用SEER数据库使用Logistic回归分析确定骨肉瘤肺转移的危险因素,进一步构建列线图和支持向量机对骨肉瘤的肺转移危险因素进行预测,并且比较列线图和支持向量机的预测能力,评估其在临床工作的应用价值。
1 资料与方法 1.1 数据来源和纳入标准使用SEER*Stat软件版本8.3.6。国际肿瘤分类学第3版形态代码(9180-9185)用于识别。纳入2010年至2016年病理诊断为原发性骨肉瘤的患者。排除标准:(1)没有阳性病理;(2)生存时间未知;(3)并非首例肿瘤;(4)有 > 1个的原发肿瘤;(5)有未知的肺转移信息。
从SEER数据库中提取数据,包括年龄、种族、性别、婚姻状况、原发部位、单发或多发肿瘤、肿瘤组织学分级、肿瘤直径、淋巴转移(N分期)和骨转移。婚姻状况分为已婚和未婚(包括单身、离婚、分居和丧偶)。原发部位分为四肢骨骼、中轴骨骼和其他。肿瘤组织学分级为Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级和未知。
1.2 统计学分析使用软件包IBM SPSS 22.0进行统计学分析。连续变量用均值±标准差(x±s)表示,分类变量用频数(百分比)表示。连续变量比较采用独立样本t检验,分类变量比较采用χ2检验。采用Logistic回归模型对骨肉瘤肺转移相关的因素进行单因素分析。对其中P < 0.05的因素进一步行多因素Logistic回归分析。通过受试者工作特征(receiver operating characteristic,ROC)曲线评估变量累积效应的预测准确性。以P < 0.05为差异具有统计学意义。
1.3 列线图根据Logistic回归结果,有统计学意义的危险因素纳入列线图。进一步使用10-Fold cross validation方法对结果列线图进行验证,计算平均曲线下面积(area under the curve,AUC)。列线图的开发和验证由R版本3.5.1(http://www.r-project.org/)制作。
1.4 支持向量机采用linear核函数。在纳入的1 038例患者中,随机选择830例患者(80.0%)进行培训,其余208例患者(20.0%)进行测试。利用训练数据集,采用递归特征消除法进行特征选择。输入特征可以记录为‘xlsx’或‘txt’格式,并上传到支持向量机模型中。将高级的和开源的编程语言Python2.7和高效的数据挖掘工具Scikit-Learn0.20.1用于机器学习编码。总体准确率指正确预测患者的比例。
1.5 模型能力评价通过绘制列线图最大AUC的ROC曲线和支持向量ROC曲线,计算ROC的AUC来评价列线图和支持向量机2个模型的性能。
2 结果 2.1 患者一般特征共纳入1 038例原发性骨肉瘤患者。其中,肺转移患者173例(16.7%),年龄8~87岁。无肺转移患者865例(83.3%),年龄5~83岁。无肺转移和肺转移的患者的年龄、种族、肿瘤组织学分级、左侧/右侧、肿瘤个数和婚姻状况比较,差异均无统计学意义(均P > 0.05,表 1)。肺转移的患者肿瘤直径更大,生存时间更短,男性患者占比更高(均P < 0.05)。肺转移患者的原发肿瘤部位为四肢骨骼和出现骨转移的比例也更高(均P < 0.05)。非肺转移患者在N分期中N1期占比更高(P < 0.05)。
| 临床特征 | 无肺转移(n=865) | 肺转移(n=173) | t/χ2值 | P值 |
| 年龄(岁,x±s) | 31.49±23.07 | 29.18±23.16 | 1.638 | 0.231 |
| 肿瘤直径(cm,x±s) | 9.6±6.5 | 12.1±6.5 | 11.009 | < 0.01 |
| 生存时间(月,x±s) | 30.2±22.8 | 17.4±17.0 | 13.642 | < 0.01 |
| 性别 | 9.474 | 0.023 | ||
| 男性 | 463(53.5) | 109(63.0) | ||
| 女性 | 402(46.5) | 64(30.0) | ||
| 种族 | 1.201 | 0.981 | ||
| 白种人 | 656(75.8) | 131(75.7) | ||
| 黑种人 | 121(14.0) | 25(14.5) | ||
| 其他 | 88(10.2) | 17(9.8) | ||
| 原发部位 | 8.992 | 0.038 | ||
| 四肢骨骼 | 584(67.5) | 132(76.3) | ||
| 中轴骨骼 | 214(24.7) | 26(15.0) | ||
| 其他 | 67(7.7) | 15(8.7) | ||
| 组织学分级 | 1.602 | 0.282 | ||
| Ⅰ级 | 21(2.4) | 1(0.6) | ||
| Ⅱ级 | 32(3.7) | 6(3.5) | ||
| Ⅲ级 | 216(25.0) | 52(30.1) | ||
| Ⅳ级 | 423(48.9) | 84(48.6) | ||
| 未知 | 173(20.0) | 30(17.3) | ||
| 左侧/右侧 | 5.343 | 0.083 | ||
| 左侧 | 397(45.9) | 79(45.7) | ||
| 右侧 | 366(42.3) | 83(18.5) | ||
| 未知 | 102(11.8) | 11(6.4) | ||
| N分期 | 25.694 | < 0.01 | ||
| N0 | 826(95.5) | 146(84.4) | ||
| N1 | 19(2.2) | 15(8.7) | ||
| NX | 20(2.3) | 12(6.9%) | ||
| 骨转移 | 20.238 | < 0.01 | ||
| 否 | 848(98.0) | 147(85.0) | ||
| 是 | 17(1.6) | 26(15.0) | ||
| 单发或多发肿瘤 | 2.542 | 0.177 | ||
| 单发 | 716(82.8) | 151(87.3) | ||
| 多发 | 149(17.2) | 22(12.7) | ||
| 婚姻状况 | 1.344 | 0.703 | ||
| 未婚 | 224(25.9) | 42(24.3) | ||
| 已婚 | 641(74.1) | 131(75.7) |
对1 038例患者作单因素和多因素Logistic回归分析。单因素分析显示,性别、肿瘤直径、原发部位、骨转移和淋巴转移是影响肺转移的预后因素(均P < 0.05)。进一步行多因素Logistic分析显示这5个因素均为肺转移独立预后因素(均P < 0.05,表 2)。
| 变量 | 单因素分析 | 多因素分析 | |||
| OR(95% CI) | P值 | OR(95% CI) | P值 | ||
| 年龄 | 0.996 (0.988~1.003) |
0.231 | / | / | |
| 肿瘤直径 | 1.049 (1.024~1.075) |
< 0.01 | 1.037 (1.011~1.063) |
< 0.01 | |
| 性别 | |||||
| 男性 | 对照组 | 对照组 | |||
| 女性 | 0.676 (0.483~0.947) |
< 0.05 | 0.664 (0.464~0.951) |
< 0.05 | |
| 种族 | |||||
| 白种人 | 对照组 | / | / | ||
| 黑种人 | 1.035 (0.647~1.655) |
0.887 | / | / | |
| 其他 | 0.967 (0.557~1.680) |
0.906 | / | / | |
| 原发部位 | |||||
| 四肢骨骼 | 对照组 | 对照组 | |||
| 中轴骨骼 | 0.538 (0.343~0.842) |
< 0.01 | 0.433 (0.260~0.723) |
< 0.01 | |
| 其他 | 0.991 (0.549~1.788) |
0.975 | 0.886 (0.466-1.685) |
0.886 | |
| 组织学分级 | |||||
| Ⅰ级 | 对照组 | / | / | ||
| Ⅱ级 | 3.937 (0.442~35.091) |
0.219 | / | / | |
| Ⅲ级 | 5.059 (0.668~38.447) |
0.117 | / | / | |
| Ⅳ级 | 4.170 (0.553~31.427) |
0.166 | / | / | |
| 未知 | 3.642 (0.472~28.096) |
0.215 | / | / | |
| 左侧/右侧 | |||||
| 左侧 | 对照组 | / | / | ||
| 右侧 | 1.140 (0.812~1.600) |
0.450 | / | / | |
| 未知 | 0.542 (0.278~1.056) |
0.072 | / | / | |
| N分期 | |||||
| N0 | 对照组 | 对照组 | |||
| N1 | 4.466 (2.219~8.989) |
< 0.01 | 4.265 (1.954~9.306) |
< 0.01 | |
| NX | 3.395 (1.624~7.093) |
< 0.01 | 3.480 (1.596~7.587) |
< 0.01 | |
| 骨转移 | |||||
| 否 | 对照组 | 对照组 | |||
| 是 | 8.823 (4.671~16.664) |
< 0.01 | 9.868 (4.915~19.810) |
< 0.01 | |
| 单发或多发肿瘤 | |||||
| 单发 | 对照组 | / | / | ||
| 多发 | 0.700 (0.433~1.132) |
0.146 | / | / | |
| 婚姻状况 | |||||
| 未婚 | 对照组 | / | / | ||
| 已婚 | 1.090 (0.746~1.593) |
0.656 | / | / | |
列线图是通过合并Logistic回归结果来构建的(图 1)。通过总结每个预测因子的特异点,然后测量肺转移的总分,可以计算出患者肺转移的风险概率。10-fold cross的最大AUC值为0.769,平均AUC值为0.695。
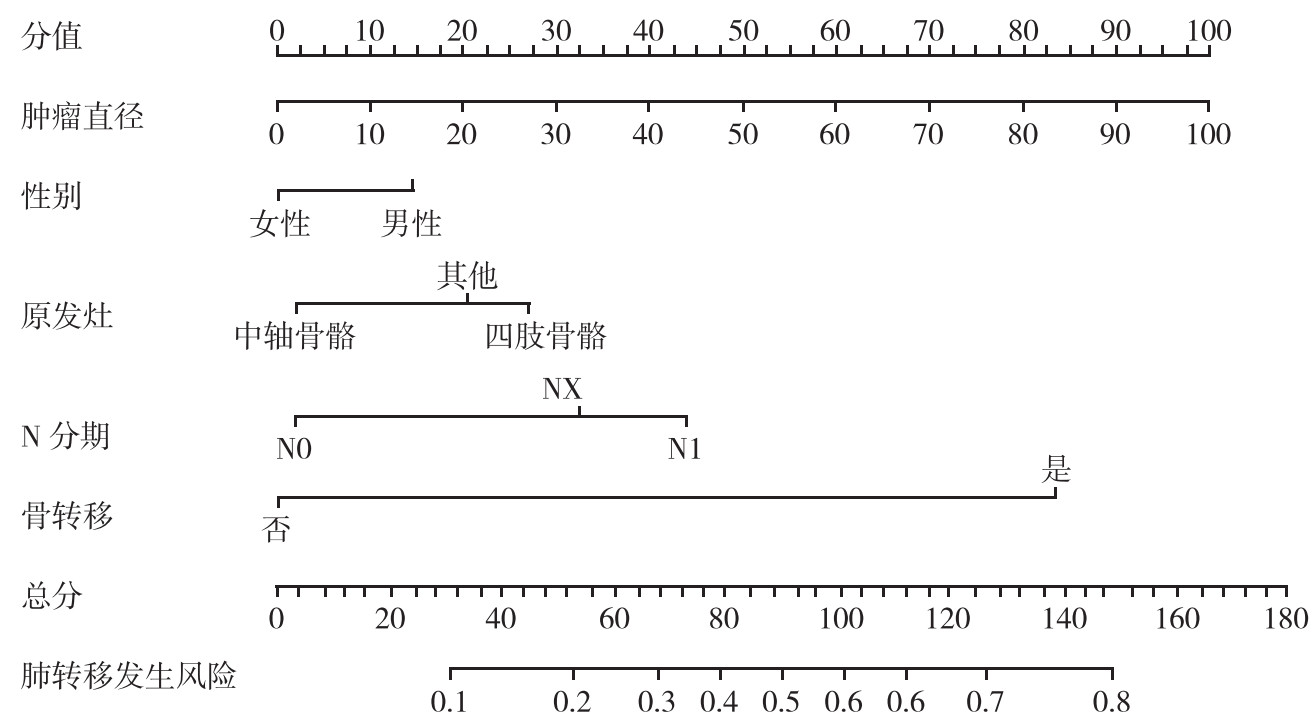
|
| 图 1 列线图预测骨肉瘤肺转移的风险 Fig.1 Nomogram predicting risks for pulmonary metastasis in patients with osteosarcoma |
ROC曲线分析使用支持向量机模型对骨肉瘤出现肺转移的预测结果显示,AUC为0.792,准确率为0.861(图 2)。
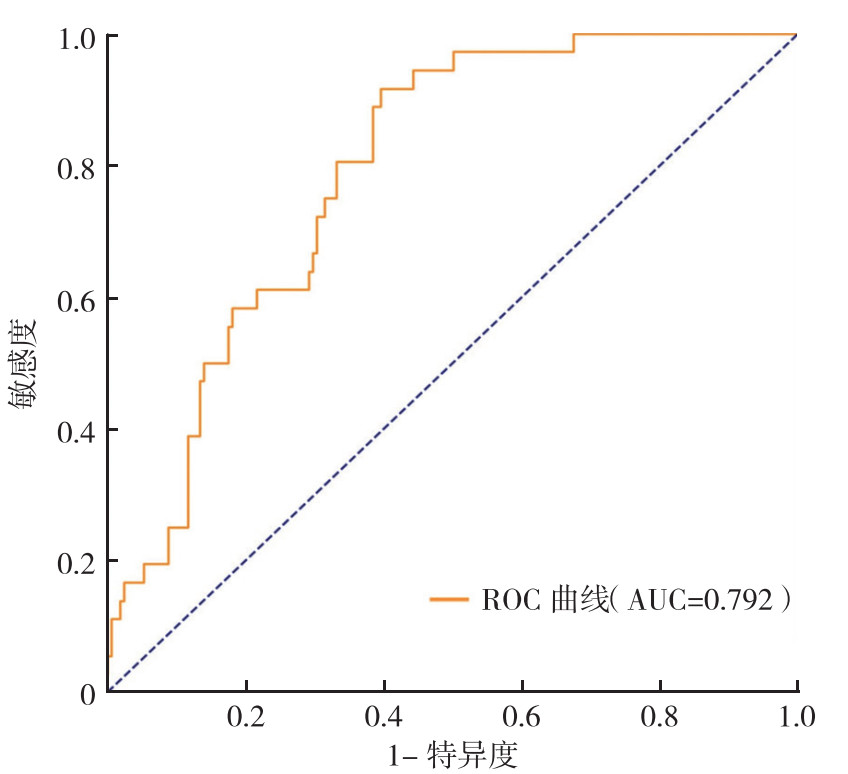
|
| 图 2 支持向量机模型预测骨肉瘤肺转移的ROC曲线 Fig.2 ROC curve for predicting pulmonary metastasis of osteosarcoma using support vector machine model |
绘制列线图的10-fold cross validation的最大AUC值的ROC曲线显示,AUC值最高为0.769(图 3)。列线图和支持向量机模型的AUC值比较显示,支持向量机模型有更好的预测能力(0.792 > 0.769)。
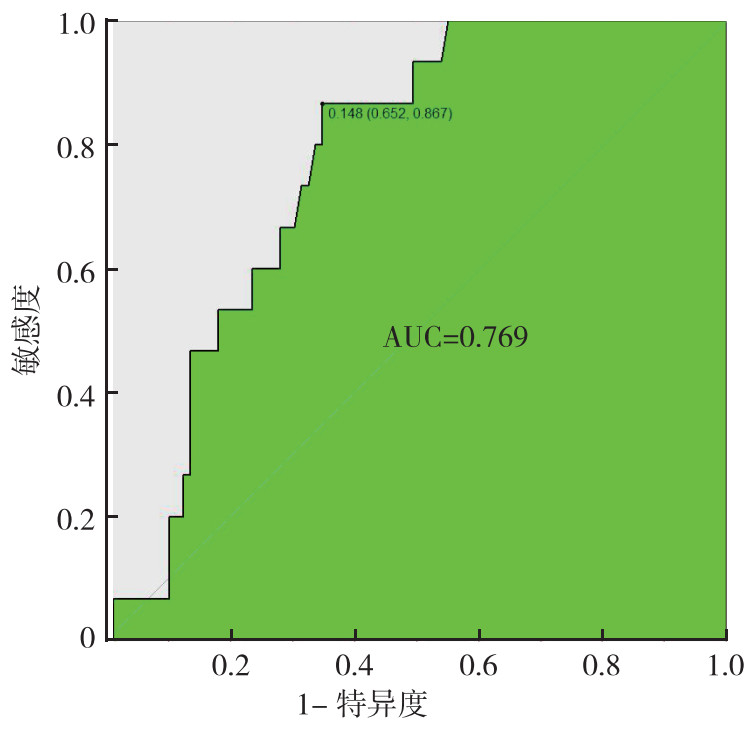
|
| 图 3 列线图回归模型预测骨肉瘤肺转移的ROC曲线 Fig.3 ROC curve for predicting pulmonary metastasis of osteosarcoma using nomogram regression model |
本研究对来自SEER数据库中1 038例骨肉瘤患者的多个临床变量与肺转移的关系进行评估,并通过多因素Logistic回归分析确定独立的预测因素。建立列线图和支持向量机模型,并将其应用于肺转移预测,取得了较好的效果。先前的研究结果显示,在诊断时,10%~15%的原发性骨肉瘤患者有可检测到的转移,其中约90%发生在肺部[3, 24]。本研究中,骨肉瘤患者的肺转移率为16.7%,与之前研究的结论差距不大[3, 24]。有针对出现肺转移的骨肉瘤患者治疗的研究结果认为,如果肺外部位不受控制,治疗肺转移的指标应该仔细确定;然而,如果肺外部位可以控制,应该考虑手术治疗[25]。因此,考虑到肺转移对骨肉瘤患者的预后有巨大影响,筛选出导致肺转移的高危因素,并有效地预测骨肉瘤患者出现肺转移的风险,具有重要的临床价值。
本研究发现,骨肉瘤患者肿瘤直径越大出现肺转移的风险越高(OR=1.037)。有研究发现,直径较小的骨肉瘤患者有着更好生存预期[8]。肿瘤直径大的肿瘤有更强的侵袭性,更容易导致肺转移[26]。较大的肿瘤直径也意味其拥有更长的生长时间,从而增加转移风险。女性骨肉瘤患者比男性患者有更低的肺转移风险(OR=0.664)。目前尚未有相关研究关注到性别对于骨肉瘤肺转移的影响,考虑女性可能比男性更加注重身体的变化,因此会有更加积极的医疗倾向,有更高的诊断率。同时,有研究认为,男性是影响骨肉瘤患者预后的高危因素[27]。因此,性别对骨肉瘤肺转移的影响机制需要相关研究者进一步关注。在肿瘤N分期中,出现N1和NX期患者比N0期患者风险更大。根据其OR值显示,N1期患者风险为N0期患者的4.265倍,NX期患者风险为N0期的3.480倍。骨肉瘤患者出现骨转移的概率是非常低的。本研究中,无肺转移的患者有95.5%没有淋巴转移,肺转移的患者也有84.4%没有淋巴转移。因此,出现淋巴转移的骨肉瘤可能极具侵袭性,从而导致更容易出现肺转移。有研究发现,出现淋巴局部转移或者远端转移的患者生存率低于其他患者[28]。临床医师不能因为骨肉瘤出现淋巴转移概率较低就忽略淋巴部位的检查,造成不可挽回的后果。这一点与出现骨转移的骨肉瘤的患者往往有更高的肺转移风险相同。
本研究中,出现肺转移的骨肉瘤患者中15%同时出现骨转移,远大于没有肺转移患者中骨转移的比例(1.6%)。多因素Logistic回归结果显示,骨转移的OR值为9.868,意味着伴有骨转移的骨肉瘤患者出现肺转移风险为无骨转移患者的9.868倍。因此,临床医师在面对出现骨转移的骨肉瘤患者时,应着重关注患者的肺部情况。目前,尚未见到骨肉瘤患者骨转移对于肺转移影响的相关研究报道,对于骨转移与肺转移之间的联系还需要进一步研究。肿瘤的原发部位也是值得关注的危险因素。本研究结果显示,相对于无肺转移的骨肉瘤患者,伴有肺转移骨肉瘤患者的原发部位更多出现在四肢骨骼。原发部位是轴位骨出现肺转移的风险仅为四肢骨的0.433倍。发病部位为四肢的骨肉瘤更容易肺转移是一个非常奇怪的结果,既往认知认为出现在脊椎部位的骨肉瘤从解剖位置考虑,都更容易出现肺转移[29]。骨盆部位骨肉瘤因为化疗敏感性低于四肢骨肉瘤,所以其肺转移率是高于四肢骨肉瘤的。同时,脊椎骨肉瘤因为手术难度极大,难以获得广泛的外科边界也更容易复发和肺转移。因此中轴骨的骨肉瘤肺转移率在一般认为都是高于四肢骨肉瘤的[30]。但是,本研究显示,四肢骨肉瘤的肺转移比例更高。考虑到SEER数据库纳入了北美地区 > 30%的人口,数据量庞大,SEER数据库出现偏倚可能性较小。可能的原因之一是骨盆和脊椎等轴位骨肉瘤在SEER数据库的随访时间不足。另外一个原因在于,目前主要关于骨肉瘤肺转移的研究均为回顾性研究,尚未有关于骨肉瘤肺转移的前瞻性研究,回顾性研究只能做相关性分析是其固有缺陷。同时,虽然骨肉瘤可发生在任何骨骼,但最常见的部位是长骨干骺端,尤其是股骨远端和胫骨近端,其次是肱骨,其他部位少见[31],这都有可能造成统计学结果出现数据偏移。因此,骨肉瘤的原发部位对于肺转移的影响还需进一步的前瞻性研究作探索。
临床医师经常使用列线图来做准确和个性化的医疗决策,尤其在肿瘤学中的应用更为广泛[32-34]。本研究建立了实用的列线图来预测骨肉瘤患者的出现肺转移的风险。使用的10-fold cross validation的结果也显示其预测性能较好。机器学习能够有效地从训练数据中学习,对新的数据做出准确的预测或决策,有相关研究使用机器学习用于预测骨肉瘤的5年生存率,也有研究通过MRI与机器学习结合用于鉴别颅底脊索瘤和骨肉瘤。本研究的新颖性是使用支持向量机技术从常规可用变量中预测骨肉瘤患者出现肺转移的风险。该模型的AUC为0.792,预测准确率为0.861,表明该模型对骨肉瘤肺转移有较好的预测效果,可广泛应用于临床。同时,与传统的列线图回归比较,支持向量机的模型预测能力更强。但是,列线图使用成本较低,不需要临床医师付出更多的精力和时间学习计算机等方面的操作。在一定情况下,其预测能力与使用成本的之间是值得权衡的
本研究有几个局限性。首先,本研究的数据来自SEER数据库,在北美之外地区的有效性还需进一步验证。其次,作为一项回顾性研究,可能存在数据偏倚。第三,作为一种机器学习技术,支持向量机需要硬件和软件配置,对于使用者存在一定难度。在未来,笔者考虑进一步收集不同中心的患者数据,对2个模型进行验证与更新。
综上所述,本研究对骨肉瘤患者肺转移的预测因素进行了多因素分析,结果表明,骨肉瘤患者发生肺转移的独立危险因素包括男性患者、更大的肿瘤直径、N1或NX分期、伴有骨转移和原发部位为四肢骨。建立的列线图和支持向量机模型均有较好的预测能力。
| [1] |
Ando T, Kudo Y, Iizuka S, et al. Ameloblastin induces tumor suppressive phenotype and enhances chemosensitivity to doxorubicin via Src-Stat 3 inactivation in osteosarcoma[J]. Sci Rep, 2017, 7: 40187. DOI:10.1038/srep40187 |
| [2] |
Luetke A, Meyers PA, Lewis I, et al. Osteosarcoma treatment - where do we stand? A state of the art review[J]. Cancer Treat Rev, 2014, 40(4): 523-532. DOI:10.1016/j.ctrv.2013.11.006 |
| [3] |
Bhattasali O, Vo AT, Roth M, et al. Variability in the reported management of pulmonary metastases in osteosarcoma[J]. Cancer Med, 2015, 4(4): 523-531. DOI:10.1002/cam4.407 |
| [4] |
Chou AJ, Kleinerman ES, Krailo MD, et al. Addition of muramyl tripeptide to chemotherapy for patients with newly diagnosed metastatic osteosarcoma: a report from the Children's Oncology Group[J]. Cancer, 2009, 115(22): 5339-5348. DOI:10.1002/cncr.24566 |
| [5] |
Wang LP, Li PP, Xiao X, et al. Generating lung-metastatic osteosarcoma targeting aptamers for in vivo and clinical tissue imaging[J]. Talanta, 2018, 188: 66-73. DOI:10.1016/j.talanta.2018.05.011 |
| [6] |
Anninga JK, Gelderblom H, Fiocco M, et al. Chemotherapeutic adjuvant treatment for osteosarcoma: where do we stand?[J]. Eur J Cancer, 2011, 47(16): 2431-2445. DOI:10.1016/j.ejca.2011.05.030 |
| [7] |
Ritter J, Bielack SS. Osteosarcoma[J]. Ann Oncol, 2010, 21(7_suppl): vii320-325. |
| [8] |
Miller BJ, Cram P, Lynch CF, et al. Risk factors for metastatic disease at presentation with osteosarcoma: an analysis of the SEER database[J]. J Bone Joint Surg Am, 2013, 95(13): e89. DOI:10.2106/JBJS.L.01189 |
| [9] |
Berner K, Johannesen TB, Berner A, et al. Time-trends on incidence and survival in a nationwide and unselected cohort of patients with skeletal osteosarcoma[J]. Acta Oncol, 2015, 54(1): 25-33. DOI:10.3109/0284186X.2014.923934 |
| [10] |
Renard AJ, Veth RP, Schreuder HW, et al. Osteosarcoma: oncologic and functional results. A single institutional report covering 22 years[J]. J Surg Oncol, 1999, 72(3): 125-129. |
| [11] |
Liang SL, Ren ZW, Han XX, et al. PLA2G16 expression in human osteosarcoma is associated with pulmonary metastasis and poor prognosis[J]. PLoS One, 2015, 10(5): e0127236. DOI:10.1371/journal.pone.0127236 |
| [12] |
Wang JS, Wang YG, Zhong YS, et al. Identification of co-expression modules and pathways correlated with osteosarcoma and its metastasis[J]. World J Surg Oncol, 2019, 17(1): 46. DOI:10.1186/s12957-019-1587-7 |
| [13] |
Simpson E, Brown HL. Understanding osteosarcomas[J]. JAAPA, 2018, 31(8): 15-19. DOI:10.1097/01.JAA.0000541477.24116.8d |
| [14] |
Applebaum MA, Goldsby R, Neuhaus J, et al. Clinical features and outcomes in patients with Ewing sarcoma and regional lymph node involvement[J]. Pediatr Blood Cancer, 2012, 59(4): 617-620. DOI:10.1002/pbc.24053 |
| [15] |
Schneiderman BA, Kliethermes SA, Nystrom LM. Survival in mesenchymal chondrosarcoma varies based on age and tumor location: a survival analysis of the SEER database[J]. Clin Orthop Relat Res, 2017, 475(3): 799-805. DOI:10.1007/s11999-016-4779-2 |
| [16] |
Jiang Y, Wang TY, Wei ZZ. Construction and validation of nomograms for predicting the prognosis of juvenile osteosarcoma: a real-world analysis in the SEER database[J]. Technol Cancer Res Treat, 2020, 19: 1533033820947718. |
| [17] |
Golpour P, Ghayour-Mobarhan M, Saki A, et al. Comparison of support vector machine, Naïve Bayes and logistic regression for assessing the necessity for coronary angiography[J]. Int J Environ Res Public Health, 2020, 17(18): 6449. DOI:10.3390/ijerph17186449 |
| [18] |
Iasonos A, Schrag D, Raj GV, et al. How to build and interpret a nomogram for cancer prognosis[J]. J Clin Oncol, 2008, 26(8): 1364-1370. DOI:10.1200/JCO.2007.12.9791 |
| [19] |
李文乐, 胡朝晖, 王永辉, 等. 列线图在骨肿瘤疾病的应用与研究进展[J]. 中国骨与关节杂志, 2021, 10(8): 624-629. DOI:10.3969/j.issn.2095-252X.2021.08.011 |
| [20] |
李文乐, 胡朝晖, 王永辉, 等. 基于SEER数据库脊索瘤临床预测模型的建立及验证[J]. 中国骨与关节杂志, 2021, 10(2): 85-92. |
| [21] |
李文乐, 王浩胜, 宁丽俊, 等. 骨质疏松患者经皮椎体成形后骨水泥渗漏风险分析及预测模型验证[J]. 中国组织工程研究, 2022, 26(10): 1477-1482. |
| [22] |
Liu JJ, Xu HL, Chen Q, et al. Prediction of hematoma expansion in spontaneous intracerebral hemorrhage using support vector machine[J]. EBioMedicine, 2019, 43: 454-459. DOI:10.1016/j.ebiom.2019.04.040 |
| [23] |
Arora A, Lin JJ, Gasperian A, et al. Comparison of logistic regression, support vector machines, and deep learning classifiers for predicting memory encoding success using human intracranial EEG recordings[J]. J Neural Eng, 2018, 15(6): 066028. DOI:10.1088/1741-2552/aae131 |
| [24] |
Ferrari S, Mercuri M, Bacci G, et al. Comment on "prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1, 702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols"[J]. J Clin Oncol, 2002, 20(12): 2910-2911. DOI:10.1200/JCO.2002.20.12.2910 |
| [25] |
Dear RF, Kelly PJ, Wright GM, et al. Pulmonary metastasectomy for bone and soft tissue sarcoma in Australia: 114 patients from 1978 to 2008[J]. Asia Pac J Clin Oncol, 2012, 8(3): 292-302. DOI:10.1111/j.1743-7563.2012.01521.x |
| [26] |
Meazza C, Scanagatta P. Metastatic osteosarcoma: a challenging multidisciplinary treatment[J]. Expert Rev Anticancer Ther, 2016, 16(5): 543-556. DOI:10.1586/14737140.2016.1168697 |
| [27] |
Duchman KR, Gao YB, Miller BJ. Prognostic factors for survival in patients with high-grade osteosarcoma using the Surveillance, Epidemiology, and End Results (SEER) Program database[J]. Cancer Epidemiol, 2015, 39(4): 593-599. DOI:10.1016/j.canep.2015.05.001 |
| [28] |
Bacci G, Ferrari S, Longhi A, et al. High-grade osteosarcoma of the extremity: differences between localized and metastatic tumors at presentation[J]. J Pediatr Hematol Oncol, 2002, 24(1): 27-30. DOI:10.1097/00043426-200201000-00008 |
| [29] |
耿亚飞, 李玲, 夏春燕. 骨肉瘤RNA生物标志物的研究进展[J]. 实用肿瘤杂志, 2021, 36(4): 375-378. |
| [30] |
赖续文, 罗锦霞, 崔文志, 等. 经典型骨肉瘤中Hes1蛋白的表达及其临床意义[J]. 实用肿瘤杂志, 2022, 37(4): 315-319. |
| [31] |
Ene R, Sinescu RD, Ene P, et al. Proximal tibial osteosarcoma in young patients: early diagnosis, modular reconstruction[J]. Revue Roumaine De Morphol Embryol, 2015, 56(2): 413-417. |
| [32] |
Hoshino N, Hida K, Sakai Y, et al. Nomogram for predicting anastomotic leakage after low anterior resection for rectal cancer[J]. Int J Colorectal Dis, 2018, 33(4): 411-418. DOI:10.1007/s00384-018-2970-5 |
| [33] |
Su TW, Zhong X, Ye L, et al. A nomogram for predicting the presence of germline mutations in pheochromocytomas and paragangliomas[J]. Endocrine, 2019, 66(3): 666-672. DOI:10.1007/s12020-019-02075-9 |
| [34] |
Wu JY, Zhou Q, Pan ZY, et al. Development and validation of a nomogram for predicting long-term overall survival in nasopharyngeal carcinoma: a population-based study[J]. Medicine (Baltimore), 2020, 99(4): e18974. DOI:10.1097/MD.0000000000018974 |
 2023, Vol. 38
2023, Vol. 38


