文章信息
- 孙萌
- 肝脏孤立性纤维瘤超声造影与增强MRI影像学表现对比分析一例
- 实用肿瘤杂志, 2022, 37(3): 267-270
基金项目
- 深圳市医疗卫生三名工程(SZSM201612027);深圳市医学重点学科(SZXK052)
-
通信作者
- 孙萌,E-mail:sunmengtsh@163.com
-
文章历史
- 收稿日期:2021-04-03
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是一种少见的梭形细胞肿瘤。多数SFT临床上呈良性发展过程,但具有恶性潜能,约10%~20%呈恶性,可局部复发,有转移趋势[1]。通常发生在胸膜中,胸膜外相对少见[2-3]。发生在肝脏的孤立性纤维性肿瘤(solitary fibrous tumor of the liver,SFTL)病例罕见,从1931年至2019年仅84例SFTL相关英文报道[4],影像学病例有较少报道[5-13],尚未发现关于SFTL超声造影与增强MRI影像学表现对比分析的报道。笔者收集本院1例经病理确诊为SFTL的超声造影和增强MRI的影像学资料作病例分析,并进行相关文献复习。
1 病例资料患者女性,47岁,平日无明显不适,2018年7月11日体检时超声检查发现肝脏实性占位性病变,2 d后来院就诊。既往体健,无肝病病史,无家族遗传病史,既往20年前曾行剖宫产手术,无家族肿瘤史。查体:心率71次/min,体温36.3℃,生命体征平稳,心肺功能正常。无腹痛和黄疸等阳性体征。实验室检查:血、尿和粪常规正常,生化全项正常,乙肝和丙肝系列正常,肿瘤六项(女性)正常。
2018年7月13日常规超声及超声造影表现:肝脏背景实质回声均匀,肿瘤为单发,大小约45 mm×43 mm×36 mm,边界清晰,形态规则,位于肝内S4段,紧邻第一肝门区,呈均匀低回声表现,对周围门静脉主干及胆囊呈推挤移位改变,未见明显直接侵犯邻近组织表现,肝内胆管及胆囊形态大小正常(图 1A)。彩色多普勒显示肿瘤周边及内部未见明显血流信号(图 1B~1C)。2018年7月18日行肝肿物切除术及胆囊切除术,术后6个月灰阶超声表现未见复发(图 1D)。超声造影表现为肿瘤动脉期18 s与周围正常肝脏实质同步开始显影,增强边缘清晰,呈向心性不均匀高增强(图 2A),28 s到达高峰,中心部可见少量灌注缺损(图 2B),53 s开始消退(图 2C),门脉期快速减退呈低增强,延迟期显示低增强(图 2D),肿瘤整体表现为“快进快出”型灌注模式。超声造影结果提示:肝内S4段实性占位性病变,结合超声造影,肝细胞性肝癌不除外。
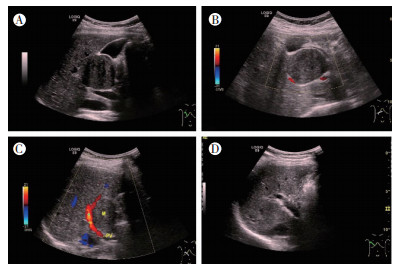
|
| 注 A:SFTL灰阶超声表现示,单发,边界清晰,形态规则,位于肝内S4~S5段交界处,紧邻第一肝门区,呈均匀低回声表现;B:SFTL彩色多普勒超声表现示,肿瘤周边及内部未见明显血流信号;C:SFTL挤压门静脉主干超声表现;D:SFTL术后6个月灰阶超声表现未见复发 图 1 SFTL术前二维及彩色多普勒超声表现及术后二维表现 |
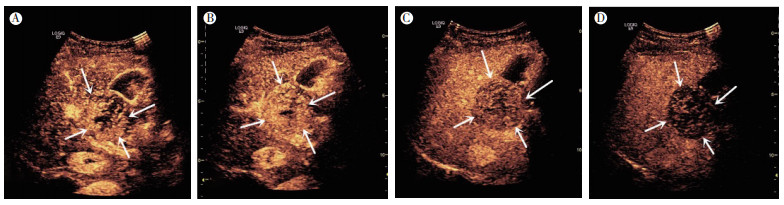
|
| 注 A:SFTL动脉期21 s超声造影表现示,与周围正常肝脏实质同步开始显影,增强边缘清晰,呈向心性不均匀高增强;B:SFTL动脉期28 s超声造影表现示,到达高峰,中心部可见少量灌注缺损;C:SFTL门脉期58 s超声造影表现示,门脉期快速减退呈低增强;D:SFTL延迟期120 s超声造影表现示,延迟期显示低增强;箭头示SFTL 图 2 不同时期SFTL超声造影表现 |
2018年7月16日MRI平扫及增强MRI表现:MRI平扫显示,肝内S4段类圆形肿块,大小约48 mm×42 mm×36 mm,T1加权像(T1-weighted imaging,T1WI)呈中低信号,T2加权像(T2-weighted imaging,T2WI)呈高信号改变(图 3A),边缘光滑。钆喷酸葡胺造影剂增强扫描显示,动脉期病灶未见强化(图 3B),门静脉和延迟期病灶呈渐进强化(图 3C~3D),内见无强化区域,周边可见假包膜,门静脉受压。MRI平扫及增强MRI结果提示,肝内S4段占位,考虑良性肿瘤性病变,考虑不典型血管瘤和腺瘤可能。
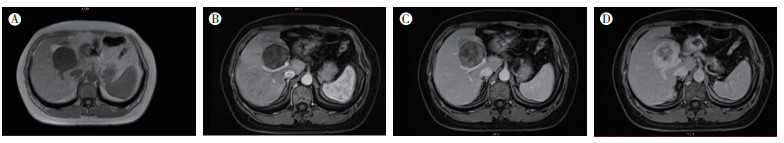
|
| 注 A:SFTL的MRI平扫表现示,肝内S4段类圆形肿块,T1WI呈中低信号;B:SFTL的动脉期增强MRI表现示,病灶未见强化;C:SFTL的门静脉期增强MRI表现示,门静脉病灶呈渐进强化;D:SFTL的延迟期增强MRI表现示,延迟期病灶呈渐进不均匀强化 图 3 SFTL平扫MRI及增强MRI表现 |
2018年7月18日行肝肿物切除术及胆囊切除术。术中所见及病理检查示:肿瘤发生在肝床部位(门静脉主干表面Glisson鞘),与胆囊相邻,大小约5 cm×5 cm×4 cm,结节型,结节外可见包膜,切面淡黄、质韧(图 4A)。病理光学显微镜表现:梭形细胞增生,核长椭圆形,二端较尖,部分钝圆,核分裂难见,细胞质丰富、红染,伴黏液样变(图 4B~4D)。免疫组织化学检查结果显示:CD117(-),CD34(+),Des(-),DOG1(-),Ki-67(+1%),S-100(-),平滑肌肌动蛋白(smooth muscle actin,SMA)(-),bcl-2(少许+),SOX10(-),STAT6(-),MUC4(-),上皮膜抗原(epithelial membrane antigen, EMA)(-)。诊断意见:SFTL。
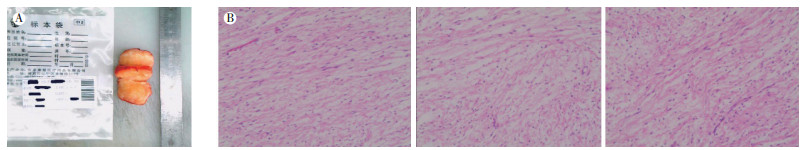
|
| 注 A:肉眼肿瘤标本,结节外可见包膜,切面淡黄、质韧;B:肿瘤标本光学显微镜表现示(HE×100),梭形细胞增生,核长椭圆形,二端较尖,部分钝圆,核分裂难见,细胞质丰富、红染,伴黏液样变 图 4 SFTL肿瘤肉眼标本及光学显微镜表现 |
SFTL是SFT发生在胸膜外的一种少见类型肿瘤[2],组织来源可能是间质细胞由Glisson鞘或肝内结缔组织增生而形成,肿瘤可带蒂[4]。SFTL多数表现为良性肿瘤的特征,80%的患者早期无明显症状,当肿瘤增大压迫重要脏器时,可出现相应部位及肿瘤效应的一系列症状,包括黄疸、疼痛、体质量减轻、恶心及发热等症状[3]。晚期可出现肝功能不全或衰竭。实验室检查一般是无特异性表现,部分病例肿瘤巨大时可合并糖蛋白抗原125(carbohydrate antigen 125,CA125)升高。目前临床上SFTL的首选治疗方法为手术完整切除[3]。
2.1 SFTL影像学特征与病理对比分析SFTL瘤体成分复杂,内常含肿瘤细胞、血管、胶原组织及丰富的纤维组织等,其中肿瘤细胞稀疏区、细胞密集区、稠密胶原基质以及大量的薄壁血管分布不均,被纤维性间质分隔,且肿瘤较大时可出现多种形式变性坏死,如囊性变、出血和钙化等。基于以上病理特征,SFTL的影像学表现多样,并有报道肿瘤的大小和是否合并液化或钙化与肿瘤的恶性度呈正相关[8]。
SFTL的灰阶超声少有报道[5-7],表现为单发低回声实质团块,回声均匀或不均匀,形态规则,边界清,有包膜;彩色多普勒显示未见明显血流信号或周边见少量线状或点状血流。本病例超声表现与相关报道一致[5-7]。关于SFTL的超声造影表现罕有报道。周爱云等[7]报道1例SFTL恶性病灶,大小约73 mm×65 mm,合并液化,体积大于本病例的45 mm×43 mm×36 mm。本例报道病理结果为良性,虽然二者病理结果良恶性不同,但超声造影表现一致,表现为:动脉期呈向心性不均匀高增强,门脉期快速减退呈低增强,延迟期呈低增强,肿瘤整体表现为“快进快出”型灌注模式。从病理学角度分析原因,由于瘤体内部呈梭形的瘤细胞,细胞质丰富,细胞疏松区与密集区之间声阻抗差异较小,这种较为致密的细胞及间质排列方式在超声下表现为低回声,而肿瘤内部纤维性间质分隔的多少及肿瘤是否合并变性坏死决定了超声表现为回声是否均匀。虽然肿瘤间质血管较丰富,但多数为较细小和流速低的微小血管,彩色多普勒血流显像对此类血管血流不易显示,故常规超声容易显示为SFTL是乏血供肿瘤的假象。而超声造影为纯血池造影剂,造影剂能客观准确地显示病灶的微循环情况、血管分布及灌注过程,所以超声造影显示SFTL在动脉期呈向心性不均匀高增强,真实反映SFTL其实是一种富血供肿瘤。
目前SFTL的MRI影像学诊断有少量报道[8-13],MRI信号特征比较显著,由于纤维成分的存在,多数肿瘤T2WI整体信号偏低,多呈高信号、稍高信号、等信号甚至低信号的混杂信号[14]。高信号、稍高信号和等信号反映富细胞区所致,高信号区反映肿瘤出血、囊变、坏死或黏液变性区[15],低信号区反映致密胶原纤维、细胞结构稀疏及质子运动较少。Johnson等[16]认为T2WI内出现低信号区域为SFT较具特征的MRI表现。T1WI多呈等或低信号。有报道SFT具有持续不均匀强化及动态增强整体呈渐进延迟强化等特点,呈“慢进慢出”型增强模式,但肿瘤较小时(≤5 cm),多表现为渐进延迟均匀强化、周边强化或无强化[17]。当肿瘤较大(>5 cm)时,多表现为渐进延迟不均匀强化,这与病灶内的出血、坏死、囊变、黏液变及透明化间质成分有关[14]。因MRI在SFTL上具有的特征性表现,在所有影像学手段中,MRI可作为首选。本例病灶大小<5 cm,肿瘤内部未出现坏死变性区域,T1WI呈较均匀中低信号,T2WI呈较均匀高信号改变,MRI增强扫描动脉期病灶未见强化,门静脉和延迟期病灶呈渐进延迟强化,与相关报道一致[17]。
2.2 超声造影与增强MRI诊断学特征差异原因分析本例SFTL超声造影特征与肝脏恶性肿瘤相似,呈“快进快出”型灌注模式,而增强MRI影像学表现类似于良性肿瘤特征,呈“慢进慢出”型灌注模式,二者表现明显不同,为影像学诊断SFTL带来较大的困难。笔者推测原因可能是SFTL富含纤维组织的病理特点和SFTL超声造影与增强MRI各自增强原理不同造成的。超声造影剂声诺维为血管内造影剂,微气泡直径大,不会外渗出血管到达细胞间隙。而MRI的造影剂为细胞外造影剂,是小分子或原子微粒,直径远小于超声造影剂,且具有水溶性,进入血管后能够通过毛细血管壁,继续弥散到血管外的细胞间隙。由于SFTL肿瘤富含纤维组织及薄壁血管,边缘处肿瘤细胞及血管分布较多,中心部血管稀疏且纤维组织较多,且较大肿瘤内部常合并出血及坏死,故超声造影动脉期呈向心性不均匀高增强,门脉期延迟期呈低增强,呈“快进快出”型增强模式。而增强MRI造影剂在血管与纤维组织之间弥散缓慢,可存留在细胞间隙中呈进行中延迟强化,呈“慢进慢出”型增强模式。这种完全不同的增强模式差异在肝胆管细胞癌及肝上皮样血管内皮细胞瘤等含有较多纤维组织成分的肿瘤上也有类似表现[18-21]。
综上所述,SFTL超声造影与增强MRI具有完全不同的影像学特点,超声造影表现为“快进快出”型,类似肝脏恶性肿瘤灌注模式。增强MRI表现为渐进性持续强化,呈“慢进慢出”型灌注模式,类似肝脏良性肿瘤灌注模式。SFTL的造影影像学具有多样性,也客观反映SFTL虽然多数为良性,但具有恶性潜能的病理特征。由于增强MRI软组织分辨率高,不受气体、肥胖和肋弓遮挡等因素的影响,且具有渐进性持续强化的特征性表现,可作为所有影像学诊断方法中的首选,超声造影可作为增强MRI的有益补充,综合2种可提高SFTL的术前诊断,最终结果仍需通过病理诊断确诊。
| [1] |
Shinde RS, Gupta A, Goel M, et al. Solitary fibrous tumor of the liver-An unusual entity: A case report and review of literature[J]. Ann Hepatobiliary Pancreat Surg, 2018, 22(2): 156-158. DOI:10.14701/ahbps.2018.22.2.156 |
| [2] |
Rouy M, Guilbaud T, Birnbaum DJ. Liver solitary fibrous tumor: A rare incidentaloma[J]. J Gastrointest Surg, 2021, 25(3): 852-853. DOI:10.1007/s11605-020-04701-8 |
| [3] |
苗永兴, 陈忠达, 于骞, 等. 胸膜孤立性纤维瘤CT诊断及鉴别[J]. 实用肿瘤杂志, 2014, 29(6): 579-582. |
| [4] |
Chen N, Slater K. Solitary fibrous tumour of the liver-report on metastasis and local recurrence of a malignant case and review of literature[J]. World J Surg Oncol, 2017, 15(1): 27. DOI:10.1186/s12957-017-1102-y |
| [5] |
许辉, 袁海霞. 孤立性纤维瘤的影像学表现[J]. 江西医药, 2018, 53(8): 889-891. DOI:10.3969/j.issn.1006-2238.2018.8.041 |
| [6] |
Ohmura Y, Takeda Y, Katsura Y, et al. A case of solitary fibrous tumors of the liver[J]. Gan To Kagaku Ryoho, 2020, 47(3): 525-527. |
| [7] |
周爱云, 郭素萍, 朱皖, 等. CEUS误诊肝脏孤立性纤维性肿瘤1例[J]. 中国医学影像技术, 2016, 32(9): 1400. |
| [8] |
Delvecchio A, Duda L, Conticchio M, et al. Doege-Potter syndrome by malignant solitary fibrous tumor of the liver: A case report and review of literature[J]. World J Gastroenterol Surg, 2019, 11(8): 348-357. DOI:10.4240/wjgs.v11.i8.348 |
| [9] |
Kandpal H, Sharma R, Gupta SD, et al. Solitary fibrous tumor of the liver: a rare imaging diagnosis using MRI and diffusion-weighted imaging[J]. Br J Radiol, 2008, 81(2): 282-286. |
| [10] |
Yugawa K, Yoshizumi T, Mano Y, et al. Solitary fibrous tumor in the liver: case report and literature review[J]. Surg Case Rep, 2019, 5(1): 68. DOI:10.1186/s40792-019-0625-6 |
| [11] |
Nam HC, Sung PS, Jung ES, et al. Solitary fibrous tumor of the liver mimicking malignancy[J]. Korean J Intern Med, 2020, 35(3): 734-735. DOI:10.3904/kjim.2018.442 |
| [12] |
Jakob M, Schneider M, Hoeller I, et al. Malignant solitary fibrous tumor involving the liver[J]. World J Gastroenterol, 2013, 19(21): 3354-3357. DOI:10.3748/wjg.v19.i21.3354 |
| [13] |
Maccio L, Bonetti LR, Siopis E, et al. Malignant metastasizing solitary fibrous tumors of the liver: a report of three cases[J]. Pol J Pathol, 2015, 66(1): 72-76. |
| [14] |
王国松, 夏瑞明, 孔一曼, 等. 胸膜外孤立性纤维瘤影像学诊断与鉴别诊断[J]. 医学影像学杂志, 2015, 25(8): 1388-1392. |
| [15] |
Ginat DT, Bokhari A, Bhatt S, et al. Imaging features of solitary fibrous tumors[J]. Am J Roentgenol, 2011, 196(3): 487-495. DOI:10.2214/AJR.10.4948 |
| [16] |
Johnson TRC, Pedrosa I, Goldsmith J, et al. Magnetic resonance imaging findings in solitary fibrous tumor of the kidney[J]. J Comput Assist Tomography, 2005, 29(4): 481-483. DOI:10.1097/01.rct.0000166637.24037.41 |
| [17] |
Kakihara D, Yoshimitsu K, Eto M, et al. MRI of retroperitoneal solitary fibrous tumor in the suprarenal region[J]. Am J Roentgenol, 2007, 188(6): W512-514. DOI:10.2214/AJR.05.0537 |
| [18] |
吴涛, 许尔蛟, 郑荣琴, 等. 肝门部胆管癌超声造影与增强MRI增强模式的对比研究[J]. 中华医学超声杂志: 电子版, 2012, 9(3): 211-215. DOI:10.3877/cma.j.issn.1672-6448.2012.03.006 |
| [19] |
张博, 司芩, 钱晓莉, 等. 肝外胆管癌超声造影灌注特征与增强MRI成像对比分研究[J]. 临床肿瘤学杂志, 2015, 20(4): 343-346. |
| [20] |
黄婷, 潘敏强, 黄品同. 肝上皮样血管内皮细胞瘤超声造影表现[J]. 实用肿瘤杂志, 2021, 36(3): 272-275. |
| [21] |
陈华福, 林晓强, 陈达丰. 肝上皮样血管内皮细胞瘤一例[J]. 实用肿瘤杂志, 2021, 36(2): 174-176. |
 2022, Vol. 37
2022, Vol. 37


