文章信息
- 于冠宇, 王薇, 龚海峰, 隋金珂, 朱晓明, 沈浮, 白辰光, 杨继金, 张火俊, 李刚, 周伟平, 张卫
- Yu Guanyu, Wang Wei, Gong Haifeng, Sui Jinke, Zhu Xiaoming, Shen Fu, Bai Chenguang, Yang Jijin, Zhang Huojun, Li Gang, Zhou Weiping, Zhang Wei
- 乙状结肠癌伴肝巨大转移灶患者的MDT诊疗
- MDT diagnosis and treatment of sigmoid colon cancer with huge liver metastases
- 实用肿瘤杂志, 2021, 36(6): 483-489
- Journal of Practical Oncology, 2021, 36(6): 483-489
基金项目
- 第三批国家临床重点专科军队建设项目;上海市领军人才(2018年度);上海市扬帆计划(21YF1459300);长海医院院级科研项目(2018QNA019);海军军医大学第一附属医院“234学科攀峰计划”(2019YXK032)
-
通信作者
- 张卫, E-mail: weizhang2000cn@163.com
-
文章历史
- 收稿日期:2021-08-05
2. 海军军医大学第一附属医院肿瘤内科, 上海 200433;
3. 海军军医大学第一附属医院影像医学科, 上海 200433;
4. 海军军医大学第一附属医院病理科, 上海 200433;
5. 海军军医大学第一附属医院介入科, 上海 200433;
6. 海军军医大学第一附属医院放疗科, 上海 200433;
7. 海军军医大学第一附属医院肝胆外科, 上海 200433;
8. 海军军医大学第三附属医院肝外三科, 上海 200433
2. Oncology Department, the First Affiliated Hospital of Naval Medical University, Shanghai 200433, China;
3. Imaging Medicine Department, the First Affiliated Hospital of Naval Medical University, Shanghai 200433, China;
4. Pathology Department, the First Affiliated Hospital of Naval Medical University, Shanghai 200433, China;
5. Interventional Medicine Department, the First Affi liated Hospital of Naval Medical University, Shanghai 200433, China;
6. Radiotherapy Department, the First Affi liated Hospital of Naval Medical University, Shanghai 200433, China;
7. Hepatobiliary Surgery Department, the First Affi liated Hospital of Naval Medical University, Shanghai 200433, China;
8. The Third Department of Hepatic Surgery, the Third Affi liated Hospital of Naval Medical University, Shanghai 200433, China
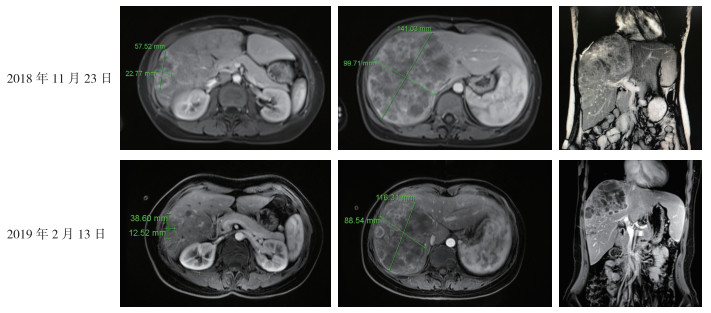
患者,女性,31岁。2018年11月23日因体检发现肝脏占位半月余于海军军医大学第一附属医院结直肠肿瘤多学科门诊就诊。患者2018年11月14日行PET-CT检查提示:乙状结肠恶性病变可能大,伴肝脏多发转移。2018年11月16日外院肠镜检查提示:距肛门20 cm处见一结节状肿物约3 cm×3 cm,活检质脆易出血。肠镜病理检查结果提示:绒毛状腺瘤癌变。基因检测结果提示:乙状结肠肿瘤鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)Exon-2 G12D突变型,神经母细胞瘤病毒癌基因RAS同系物(neuroblastoma RAS viral oncogene homolog,NRAS)和鼠类肉瘤滤过性毒菌致癌基因同源体B1(V-raf murine sarcoma viral oncogene homolog B1,BRAF)为野生型。2018年11月23日肝脏MR平扫+增强提示:肝脏多发占位性病变,结合病史考虑转移瘤伴瘤内出血(图 1)。肿瘤标志物:癌胚抗原(carcinoembryonic antigen,CEA) > 1 000 ng/mL,糖类抗原CA199(carbohydrate antigen 199,CA199)155.83 ng/mL。患者既往患有强直性脊柱炎,服用中药控制可。2014年曾行剖宫产。初步诊断为乙状结肠癌伴肝转移(cT3NxM1a ⅣA期)。
|
| 注 2018年11月23日肝脏增强MR示,肝脏多发转移瘤伴瘤内出血;2019年2月13日肝脏增强MR示,肝脏多发转移瘤治疗后,较前(2018年11月23日)有所缩小 图 1 乙状结肠癌肝转移患者mFOLFOXIRI方案转化治疗一次前后肝脏增强MR检查结果 Fig.1 Liver enhanced MR examination results of the sigmoid colon cancer patient with liver metastases before and after mFOLFOXIRI transformation treatment for one time |
沈浮副主任医师(影像医学科):该患者肝右叶可见巨大转移灶,累及门静脉右支可能,下方伴子灶形成。转移瘤内可见部分出血信号改变。PET-CT检查可见肝脏多发转移灶及乙状结肠病灶2处肿瘤摄取值增高,结合肠镜等病史可明确患者为乙状结肠癌伴肝脏转移。
白辰光副主任医师(病理科):该患者肠镜活检组织为腺癌,KRAS基因为突变型,NRAS/BRAF基因为野生型。肝脏组织未取病理活检。
李刚副主任医师(肝胆外科):该患者肝脏转移瘤巨大,结合病史及影像结果,技术上可完整切除,患者复发风险评分(clinical risk score,CRS)为5分,但考虑切除转移灶后剩余肝脏体积不足,建议缩瘤后再行切除手术,以尽可能保证术后肝脏功能。
王薇副主任医师(肿瘤内科):患者明确临床可诊断Ⅳ期乙状结肠癌(肝脏转移),肿瘤生物学行为差,属KRAS突变,NRAS/BRAF野生型的左半结肠癌,且仅有肝脏转移。患者年龄31岁,比较年轻,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0分。目前治疗目标是治愈意向的无瘤状态(no evidence of disease,NED),尽量缩小肝脏转移灶,为根治性手术争取机会。KRAS突变的转移性结直肠癌,患者年轻,一般状况良好,以缩瘤转化为治疗目的,临床上建议应用氟尿嘧啶+奥沙利铂+伊立替康联合的mFOLFOXIRI的三药治疗联合贝伐珠单抗靶向治疗,以期达到最佳的疗效。综上所述,建议全身治疗方案采取mFOLFOXIRI联合贝伐珠单抗靶向治疗。
于冠宇主治医师(肛肠外科):患者目前诊断Ⅳ期结肠癌,仅有肝转移,没有明显梗阻和出血症状,结合患者一般情况,建议先行全身化疗控制肿瘤,后续进一步评估肝脏转移灶缩瘤情况,再行评估手术切除方案。化疗期间注意密切观察患者梗阻、出血和穿孔等病情出现进展情况,如出现梗阻可行内镜下支架置入或结肠原发灶先切除等方案。
张卫主任医师(肛肠外科)总结:结合MDT团队专家的分析,该患者治疗目标为:NED,原发灶暂无明显梗阻和穿孔等风险,可切除。肝脏转移瘤技术上潜在可切除,CRS 5分,为后续治疗尽可能保留更多的肝组织,应缩瘤后手术。肿瘤生物学行为差,KRAS突变,NRAS/BRAF野生型左半结肠癌,仅肝转移。年轻,ECOG 0分。建议先行mFOLFOXIRI三药化疗联合贝伐珠单抗靶向治疗,3个月后评估手术指征及方案。
2.1.2 治疗情况患者2018年11月24日至2019年2月15日行mFOLFOXIRI(奥沙利铂130 mg d1静脉注射,伊立替康240 mg d1静脉注射,氟尿嘧啶4 g 46 h微量泵持续静脉滴注,亚叶酸钙300 mg d1静脉注射)+贝伐珠单抗300 mg d1静脉注射治疗,每2周重复,共4个周期。
2019年2月22日行第1次化疗后评估,肝脏转移灶较前明显缩小,2019年3月1日再次至海军军医大学第一附属医院结直肠肿瘤多学科门诊就诊。
2.2 第2次MDT讨论及治疗情况 2.2.1 第2次MDT讨论(2019年3月1日)沈浮副主任医师(影像医学科):根据患者2月13日肝脏增强MR检查情况(图 1),肝实质内见多个团块及结节状异常信号,大小不一。T1加权像(T1 weighted image,T1WI)呈等低信号,T2加权像(T2 weighted image,T2WI)呈高低混杂信号,弥散受限,动态增强病灶边缘环行强化,较大者大小约为9.0 cm×12.0 cm。胆囊不大,未见异常信号。脾脏、胰腺及双肾未见异常。腹膜后未见肿大淋巴结。考虑肝脏多发转移瘤治疗后改变,较前(2018年11月23日)有所缩小。2月12日患者的盆腔增强MR检查可见乙状结肠肠壁部分增厚,可见不均匀强化,周围系膜脂肪间隙清晰,直肠上动脉周围未见明显肿大淋巴结,双侧盆壁髂血管旁未见肿大淋巴结。
李刚副主任医师(肝胆外科):患者经过化疗后肝脏转移灶体积较前缩小,根据实体肿瘤疗效评估标准(Response Evaluation Criteria In Solid Tumors,RECIST)评估疗效最长径之和缩小23%[1]。现已具备肝脏手术条件,同时患者及家属手术意愿强烈。考虑到术后残余肝体积不足,可先行门静脉栓塞(portal vein embolization, PVE)使左肝体积代偿性增大后,行肝脏转移瘤手术切除。
杨继金主任医师(介入科):肝脏术前行PVE治疗,已得到广泛认可及应用。PVE用于结直肠癌肝转移术前准备也在近年来成熟发展[2],该患者年纪轻,肿瘤对化疗反应好,外科具备手术条件,经评估可以先行PVE治疗。
王薇副主任医师(肿瘤内科):患者mFOLFOXIRI联合贝伐珠单抗化疗效果明确,耐受佳,可考虑继续化疗2个周期。因贝伐珠单抗应用影响组织愈合,造成术后出血等并发症风险增高,考虑该患者拟近期行手术治疗,可先停用贝伐珠单抗,继续三药化疗,做手术准备。
于冠宇主治医师(肛肠外科):患者明确乙状结肠癌,肝脏转移灶明确可切除,如进行手术,可通过1次手术切除2个病灶。结肠病灶建议通过腹腔镜方式切除,腹腔镜具有精细操作、微创化和术后恢复时间快等特点;肝脏转移病灶大,建议通过开腹手术方式切除。通过腹腔镜结合开腹手术同期切除结直肠癌肝转移在本中心已多次应用,并已撰写总结性文章[3],该手术方式避免二次手术给患者带来的打击和压力,并充分发挥腹腔镜结直肠手术和开腹肝脏手术的优势,在近期和远期并发症方面表现优异。
张卫主任医师(肛肠外科)总结:患者肝转移灶较前缩小,乙状结肠病灶退缩良好,具备手术条件,建议再行1次mFOLFOXIRI方案化疗,进行PVE代偿性增大左肝体积,评估后准备行腹腔镜结合开腹方式同期切除结直肠癌及肝转移灶。
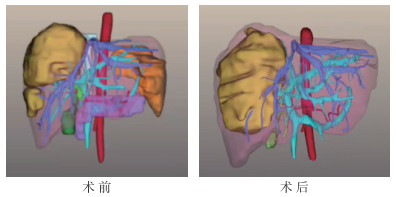
2.2.2 治疗情况患者于2019年3月3日再行1次mFOLFOXIRI方案化疗,2019年3月18日于东方肝胆外科医院行PVE术,术前左半肝体积为28.6%,术后左半肝体积为37.5%,明显增大(图 2)。
|
| 图 2 乙状结肠癌肝转移患者PVE术前和术后肝脏体积三维图 Fig.2 Three-dimensional images of liver volume before PVE and after PVE in the sigmoid colon cancer patient with liver metastases |
患者于2019年4月1日在海军军医大学第一附属医院肛肠外科行腹腔镜辅助乙状结肠切除术+开腹肝转移瘤切除术(+胆囊切除术)。术后恢复顺利,术后第1天进食流质,第5天拔除腹腔引流管,第6天出院。
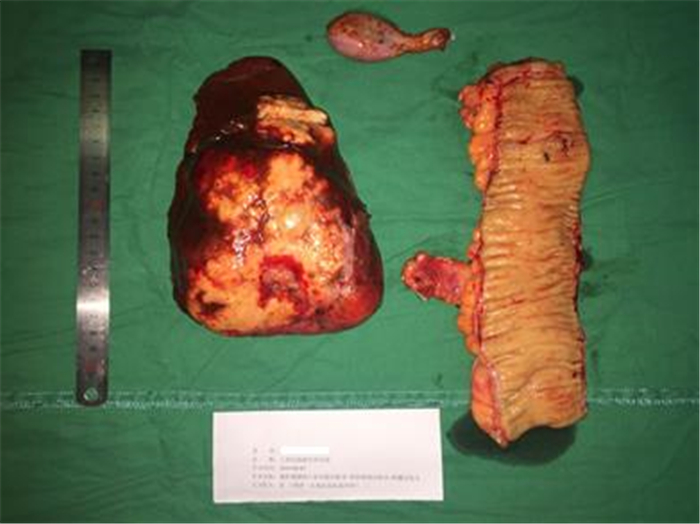
术后标本肿瘤大小:乙状结肠肿瘤为1 cm×0.5 cm×0.3 cm;肝脏肿瘤为12 cm×7 cm×9 cm(图 3)。病理检查结果示:乙状结肠中分化腺癌伴肝脏转移[ypT1N1aM1a ⅣA期,肿瘤消退分级(tumor regression grade,TRG)3级],肿瘤浸润至黏膜下层,系膜淋巴结转移(1/13),癌结节(-)、脉管癌栓(-)、神经(-)、切缘(-)、胆囊(-)。基因分型:KRAS Exon-2 G12D突变,NRAS、BRAF和phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha(PIK3CA)野生型。免疫组织化学检查示:错配修复正常(proficient DNA mismatch repair,pMMR)[mutS homolog 2(MSH2)阳性,MSH6阳性,mutL homolog 1(MLH1)阳性,PMS1 homolog 2(PMS2)阳性]。
|
| 图 3 乙状结肠癌肝转移患者肠肝同期切除术后乙状结肠和肝脏肿瘤标本 Fig.3 Sigmoid colon and liver tumor specimens from the sigmoid colon cancer patient with liver metastases after simultaneous resection of sigmoid colon and liver |
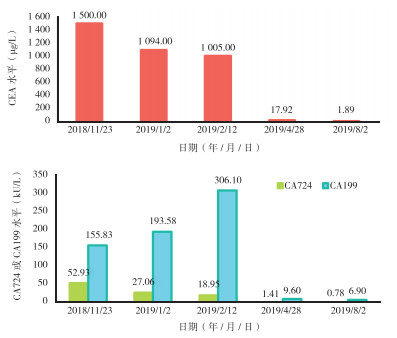
患者术后14 d进行复查评估,CEA、CA199和CA724水平恢复正常(图 4)。肝脏增强MR和胸部CT平扫未见明显异常。盆腔增强MR检查示:左侧髂骨近骶骨处及髋臼前缘小斑片状强化灶,考虑转移。为进一步明确可疑左侧髂骨转移灶评估处理方案及术后治疗方案,患者于2019年4月26日于海军军医大学第一附属医院结直肠肿瘤多学科门诊就诊。
|
| 注 A:CEA变化趋势;B:CA199和CA724变化趋势 图 4 乙状结肠癌肝转移患者血肿瘤标志物变化趋势图 Fig.4 Change trends of blood tumor markers in the sigmoid colon cancer patient with liver metastases |
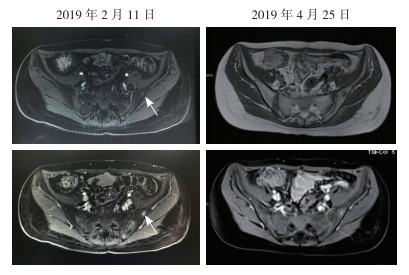
沈浮副主任医师(影像医学科):通过与2019年2月11日盆腔增强MR检查比较,本次左侧髂骨病灶无明显变化(图 5)。肝脏和腹腔内可见术后改变,无明显复发和转移征象。髂骨病灶建议进一步放射性核素骨扫描检查,明确转移情况。
|
| 注 箭头示左侧髂骨病灶 图 5 乙状结肠癌肝转移患者两次复查盆腔增强MR影像比较 Fig.5 Comparison of pelvic enhanced MR images in the sigmoid colon cancer patient with liver metastases |
王薇副主任医师(肿瘤内科):患者术后病理明确诊断为乙状结肠中分化腺癌伴肝脏转移(ypT1N1aM1a ⅣA期,TRG 3级),KRAS Exon-2 G12D突变,NRAS、BRAF和PIK3CA野生型;免疫组织化学检查示pMMR。术前转化治疗过程中,mFOLFOXIRI联合贝伐珠单抗治疗效果良好,建议继续行该方案术后化疗。
张卫主任医师(肛肠外科)总结:患者经过腹腔镜结合开腹治疗乙状结肠癌伴肝脏转移,术后无并发症,恢复良好。结合术前化疗反应及患者病理检查结果和基因类型,继续行mFOLFOXIRI联合贝伐珠单抗方案治疗,并行全身骨扫描明确髂骨病灶性质。
2.3.2 治疗情况患者于2019年5月2日至2019年9月12日接受mFOLFOXIRI联合贝伐珠单抗治疗共6个周期,因耐受欠佳,反复出现Ⅱ~Ⅲ度中性粒细胞下降,胃肠道反应较重,2019年6月11日起化疗减量20%。2019年5月21日骨扫描结果显示:(1)胸6椎体及左髂骨骨质改变,考虑转移瘤可能;(2)部分下胸椎骨质密度减低伴放射性摄取升高;(3)胸5椎体血管瘤;(4)右坐骨结节病灶,考虑良性病变。发现该情况后,继续原方案化疗。2019年10月9日复查骨扫描结果显示:(1)胸6椎体棘突转移瘤可能;(2)T9及T10椎体显像剂摄取较前减低;(3)胸5椎体血管瘤;(4)左侧髂骨及右坐骨良性病变可能。2019年10月复查肝脏增强MR、盆腔增强MR和胸部CT平扫均未见明显复发转移。
就患者围手术期治疗后下一步治疗方案和是否建议胸椎局部放疗等问题再次进行MDT会诊。
2.4 第4次MDT讨论及治疗情况 2.4.1 第4次MDT讨论(2019年10月11日)沈浮副主任医师(影像医学科):患者胸6椎体考虑骨转移可能;胸5椎体考虑血管瘤较为明确,CT图像呈“栅栏样改变”;胸10病灶CT未见改变,发射型计算机断层扫描(emission computed tomography,ECT)有摄取,性质待定;左髂骨病灶多次对比边缘有骨质硬化,增强后轻度强化,优先考虑良性病变。
张火俊主任医师(放疗科):患者目前影像结果显示胸6椎体骨转移,建议进行密切随访,必要时可行PET-CT检查进一步明确诊断,因该椎体属承重椎体,可考虑行局部放疗。
王薇副主任医师(肿瘤内科):患者术后已行6个周期mFOLFOXIRI联合贝伐珠单抗方案治疗,目前仅有椎体可疑转移灶,同时患者对化疗耐受不佳,可考虑行卡培他滨联合贝伐珠单抗治疗。
张卫主任医师(肛肠外科)总结:患者术后已行6个周期mFOLFOXIRI联合贝伐珠单抗化疗,目前腹腔术区及肺脏未见明确复发转移灶,椎体可疑转移灶。为进一步控制病情,巩固根治性手术效果,建议行卡培他滨联合贝伐珠单抗维持治疗,密切随访观察。
2.4.2 治疗情况患者于2019年10月10日开始进行卡培他滨联合贝伐珠单抗维持化疗,共5个周期。具体方案如下:卡培他滨口服1.5 g每天2次d1~14,贝伐珠单抗400 mg静脉滴注d1,每3周重复。并予唑来膦酸4 mg每4周1次。至2020年2月,患者状态佳,ECOG评分0分。
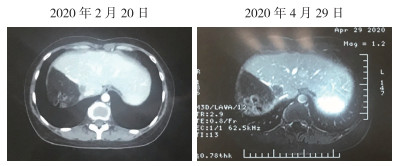
2020年2月因新冠疫情于外院进行复查和治疗。肝脏增强MR检查发现肝脏转移瘤复发(图 6),后予mFOLFOXIRI联合贝伐珠单抗治疗1次,3月27日第2次化疗期间,患者对奥沙利铂过敏改行FOLFIRI方案(氟尿嘧啶+伊立替康)联合贝伐珠单抗化疗2个周期,患者化疗期间胃肠道反应明显。2020年4月29日复查肝脏增强MR发现肝脏复发灶较前增大。遂至海军军医大学第一附属医院结直肠肿瘤多学科门诊进行会诊。
|
| 图 6 乙状结肠癌肝转移患者2020年化疗前后肝脏增强MR影像比较 Fig.6 Comparison of liver enhanced MR images before and after chemotherapy in the sigmoid colon cancer patient with liver metastases in 2020 |
沈浮副主任医师(影像医学科):肝脏术后改变,靠近切缘处病灶较前增大,考虑肝脏转移瘤复发。胸部CT和盆腔MRI增强较前相仿。
李刚副主任医师(肝胆外科):根据病史及治疗经过,可以明确该肝脏新发病灶为转移复发灶,结合影像结果,可以考虑手术切除。
王薇副主任医师(肿瘤内科):患者目前化疗反应严重,肝脏复发灶较前增大,手术治疗后可根据复查结果考虑等待观察或口服呋喹替尼治疗。
张卫主任医师(肛肠外科)总结:患者目前肝脏转移灶复发,化疗反应欠佳,应尽快行手术治疗切除肝脏转移灶,考虑患者无法继续耐受化疗,术后可随诊观察或口服呋喹替尼治疗。
2.5.2 治疗情况患者2020年6月5日于东方肝胆外科医院行肝脏肿瘤切除术,术后病理检查显示中分化腺癌,结合病史符合结肠癌术后肝转移。肝脏术后密切随访,等待观察。患者于2020年9月复查发现盆腔新发淋巴结转移,肝脏复发转移瘤,后口服呋喹替尼5 mg每天1次治疗。2021年3月20日复查发现盆腔转移淋巴结消退,肝脏转移病灶较前缩小。因不良反应大,呋喹替尼逐步减量至3 mg每天1次。2021年7月5日肝脏增强MR检查显示术区旁2枚边缘强化病灶,长径分别为1.3和1.5 cm,血CEA 8.4 μg/L,予东方肝胆外科医院行肝转移灶切除术,术后病理检查显示:转移性腺癌,中分化,人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)(-)。2021年8月9日随访,恢复佳,肝脏未见活性病灶,盆腔未见转移淋巴结。
3 讨论结直肠癌是全球最常见的恶性肿瘤之一,中国结直肠癌发病率呈逐年上升趋势[4]。结直肠癌的治疗手段以手术为主,同时根据肿瘤部位、恶性程度、基因情况、局部浸润或转移情况辅以放疗、化疗、靶向治疗、介入治疗甚至免疫治疗[5-7]。晚期结直肠癌是结直肠癌诊治中最为复杂的,结直肠癌最常出现的远处转移部位是肝脏,约50%的转移患者首发肝转移,且肝转移灶切除术后还有一定概率复发[8],因此晚期结直肠癌的诊疗模式具有很大挑战。目前,国际上对于转移性结直肠癌的诊治制定了相应指南[9],我国也根据不同部位的转移性结直肠癌治疗完善了专家共识[10]。
MDT综合治疗模式是针对复杂或晚期结直肠癌的重要诊治手段,影像科和病理科确定诊断,同时结直肠外科结合肿瘤内科、放疗科、肝胆外科和介入科等围绕病情进行充分讨论,详细评估患者的一般情况,制定个体化治疗方案,整合不同学科专家的意见后进行一系列综合干预治疗[11-12]。海军军医大学第一附属医院自2015年成立结直肠肿瘤多学科门诊至今,已为3 000余例次患者进行MDT专家会诊。MDT以患者为中心,以多学科专家平台为抓手,精准制定个体化治疗方案[13],有利于降低肿瘤的复发和转移[14]。再者,MDT门诊可以缓解患者看病难、流程琐碎和诊治不清等问题,在多学科门诊制定方案后由专家组成员跟踪后续治疗,有利于提高患者治疗满意度。此外,MDT模式聚集各个科室的专家,也有助于学科的交流和融合,对于疾病诊治教学和人才培养具有重大意义。本文介绍1例乙状结肠癌伴肝巨大转移灶病例,在MDT专家组团队的建议下,结合患者意愿和个人身体状况,通过转化治疗+PVE术后腹腔镜结合开腹同期切除乙状结肠癌伴肝转移巨大转移灶,有效控制疾病进展,患者获得较好的生活质量。综上所述,MDT模式已被认为是提高结直肠癌尤其是复杂的晚期结直肠癌的诊治水平的重要手段[13, 15]。MDT水平以及患者与MDT团队的有效配合是诊治关键。
| [1] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [2] |
李华驰, 刘佩, 陈双倩, 等. 结直肠癌肝转移肝切除术前门静脉栓塞临床疗效的Meta分析[J]. 中华实验外科杂志, 2015, 32(6): 1418-20. DOI:10.3760/cma.j.issn.1001-9030.2015.06.074 |
| [3] |
黄联盟, 张卫, 孟荣贵, 等. 腹腔镜联合同期开放手术与全开放手术治疗同时性结直肠癌肝转移临床对比研究[J]. 中华实用外科杂志, 2020, 40(5): 97-101. |
| [4] |
Siegel Rebecca L, Miller Kimberly D, Sauer Ann G, et al. Colorectal cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(3): 145-164. DOI:10.3322/caac.21601 |
| [5] |
Swedish Rectal Cancer Trial, Cedermark B, Dahlberg M, et al. Improved survival with preoperative radiotherapy in resectable rectal cancer[J]. New Engl J Med, 1997, 336(14): 980-987. DOI:10.1056/NEJM199704033361402 |
| [6] |
赵菁, 胡涵光, 翁姗姗, 等. 免疫检查点抑制剂在结直肠癌中的研究进展[J]. 实用肿瘤杂志, 2020, 35(6): 13-18. |
| [7] |
Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer[J]. New Engl J Med, 2004, 351(17): 1731-1740. DOI:10.1056/NEJMoa040694 |
| [8] |
Fong Y, Cohen AM, Fortner JG, et al. Liver resection for colorectal metastases[J]. J Clin Oncol, 1997, 15(3): 938-946. DOI:10.1200/JCO.1997.15.3.938 |
| [9] |
Van CE, Cervantes A, Adam R, et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer[J]. Ann Oncol, 2016, 27(8): 1386-1422. DOI:10.1093/annonc/mdw235 |
| [10] |
Ren L, Zhu D, Benson AB, et al. Shanghai international consensus on diagnosis and comprehensive treatment of colorectal liver metastases (version 2019)[J]. Eur J Surg Oncol, 2020, 46(6): 955-966. DOI:10.1016/j.ejso.2020.02.019 |
| [11] |
秦新裕, 冯青阳, 许剑民. 重视并规范化开展结直肠癌肝转移多学科综合治疗[J]. 中国实用外科杂志, 2013, 33(8): 619-621. |
| [12] |
万德森. 大力推广多学科综合治疗模式提高结直肠癌的诊疗水平[J]. 广东医学, 2019, 40(17): 2425-2427. |
| [13] |
曹文明, 邓雪英, 陈波, 等. 晚期Luminal (HER2阴性)型乳腺癌患者的MDT诊疗[J]. 实用肿瘤杂志, 2018, 33(6): 21-28. |
| [14] |
Lv Y, Feng QY, Wei Y, et al. Benefits of multi-disciplinary treatment strategy on survival of patients with colorectal cancer liver metastasis[J]. Clin Transl Med, 2020, 10(3): e121. |
| [15] |
蔡国响, 戴卫星, 蔡三军. 结直肠癌多学科综合治疗的现状与未来[J]. 中华胃肠外科杂志, 2016, 19(6): 607-611. |
 2021, Vol. 36
2021, Vol. 36


