文章信息
- 孙琦, 许建芳, 宿杰·阿克苏, 姜艳, 罗瑞晨, 朱艳君, 刘斌
- Sun Qi, Xu Jianfang, Sujie Akesu, Jiang Yan, Luo Ruichen, Zhu Yanjun, Liu Bin
- HHLA2与PD-L1在结直肠癌组织中的表达及临床病理学意义
- Expression of HHLA2 and PD-L1 in colorectal carcinoma and its clinical significance
- 实用肿瘤杂志, 2022, 37(4): 339-345
- Journal of Practical Oncology, 2022, 37(4): 339-345
-
通信作者
- 刘斌, E-mail:liumb@189.cn
-
文章历史
- 收稿日期:2021-07-13
2. 复旦大学附属中山医院病理科,上海 200032;
3. 联勤保障部队第九四〇医院病理科,甘肃 兰州 730050
2. Department of Pathology, Zhongshan Hospital, Fudan University, Shanghai 200032, China;
3. Department of Pathology, the 940th Hospital of Joint Logistics Support Force of Chinese People's Liberation Army, Lanzhou 730050, China
结直肠癌是常见的消化道恶性肿瘤之一,因其高发病率和死亡率,对人类的生命健康造成巨大威胁[1]。免疫治疗改变了癌症的传统治疗格局,延长大量中晚期恶性肿瘤患者的生存时间。但其代表药物程序性死亡受体-1(programmed death-1,PD-1)和程序性死亡受体配体-1(programmed death ligand-1,PD-L1)抑制剂仍存在适用人群较少、疗效预测不准确和易产生耐药性等问题[2-4]。因此,在肿瘤诊治中寻找新的免疫通路和生物标志物具有重要的科学意义。
在多种恶性肿瘤中,人内源性逆转录病毒-H长末端重复关联蛋白2(human endogenous retrovirus subfamily H long terminal repeat associating protein 2,HHLA2)异常表达,且与肿瘤发生和发展及患者预后密切相关,具有作为新的免疫治疗靶点的潜力[5-12]。同时HHLA2与PD-L1的相关性研究在非小细胞肺癌[9]和肝内胆管癌[10]已有报道,但在结直肠癌中还鲜有报道。本研究检测结直肠癌中HHLA2与PD-L1的表达,分析其临床病理学意义及两者之间的相关性,旨在为结直肠癌免疫治疗提供新思路。
1 资料与方法 1.1 一般资料收集2017年3月至2017年9月在联勤保障部队第九四〇医院确诊并经手术治疗的临床病理资料完整的120例结直肠腺癌患者,排除术前接受新辅助化疗、转移性癌或伴有其他部位癌症的患者。其中男性78例,女性42例;年龄26~85岁,中位年龄59岁;高分化腺癌26例,中分化腺癌83例,低分化腺癌11例;伴淋巴结转移46例,脉管浸润21例。
1.2 组织芯片组织芯片制作方法参照文献[13],构建3个芯片,由2名高年资病理医师通过观察HE切片,选取肿瘤代表性区域,制作成结直肠癌组织芯片,切成4 μm厚切片待用。
1.3 免疫组织化学4 μm厚切片经烤片、脱蜡和水化放入高压锅中,EDTA缓冲液(pH 8.0)热修复3 min,自然冷却,加入H2O2溶液,37℃温箱10 min,PBS缓冲液震荡洗涤3次,每次3 min,加入一抗HHLA2(ab214327,美国Abcam公司;1∶400)、PD-L1(SP142,福州迈新公司;即用型)和TP53单抗(MX008,福州迈新公司;即用型),37℃温箱孵育1.5~2 h,PBS缓冲液震荡洗涤3次,每次3 min,滴加快捷型酶标羊抗鼠/兔IgG聚合物(即用型),37℃温箱孵育30 min,PBS缓冲液震荡洗涤3次,每次3 min,擦干,每张切片滴加配置好的DAB溶液,显色2 min,光学显微镜下观察染色,每张切片显色时间2~5 min。自来水冲洗1 min。苏木精对比染色,稀氨水返蓝,脱水,透明,中性树胶封固。
1.4 结果判读HHLA2的判读采用半定量评分法[6]。根据阳性细胞染色强度计分:未着色的评为0分,浅黄色1分,棕黄色2分,棕褐色3分。根据阳性细胞率计分:< 5%记为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,> 75%为4分。免疫组织化学评分(immunohistochemical scores,IHS)=染色强度×阳性细胞率。IHS:0分为阴性,1~4分为弱阳性,5~8分为中阳性,9~12为强阳性。由2名有丰富经验的病理科主治及以上医师采用双盲法判断。
TP53判读标准:> 50%的肿瘤细胞中有强的细胞核染色定义为阳性,否则为阴性。
PD-L1判读采用肿瘤比例评分方法(tumor proportion score,TPS;即阳性肿瘤细胞占肿瘤细胞总数百分比)评估结直肠癌细胞染色:未着色及阳性细胞数≤1%为阴性,阳性细胞数 > 1%为阳性。
1.5 随访通过短信及电话等方式对患者及家属进行随访,并结合门诊复查资料,随访120例结直肠癌患者,了解患者出院后有无肿瘤复发、转移、死亡或并发其他疾病等生存状况。统计患者无进展生存期(progression-free survival,PFS),即患者手术出院后至发现疾病进展或任何原因引起死亡的时间。共获得完整随访资料99例,随访时间6~36个月。
1.6 统计学分析应用SPSS 22.0软件进行统计学分析。计数资料采用χ2检验或Fisher精确检验及Spearman等级相关分析。采用Kaplan-Meier法绘制生存曲线,通过log-rank检验进行差异性比较。采用Cox回归风险模型进行多因素生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 结直肠癌组织中HHLA2的表达HHLA2在结直肠癌组织中表达于肿瘤细胞的细胞膜和细胞质(图 1),在癌旁组织中表达呈弱阳性或阴性。在结直肠癌组织中6例(5.0%)阴性,32例(26.9%)弱阳性,56例(47.1%)中阳性,25例(21.0%)强阳性。HHLA2表达在结直肠癌患者的年龄、性别、发病部位、脉管浸润、淋巴结转移、远处转移、浸润深度和临床分期方面比较,差异均无统计学意义(均P > 0.05),在肿瘤分化程度方面比较,差异具有统计学意义(P < 0.05,表 1)。经Spearman等级相关分析发现,HHLA2表达与肿瘤分化程度呈负相关(r=-0.212,P=0.021)。
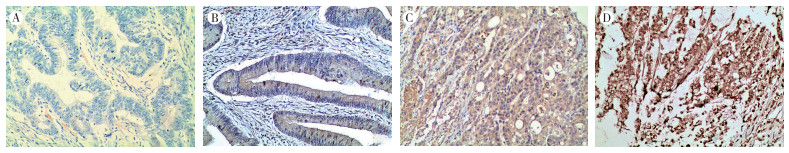
|
| 注 A:HHLA2在结直肠癌中呈阴性;B:HHLA2在高分化腺癌中呈弱阳性;C:HHLA2在中分化腺癌中呈中阳性;D:HHLA2在低分化腺癌中呈强阳性;HHLA2:人内源性逆转录病毒-H长末端重复关联蛋白2(human endogenous retrovirus subfamily H long terminal repeat associating protein 2) 图 1 HHLA2在结直肠癌组织中的表达(MaxVision×100) Fig.1 HHLA2 expression in colorectal carcinoma tissues (MaxVision×100) |
| 临床病理特征 | 总例数 | HHLA2 | χ2值 | P值 | |||
| 阴性 | 弱阳性 | 中阳性 | 强阳性 | ||||
| 性别 | 0.943 | 0.848 | |||||
| 女性 | 42 | 1(2.3) | 11(26.2) | 21(50.0) | 9(21.5) | ||
| 男性 | 78 | 5(6.4) | 22(28.2) | 35(44.9) | 16(20.5) | ||
| 年龄 | 2.393 | 0.519 | |||||
| < 60岁 | 56 | 2(3.6) | 19(33.9) | 24(42.9) | 11(19.6) | ||
| ≥60岁 | 64 | 4(6.3) | 14(21.9) | 32(50.0) | 14(21.8) | ||
| 分化程度 | 12.181 | 0.039 | |||||
| 低 | 14 | 0(0.0) | 3(21.4) | 3(21.4) | 8(57.2) | ||
| 中 | 84 | 6(7.1) | 22(26.2) | 43(51.2) | 13(15.5) | ||
| 高 | 22 | 0(0.0) | 8(36.3) | 10(45.4) | 4(18.3) | ||
| 脉管浸润 | 2.907 | 0.387 | |||||
| 无 | 99 | 4(4.0) | 26(26.3) | 49(49.4) | 20(20.3) | ||
| 有 | 21 | 2(9.5) | 7(33.3) | 7(33.3) | 5(23.9) | ||
| 淋巴结转移 | 2.108 | 0.554 | |||||
| 无 | 74 | 4(5.4) | 18(24.3) | 38(51.4) | 14(18.9) | ||
| 有 | 46 | 2(4.3) | 15(32.6) | 18(39.1) | 11(24.0) | ||
| 远处转移 | 3.061 | 0.351 | |||||
| 无 | 102 | 4(3.9) | 27(26.4) | 50(49.1) | 21(20.6) | ||
| 有 | 18 | 2(11.2) | 6(33.3) | 6(33.3) | 4(22.2) | ||
| 肿瘤原发灶 | 1.118 | 0.803 | |||||
| 直肠 | 64 | 2(3.1) | 18(28.1) | 31(48.5) | 13(20.3) | ||
| 结肠 | 56 | 4(7.1) | 15(26.8) | 25(44.6) | 12(21.5) | ||
| 浸润深度 | 3.020 | 0.374 | |||||
| T1~T2 | 26 | 1(3.8) | 6(23.1) | 16(61.5) | 3(11.6) | ||
| T3~T4 | 94 | 5(5.3) | 27(28.7) | 40(42.6) | 22(23.4) | ||
| 临床分期 | 2.081 | 0.564 | |||||
| Ⅰ~Ⅱ期 | 70 | 4(5.7) | 17(24.3) | 36(51.4) | 13(18.6) | ||
| Ⅲ~Ⅳ期 | 50 | 2(4.0) | 16(32.0) | 20(40.0) | 12(24.0) | ||
| 注 HHLA2:人内源性逆转录病毒-H长末端重复关联蛋白2(human endogenous retrovirus subfamily H long terminal repeat associating protein 2) | |||||||
PD-L1主要表达于结直肠癌细胞的细胞膜(图 2)。PD-L1阴性84例(70.0%),阳性36例(30.0%)。结直肠癌患者PD-L1表达在肿瘤的发生部位方面比较,直肠癌中表达高于结肠癌(P < 0.05);在性别、年龄、肿瘤分化程度、浸润深度、淋巴结转移、远处转移、脉管浸润及TNM临床分期方面比较,差异均无统计学意义(均P > 0.05,表 2)。
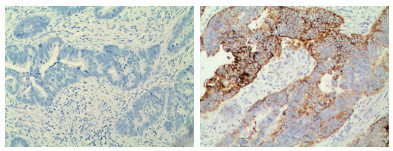
|
| 图 2 PD-L1在结直肠癌组织中的表达(MaxVision×100) Fig.2 PD-L1 expression in colorectal carcinoma tissues (MaxVision×100) |
| 临床病理特征 | 总例数 | PD-L1 | χ2值 | P值 | |
| 阴性 | 阳性 | ||||
| 性别 | 0.342 | 0.559 | |||
| 男性 | 78 | 56(71.8) | 22(28.2) | ||
| 女性 | 42 | 28(66.7) | 14(33.3) | ||
| 年龄 | 0.078 | 0.780 | |||
| < 60岁 | 59 | 42(71.2) | 17(28.8) | ||
| ≥60岁 | 61 | 42(68.9) | 19(31.1) | ||
| 分化程度 | 4.132 | 0.127 | |||
| 低 | 14 | 7(50.0) | 7(50.0) | ||
| 中 | 84 | 59(70.2) | 25(29.8) | ||
| 高 | 22 | 18(81.9) | 4(18.1) | ||
| 肿瘤部位 | 6.508 | 0.039 | |||
| 直肠 | 64 | 40(62.5) | 24(37.5) | ||
| 结肠 | 56 | 41(73.2) | 12(26.7) | ||
| 浸润深度 | 0.009 | 0.923 | |||
| T1~T2 | 26 | 18(69.2) | 8(30.8) | ||
| T3~T4 | 94 | 66(70.2) | 28(29.8) | ||
| 淋巴结转移 | 0.107 | 0.743 | |||
| 无 | 74 | 51(68.9) | 23(31.1) | ||
| 有 | 46 | 33(71.7) | 13(28.3) | ||
| 远处转移 | 0.797 | 0.372 | |||
| 无 | 102 | 73(71.6) | 29(28.4) | ||
| 有 | 18 | 11(61.1) | 7(38.9) | ||
| 临床分期 | 0.000 | 1.000 | |||
| Ⅰ~Ⅱ期 | 70 | 49(70.0) | 21(30.0) | ||
| Ⅲ~Ⅳ期 | 50 | 35(70.0) | 15(30.0) | ||
| 脉管浸润 | 0.135 | 0.714 | |||
| 无 | 99 | 70(70.7) | 29(29.3) | ||
| 有 | 21 | 14(66.7) | 7(33.3) | ||
| 注 PD-L1:程序性死亡受体配体-1(programmed death ligand-1) | |||||
结直肠癌组织中PD-L1表达阳性和阴性患者HHLA2表达比较,差异具有统计学意义(P < 0.01,表 3)。HHLA2表达和PD-L1表达呈正相关(r=0.211,P=0.021)。
| PD-LI | 总例数 | HHLA2 | χ2值 | P值 | |||
| 阴性 | 弱阳性 | 中阳性 | 强阳性 | ||||
| 阴性 | 84 | 6 | 23 | 44 | 11 | 11.557 | 0.007 |
| 阳性 | 36 | 0 | 10 | 12 | 14 | ||
| 注 HHLA2:人内源性逆转录病毒-H长末端重复关联蛋白2(human endogenous retrovirus subfamily H long terminal repeat associating protein 2);PD-L1:程序性死亡受体配体-1(programmed death ligand-1) | |||||||
排除掉组织芯片缺失及部分组织脱片,免疫组织化学共检测101例结直肠癌患者的TP53表达,其中TP53阴性26例(25.7%),阳性75例(74.3%)。结直肠癌中PD-L1表达与TP53表达呈正相关(r=0.234,P=0.018;表 4)。
| TP53 | 总例数 | PD-L1 | χ2值* | P值 | |
| 阴性 | 阳性 | ||||
| 阴性 | 26 | 23 | 3 | 5.533 | 0.019 |
| 阳性 | 75 | 48 | 27 | ||
| 注 PD-L1:程序性死亡受体配体-1(programmed death ligand-1);*配对χ2检验 | |||||
Kaplan-Meier法分析显示,HHLA2的表达与结直肠癌患者PFS相关,HHLA2强阳性患者PFS短于其他患者,差异具有统计学意义(P < 0.01,图 3)。运用多因素Cox风险回归分析HHLA2的表达与患者预后的影响因素,HHLA2不是结直肠癌患者预后的独立影响因素, 远处转移是影响患者预后的因素(P < 0.01,表 5)。
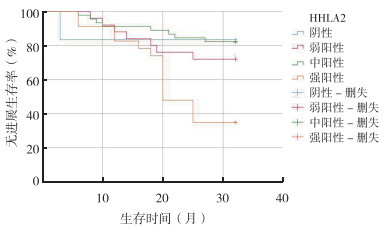
|
| 注 HHLA2:人内源性逆转录病毒-H长末端重复关联蛋白2(human endogenous retrovirus subfamily H long terminal repeat associating protein 2) 图 3 HHLA2表达与结直肠癌患者无进展生存期的关系 Fig.3 Correlation between HHLA2 expression and progression-free survival of colorectal carcinoma patients |
| 因素(参照) | HHLA2 | PD-L1 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 性别(女性) | 0.715(0.303~1.688) | 0.444 | 1.006(0.439~2.305) | 0.988 | |
| 年龄(< 60岁) | 1.442(0.661~3.146) | 0.358 | 1.574(0.709~3.494) | 0.265 | |
| 分化程度(低分化) | |||||
| 中分化 | 1.201(0.429~3.393) | 0.722 | 0.610(0.238~1.563) | 0.303 | |
| 高分化 | 0.458(0.089~2.363) | 0.351 | 0.372(0.069~1.988) | 0.247 | |
| 脉管浸润(无) | 0.946(0.362~2.470) | 0.909 | 0.881(0.335~2.318) | 0.798 | |
| 淋巴结转移(无) | 0.838(0.235~2.983) | 0.785 | 1.228(0.315~4.778) | 0.767 | |
| 远处转移(无) | 6.139(2.257~16.699) | < 0.01 | 3.002(1.209~7.456) | 0.018 | |
| 浸润深度(T1~T2) | 2.308(0.496~10.736) | 0.286 | 3.234(0.723~14.457) | 0.125 | |
| 临床分期(Ⅰ~Ⅱ期) | 1.875(0.464~7.583) | 0.378 | 1.738(0.387~7.799) | 0.470 | |
| HHLA2(阴性) | |||||
| 弱阳性 | 1.193(0.126~11.334) | 0.878 | |||
| 中阳性 | 0.964(0.113~8.233) | 0.974 | |||
| 强阳性 | 5.757(0.643~51.548) | 0.118 | |||
| PD-L1(阴性) | 2.402(1.093~5.278) | 0.029 | |||
| 注 HHLA2:人内源性逆转录病毒-H长末端重复关联蛋白2(human endogenous retrovirus subfamily H long terminal repeat associating protein 2);PD-L1:程序性死亡受体配体-1(programmed death ligand-1) | |||||
Kaplan-Meier法分析显示,PD-L1在肿瘤细胞上表达与预后相关(P < 0.01),PD-L1阳性患者PFS短于PD-L1阴性患者(P < 0.05,图 4)。多因素Cox风险回归发现,PD-L1是患者预后的独立影响因素(P < 0.05,表 5),肿瘤细胞上PD-L1阳性表达的患者预后更差。
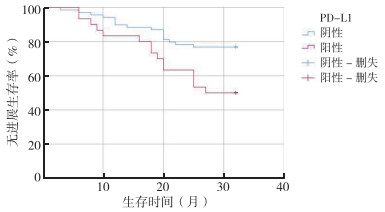
|
| 注 PD-L1:程序性死亡受体配体-1(programmed death ligand-1) 图 4 PD-L1表达与结直肠癌患者无进展生存的关系 Fig.4 Correlation between PD-L1 expression and the progression-free survival of colorectal carcinoma patients |
作为B7家族成员,HHLA2与其他B7家族成员的结构具有一定的相似性[14],其生物学功能包括:(1)在T细胞信号的刺激下抑制CD4+和CD8+ T细胞的增殖;(2)减少T细胞产生的细胞因子[15];(3)与活化的T细胞及其他免疫细胞上的特异性受体相互作用,促使肿瘤细胞逃避免疫监视[16]。目前,HHLA2研究主要集中于不同实体肿瘤中HHLA2的异常表达与患者临床病理特征的关系,进一步证实HHLA2阳性表达与患者预后和T淋巴细胞之间的相关性,提示HHLA2是潜在的免疫治疗靶点[17]。HHLA2在结直肠癌中研究较少。有研究运用免疫组织化学检测63例结直肠癌患者中HHLA2的表达发现,在结直肠癌中HHLA2阳性率与阳性强度高于癌旁组织;HHLA2高表达组中CD8阳性细胞数量低于HHLA2低表达组,提示HHLA2在结直肠癌中可以抑制T细胞的功能;HHLA2的表达水平与结直肠癌患者的生存预后存在相关性[6]。
本研究在该研究基础上扩大样本量(120例),同时探讨肿瘤原发部位和肿瘤分化程度等因素。结果显示,HHLA2在结直肠癌中阳性表达率为95.0%,其中高表达(中阳+强阳)患者占67.5%,结肠癌组织中HHLA2的阳性率与阳性强度高于癌旁组织,与Zhu等[6]研究结果基本一致。本研究发现,HHLA2在结直肠癌中的表达与肿瘤分化程度呈负相关(r=-0.212,P=0.021),低分化肿瘤中HHLA2表达强度更高;提示低分化肿瘤细胞中HHLA2表达增加,可以抑制CD4+和CD8+ T细胞的增殖,与其配体结合导致肿瘤细胞发生免疫逃逸,促进肿瘤的发生和进展[16]。肿瘤的分化程度与肿瘤的恶性程度密切相关,肿瘤分化程度越低,侵袭性越强,肿瘤恶性程度越高,提示HHLA2强阳性的患者,患者预后可能更差。进一步研究也证实,HHLA2强阳性表达的患者生存时间降低,低分化结直肠癌患者的预后更差(P < 0.01)。HHLA2强阳性患者的PFS降低,但Cox回归模型显示,HHLA2表达不是结直肠癌患者预后的独立影响因素,分析造成这种结果的原因可能是样本量不足。综上所述,HHLA2在结直肠癌中异常表达,与肿瘤分化程度呈负相关,与结直肠癌患者的预后密切相关,有潜力成为结直肠癌免疫治疗新的靶点和生物标志物。
筛选合适的生物标志物预测抗PD-1/PD-L1治疗的疗效具有十分重要的科学意义。目前,PD-L1的表达量仍是预测PD-1/PD-L1抑制剂的疗效的重要指标[18-19]。在结直肠癌中,PD-L1的表达与患者预后的关系尚无定论[20-21]。本研究发现,肿瘤细胞中PD-L1表达在肿瘤原发灶部位方面比较,差异具有统计学意义(P < 0.05),与Kim等[22]研究结果相似。虽然结肠癌与直肠癌基因改变的模式是相同的,但两者肿瘤微环境以及周边淋巴管和血管等分布及数量差异可能是导致PD-L1表达有差异的原因之一。同时样本量不够大、检测平台和抗体不同以及判读指标不一也可能造成本结果与其他研究有差异。Cox风险回归结果显示,PD-L1为结直肠癌患者预后的独立危险因素(P < 0.05),PD-L1阳性表达的患者预后更差。TP53基因是重要的抑癌基因,在抑制基因突变以及肿瘤发生和发展中发挥重要作用,且在结直肠癌中突变率较高,与多种肿瘤预后密切相关,已作为结直肠癌常规筛查。有研究报道,TP53突变肿瘤细胞与PD-L1表达密切相关,在肺腺癌中TP53突变会降低患者对表皮生长因子受体络氨酸激酶抑制剂治疗的反应时间,且TP53突变肿瘤中PD-L1表达更高[23]。TP53突变患者可能拥有更好的免疫治疗效果[24]。而目前在结直肠癌中关于TP53与PD-L1的关系研究较少。本研究发现,TP53表达与PD-L1表达呈正相关(r=0.234,P=0.018),与既往研究[23-24]结果一致。推测在结直肠癌中TP53突变可引起多种基因激活,促进肿瘤浸润淋巴细胞的增殖[24],具有更强的免疫原性,继而诱导PD-L1的表达。提示在结直肠癌肿瘤免疫治疗中,TP53突变患者可能更好地从免疫治疗中获益,同时为寻找更准确的PD-1/PD-L1抑制剂生物标志物提供一定的参考。
HHLA2与PD-L1之间的关系的相关研究已在多种实体肿瘤开展[5-10]。在骨肉瘤中有检测到HHLA2的表达,其在晚期肿瘤和转移性组织中高表达,且免疫荧光双染显示,HHLA2表达比例高于PD-L1[5]。在肝内胆管癌[10]和肾透明细胞癌[7]中,HHLA2的表达高于PD-L1,在部分PD-L1阴性患者中HHLA2表达异常升高,与PD-L1比较,HHLA2阳性率更高,具有更明确的预后意义。非小细胞肺癌中发现,与PD-L1比较,HHLA2对T细胞受体介导的人类CD4+和CD8+ T细胞增殖具有更强的抑制作用[8-9]。因此,HHLA2作为PD-L1阴性肿瘤的免疫治疗突破点是有科学与应用价值的。目前,结直肠癌中关于HHLA2与PD-L1关系的研究报道甚少。本研究结果表明,结直肠癌中HHLA2与PD-L1表达呈正相关(r=0.211,P=0.021),且HHLA2在结直肠癌组织中阳性率为95.0%,远高于PD-L1的30.0%。推测HHLA2和PD-L1在肿瘤微环境中存在着部分相同的作用机制,可为结直肠癌中PD-L1表达阴性患者的免疫治疗提供新思路。
综上所述,HHLA2有望成为结直肠癌免疫治疗新的靶点和预后标志物,在结直肠癌组织中,HHLA2表达与PD-L1呈正相关,TP53与PD-L1表达呈正相关,提示在肿瘤发生和发展可能分别起相互促进的作用,可为免疫治疗的更好应用提供新思路。同时,本研究也存在样本量不够大和对相关机制的研究不够深入等不足。后期,笔者将通过扩大样本量以及采用细胞和动物实验对其具体作用机制进行更深入探讨,以期为临床提供更多参考。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
Riley RS, June CH, Langer R, et al. Delivery technologies for cancer immunotherapy[J]. Nat Rev Drug Discov, 2019, 18(3): 175-196. DOI:10.1038/s41573-018-0006-z |
| [3] |
Jackson CM, Choi J, Lim M. Mechanisms of immunotherapy resistance: lessons from glioblastoma[J]. Nat Immunol, 2019, 20(9): 1100-1109. DOI:10.1038/s41590-019-0433-y |
| [4] |
刘爽, 姜婷, 陈功, 等. 局部进展期直肠癌治疗模式新进展[J]. 实用肿瘤杂志, 2021, 36(1): 10-17. |
| [5] |
Koirala P, Roth ME, Gill J, et al. HHLA2, a member of the B7 family, is expressed in human osteosarcoma and is associated with metastases and worse survival[J]. Sci Rep, 2016, 6(1): 31154. DOI:10.1038/srep31154 |
| [6] |
Zhu Z, Dong W. Overexpression of HHLA2, a member of the B7 family, is associated with worse survival in human colorectal carcinoma[J]. Onco Targets Ther, 2018, 11(1): 1563-1570. |
| [7] |
Chen D, Chen W, Xu Y, et al. Upregulated immune checkpoint HHLA2 in clear cell renal cell carcinoma: a novel prognostic biomarker and potential therapeutic target[J]. J Med Genet, 2019, 56(1): 43-49. DOI:10.1136/jmedgenet-2018-105454 |
| [8] |
Cheng H, Janakiram M, Borczuk A, et al. HHLA2, a new immune checkpoint member of the B7 family, is widely expressed in human lung cancer and associated with EGFR mutational status[J]. Clin Cancer Res, 2017, 23(3): 825-832. DOI:10.1158/1078-0432.CCR-15-3071 |
| [9] |
Cheng H, Borczuk A, Janakiram M, et al. Wide expression and significance of alternative immune checkpoint molecules, B7x and HHLA2, in PD-L1-negative human lung cancers[J]. Clin Cancer Res, 2018, 24(8): 1954-1964. DOI:10.1158/1078-0432.CCR-17-2924 |
| [10] |
Jing CY, Fu YP, Yi Y, et al. HHLA2 in intrahepatic cholangiocarcinoma: an immune checkpoint with prognostic significance and wider expression compared with PD-L1[J]. J Immunother Cancer, 2019, 7(1): 77. DOI:10.1186/s40425-019-0554-8 |
| [11] |
Shimonosono M, Arigami T, Yanagita S, et al. The association of human endogenous retrovirus-H long terminal repeat-associating protein 2 (HHLA2) expression with gastric cancer prognosis[J]. Oncotarget, 2018, 9(31): 22069-22078. DOI:10.18632/oncotarget.25179 |
| [12] |
Chen Q, Wang J, Chen W, et al. B7-H5/CD28H is a co-stimulatory pathway and correlates with improved prognosis in pancreatic ductal adenocarcinoma[J]. Cancer Sci, 2019, 110(2): 530-539. DOI:10.1111/cas.13914 |
| [13] |
张登才, 刘斌, 张丽华, 等. 一种简便实用的组织芯片制作方法[J]. 诊断病理学杂志, 2013, 20(11): 722-724. DOI:10.3969/j.issn.1007-8096.2013.11.015 |
| [14] |
Zhao R, Chinai JM, Buhl S, et al. HHLA2 is a member of the B7 family and inhibits human CD4 and CD8 T-cell function[J]. Proc Natl Acad Sci U S A, 2013, 110(24): 9879-9884. DOI:10.1073/pnas.1303524110 |
| [15] |
Zhu Y, Yao S, Iliopoulou BP, et al. B7-H5 costimulates human T cells via CD28H[J]. Nat Commun, 2013, 4(6): 2043. |
| [16] |
Rieder SA, Wang J, White N, et al. B7-H7 (HHLA2) inhibits T-cell activation and proliferation in the presence of TCR and CD28 signaling[J]. Cell Mol Immunol, 2021, 18(6): 1503-1511. DOI:10.1038/s41423-020-0361-7 |
| [17] |
刘春, 邓述恺. HHLA2在恶性肿瘤中的研究进展[J]. 中国免疫学杂志, 2018, 34(2): 306-309, 316. DOI:10.3969/j.issn.1000-484X.2018.02.031 |
| [18] |
王俊, 冉凤鸣, 钱羽. PD-L1表达检测的研究进展[J]. 实用肿瘤杂志, 2020, 35(1): 89-93. |
| [19] |
Eriksen AC, Sorensen FB, Lindebjerg J, et al. Programmed death ligand-1 expression in stage Ⅱ colon cancer-experiences from a nationwide populationbased cohort[J]. BMC Cancer, 2019, 19(1): 142. DOI:10.1186/s12885-019-5345-6 |
| [20] |
Zhu H, Qin H, Huang Z, et al. Clinical significance of programmed death ligand-1 (PD-L1) in colorectal serrated adenocarcinoma[J]. Int J Clin Exp Pathol, 2015, 8(8): 9351-9359. |
| [21] |
Li Y, Liang L, Dai W, et al. Prognostic impact of programed cell death-1 (PD-1) and PD-ligand 1 (PD-L1) expression in cancer cells and tumor infiltrating lymphocytes in colorectal cancer[J]. Mol Cancer, 2016, 15(1): 55. DOI:10.1186/s12943-016-0539-x |
| [22] |
Kim KJ, Yang HK, Kim WH, et al. Combined prognostic effect of PD-L1 expression and immunoscore in microsatellite-unstable advanced gastric cancers[J]. Oncotarget, 2017, 8(35): 58887-58902. DOI:10.18632/oncotarget.19439 |
| [23] |
Biton J, Mansuet-Lupo A, Pécuchet N, et al. TP53, STK11, and EGFR mutations predict tumor immune profile and the response to anti-PD-1 in lung adenocarcinoma[J]. Clin Cancer Res, 2018, 24(22): 5710-5723. |
| [24] |
Dong ZY, Zhong WZ, Zhang XC, et al. Potential predictive value of TP53 and KRAS mutation status for response to PD-1 blockade immunotherapy in lung adenocarcinoma[J]. Clin Cancer Res, 2017, 23(12): 3012-3024. |
 2022, Vol. 37
2022, Vol. 37


