文章信息
- 庞霄君, 丁秋龙, 潘文胜
- 早期食管癌内镜黏膜下剥离术后胃体上部穿孔一例诊治分析
- 实用肿瘤杂志, 2019, 34(3): 267-269
-
作者简介
- 庞霄君(1981-), 女, 浙江天台人, 主治医师, 从事消化系统疾病临床诊治研究.
-
通信作者
- 丁秋龙, 306934044@qq.com
-
文章历史
- 收稿日期:2019-01-06
2. 浙江省人民医院消化内科, 浙江 杭州 310003
内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已成为消化道早癌及癌前病变的首选治疗方法[1],但ESD有发生穿孔、出血、疼痛和感染等风险,其中穿孔最为危急;穿孔多发生于ESD手术区域,而发生在ESD手术部位以外区域较为少见。近来本院收治1例早期食管癌患者,经ESD治疗食管黏膜病变,术中出现胃体上部穿孔,经内镜下钛夹闭合创面后保守治疗,完全康复出院。现报道如下。
1 病例资料患者男性,51岁,于2018年8月1日在浙江省天台县人民医院体检。查胃镜发现,距门齿28~35 cm食管黏膜轻度凹陷,表面粗糙,病变呈螺旋状,长度7 cm,0~Ⅱc型病变(图 1A);病理检查提示食管高级别上皮内瘤变。于2018年8月10日行窄带成像术(narrow band imagind,NBI)+放大内镜检查。观察病变部位的上皮乳头内毛细血管袢(intraepithlial papillary capillary loops, IPCL)形态,参照日本食管学会2012年制定的IPCL分型[2-3],见病变部位IPCL血管形态扩张迂曲,粗细不均、形态不一的襻状血管(B1型);局部还可见毛细血管襻形成较少的异常血管,非襻状血管(B2型)。碘染色见病变区域呈不染或浅染,并可见粉红征(图 1B~1C)。判断浸润深度最深处为黏膜肌层至黏膜下层浅层,考虑早期食管癌,有ESD的相对适应证[1]。获得患者知情同意后,于2018年8月22日收入本院行ESD术治疗。

|
| 注 A:距门齿28~35 cm食管黏膜轻度凹陷,表面粗糙,病变呈螺旋状,长度7 cm;B:NBI下,病灶有边界,呈茶褐色改变;C:碘染色,病变呈不染或浅染,并可见粉红征;D:食管ESD术后创面;E:胃体上部穿孔;F:钛夹夹闭穿孔创面 图 1 食管肿瘤内镜下表现和内镜下黏膜剥离术及术后创面情况 |
完善相关术前准备,并签署手术知情同意书,特别告知患者及家属术中如有发生穿孔,内镜下修补术失败,有转腔镜或开胸腹行缝合术可能。ESD术在全身麻醉下进行,操作步骤如下:确定病变范围和深度;标记;黏膜下注射;切开;黏膜下剥离;创面处理。患者在手术过程中,曾出现一度躁动,恶心,呃逆,经加深麻醉深度后好转。手术结束时,观察食管病变部位,病灶已完整切除,创面光整(图 1D)。内镜进入胃腔内抽吸液体及气体时,发现胃体上部小弯侧穿孔,直径达到1.0 cm(图 1E)。立即用多枚钛夹夹闭创面(图 1F)。术后给予特别护理,心电监护,禁食,胃肠减压;并给予艾司奥美拉唑钠注射液(商品名:耐信)40 mg,静脉滴注,2次/d,制酸护胃治疗;哌拉西林钠他唑巴坦钠注射液(商品名:邦达)3.375 g,静脉滴注,3次/d,抗感染治疗。
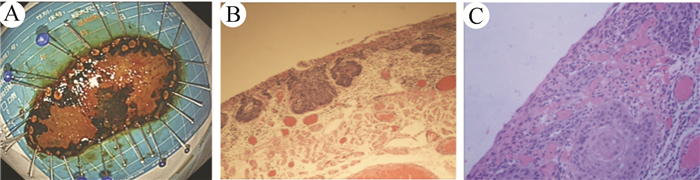
术后1周病理结果提示,(食管)鳞状细胞癌,局部浸润至黏膜下层(侵犯深度100 μm),病变面积8.0 cm×2.8 cm,周切缘及基底阴性(图 2A~2C)。
|
| 注 A:手术标本,病变面积8.0 cm×2.8 cm;B:术后病理检查结果(HE×40);C:术后病理检查结果(HE×200) 图 2 手术标本及术后病理检查结果 |
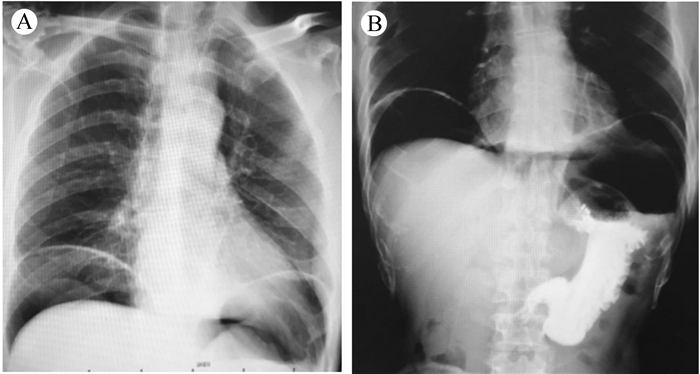
术后患者曾出现右侧下胸痛及上腹疼痛;查体无腹膜刺激症状,给予查肌钙蛋白正常,血气分析,心电图正常,血常规提示降钙素原及C反应蛋白(C-reactive protein,CRP)升高,腹部立位片及腹部CT检查提示两膈下多量游离气体(图 3A),考虑与胃穿孔相关,继续积极内科保守治疗后,患者病情逐渐好转。术后8 d患者无不适主诉,查体无阳性体征,查血常规示CRP及降钙素原正常,给予上消化道造影,发现上消化道无造影剂外溢(图 3B),遂给予逐步恢复饮食,患者术后2周完全康复出院。
|
| 注 A:腹部立位片提示膈下游离气体;B:上消化道造影提示无造影剂外溢 图 3 术后腹部立位片及上消化道造影检查结果 |
ESD作为消化道早期肿瘤的首选治疗方法,其对于消化道早癌的疗效可与外科手术相当[4-5]。ESD的治疗风险主要包括出血、穿孔、皮下气肿[6]、疼痛与感染。胃ESD穿孔率为1.2%~9.7%[7],食管穿孔率为0%~6%[8],结直肠穿孔率1.4%~10.0%[9]。穿孔的部位一般发生在手术部位,发生的原因可能与病变类型、病变发生的位置及病变深度、手术医师的操作经验、手术时间以及患者的疾病状态等因素有关。对于穿孔的处理,国内外也有多种不同的方法报道,多数ESD术后穿孔可用金属钛夹夹闭[10-11];还可以选用钛夹联合尼龙绳闭合术;针对较大的穿孔,还可采用Qver-The-Scope-Clip system(OTSC)耙状金属夹系统等[12-13]。
ESD的穿孔,一般发生在手术部位,但该患者为早期食管癌,病变完整切除,手术创面光整,无出血穿孔等表现。该病例的穿孔发生在非手术部位,位于胃体上部小弯侧。此种穿孔现象,使用PubMed查找外文文献及在万方数据库中检索均未发现类似穿孔的病例报道。分析出现该穿孔可能的原因:患者食管病灶大,ESD操作时间长,胃腔内气体积聚,压力较高,加上在手术过程中,可能因麻醉深浅度全程不一致,患者曾出现一度躁动、恶心、呃逆、胃腔内压力骤然升高,引起胃体上部小弯胃壁全层撕裂伤,最终导致局部穿孔。针对本例穿孔,采取金属钛夹夹闭创面(与手术部位发生穿孔的处理原则相同),术后禁食,胃肠减压,应用质子泵抑制剂(proton pump inhibitor, PPI),抗感染,并营养支持对症治疗;患者康复出院。
该病例诊治提示行ESD时需注意以下事项。(1)掌握ESD适应证,术前应向患者及家属详细讲解ESD操作过程和可能的结果以及存在的风险,并签署知情同意书;该病例ESD手术指征明确,术前与患者及家属充分告知,术中出现胃穿孔,患者及家属能理解接受。(2)ESD过程中,要时刻注意抽吸消化道腔内气体;若发生穿孔,尽量减少注气量;本院ESD操作时采用高纯二氧化碳注气,代替空气,加速气体吸收,缓解气腹的程度。(3)尽量吸净胃内的液体,避免穿孔后大量液体进入腹腔。(4)警惕非手术部位的并发症。(5)发生穿孔后,尽量缩短手术操作时间。(6)上消化道ESD手术耗时相对较长,一般在全身麻醉及气管插管状态下进行治疗较为安全,手术过程中注意麻醉深浅度,保持麻醉过程中深浅度一致。
随着内镜技术日新月异的发展,技术难度较大的ESD术已日益普及,操作时采取必要的防范措施,最大限度地降低操作风险,使ESD技术的发展不断完善。
| [1] |
内镜黏膜下剥离术专家协助组. 消化道黏膜病变内镜下剥离术治疗专家共识[J]. 中华胃肠外科杂志, 2012, 15(10): 1083-1086. DOI:10.3760/cma.j.issn.1671-0274.2012.10.028 |
| [2] |
Oyama T, Inoue H, Arima M, et al. Prediction of the invasion depth of superficial squamous cell carcinoma based on microvessel morphology:magnifying endoscopic classification of the Japan Esophageal Society[J]. Esophagus, 2017, 14(2): 105-112. DOI:10.1007/s10388-016-0527-7 |
| [3] |
Oyama T, Ishihara R, Takeuchi M, et al. Tu 1588 Usefulness of Japan Esophageal Society classification of magnified endoscopy for the diagnosis of superficial esophageal squamous cell carcinoma[J]. Gastrointest Endosc, 2012, 75(4): AB456. |
| [4] |
Toyonaga T, Man-i M, East JE, et al. 1, 635 Endoscopic submucosal dissection cases in the esophagus, stomach, and colorectal:complication rates and long-term outcomes[J]. Surg Endosc, 2013, 27(3): 1000-1008. DOI:10.1007/s00464-012-2555-2 |
| [5] |
Chiu PW, Teoh AY, To KF, et al. Endoscopic submucosal dissection (ESD) compared with gastrectomy for treatment of early gastric neoplasia:a retrospective cohort study[J]. Surg Endosc, 2012, 26(12): 3584-3591. DOI:10.1007/s00464-012-2371-8 |
| [6] |
陈燕, 吾红光, 潘文胜. 直肠腺瘤内镜黏膜下剥离术后颈部纵隔广泛气肿一例[J]. 实用肿瘤杂志, 2017, 32(3): 273-275. |
| [7] |
Cho KB, Jeon WJ, Kim JJ. Worldwide experiences of endoscopic submucosal dissection:not just Eastern acrobatics[J]. World J Gastroenterol, 2011, 17(21): 2611-2617. DOI:10.3748/wjg.v17.i21.2611 |
| [8] |
Ono S, Fujishiro M, Koike K. Endoscopic submucosal dissection for superficial esophageal neoplasms[J]. World J Gastrointest Endosc, 2012, 4(5): 162-166. DOI:10.4253/wjge.v4.i5.162 |
| [9] |
钟彩玲, 苏艺胜, 李叶, 等. 内镜下钛夹夹闭治疗大肠ESD术后超24h迟发穿孔2例[J]. 现代消化及介入诊疗, 2018, 23(3): 430-432. DOI:10.3969/j.issn.1672-2159.2018.03.059 |
| [10] |
Suzuki H, Ikeda K. Endoscopic mucosal resection and full thickness resection with complete defect closure for early gastrointestinal malignancies[J]. Endoscopy, 2001, 33(5): 437-439. DOI:10.1055/s-2001-14269 |
| [11] |
Zhou PH, Yao LQ, Qin XY, et al. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria[J]. Surg Endosc, 2011, 25(9): 2926-2931. DOI:10.1007/s00464-011-1644-y |
| [12] |
张银, 范志宁, 吴浩, 等. 内镜下荷包缝合术用于胃壁切除术穿孔后创面的闭合[J]. 中华胃肠外科杂志, 2015, 18(2): 150-154. DOI:10.3760/cma.j.issn.1671-0274.2015.02.013 |
| [13] |
陆浩. 1例内镜下黏膜剥离术穿孔患者的处理体会[J]. 中国内镜杂志, 2016, 22(9): 108-110. |
 2019, Vol. 34
2019, Vol. 34


