文章信息
- 李盼, 王云月, 阮骊韬
- Li Pan, Wang Yunyue, Ruan Litao
- 乳腺癌患者临床病理及超声特征与同侧腋窝淋巴结转移的关系
- Correlation between clinicopathological and ultrasound characteristics and ipsilateral axillary lymph node metastasis in breast cancer patients
- 实用肿瘤杂志, 2022, 37(5): 418-423
- Journal of Practical Oncology, 2022, 37(5): 418-423
-
通信作者
- 阮骊韬, E-mail: rulitao@163.com
-
文章历史
- 收稿日期:2021-04-22
乳腺癌作为严重威胁人群健康的癌症之一,其发病率一直居于全球前列。2018年的全球癌症统计报告显示,2018年全球乳腺癌新发患者估计为2 088 849例,占到总新发肿瘤例数的11.6%,乳腺癌死亡例数高达616 679例,占总肿瘤死亡例数的6.6%[1]。虽然我国女性乳腺癌死亡率较低,但其发病率已居于城乡女性首位,同时呈现不断上升趋势[2-4]。腋窝淋巴结状态对乳腺癌患者的治疗及预后有重要影响,而现阶段对乳腺癌患者的腋窝淋巴结状态检测主要还是依靠腋窝淋巴结清扫术,这会对乳腺癌患者的生活质量及其预后会有较大影响[5-6]。因此本文拟通过探讨乳腺癌患者超声特征与同侧腋窝淋巴结转移的相关性,对乳腺癌的腋窝淋巴结转移进行预测。
1 资料与方法 1.1 研究对象选取2019年1月至7月在本院就诊的女性乳腺癌患者120例作为研究对象。所有患者均为单发、初发初治、无远处转移且接受手术治疗,术中均行同侧腋窝淋巴结清扫术或前哨淋巴结活检。患者年龄27~78岁,(52.7±10.8)岁。本研究已通过本院医学伦理委员会审批。
1.2 仪器与方法采用Philips IU22超声诊断仪(皇家飞利浦电子集团,荷兰)的5~12 MHz线阵探头或LoGiq E9超声诊断仪(GE, 美国)的5~15 MHz线阵探头,选用乳腺的检查条件。由 > 3年超声检查经验的医师观察乳腺肿物及腋窝淋巴结,二维超声时选择病灶最大切面为标准切面,彩色多普勒血流显像(color Doppler flow imaging,CDFI)及脉冲频谱多普勒(pulsed-wave Doppler,PW)时选择乳腺病灶血供最丰富切面为标准切面,观察并记录病灶特征(病灶多发者:病灶大小取所有病灶最大径之和,其余参数选择最大病灶记录),记录病灶的数目、象限、大小、纵横比、形态、边缘毛刺征、微钙化及Adler血流分级等相关参数。记录病灶的病理分型和组织学分级,判断雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)的表达状态、Ki-67阳性百分比、分子分型及同侧腋窝淋巴结是否转移。
1.3 统计学分析数据录入采用Excel 2010软件;数据分析采用SPSS 20.0软件。计量资料采用均数±标准差(x±s)进行描述。若数据符合正态分布,组间比较采用t检验;若不符合,则采用秩和检验进行分析。计数资料采用频数(百分比)进行描述,组间比较采用χ2检验。危险因素的探讨采用二分类Logistic回归。以P < 0.05为差异具有统计学意义。
2 结果 2.1 基本临床病理特征及与同侧腋窝淋巴结转移的关系120例患者中,同侧腋窝淋巴结转移阳性49例,阴性71例。同侧腋窝淋巴结转移阳性和阴性患者在年龄、ER水平、PR水平、HER2水平、Ki-67表达及分子分型方面比较,差异均无统计学意义(均P > 0.05,表 1)。
| 临床特征 | 总例数 | 同侧腋窝淋巴结 | t/χ2值 | P值 | |
| 阳性(n=49) | 阴性(n=71) | ||||
| 年龄(x±s,岁) | / | 54.07±1.34 | 50.71±1.42 | 1.680 | 0.096 |
| ER | 2.422 | 0.120 | |||
| (+) | 81 | 37(45.7) | 44(54.3) | ||
| (-) | 39 | 12(30.8) | 27(69.2) | ||
| PR | 2.368 | 0.124 | |||
| (+) | 56 | 27(48.2) | 29(51.8) | ||
| (-) | 64 | 22(34.4) | 42(65.5) | ||
| HER2 | 0.001 | 0.978 | |||
| (+) | 32 | 13(40.6) | 19(59.4) | ||
| (-) | 88 | 36(40.9) | 52(59.1) | ||
| Ki-67 | 0.004 | 0.952 | |||
| (+) | 98 | 40(40.8) | 58(59.2) | ||
| (-) | 22 | 9(40.9) | 13(59.1) | ||
| 分子分型 | 2.705 | 0.439 | |||
| LuminalA | 18 | 7(38.9) | 11(61.1) | ||
| LuminalB | 62 | 29(46.8) | 33(53.2) | ||
| HER2 | 16 | 4(25.0) | 12(75.0) | ||
| Triple negative | 24 | 9(37.5) | 15(62.5) | ||
| 注ER≥1%为(+);PR≥1%为(+);HER2(3+)或HER2(2+)且FISH扩增为(+);Ki-67≥14%为(+);腋窝淋巴结≥1为阳性;ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor-2) | |||||
同侧腋窝淋巴结转移阳性和阴性患者在乳腺结节大小、形态、所在象限和内部血流情况方面比较,差异均具有统计学意义(均P < 0.05,表 2,图 1~2)。结节≥20 mm,更易出现同侧腋窝淋巴结转移;该亚组中,转移阳性31例(52.5%)。形态规则结节亚组无同侧腋窝淋巴结转移,不规则亚组转移阳性49例(48.0%)。在不同象限亚组,外上象限转移最多,共30例(56.6%),外下象限次之,转移10例(45.5%),内上象限转移7例(24.1%),内下象限转移仅2例(12.5%)。另外,在不同血流亚组,血流越丰富,同侧腋窝淋巴结转移阳性比例越高;血流为0级时,转移阳性率是29.3%;1和2级血流亚组转移阳性率分别为41.4%和37.5%;3级血流亚组转移阳性率是68.0%。同侧腋窝淋巴结转移阳性和阴性患者在结节的纵横比、是否存在毛刺征以及钙化灶方面比较,差异均无统计学意义(均P > 0.05)。
| 超声参数 | 同侧腋窝淋巴结 | χ2值 | P值 | |
| 阳性(n=49) | 阴性(n=71) | |||
| 大小 | 6.586 | 0.010 | ||
| < 20 mm | 18(29.5) | 43(70.5) | ||
| ≥20 mm | 31(52.5) | 28(47.5) | ||
| 象限 | 14.313 | 0.003 | ||
| 外上象限 | 30(56.6) | 23(43.4) | ||
| 外下象限 | 10(45.5) | 12(54.5) | ||
| 内上象限 | 7(24.1) | 22(75.9) | ||
| 内下象限 | 2(12.5) | 14(87.5) | ||
| 形态 | 14.615 | < 0.01 | ||
| 规则 | 0(0.0) | 18(100.0) | ||
| 不规则 | 49(48.0) | 53(52.0) | ||
| 纵横比 | 0.085 | 0.771 | ||
| < 1 | 43(41.3) | 61(58.7) | ||
| ≥1 | 6(37.5) | 10(62.5) | ||
| 毛刺征 | 1.855 | 0.173 | ||
| (+) | 31(46.3) | 36(53.7) | ||
| (-) | 18(34.0) | 35(66.0) | ||
| 钙化 | 0.566 | 0.452 | ||
| (+) | 22(44.9) | 27(55.1) | ||
| (-) | 27(38.0) | 44(62.0) | ||
| Adler血流分级 | 10.865 | 0.012 | ||
| 0级 | 17(29.3) | 41(70.7) | ||
| 1级 | 12(41.4) | 17(58.6) | ||
| 2级 | 3(37.5) | 5(62.5) | ||
| 3级 | 17(68.0) | 8(32.0) | ||
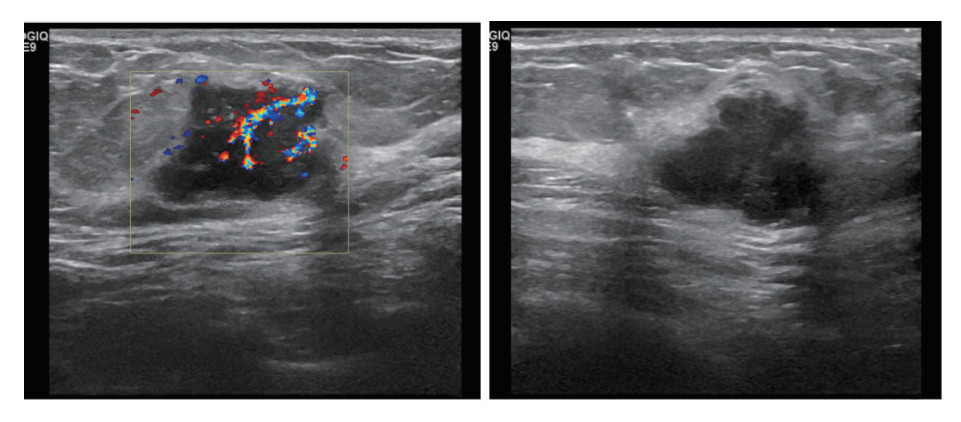
|
| 注A:乳腺超声检查图像示,肿瘤位于左乳外上象限,结节最大径23 mm,形态不规则;B:CDFI检查示,血流信号丰富,Adler分级为3级 图 1 45岁女性左乳浸润性导管癌患者术后病理提示存在左侧腋窝淋巴结转移 Fig.1 Postoperative pathology of a 45-year-old female patient with invasive ductal carcinoma of the left breast showed left axillary lymph node metastasis |
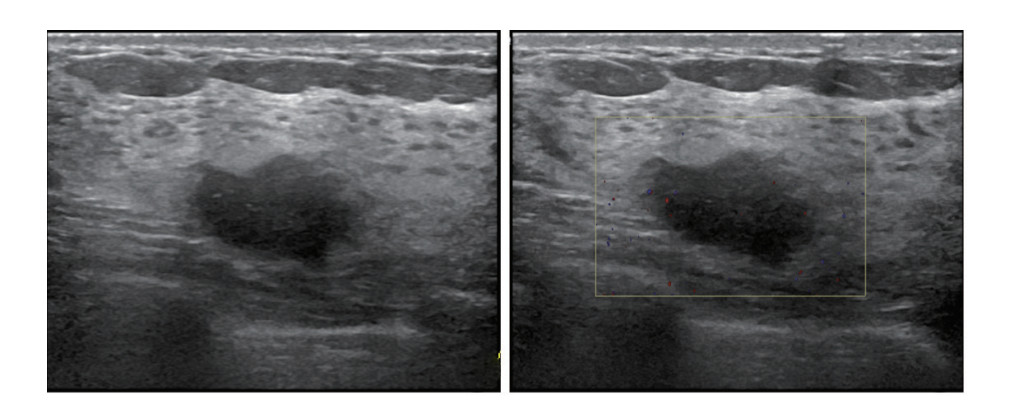
|
| 注A:乳腺超声检查图像示,肿瘤位于左乳内下象限,结节最大径18 mm,形态稍欠规则;B:CDFI检查未见明显血流信号,Adler分级为0级 图 2 57岁女性左乳浸润性导管癌患者前哨淋巴结活检未发现同侧腋窝淋巴结转移 Fig.2 Sentinel lymph node biopsy in a 57-year-old woman with invasive ductal carcinoma of the left breast revealed no ipsilateral axillary lymph node metastasis |
将上述差异具有统计学意义(P < 0.05)的单因素纳入Logistic回归分析显示,结节≥20 mm患者发生同侧腋窝淋巴结转移的风险是 < 20 mm患者的3.346倍(P < 0.01)。结节在外上象限和在外下象限的患者发生同侧腋窝淋巴结转移的风险分别是结节在内下象限的患者的13.191和7.300倍(均P < 0.05,表 3)。
| 超声特征 | P值 | OR | 95%CI |
| 大小(≥20 mm vs < 20 mm) | 0.007 | 3.346 | 1.391~8.050 |
| 象限 | |||
| 外上象限vs内下象限 | 0.002 | 13.191 | 2.489~69.914 |
| 外下象限vs内下象限 | 0.030 | 7.300 | 1.218~43.763 |
| 内上象限vs内下象限 | 0.133 | 4.012 | 0.656~24.515 |
| 形态(规则vs不规则) | 0.998 | 1 188 546 994 | 0.000~+∞ |
| Adler血流分级 | |||
| 0级vs 1级 | 0.068 | 0.542 | 0.162~1.810 |
| 0级vs 2级 | 0.586 | 0.679 | 0.169~2.731 |
| 0级vs 3级 | 0.313 | 0.338 | 0.041~2.775 |
据第8版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)乳腺癌分期标准[7],将同侧腋窝淋巴结转移数目分为1~3枚、4~9枚和≥10枚三组。三组结节的大小、象限、纵横比、毛刺征、钙化灶及乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)分类比较,差异均无统计学意义(均P > 0.05,表 4);结节形态和结节血流比较,差异均具有统计学意义(均P < 0.05,表 4)。
| 超声特征 | 同侧腋窝转移淋巴结数目 | χ2值 | P值 | |||
| (-) | 1~3枚 | 4~9枚 | ≥10枚 | |||
| 大小 | 7.054 | 0.070 | ||||
| < 20 mm | 43 (70.5) | 6 (9.8) | 5 (8.2) | 7 (11.5) | ||
| ≥20 mm | 28 (47.5) | 12 (20.3) | 10 (16.9) | 9 (15.3) | ||
| 象限 | 14.377 | 0.084 | ||||
| 外上象限 | 23 (43.4) | 12 (22.6) | 8 (15.1) | 10 (18.9) | ||
| 外下象限 | 12 (54.5) | 3 (13.6) | 4 (18.2) | 3 (13.6) | ||
| 内上象限 | 22 (75.9) | 2 (6.9) | 3 (10.3) | 2 (6.9) | ||
| 内下象限 | 14 (87.5) | 1 (6.3) | 0 (0.0) | 1 (6.3) | ||
| 形态 | 13.744 | 0.002 | ||||
| 规则 | 18 (100.0) | 0 (0.0) | 0 (0.0) | 0 (0.0) | ||
| 不规则 | 53 (52.0) | 18 (17.6) | 15 (14.7) | 16 (15.7) | ||
| 毛刺征 | 4.734 | 0.192 | ||||
| (+) | 36 (53.7) | 11 (16.4) | 12 (17.9) | 8 (11.9) | ||
| (-) | 35 (66.0) | 7 (13.2) | 3 (5.7) | 8 (15.1) | ||
| 钙化 | 1.286 | 0.732 | ||||
| (+) | 27 (55.1) | 7 (14.3) | 8 (16.3) | 7 (14.3) | ||
| (-) | 44 (62.0) | 11 (15.5) | 7 (9.9) | 9 (12.7) | ||
| Adler血流分级 | 15.753 | 0.045 | ||||
| 0级 | 41 (70.7) | 5 (8.6) | 5 (8.6) | 7 (12.1) | ||
| 1级 | 17 (58.6) | 3 (10.3) | 6 (20.7) | 3 (10.3) | ||
| 2级 | 5 (62.5) | 2 (25.0) | 0 (0.0) | 1 (12.5) | ||
| 3级 | 8 (32.0) | 8 (32.0) | 4 (16.0) | 5 (20.0) | ||
约75%的乳腺淋巴液引流入腋窝淋巴结。乳腺癌细胞可以通过乳腺实质和间质中的淋巴丛和网络迁移到腋窝淋巴结导致腋窝淋巴结转移[8]。腋窝淋巴结状态是乳腺癌患者预后的一个重要影响因素[9-10]。现阶段对乳腺癌的腋窝淋巴结状态的判断金标准是淋巴结活检,但是其并发症对患者的损伤以及病情恢复都会产生一定的影响。许多研究发现,患者确诊时年龄、肿瘤大小、所在象限、原始侵袭状态、分子分型、肿瘤分级和影像学特征等因素都可以作为腋窝淋巴结转移的预测因子[11-14]。
本研究通过对乳腺癌患者的临床病理参数及超声特征进行分析,以找到对乳腺癌患者腋窝淋巴结转移的预测因子。本研究发现,年龄、ER、PR、HER2、Ki-67表达及分子分型在同侧腋窝淋巴结转移阴性和阳性患者间比较,差异均无统计学意义(均P > 0.05),与既往研究结果不一致[15]。既往研究发现,HER2、Ki-67表达及分子分型与腋窝淋巴结是否转移相关,这可能与研究对象的选择及样本量有关[15]。本研究显示,乳腺结节大小、形态、所在象限和内部血流情况在同侧腋窝淋巴结转移阳性和阴性患者间比较,差异均具有统计学意义(均P < 0.05)。乳腺结节的大小与腋窝淋巴结的转移相关性已得到普遍认可,结节直径越大,侵袭范围越广,其发生转移的风险越高[16-17]。相关研究发现,不规则形态的结节是腋窝淋巴结转移的重要预测因子[18]。本研究显示,在不同象限亚组,外上象限组腋窝淋巴结转移最多,内下象限组最少。尽管乳腺淋巴管网存在丰富的交通,但仍存在以下规律:外侧象限的淋巴倾向引流至腋窝,而内侧象限更倾向引流至内乳淋巴结[17],这可能是外上象限的腋窝淋巴结转移最多而内下象限的腋窝淋巴结转移最少的原因。乳腺癌中血管的数量对肿瘤的生长、浸润和转移起着重要作用,增加肿瘤细胞的侵袭能力[19]。部分研究发现,肿瘤边界毛刺征是腋窝淋巴结转移的重要预测因素,系癌细胞浸润周围正常组织所致;微钙化是乳腺癌的主要征象之一,由坏死肿瘤细胞的钙沉积形成,与腋窝淋巴结转移高度相关[20]。但本研究提示,乳腺癌毛刺征、微钙化与淋巴结转移不相关,有待进一步观察。原发病灶纵横比 > 1是超声诊断乳腺癌的重要征象,但目前针对其与腋窝淋巴结转移相关性尚有争议[21]。本研究提示纵横比与腋窝淋巴结转移无关。通过多因素回归分析发现,结节的大小及结节所在象限是影响腋窝淋巴结转移的主要危险因素。结节越大,其侵袭性越强,发生转移的风险越高。同时与内下象限比较,外上象限发生转移的风险最高,其次为外下象限,再次为内上象限,与相关研究结果基本一致[17]。
另外本研究对乳腺癌超声特征与腋窝转移淋巴结数目的相关性进行初步分析发现,在不同结节的形态和血流情况患者中比较腋窝转移淋巴结数目,差异均具有统计学意义(均P < 0.05),并且血流分级越高,发生腋窝淋巴结转移的数目越多,这与血流越丰富,越易造成肿瘤细胞的转移有关。
本研究尚存在一些不足:(1)本研究为单中心的回顾性研究,可能会影响研究结果的有效性及可靠度,乳腺癌腋窝淋巴结转移的风险因素预判需要进行多中心的前瞻性研究;(2)本研究中腋窝淋巴结转移阳性率过高(> 30%),可能导致研究结果存在一定偏倚,这与研究样本量较少有关,因此仍需要进一步扩大样本量进行分析;(3)本研究未能统一使用同一型号的超声诊断仪进行图像收集。
综上所述,本研究结果显示,乳腺癌患者超声特征可作为腋窝淋巴转移诊断的重要辅助手段,特别是结节的大小和所在象限是乳腺癌腋窝淋巴结转移的重要预测因子,结节血流状态对乳腺癌腋窝淋巴结转移数量有非常重要的作用。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
马丹丹, 刘坤, 齐晓伟. 2018年全球癌症统计: 乳腺癌发病和死亡人数统计[J]. 中华乳腺病杂志: 电子版, 2018, 12(6): 375. |
| [3] |
Zuo TT, Zheng RS, Zeng HM, et al. Female breast cancer incidence and mortality in China, 2013[J]. Thorac Cancer, 2017, 8(3): 214-218. DOI:10.1111/1759-7714.12426 |
| [4] |
丰锦春, 李宇翔, 李丹, 等. 乳腺癌组织GFRα1、RET及NCAM表达水平与淋巴结转移关系的研究[J]. 实用肿瘤杂志, 2021, 36(3): 247-251. DOI:10.13267/j.cnki.syzlzz.2021.051 |
| [5] |
Si P, Zhang P, Chen T, et al. Positive nonsentinel lymph nodes are associated with poor survival in breast cancer: results from a retrospective study[J]. Clin Transl Oncol, 2019, 21(8): 1085-1092. DOI:10.1007/s12094-018-02031-5 |
| [6] |
Maeseele N, Faes J, van de Putte T, et al. Axillary lymph node dissection on the run?[J]. Facts Views Vis Obgyn, 2017, 9(1): 45-49. |
| [7] |
Giuliano AE, Edge SB, Hortobagyi GN. Eighth edition of the AJCC Cancer Staging Manual: Breast cancer[J]. Ann Surg Oncol, 2018, 25(7): 1783-1785. DOI:10.1245/s10434-018-6486-6 |
| [8] |
Degnim AC, Scow JS, Hoskin TL, et al. Randomized controlled trial to reduce bacterial colonization of surgical drains after breast and axillary operations[J]. Ann Surg, 2013, 258(2): 240-247. DOI:10.1097/SLA.0b013e31828c0b85 |
| [9] |
Duraker N, Caynak ZC. Axillary lymph node status and prognosis in multifocal and multicentric breast carcinoma[J]. Breast J, 2014, 20(1): 61-68. DOI:10.1111/tbj.12205 |
| [10] |
Lawn AM, Frampton AE, Krell J, et al. Lymph node ratio can further stratify prognosis in subpopulations of breast cancer patients with axillary nodal metastases[J]. Future Oncol, 2013, 9(10): 1425-1431. DOI:10.2217/fon.13.154 |
| [11] |
Zhang J, Li X, Huang R, et al. A nomogram to predict the probability of axillary lymph node metastasis in female patients with breast cancer in China: a nationwide, multicenter, 10-year epidemiological study[J]. Oncotarget, 2017, 8(21): 35311-35325. DOI:10.18632/oncotarget.13330 |
| [12] |
Yun SJ, Sohn YM, Seo M. Risk stratification for axillary lymph node metastases in breast cancer patients: what clinicopathological and radiological factors of primary breast cancer can predict preoperatively axillary lymph node metastases?[J]. Ultrasound Q, 2017, 33(1): 15-22. DOI:10.1097/RUQ.0000000000000249 |
| [13] |
Qiu XY, Jiang YL, Zhao QY, et al. Could ultrasound-based radiomics noninvasively predict axillary lymph node metastasis in breast cancer?[J]. J Ultrasound Med, 2020, 39(10): 1897-1905. DOI:10.1002/jum.15294 |
| [14] |
Zheng XY, Yao Z, Huang YN, et al. Deep learning radiomics can predict axillary lymph node status in early-stage breast cancer[J]. Nat Commun, 2020, 11(1): 1236. DOI:10.1038/s41467-020-15027-z |
| [15] |
Guo Q, Dong ZW, Zhang L, et al. Ultrasound features of breast cancer for predicting axillary lymph node metastasis[J]. J Ultrasound Med, 2018, 37(6): 1354-1353. DOI:10.1002/jum.14469 |
| [16] |
Yu XQ, Hao XY, Wan J, et al. Correlation between ultrasound appearance of small breast cancer and axillary lymph node metastasis[J]. Ultrasound Med Biol, 2018, 44(2): 342-349. DOI:10.1016/j.ultrasmedbio.2017.09.020 |
| [17] |
罗海愉, 钟洁愉, 张屿森, 等. 临床病理及超声多参数评估乳腺癌腋窝淋巴结转移的价值[J]. 中国超声医学杂志, 2018, 34(7): 590-593. |
| [18] |
Giardina C, Ricco R, Lettini T, et al. Relation between primary tumor shape and biological behavior in breast cancer[J]. Tumori, 1989, 75(2): 117-122. DOI:10.1177/030089168907500208 |
| [19] |
Zhao Y, Wang X, Huang Y, et al. Response to immunohistochemical markers' conversion after neoadjuvant chemotherapy in breast cancer patients: association between imaging and histopathologic analysis[J]. Clin Transl Oncol, 2020, 22(1): 91-102. DOI:10.1007/s12094-019-02112-z |
| [20] |
向永涛, 甘兵, 赵亮. 乳腺癌原发灶超声特征与腋窝淋巴结转移的关系[J]. 中国免疫学杂志, 2019, 35(10): 1251-1254. |
| [21] |
桑田, 张海俊, 曹玉文, 等. Logistic回归分析乳腺癌常规超声征象与腋窝淋巴结转移的关系[J]. 中国医学影像技术, 2021, 37(8): 1158-1162. |
 2022, Vol. 37
2022, Vol. 37


