文章信息
- 胡小玲, 潘敏强, 黄品同
- 超声造影联合超声引导下胰腺肿块粗针穿刺活检术确诊原发性胰腺Burkitt淋巴瘤一例
- 实用肿瘤杂志, 2021, 36(1): 73-75
-
通信作者
- 黄品同,E-mail:huangpintong@zju.edu.cn
-
文章历史
- 收稿日期:2020-07-08
患者男性,64岁,2周前无明显诱因下出现左上腹部疼痛,深呼吸时明显,伴有胀感,呈间断性加剧,无明显放射痛,无恶心呕吐、发热寒颤或腹泻便秘等不适。1周前,患者腹痛加剧,遂于2019年5月1日至当地医院就诊,查B型超声提示,脾区不均质低回声,脾脏占位。当日转至嘉兴医院就诊,查CT及MRI示,胰尾、脾脏和左肾间隙占位,侵犯周围组织,左肾下极及左肾周多发病灶。嘉兴医院予以对症处理,具体不详。患者为求进一步治疗于2019年5月17日至本院就诊,肝胆胰外科拟以胰腺肿物收住入院。患者自起病来,基础状况可,体质量未见明显增减。查体示左上腹轻压痛明显。患者既往有高血压史4年余,高血糖10年余,自诉血压和血糖控制可。2019年5月19日本院超声提示,胰腺体积增大,包膜欠光整,胰腺实质回声欠均匀,胰腺尾部可见一低回声肿块,大小约10.5 cm×7.1 cm,边界可辨,内回声不均,在低回声背景下,可见点条状和网格状稍高回声,彩色多普勒血流显像(colour doppler flow imaging,CDFI)示其内可见血流信号,肿块侵犯脾门并突入脾实质内,向下累及左肾上极,胰管未见扩张。超声造影示,胰腺尾部肿块动脉期呈不均匀高增强,后快速消退,延迟期呈筛网样改变,提示胰腺尾部占位,淋巴瘤首先考虑(图 1)。2019年5月20日本院CT检查示,胰腺尾部-脾门区见团块状软组织密度影,边缘不清,与脾脏、左肾、胃底大弯侧和结肠脾曲分界不清,增强扫描轻中度强化,其内囊变坏死部分未见强化。脾动脉及静脉被包绕。胰尾-脾门区占位,考虑恶性肿瘤,胰腺癌可能,侵犯脾脏及其动静脉、左肾、胃底大弯侧和结肠脾曲(图 2)。2019年5月22日全身PET/CT显像检查示,胰尾部、脾脏、左肾、脾肾间隙和脾胃间隙等处软组织肿块,糖代谢异常增高,考虑为淋巴瘤(图 3)。实验室检查示,血常规和肝、肾功能等无异常。肿瘤标志物检查未见异常。2019年5月23日行超声引导下胰腺肿块粗针穿刺活检术,病理提示,(胰腺穿刺标本)恶性肿瘤,倾向恶性淋巴瘤。原位杂交检查示,EBER呈阴性。免疫组织化学检查结果示,CD20 +++,CD21 +,CD19 ++,CD3 +,CD43 +,CD10 ++,BCL-2 -,BCL-6 +++,MUM-1 -,CD5 -,CD79a +++,Cyclin D1 -,Kappa ++,Lambda -,Ki-67 > 90%,p53 +/-,c-Myc(Y69) +++,CD30 -。符合B细胞非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL), GCB亚型弥漫性大B细胞性淋巴瘤。MYC基因断裂重排阳性,IGH/BCL2基因融合阴性,BCL6基因断裂重排阴性,考虑为Burkitt淋巴瘤。患者遂转入本院血液科,于2019年5月23日行R-hyper-CVAD-A方案[利妥昔单抗700 mg d0;环磷酰胺600 mg每12 h1次d1-3;长春瑞滨40 mg d4,d11;多柔比星60 mg d4;地塞米松40 mg d1-4,d11-14;21 d为1个周期)进行化疗。目前患者已行4个周期化疗,肿瘤体积明显缩小,全身情况明显改善(图 4)。
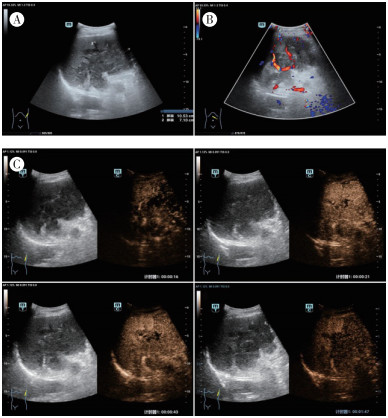
|
| 注 A:胰腺尾部可见一低回声肿块,大小约10.5 cm×7.1 cm,边界可辨,内回声不均,可见点条状和网格状稍高回声,肿块侵犯脾门并突入脾实质内,向下累及左肾上极; B:彩色多普勒超声检查示,其内可见条形血流信号; C:超声造影示,动脉期呈不均匀高增强,后快速消退,延迟期呈“筛网样”改变 图 1 胰腺尾部低回声肿块二维超声及超声造影表现 |
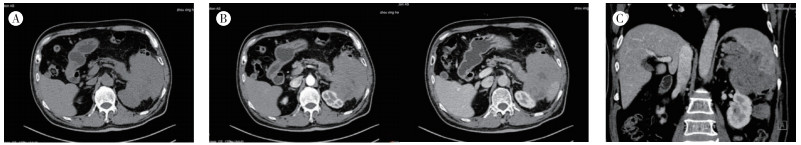
|
| 注 A:胰腺尾部-脾门区见团块状软组织密度影,边缘不清,与脾脏和左肾等分界不清; B:相邻横切面增强扫描显示,肿块呈轻中度强化; C:冠状位扫查可见肿瘤侵犯脾脏、左肾及部分肠管 图 2 胰腺尾部低回声肿块CT表现 |
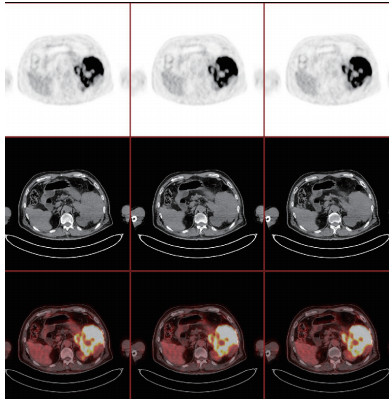
|
| 注 胰尾部、脾脏、左肾、脾肾间隙和脾胃间隙等处软组织肿块,糖代谢异常增高 图 3 胰腺尾部低回声肿块PET-CT表现 |
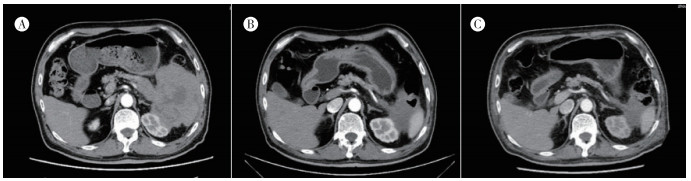
|
| 注 A:治疗前胰腺尾部肿块体积较大; B:患者行R-hyper-CVAD-A方案化疗1个月后胰腺尾部肿块明显缩小; C:患者行R-hyper-CVAD-A方案化疗2个月后胰腺尾部肿块进一步缩小 图 4 患者行R-hyper-CVAD-A方案进行化疗后胰腺尾部肿块体积明显缩小 |
原发性胰腺淋巴瘤(primary pancreatic lymphoma,PPL)是非常罕见的胰腺非上皮性恶性肿瘤,发病率仅为胰腺肿瘤的0.5%[1],是极为罕见的节外淋巴瘤,仅占节外淋巴瘤的2%。PPL多为B细胞NHL,以弥漫大B细胞淋巴瘤多见,Burkitt淋巴瘤是高度侵袭性B细胞NHL,发病以中老年男性为主,肿瘤好发于胰头部,胰体和尾部相对少见。其临床表现及实验室检查均无明显特异性,影像学表现易与胰腺导管腺癌等其他胰腺恶性肿瘤混淆,诊断有一定困难[2]。
PPL最常见的临床表现为腹痛,其次为腹部包块、腹泻和黄疸等,发热和夜间盗汗等症状罕见; 极少数患者可出现消化道出血[3]。本例患者临床主要以左上腹痛为首要表现,无发热、腹泻、黄疸及体质量下降的表现。PPL患者血清糖类抗原199(carbohydrate antigen 199,CA 199)、CA 125和癌胚抗原(carcinoembryonic antigen,CEA)多在正常范围,这对区分胰腺癌有一定价值,本例患者肿瘤标志物均无增高,胰腺癌可能性小。
PPL最常用的影像学检查包括CT、MRI和超声检查等[4]。超声作为最常用的影像检查手段,在诊断胰腺疾病中往往能够较早发现胰腺占位性病变,但同时,胰腺作为后腹膜脏器,前方有胃肠及网膜等器官遮挡,如果被检患者腹壁脂肪较厚或肠道积气严重时,将会对胰腺疾病诊断造成很大影响[5]。但在多数情况下,超声能够很好应用于胰腺检查。尤其近年来超声造影(contrast-enhanced ultrasound,CEUS)的广泛应用有效提高胰腺疾病的诊断准确率。PPL在病灶部位、内部回声及血供方面与胰腺癌无显著差异,但是在病灶大小、胆管、胰管扩张及腹膜后淋巴结肿大方面有一定差异,通常PPL肿块体积更大,伴胆管和胰管扩张少,多伴腹膜后淋巴结肿大[6]。肿瘤呈浸润性生长,包绕大血管,钙化及坏死少见,病灶一般不累及肝脏[7]。常规超声及超声造影在诊断节外淋巴瘤的确存在一定难度,但节外淋巴瘤同样具有淋巴瘤的一些特征性超声表现,如常规超声表现为肿块呈不均匀分布的低回声,在低回升背景下,可见点条状、网格状稍高回声; 超声造影延迟期“筛网样”改变是诊断淋巴瘤的重要依据,本例患者胰腺肿块常规超声及超声造影都具有诊断淋巴瘤的关键点。这与既往有关结外淋巴瘤(肝脏和脾脏淋巴瘤等)的超声造影表现具有一定相似性。PPL的CT表现主要为胰腺实质内软组织肿块密度影,增强扫描肿块一般呈低-中增强,其表现与胰腺癌较难鉴别,但在评估病变累及范围,分期及治疗后效果评估等方面具有重要意义[8]。
PPL的最终确诊主要依赖临床病理结果,超声引导下肿块粗针穿刺活检是明确病灶性质最简便、精准和有效的手段,在超声实时引导下,穿刺针能充分避开重要血管和肠管等器官,精准到达靶目标; 超声造影术前评估肿块整体情况,能够有效确定肿块有无坏死及具体位置,为精准有效获取有价值病理组织提供重要帮助。
化疗是目前治疗PPL的有效方法,手术治疗效果尚存争议。罗国培等[9]认为手术对于患者的总体生存率并无明显影响。且由于手术造成创伤大、不能彻底切除淋巴瘤、术后并发症多以及患者恢复较慢这些因素,只有患者并发胆管阻塞及胃肠道梗阻需要降压时才会实施手术。本例患者确诊胰腺Burkitt淋巴瘤后,立即转入本院血液科行R-hyper-CVAD-A方案化疗,效果明显,CT复查见瘤体明显缩小(图 4)。
总之,胰腺Burkitt淋巴瘤在临床上较为少见,容易误诊胰腺癌,但其预后要好于胰腺癌。CT及MRI表现虽然无太大特异性,但其提供的重要诊断信息结合肿瘤标志物等实验室指标,可对于该病有所考虑。常规超声及超声造影在诊断该病时有一定特点,尤其超声造影延迟肿块呈“筛网样”表现对诊断该病具有重要帮助,超声造影联合超声引导下胰腺肿块粗针穿刺活检是诊断胰腺占位性病变的有效手段。
| [1] |
Blouhos K, Boulas KA, Paraskeva A, et al. Obstructive jaundice as primary presentation of a stage ⅡE non-Hodgkin lymphoma: A decision making process between advanced lymphoma and locally advanced/metastatic pancreatic adenocarcinoma[J]. Int J Surg Case Rep, 2018, 44(7): 226-229. |
| [2] |
韩换, 王元辰, 郑建明. 原发性胰腺淋巴瘤九例临床病理分析[J]. 中华胰腺病杂志, 2018, 18(1): 51-53. DOI:10.3760/cma.j.issn.1674-1935.2018.01.015 |
| [3] |
Merkle EM, Bender GN, Brambs HJ. Imaging findings in pancreatic lymphoma: differential aspects[J]. Am J Roentgenol, 2000, 174(3): 671-675. DOI:10.2214/ajr.174.3.1740671 |
| [4] |
岳婧婧, 马媛媛, 宋琦, 等. 胰腺淋巴瘤的CT及MRI表现[J]. 中国医学计算机成像杂志, 2017, 23(2): 156-160. DOI:10.3969/j.issn.1006-5741.2017.02.011 |
| [5] |
田云飞, 洪玉蓉, 黄品同. 原发性腹膜后良恶性肿瘤的超声诊断[J]. 实用肿瘤杂志, 2020, 35(3): 249-254. |
| [6] |
白新华, 李泉水, 杨雪冰, 等. 超声检查在胰腺淋巴瘤和胰腺癌鉴别诊断中的价值[J]. 临床和实验医学杂志, 2009, 8(5): 3-5. DOI:10.3969/j.issn.1671-4695.2009.05.002 |
| [7] |
黄哲, 李开艳. 原发性胰腺淋巴瘤(侵袭性)超声表现1例[J]. 中华超声影像学杂志, 2019, 28(10): 912-913. |
| [8] |
张惠敏, 史大鹏. 原发性胰腺非霍奇金淋巴瘤影像表现[J]. 中华实用诊断与治疗杂志, 2019, 33(12): 1226-1228. |
| [9] |
罗国培, 傅德良, 杨峰, 等. 原发性胰腺淋巴瘤诊治分析: 附八例[J]. 中华肝胆外科杂志, 2008, 14(7): 471-473. DOI:10.3760/cma.j.issn.1007-8118.2008.07.011 |
 2021, Vol. 36
2021, Vol. 36


