文章信息
- 韩伟, 宋涛
- Xp11.2易位/TFE3基因融合相关性肾癌的超声表现及鉴别诊断
- 实用肿瘤杂志, 2022, 37(4): 352-356
-
通信作者
- 宋涛,E-mail:doctorsongtao@163.com
-
文章历史
- 收稿日期:2021-04-02
Xp11.2易位/TFE3基因融合相关性肾癌(renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusion,Xp11.2/TFE3 RCC),简称Xp11.2易位性肾癌或TFE3 RCC,于1986年最早发现,2004版及2016版世界卫生组织泌尿生殖肿瘤分类中,将其列为独立的肾细胞癌亚型[1]。由于此类肾脏肿瘤在世界范围内属于罕见肿瘤,其超声表现报道也较为少见。本文通过分析12例Xp11.2易位性肾癌患者的临床资料及超声资料,探讨Xp11.2易位性肾癌的超声特征,帮助超声医师了解这种疾病的超声表现,提高本病的超声诊断水平。
1 资料与方法 1.1 一般资料收集2008年1月至2020年1月本院术前经超声检查并术后经病理证实的Xp11.2易位性肾癌12例和2019年1月至2020年1月本院术前经超声检查并术后经病理证实的肾透明细胞癌30例。纳入标准:(1)有明确的病理诊断;(2)临床资料完整,图像清晰。术前进行超声造影检查者中,Xp11.2易位性肾癌4例,肾透明细胞癌17例。
1.2 超声检查仪器美国GE公司Logiq E9超声诊断仪,探头频率均为2~5 MHz,患者平卧位或侧卧位扫查肾脏,主要观察指标包括肿瘤位置、大小、边界、形态、内部回声、分隔,钙化和血流分布;肿瘤内实性区域的回声分为低回声、等回声和高回声(其中回声低于肾皮质为低回声,与肾皮质回声一致为等回声,回声高于肾皮质为高回声)。
1.3 超声造影剂意大利Bracco公司研制的脂质外壳包裹六氟化硫气体,商品名为SonoVue(声诺维)。先经肘关节团注配置好的SonoVue 1.4 mL,并快速团注5.0 mL生理盐水冲管,实时观察病灶的动态灌注过程及增强模式,记录造影全过程,通过显像分析造影剂灌注模式并存盘,分析动脉期和静脉期病灶增强程度、二期造影剂在病灶内分布情况及以超声造影定量指标[造影剂到达时间(arrival time,AT)、达峰时间(time to peak,TTP)和开始消退时间(begin to fade,BTF)]。
1.4 统计学分析采用SPSS 22.0版统计学软件进行数据分析。计数资料比较采用χ2检验。计量资料如符合正态分布,采用独立样本t检验;如不符合正态分布,则采用秩和检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 Xp11.2易位性肾癌临床资料及常规超声特征12例Xp11.2易位性肾癌中,男性3例,女性9例;年龄3.5~66岁,(26.20±17.61)岁。75.0%(9/12)的肿瘤发生于右肾,75.0%(9/12)边界清晰,83.3%(10/12)呈类圆形,50%(6/12)为囊实性。囊实性肿瘤中,约66.7%(4/6)有分隔(图 1A),100.0%(6/6)囊实性肿瘤以囊性为主。肿瘤内实性区域50.0%(6/12)呈等回声,50.0%(6/12)呈高回声。16.7%(2/12)有钙化,66.7%(8/12)有血流,血流分布于周边者约50.0%(4/8)(图 2A),分布于内部者约12.5%(1/8),周边及内部均有血流者约37.5%(3/8),50.0%(4/8)周边检测出半环状血流信号,50.0%(4/8)周边检测出点条状血流信号。75.0%(9/12)的病灶没有局部外凸。Xp11.2易位性肾癌与肾透明细胞癌临床及超声特征见表 1。4例病灶超声造影显示,与肾皮质比较,4例病灶与肾皮质同步增强,快于肾皮质消退,75.0%(3/4)呈等增强,增强不均匀(图 3A)。
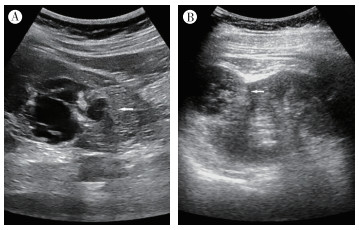
|
| 注 A:囊实性的Xp11.2易位性肾癌,囊性为主,分隔较多(箭头示);B:囊实性的肾透明细胞癌,实性为主,分隔较少(箭头示) 图 1 Xp11.2易位性肾癌患者与肾透明细胞癌患者常规超声特征比较 |
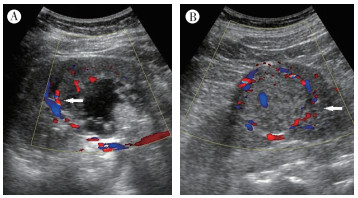
|
| 注 A:囊实性的Xp11.2易位性肾癌,周边可见不规则的点条状血流信号(箭头示);B:实性的肾透明细胞癌,周边可见环状血流信号(箭头示) 图 2 Xp11.2易位性肾癌患者与肾透明细胞癌患者彩色多普勒超声特征比较 |
| 临床特征或超声指标 | Xp11.2易位性肾癌(n=12) | 肾透明细胞癌(n=30) | χ2/t值 | P值 |
| 性别 | 11.293 | 0.001 | ||
| 男性 | 3 | 24 | ||
| 女性 | 9 | 6 | ||
| 年龄(岁,x±s) | 26.20±17.61 | 55.93±10.22 | 6.859 | < 0.01 |
| 肿瘤长径(cm,x±s) | 4.06±1.45 | 4.34±1.82 | 0.469 | 0.642 |
| 肿瘤短径(cm,x±s) | 3.20±1.18 | 3.58±1.38 | 0.843 | 0.404 |
| 所在肾脏 | 2.778 | 0.096 | ||
| 左 | 3 | 16 | ||
| 右 | 9 | 14 | ||
| 肾脏部位 | 10.570 | 0.011 | ||
| 上 | 4 | 16 | ||
| 中 | 0 | 5 | ||
| 下 | 5 | 9 | ||
| 肾窦 | 3 | 0 | ||
| 形态 | 0.226 | 0.707 | ||
| 类圆形 | 10 | 23 | ||
| 椭圆形 | 2 | 7 | ||
| 边界 | 8.311 | 0.006 | ||
| 清晰 | 9 | 8 | ||
| 不清晰 | 3 | 22 | ||
| 回声 | 1.493 | 0.292 | ||
| 实性 | 6 | 21 | ||
| 囊实性 | 6 | 9 | ||
| 回声分布 | 0.010 | 1.000 | ||
| 均匀 | 5 | 12 | ||
| 不均匀 | 7 | 18 | ||
| 实性区域回声 | 0.000 | 1.000 | ||
| 低 | 0 | 0 | ||
| 等 | 6 | 15 | ||
| 高 | 6 | 15 | ||
| 囊实性主要成分 | 8.750 | 0.007 | ||
| 囊性 | 6 | 2 | ||
| 实性 | 0 | 7 | ||
| 分隔 | 0.000 | 1.000 | ||
| 有 | 4 | 6 | ||
| 无 | 2 | 3 | ||
| 分隔数量 | 3.403 | 0.065 | ||
| 1~3 | 1 | 5 | ||
| 4~6 | 3 | 1 | ||
| 钙化 | 0.995 | 0.319 | ||
| 有 | 2 | 2 | ||
| 无 | 10 | 28 | ||
| 血流 | 2.224 | 0.136 | ||
| 有 | 8 | 26 | ||
| 无 | 4 | 4 | ||
| 血流分布 | 4.359 | 0.113 | ||
| 周边 | 4 | 20 | ||
| 内部 | 1 | 0 | ||
| 周内 | 3 | 6 | ||
| 周边血流 | 2.976 | 0.085 | ||
| 点条状 | 4 | 21 | ||
| 半环状 | 4 | 5 | ||
| 局部外凸 | 15.251 | < 0.01 | ||
| 有 | 3 | 26 | ||
| 无 | 9 | 4 |
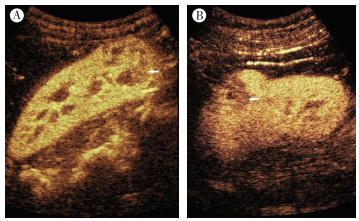
|
| 注 A:造影后14 s时,右肾下极囊实性的Xp11.2易位性肾癌呈不均匀增强,低增强区较多(箭头示);B:造影后16 s时,左肾中上部囊实性的肾透明细胞癌呈不均匀增强,低增强区较少(箭头示) 图 3 Xp11.2易位性肾癌患者与肾透明细胞癌患者超声造影特征比较 |
30例肾透明细胞癌中,男性24例,女性6例;年龄3~66岁,(55.93±10.22)岁。53.3%(16/30)的肿瘤发生于左肾,73.3%(22/30)边界不清,76.7%(23/30)呈类圆形,70.0%(21/30)为实性,30%(9/30)为囊实性。囊实性病灶中约66.7%(6/9)有分隔,77.8%(7/9)囊实性肿瘤以实性为主(图 1B)。肿瘤内实性区域50.0%(15/30)呈等回声,50%(15/30)呈高回声。6.7%(2/30)有钙化,86.7%(26/30)有血流,血流分布于周边者约76.9%(20/26,图 2B),周边及内部均有血流者约32.1%(6/26),80.7%(21/26)周边检测出点条状血流信号,19.3%(5/26)周边检测出半环状血流信号。86.7%(26/30)局部外凸。17例病灶超声造影显示,与肾皮质比较,94.1%(16/17)的病灶与肾皮质同步增强,70.6%(12/17)的病灶快于肾皮质消退,70.6%(12/17)呈等增强,增强不均匀(图 3B)。
2.3 超声造影造影时相上,Xp11.2易位性肾癌和肾透明细胞癌患者在造影剂进入方式、消退方式、造影剂分布、峰值强度和AT指标方面比较,差异均无统计学意义(均P > 0.05, 表 2)。而Xp11.2易位性肾癌的TTP及BTF均快于肾透明细胞癌(均P < 0.05)。
| 超声造影指标 | Xp11.2易位性肾癌(n=4) | 肾透明细胞癌(n=17) | χ2/t值 | P值 |
| 进入方式 | 0.247 | 0.619 | ||
| 快进 | 0 | 1 | ||
| 等进 | 4 | 16 | ||
| 消退方式 | 1.544 | 0.462 | ||
| 快 | 4 | 12 | ||
| 等 | 0 | 1 | ||
| 慢 | 0 | 4 | ||
| 造影剂分布 | 0.520 | 0.471 | ||
| 均匀 | 0 | 2 | ||
| 不均 | 4 | 15 | ||
| 峰值强度 | 2.193 | 0.334 | ||
| 高 | 0 | 4 | ||
| 等 | 3 | 12 | ||
| 低 | 1 | 1 | ||
| AT(s,x±s) | 9.50±1.29 | 11.70±2.64 | 1.603 | 0.125 |
| TTP(s,x±s) | 18.25±1.70 | 22.94±2.79 | 3.182 | 0.005 |
| BTF(s,x±s) | 23.25±2.21 | 28.58±3.37 | 2.984 | 0.008 |
| 注 AT:到达时间(arrival time);TTP:达峰时间(time to peak);BTF:开始消退时间(begin to fade) | ||||
肾透明细胞癌是最常见的恶性肾肿瘤,约占肾癌的70%,而Xp11.2易位性肾癌属于临床罕见肿瘤,主要见于儿童和青少年,占小儿肾细胞癌的20%~40%,在成人中非常罕见,据报道其发病率约为所有肾肿瘤的1%~1.6%,女性多于男性[2-3]。这种差异可能是由于Xp11.2易位性肾癌的特殊发病机制。研究发现,引起Xp11.2易位性肾癌的原因是在X染色体的短臂上TFE3的融合,男女X染色体数量存在差异,女性存在X染色体失活[4]。本研究中Xp11.2易位性肾癌平均发病年龄为26.20岁,75%为女性,与之前的报道相近[5-6],而肾透明细胞癌平均发病年龄55.9岁,高于Xp11.2易位性肾癌,此外,肾透明细胞癌以男性多见,两者在发病年龄及性别上的差异有助于这两种类型的肾细胞癌相鉴别。
本组资料中,Xp11.2易位性肾癌在常规超声上主要有以下表现:肿块平均长径4.06 cm,平均短径3.20 cm,多数病灶没有局部外凸,右肾较左肾多见,这与之前的报道一致[5-7]。肿瘤主要分布于肾脏的上部或下部实质内,少数分布于肾窦内,外形以类圆形居多,边界较清晰,部分表现为实性,部分表现为囊实性,研究报道约27.8%~88.0%的肿瘤呈囊实性[5-8],这一特征可能与肿瘤的病理变化有关,如肿瘤内部的出血、坏死或囊性改变,并可能反映异质性成分。在肿瘤的实性区域以等回声更常见,少部分表现为中高回声及高回声,这与相关报道接近[8],而囊实性肿块内多以囊性成分为主,这可能是由于该肿瘤为相对乏血供肿瘤,容易出现坏死或出血有关[9],此外,多数囊实性肿瘤内可见到分隔回声,分隔数量一般4~6。多数肿块周边及内部可检测出半环状或点条状血流信号,这可能与肿瘤的病理基础有关。肿瘤的实体组织中发现大量的毛细血管和动静脉瘘。本研究发现,约16.7%的病灶中出现钙化,在以前的许多报道中,钙化被认为是Xp11.2易位性肾癌的重要标志[9-10]。据报道,约23.8%~59.1%的病灶内可见钙化[8-11]。研究发现,钙化可能出现在病变的边缘,并且往往与年龄增加有关,这可能是诊断的另一个线索[10]。但有研究结果显示,在9例Xp11.2易位性肾癌患者中没有钙化的证据[12],此外,嫌色性RCC和其他常见的RCC亚型也可能在不同的时间出现钙化[11]。由此可见,虽然在Xp11.2易位性肾癌中钙化较为常见,但钙化的发生有可能无助于Xp11.2易位性肾癌与其他RCC亚型的鉴别。超声造影中,Xp11.2易位性肾癌与肾皮质同步增强,快于肾皮质消退,呈不均匀强化,实性部分与肾皮质一致,呈等增强。而许多以往的研究也发现Xp11.2易位癌出现早期增强及不均匀强化[5, 7-8]。
本研究常规超声结果显示,在Xp11.2易位性肾癌与肾透明细胞癌的鉴别中,两者在肿瘤分布、边界、囊实性主要成分和局部外凸指标方面比较,差异均具有统计学意义(均P < 0.05)。与Xp11.2易位性肾癌不同的是,肾透明细胞癌主要分布与肾脏的上部分,肿瘤边界多不清晰,约86.7%的肾透明细胞癌有局部外凸的表现。研究表明,当Xp11.2易位性肾癌较大时,向周围组织浸润,也表现出膨胀性外观[5]。在囊实性肿块内的主要回声指标中,肾透明细胞癌多以实性成分为主,这可能与肾透明细胞癌的细胞学特征有关,较少发生坏死或囊性变[7]。在分隔数量指标方面比较,虽然两者差异无统计学意义(P > 0.05),但肾透明细胞癌分隔数量多数为1~3,少于Xp11.2易位性肾癌。肾透明细胞癌主要为富血供肿瘤,超声造影时主要表现为等增强及高增强,本研究约23.5%呈高增强,70.6%呈等增强, 与相关报道一致[13]。本组超声造影结果显示,Xp11.2易位性肾癌与肾皮质同步增强,快于肾皮质消退,呈不均匀等增强,两者在增强模式方面比较,差异无统计学意义(P > 0.05),然而,Xp11.2易位性肾癌不均匀增强较肾透明细胞癌更常见。在造影时相上,虽然AT指标方面两者比较差异无统计学意义(P > 0.05),但Xp11.2易位性肾癌AT有快于肾透明细胞癌的趋势,在TTP及BTF指标中,Xp11.2易位性肾癌均快于肾透明细胞癌(均P < 0.05)。
本研究有一定的局限性:(1)Xp11.2易位性肾癌是一种非常罕见的肾癌,由于其样本量小和回顾性研究的性质,其超声表现可能不全面;(2)有学者认为XP11.2易位性肾癌的影像学表现可能与乳头状RCC相似,因为肿瘤和乳头状RCC之间存在形态学重叠[14],而本研究只与肾透明细胞癌比较,因此其他类型肾脏肿瘤还需要进一步的研究比较。另有研究发现,免疫组织化学法检测GATA3可用于区分透明细胞乳头状肾细胞癌与其他形态学相似的肾细胞癌[15]。
总而言之,Xp11.2易位性肾癌的超声诊断仍然是一个挑战, 当年轻女性发现肾脏肿瘤时,其超声如表现为类圆形、边界清晰而没有局部外凸的实性等回声或囊实性肿块,并且超声造影表现为同步不均匀等增强,快速消退时,应怀疑Xp11.2易位性肾癌的可能性,同时需要与肾透明细胞癌及其他亚型相鉴别。
| [1] |
Ross H, Argani P. Xp11 translocation renal cell carcinoma[J]. Pathology, 2010, 42(4): 369-273. DOI:10.3109/00313021003767348 |
| [2] |
Karashima T, Kuno T, Kuroda N, et al. Bilateral Xp11.2 translocation renal cell carcinoma: a case report[J]. BMC Urol, 2018, 18(1): 106-110. DOI:10.1186/s12894-018-0419-3 |
| [3] |
沈棋, 胡帅, 李峻, 等. 15例Xp11.2易位/TFE3基因融合相关性肾癌的临床病理特点分析[J]. 中华临床医师杂志: 电子版, 2020, 14(2): 105-109. |
| [4] |
Zhuang W, Liu N, Guo H, et al. Gender difference analysis of Xp11.2 translocation renal cell carcinomas's attack rate: a meta-analysis and systematic review[J]. BMC Urology, 2020, 20(1): 130-139. DOI:10.1186/s12894-020-00696-1 |
| [5] |
Ling W, Ma X, Luo Y, et al. Ultrasonographic findings of renal cell carcinomas associated with Xp11.2 translocation/TFE3 gene fusion[J]. Contrast Media Mol Imaging, 2017, 1(2017): 2958357. |
| [6] |
Chen X, Zhu Q, Li B, et al. Renal cell carcinoma associated with Xp11.2 translocation/TFE gene fusion: imaging findings in 21 patients[J]. Eur Radiol, 2017, 27(2): 543-552. DOI:10.1007/s00330-016-4421-4 |
| [7] |
He J, Gan W, Liu S, et al. Dynamic computed tomographic features of adult renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusions: Comparison with clear cell renal cell carcinoma[J]. J Comput Assist Tomogr, 2015, 39(5): 730-736. DOI:10.1097/RCT.0000000000000263 |
| [8] |
Wei S, Tian F, Xia Q, et al. Contrast-enhanced ultrasound findings of adult renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusion: comparison with clear cell renal cell carcinoma and papillary renal cell carcinoma[J]. Cancer Imaging, 2020, 20(1): 1. DOI:10.1186/s40644-019-0268-7 |
| [9] |
Liu K, Xie P, Peng W, et al. Renal carcinomas associated with Xp11.2 translocations/TFE3 gene fusions: findings on MRI and computed tomography imaging[J]. J Magn Reson Imaging, 2014, 40(2): 440-447. DOI:10.1002/jmri.24349 |
| [10] |
He J, Huan Y, Qiao Q, et al. Renal carcinomas associated with Xp11.2 translocations: Are CT fifindings suggestive of the diagnosis?[J]. Clin Radiol, 2014, 69(1): 45-51. DOI:10.1016/j.crad.2013.08.004 |
| [11] |
Zhang J, Lefkowitz RA, Ishill NM, et al. Solid renal cortical tumors: differentiation with CT[J]. Radiology, 2007, 244(2): 494-504. DOI:10.1148/radiol.2442060927 |
| [12] |
Zhu QQ, Wang ZQ, Zhu WR, et al. The multislice CT fifindings of renal carcinoma associated with XP11.2 translocation/TFE gene fusion and collecting duct carcinoma[J]. Acta Radiol, 2013, 54(3): 355-362. DOI:10.1258/ar.2012.120255 |
| [13] |
刘龙, 杜联芳, 史秋生, 等. 超声造影定性及定量评价不同大小肾透明细胞癌[J]. 临床超声医学杂志, 2019, 21(8): 570-573. DOI:10.3969/j.issn.1008-6978.2019.08.003 |
| [14] |
Gong P, Zhuang Q, Wang K, et al. Adult-onset renal cell carcinoma associated with Xp11.2 translocation/TFE3 gene fusion 3 case reports and review of literature[J]. Medicine, 2018, 97(24): e11023. DOI:10.1097/MD.0000000000011023 |
| [15] |
郑海红, 翁寿向, 甘梅富. GATA3在透明细胞乳头状肾细胞癌中的表达及意义[J]. 实用肿瘤杂志, 2021, 35(2): 150-153. |
 2022, Vol. 37
2022, Vol. 37


