文章信息
- 郭曦, 游洋, 庄荣源, 张晨璐, 申锋, 周宇红
- 艾立布林单药或联合方案治疗晚期成人软组织肉瘤的疗效及安全性分析
- Efficacy and safety of eribulin or combination regimen in treatment of advanced adult soft tissue sarcoma
- 实用肿瘤杂志, 2021, 36(5): 406-411
- Journal of Practical Oncology, 2021, 36(5): 406-411
基金项目
- 北京希思科临床肿瘤研究基金(Y-sy2018-148)
-
作者简介
- 周宇红,E-mail:zhou.yuhong@zs-hospital.sh.cn.
-
文章历史
- 收稿日期:2021-01-28
软组织肉瘤(soft tissue sarcoma,STS)是一类起源于黏液、纤维、脂肪、血管和淋巴管等结缔组织的恶性肿瘤,约占全部恶性肿瘤的1%,恶性程度高且亚类繁多。手术是治疗早期STS的主要手段,但对于不可手术切除或远处转移的STS患者,内科药物治疗是重要的治疗手段。晚期STS的标准治疗主要是以蒽环类药物为主的化疗,二线治疗无标准化疗方案。根据不同亚型和既往治疗制定复发或后线方案。目前我国STS诊治仍不规范,且可及的有效药物并不多,晚期患者的整体预后仍较差。
近年来,随着药物的迅速研发和二代测序的普及,个体化诊治改善了部分患者的预后。艾立布林(eribulin)作为微管蛋白聚合抑制剂,是一种合成的大田软海绵素(halichondrin B)类似物,2013年已在国外上市并在乳腺癌和软组织肿瘤中均呈现出较好疗效,已在欧美和日本多国获批用于治疗脂肪肉瘤或STS。2019年终于在我国获批上市用于晚期乳腺癌,药物可及也使其成为复发难治STS的新选择。本研究回顾性收集复旦大学附属中山医院肿瘤内科晚期STS成人患者使用艾立布林单药或联合方案的疗效及安全性,分析并总结艾立布林在中国STS患者真实世界数据。
1 资料与方法 1.1 一般资料回顾性分析2020年1月1日至2020年10月30日在复旦大学附属中山医院肿瘤内科就诊的病程中含艾立布林方案治疗的成人晚期STS患者20例,均具备完整的组织病理学和影像学检查资料,且有≥1个可测量病灶。其中,男性9例,女性11例;年龄23~61岁,中位年龄47岁;其中,L型肉瘤共16例(包含脂肪肉瘤9例,平滑肌肉瘤7例),非L型肉瘤4例(包括滑膜肉瘤2例、孤立性纤维瘤1例和横纹肌肉瘤1例)。19例为常规化疗失败以后的复发难治型,1例为初治。除这1例患者因肾功能不全选择艾立布林单药为姑息1线治疗,其余均为2线及以上治疗。多数患者存在多发转移,少数为单发转移,其次为腹盆腔巨大包块无法手术切除者。18例ECOG/PS评分为1~2分,2例为3分。肿瘤负荷大、既往多线药物治疗仍快速进展或换用艾立布林方案前正在使用抗血管靶向药物的患者13例选择联合用药方案(艾立布林联合治疗组),其余7例则选择艾立布林单药(艾立布林单药组)。患者的肿瘤原发部位、细分的肿瘤病理类型、肿瘤转移情况和具体联合方案等见表 1。本研究通过医院伦理委员会审核批准(审查编号B2020-338)。
1.2 治疗方案20例患者均为复发难治性成人晚期STS,尤其3线及以上治疗占50.0%(表 1)。此外,除2例平滑肌肉瘤和5例黏液圆脂肪肉瘤患者使用艾立布林单药治疗外,其余患者均选择联合艾立布林的方案治疗。依据不同病理亚型和个体既往治疗情况,联合方案组成不同,其中以联合化疗药物吉西他滨或抗血管靶向药物为多。其他联合药物为西达苯胺和免疫检查点抑制剂程序性死亡蛋白1(programmed death-1,PD-1)抗体等。
| 临床特征 | 例数(%) |
| 性别 | |
| 男性 | 11(55.0) |
| 女性 | 9(45.0) |
| 年龄 | |
| ≤40岁 | 5(25.0) |
| > 40岁 | 15(75.0) |
| 原发部位 | |
| 肢体 | 6(30.0) |
| 腹膜后 | 7(35.0) |
| 盆腔 | 4(20.0) |
| 其他 | 3(15.0) |
| 病理亚型 | |
| 脂肪肉瘤 | 9(45.0)a |
| 平滑肌肉瘤 | 7(35.0) |
| 滑膜肉瘤 | 2(10.0) |
| 孤立性纤维瘤 | 1(5.0) |
| 横纹肌肉瘤 | 1(5.0) |
| 转移部位 | |
| 单个器官或局部大包块 | 5(25.0) |
| 多发转移 | 15(75.0) |
| 治疗线数 | |
| 一线 | 1(5.0) |
| 二线 | 9(45.0) |
| 三线 | 7(35.0) |
| 四线及以上 | 3(15.0) |
| 治疗方案 | |
| 艾立布林单药 | 7(35.0) |
| 艾立布林联合方案 | 13(65.0)b |
| 注a其中去分化脂肪肉瘤2例,黏液圆脂肪肉瘤6例,多形性脂肪肉瘤1例;b其中联合吉西他滨5例,联合抗血管酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)6例,联合西达本胺1例,联合免疫1例 | |
化疗前常规给予帕洛诺司琼预防恶心呕吐。所有患者均未行聚乙二醇粒细胞集落刺激因子预防性治疗。艾立布林的标准使用方法为每次1.4 mg/m2,第1天和第8天静脉滴注,每3周为1个周期,用药持续至疾病进展或出现不可耐受的不良反应。该药物单支包装剂量为1 mg,因其价格昂贵且在国内未被纳入医保支付,在真实临床实践中本研究所有患者选择固定剂量2 mg/次。吉西他滨选择1 g/m2,第1天和第8天静脉给药,每3周为1个周期,抗血管靶向药物安罗替尼10 mg/d,连续口服2周休息1周,培唑帕尼口服400 mg/d,连续2周休息1周,西达苯胺每周口服2次,每次20 mg,连续2周休息1周。
所有患者共接受70个周期的治疗,中位治疗3(2~6)个周期。中位随访时间为4.5(1.8~9)个月,随访内容包括生存情况、可评估病灶的影像学检查结果、血常规、肝肾功能、血糖血脂和不良反应等。随访方式包括复诊和电话随访。无失访,5例已经死亡,5例仍在使用艾立布林单药或联合方案,10例因疾病进展目前使用后线治疗中。后续治疗包括曲贝替定、PD-1抗体、替莫唑胺、脂质体多柔比星、培唑帕尼和依维莫司等药物和细胞治疗等。
1.3 疗效及不良反应评定每2~3个周期化疗后,参照实体瘤疗效评价标准1.1(Response Evaluation Criteria In Solid Tumors 1.1,RECIST1.1)进行肿瘤学评估[1]:包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。计算客观有效率(objective response rate,ORR)及疾病控制率(disease control rate,DCR)。ORR为CR与PR百分比之和。DCR为CR、PR与SD百分比之和。参照RECIST1.1计算肿瘤缓解深度(deepness of response,DpR)[2]。记录患者的疾病无进展生存时间(progression free survival,PFS)及总生存时间(overall survival,OS)。不良反应参照常见不良事件评价标准5.0(Common Terminology Criteria for Adverse Events version 5.0,CTCAE 5.0)记录[3]。
1.4 统计学分析采用Prism7.0软件进行统计学分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验。采用Cox生存曲线进行生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 近期疗效20例患者化疗后,0例CR,3例PR,7例SD,ORR为15.0%,DCR为50.0%。3例PR患者均为脂肪肉瘤亚型,典型影像学改变见图 1。> 50%的平滑肌肉瘤亚型患者保持SD。由脂肪肉瘤和平滑肌肉瘤组成的L型肉瘤组的ORR和DCR均高于非L型肉瘤(P=0.348,P=0.025;表 2)。4例非L型肉瘤患者在治疗后均出现PD,其中2例滑膜肉瘤患者在接受治疗时ECOG/PS为3分,可能也是响应率较低的重要因素。艾立布林单药组和艾立布林联合治疗组ORR及DCR比较,差异均无统计学意义(P=0.948,P=0.639;表 3)。
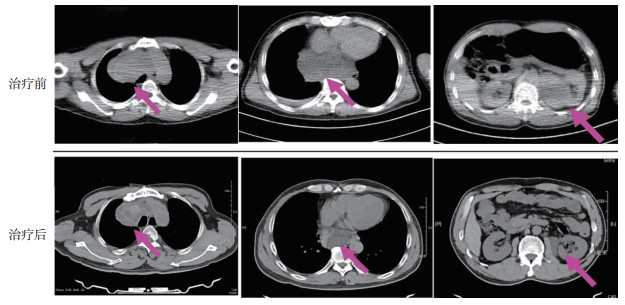
|
| 注 箭头示前纵隔、后纵隔或左肾后方病变 图 1 1例黏液脂肪肉瘤患者艾立布林治疗前后的影像学改变 Fig.1 Radiographic change of a patient with myxoid liposarcoma before and after eribulin treatment |
| STS人群 | CR | PR | SD | PD | ORR(%) | DCR(%) |
| 总队列(n=20) | 0 | 3 | 7 | 10 | 15.0 | 50.0 |
| L型肉瘤(n=16) | 0 | 3 | 7 | 6 | 18.8 | 62.5 |
| 脂肪肉瘤(n=9) | 0 | 3 | 3 | 3 | 33.3 | 66.7 |
| 平滑肌肉瘤(n=7) | 0 | 0 | 4 | 3 | 0.0 | 57.1 |
| 非L型肉瘤(n=4) | 0 | 0 | 0 | 4 | 0.0 | 0.0 |
| 注STS:软组织肉瘤(soft tissue sarcoma);CR:完全缓解(complete response);PR:部分缓解(partial response);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease);ORR:客观有效率(objective response rate);DCR:疾病控制率(disease control rate) | ||||||
| STS治疗队列 | CR | PR | SD | PD | ORR(%) | DCR(%) |
| 艾立布林单药治疗(n=7) | 0 | 1 | 3 | 3 | 14.3 | 57.1 |
| 艾立布林联合治疗(n=13) | 0 | 2 | 4 | 7 | 15.4 | 46.2 |
| 联合吉西他滨(n=5) | 0 | 1 | 1 | 3 | 20.0 | 40.0 |
| 联合抗血管TKIs(n=6) | 0 | 1 | 2 | 3 | 16.7 | 50.0 |
| 注STS:软组织肉瘤(soft tissue sarcoma);CR:完全缓解(complete response);PR:部分缓解(partial response);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease);ORR:客观有效率(objective response rate);DCR:疾病控制率(disease control rate);TKIs:酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs) | ||||||
20例患者中位PFS为2.5个月(图 2A)。中位OS尚不成熟。L型肉瘤组的中位PFS达到3个月,而非L型肉瘤组仅1个月,两组比较,差异具有统计学意义(P < 0.01,图 2B)。其中,脂肪肉瘤组中位PFS为2.6个月,平滑肌肉瘤组为3个月。艾立布林单药组和联合治疗组中位PFS分别为2.8个月和2.0个月(P=0.382)。9例脂肪肉瘤患者中3例PR,艾立布林开始起效的时间为1.3、2.3和4个月,DpR时间为4.3、2.5和1.1个月。
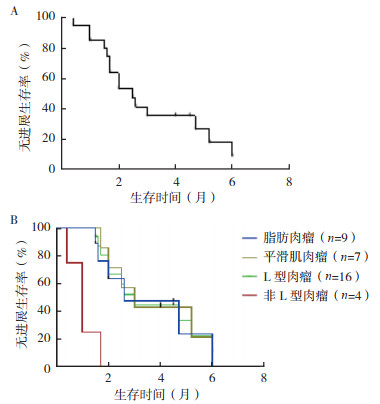
|
| 注 A:所有软组织肉瘤患者的无进展生存曲线;B:L型肉瘤和非L型肉瘤患者无进展生存曲线 图 2 晚期成人软组织肉瘤患者艾立布林治疗后的无进展生存曲线 Fig.2 Progression-free survival curve of advanced adult soft tissue sarcoma patients treated with eribulin |
从DpR看,瀑布图显示黏液型脂肪肉瘤患者的病灶缩小程度较大,而平滑肌肉瘤患者在治疗后以SD为主(图 3)。滑膜肉瘤、孤立性纤维瘤和横纹肌肉瘤患者均未显示出对艾立布林敏感。
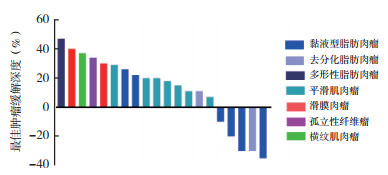
|
| 图 3 20例晚期成人软组织肉瘤患者艾立布林治疗后的最佳肿瘤缓解深度瀑布图 Fig.3 Waterfall plot of best deepness of response in 20 advanced adult soft tissue sarcoma patients treated with eribulin |
化疗不良反应以血液异常改变为主。其中3级及以上中性粒细胞减少1次,血小板减少1次,未见恶心呕吐及外周神经麻木发生。3例患者出现血甘油三酯轻度升高,这3例均为艾立布林单药治疗,推测血甘油三酯升高发生可能与该药有关(表 4)。
| 不良反应 | 所有级别 | 3级及以上 |
| 白细胞减少 | 7(35.0) | 1(5.0) |
| 中性粒细胞减少 | 5(25.0) | 1(5.0) |
| 贫血 | 7(35.0) | 1(5.0) |
| 血小板减少 | 2(10.0) | 1(5.0) |
| 乏力 | 5(25.0) | 0(0.0) |
| 高凝状态 | 2(10.0) | 0(0.0) |
| 脱发 | 1(5.0) | 0(0.0) |
| 口腔溃疡 | 1(5.0) | 1(5.0) |
| 甘油三酯升高 | 3(15.0) | 0(0.0) |
晚期软组织肿瘤以姑息化疗为主,一线化疗首选蒽环类药物,二线没有标准方案,可根据病理类型和个体情况选择达卡巴嗪、吉西他滨、紫杉醇、异环磷酰胺、长春新碱和替莫唑胺等化疗药物,另外可选择多靶点抗血管靶向药物,培唑帕尼、安罗替尼和瑞戈非尼等[4];部分特定亚型可尝试PD-1抗体治疗[5]。但整体疗效欠佳。艾立布林开发较早,但直到2019年才在我国获批,用于晚期乳腺癌[6]。艾立布林在美国和欧洲批准用于曾经接受过含蒽环类药物治疗的不可切除或转移性脂肪肉瘤,在日本批准用于不可切除的或转移性软组织肉瘤。其通过结合在微管延长端高亲和位点,形成无功能蛋白聚合物,引起不可逆的有丝分裂堵塞,导致细胞死亡,对紫杉醇耐药后患者依然有效[7]。鉴于其在国外的随机Ⅲ期软组织肿瘤研究中的循证医学证据,我国进展期肉瘤患者的诊治有了新的选择。
309研究入组了452例既往接受≥2种化疗方案的进展期脂肪肉瘤和平滑肌肉瘤患者,随机分为艾立布林或达卡巴嗪组,结果提示艾立布林改善总体人群的OS,绝对获益达到2.2个月,其中脂肪肉瘤亚组的获益更是高达7.2个月;脂肪肉瘤亚组中位PFS为2.9个月[8]。本研究共入组8例2线及以上治疗的脂肪肉瘤,3例PR,3例SD,中位PFS为2.6个月,中位OS尚未达到,同309研究的数据相似。研究中3例PR的患者均出现在脂肪肉瘤组,艾立布林方案开始起效的时间为1.3、2.3和4.0个月,DoR分别为4.3、2.5和1.1个月,提示艾立布林后线使用的疗效并不持久,需要探索前线使用或更合理的联合治疗策略。
来自日本的真实世界研究发现,艾立布林对L型肉瘤的疗效优于非L型肉瘤,L型肉瘤组DCR为49.6%,而非L型肉瘤组为32.0%,中位PFS分别为3.4个月和2.2个月[9-10]。对日本102家医院的255例艾立布林方案的STS患者的回顾性研究显示,脂肪肉瘤组和平滑肌肉瘤组的ORR和DCR相似;包含未分化多形性肉瘤、血管肉瘤、滑膜肉瘤和横纹肌肉瘤等的非L型肉瘤患者也能从中获益[10]。本研究中L型肉瘤组DCR达62.5%,中位PFS达3.0个月,纳入的脂肪肉瘤以黏液脂肪肉瘤病理亚型为多,而此型对放化疗最为敏感,可能也是DCR高的原因;纳入的7例平滑肌肉瘤并无缓解病例,4例(57.1%)患者以SD为主。本研究中非L型肉瘤组DCR为0.0%,中位PFS仅1.0个月,差于日本的数据[10],这可能与病例数较少且治疗处于最末线有关。
研究发现,艾立布林具备血管重塑、改善肿瘤微环境和提升序贯药物的抗肿瘤活性效应的优势[11];此外,还可以抑制上皮细胞间质转化,促进间质细胞上皮转化[12]。这是其联合其他药物,如化疗药物、抗血管靶向药物及免疫检查点抑制剂有效的可能机制之一。2020年美国临床肿瘤学会报道LEADER研究[13],在晚期脂肪肉瘤和平滑肌肉瘤一线治疗中,艾立布林联合仑伐替尼治疗的ORR达到28.5%,中位随访24周时,中位PFS为37周,中位OS未达到,研究的相关数据优于既往肉瘤的单纯化疗方案。
针对晚期乳腺癌一线化疗的随机Ⅱ期研究中,艾立布林联合吉西他滨较紫杉醇联合吉西他滨的神经毒性更小,而疗效相近[14]。一项研究显示,艾立布林联合吉西他滨对平滑肌肉瘤及脂肪肉瘤细胞株的增殖能力有协同增效抑制的作用[15]。对于体能状态好的晚期STS患者,本中心也积极探索艾立布林联合方案的疗效及不良反应。5例肉瘤患者选择艾立布林联合吉西他滨为挽救方案,ORR达20.0%。在后线治疗中取得这样的ORR非常难得,值得深入研究。
除联合化疗药物吉西他滨,艾立布林联合抗血管靶向药物或PD-1抗体均显示出确切的临床有效性,而不良反应在可控范围内,但是联合方案较单药并未能进一步提高疗效。分析原因可能与选择联合方案的患者既往存在快速进展或大肿瘤负荷本身即预后不佳有关。因此,在艾立布林基础上加用其他药物是否可以提高ORR、DCR或延长PFS,仍值得开展前瞻性随机对照研究来探索。
艾立布林最常见的不良反应为骨髓抑制,其中以中性粒细胞计数降低为多见,偶见贫血,血小板减少症罕见。其胃肠道反应轻微,疲劳和脱发不明显,未见神经麻木发生。在联合其他药物治疗后,相关不良反应的发生率有一定升高,但均在可控范围内。目前尚未观察到非预期的不良事件。这些数据提示中国肉瘤群体对该药的整体耐受性良好,单药及联合用药的安全性均较高。
综上所述,艾立布林单药或联合方案是治疗晚期STS的新策略,近期疗效与国外文献报道相近[8-10],而不良反应并无增加,中国肉瘤患者的耐受性良好。后续治疗及生存随访仍在进行中。本研究为单中心小样本回顾性研究,且联合方案多样,偏倚不可避免,有必要进一步深入开展随机对照临床研究,以探讨艾立布林联合不同方案治疗不同病理亚型STS的价值。
| [1] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [2] |
Nozawa H, Nishikawa T, Tanaka T, et al. 'Deepness of response' is associated with overall survival in standard systemic chemotherapy for metastatic colorectal cancer[J]. Chemotherapy, 2014, 60(5/6): 360-367. |
| [3] |
Freites-Martinez A, Santana N, Arias-Santiago S, et al. Using the Common Terminology Criteria for Adverse Events (CTCAE - Version 5.0) to evaluate the severity of adverse events of anticancer therapies[J]. Actas Dermosifiliogr: Engl Ed, 2021, 112(1): 90-92. DOI:10.1016/j.ad.2019.05.009 |
| [4] |
张星. 软组织肉瘤的药物治疗[J]. 中华医学杂志, 2019, 99(37): 2889-2892. DOI:10.3760/cma.j.issn.0376-2491.2019.37.003 |
| [5] |
Tawbi HA, Burgess M, Bolejack V, et al. Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial[J]. Lancet Oncol, 2017, 18(11): 1493-1501. DOI:10.1016/S1470-2045(17)30624-1 |
| [6] |
项敏利, 胡晓昀, 王卓. 艾日布林治疗相关的皮肤毒性二例[J]. 实用肿瘤杂志, 2021, 36(4): 348-351. |
| [7] |
Smith JA, Wilson L, Azarenko O, et al. Eribulin binds at microtubule ends to a single site on tubulin to suppress dynamic instability[J]. Biochemistry, 2010, 49(6): 1331-1337. DOI:10.1021/bi901810u |
| [8] |
Schöffski P, Chawla S, Maki RG, et al. Eribulin versus dacarbazine in previously treated patients with advanced liposarcoma or leiomyosarcoma: a randomised, open-label, multicentre, phase 3 trial[J]. Lancet, 2016, 387(10028): 1629-1637. DOI:10.1016/S0140-6736(15)01283-0 |
| [9] |
Nakamura T, Tsukushi S, Asanuma K, et al. The clinical outcome of eribulin treatment in Japanese patients with advanced soft tissue sarcoma: a Tokai Musculoskeletal Oncology Consortium study[J]. Clin Exp Metastasis, 2019, 36(4): 343-350. DOI:10.1007/s10585-019-09980-3 |
| [10] |
Kobayashi E, Naito Y, Asano N, et al. Interim results of a real-world observational study of eribulin in soft tissue sarcoma including rare subtypes[J]. Jpn J Clin Oncol, 2019, 49(10): 938-946. DOI:10.1093/jjco/hyz096 |
| [11] |
Funahashi Y, Okamoto K, Adachi Y, et al. Eribulin mesylate reduces tumor microenvironment abnormality by vascular remodeling in preclinical human breast cancer models[J]. Cancer Sci, 2014, 105(10): 1334-1342. DOI:10.1111/cas.12488 |
| [12] |
Yoshida T, Ozawa Y, Kimura T, et al. Eribulin mesilate suppresses experimental metastasis of breast cancer cells by reversing phenotype from epithelial-mesenchymal transition (EMT) to mesenchymal-epithelial transition (MET) states[J]. Br J Cancer, 2014, 110(6): 1497-1505. DOI:10.1038/bjc.2014.80 |
| [13] |
Chen WW, Yu CW, Hong RL, et al. A Ⅰb/Ⅱ study of the combination of lenvatinib (L) and eribulin (E) in advanced liposarcoma (LPS) and leiomyosarcoma (LMS) (LEADER)[J]. J Clin Oncol, 2020, 38(Suppl 15): 11507. |
| [14] |
Park YH, Im SA, Kim SB, et al. Phase Ⅱ, multicentre, randomised trial of eribulin plus gemcitabine versus paclitaxel plus gemcitabine as first-line chemotherapy in patients with HER2-negative metastatic breast cancer[J]. Eur J Cancer, 2017, 86(11): 385-393. |
| [15] |
Moura D S, Lopez Alvarez M, Salinas Villegas A, et al. Combination of eribulin plus gemcitabine in L-sarcomas[J]. Ann Oncol, 2018, 29(Suppl 8): 594. |
 2021, Vol. 36
2021, Vol. 36

