文章信息
- 王展怀, 张波, 叶垚, 韩树高
- Wang Zhanhuai, Zhang Bo, Ye Yao, Han Shugao
- 增强CT肿瘤TER值预测Ⅰ~Ⅲ期肿块型肝内胆管癌根治术后患者预后的临床价值
- Clinical prognostic value of TER of contrast-enhanced CT for patients with stage Ⅰ-Ⅲ mass-forming intrahepatic cholangiocarcinoma after radical resection
- 实用肿瘤杂志, 2022, 37(3): 237-243
- Journal of Practical Oncology, 2022, 37(3): 237-243
基金项目
- 浙江省自然科学基金项目(LY20H180015)
-
通信作者
- 韩树高,E-mail:hanshugao@zju.edu.cn
-
文章历史
- 收稿日期:2021-02-08
2. 浙江大学医学院附属第二医院肝胆胰外科,浙江 杭州 310009;
3. 浙江大学医学院附属第二医院放射科,浙江 杭州 310009
2. Department of Hepatobiliary and Pancreatic Surgery, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China;
3. Department of Radiology, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
肝内胆管癌是一种具备高度侵袭性和致死性的肝内原发性上皮来源恶性肿瘤,占原发性肝脏恶性肿瘤的15%,是仅次于原发性肝癌的第二常见肝内恶性肿瘤[1-2]。美国国家癌症研究所Surveillance, Epidemiology,and End Results(SEER)数据库评估1973年至2012年肝内胆管癌与肝外胆管癌的年龄校正后发病率趋势发现,肝内胆管癌的发病率从0.44/10万增至1.18/10万,平均每年增加2.3%[3]。目前认为肝内胆管癌根治性手术是能够提供长期生存获益的最佳治疗选择,但术后复发率可达60%,中位复发时间约9个月,复发病例5年生存率仅15%[4]。多数肝内胆管癌病例在诊断时已处于晚期无法治愈的阶段(如肝内多发转移和腹膜后淋巴结转移等),发病个体缺乏可用于判断预后的高危因素[1, 5]。建立肝内胆管癌复发高危预测与预后模型,为确诊病例提供精准的预后分析,有助于根据生物学特征制订最佳的治疗方案和手术决策。
上世纪动态多排螺旋CT(multi-detector CT,MDCT)的出现,极大改变恶性肿瘤的临床诊治策略。MDCT提供的无创检查和高分辨率图像实现了实体肿瘤的早期诊断[6]。静脉注射造影剂增强CT扫描方法进一步丰富了CT影像学鉴别诊断方法,对恶性肿瘤的术前分期、复发或转移病灶评估至关重要。对于肝脏病变,本中心常规采用三期增强MDCT扫描。肿瘤密度以CT衰减系数Hounsfield unit(HU)值作为测量参数之一。动态CT下感兴趣区(region of interest,ROI)肿瘤密度的增强状态与通过肿瘤区域的造影剂量即肿瘤内微血管密切相关[7]。多项研究提示,增强CT图像中肿瘤密度可作为肿瘤靶向治疗疗效评估的指标[8-9]。
特别需要指出,多项回顾性研究表明,增强CT中肿瘤增强状态可作为肿瘤预后因素[10-14]。增强CT中肿瘤增强状态是否与肿块型肝内胆管癌的临床预后相关尚有待明确。本回顾性研究假设术前多期增强CT图像的肿瘤强化程度是Ⅰ~Ⅲ期肿块型肝内胆管癌根治性切除术的一项预后因素。研究目的是建立一个基于影像学的模型来预测相关肝内胆管癌的总生存率(overall survival,OS)和无瘤生存(disease free survival,DFS),以此辅助此类肝内胆管癌治疗决策。
1 资料与方法 1.1 伦理声明肝内胆管癌组织取自浙江大学医学院附属第二医院,并经临床研究伦理委员会批准。研究数据以匿名方式收集,本回顾性观察符合赫尔辛基宣言。
1.2 病例入组2011年1月至2017年12月,连续纳入术前获得增强CT影像的肝内胆管癌病例,所有病例均接受肝内胆管癌根治术。入组标准:可手术病例;术前行增强CT评估病灶;术后病理确诊。排除标准:管周浸润型或管内生长型肝内胆管癌未在肝实质形成肿块者;既往肝切除术或胆管手术史;外院行术前评估无法提供CT数字图像;围手术期死亡;无法行根治性切除术;失访。本研究的观察终点是5年OS率和DFS率。肿瘤分期参考美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期第8版[15]。术后辅助化疗及随访按美国国家综合癌症网络指南(www.nccn.org)和中国临床肿瘤学会胆管恶性肿瘤指南(www.csco.org.cn)进行,所有病例定期随访,随访截止时间为2021年1月。
1.3 CT扫描方案CT扫描采用第二代双源CT(SOMATOM Definition AS,西门子公司,德国)进行。使用高压注射器(Mallinckrodt,美国)以2.5~3 mL/s的流速注射1.5 mL/kg含碘造影剂(碘海醇,300 mgI/L)。对比剂注射后10 s跟踪扫描,主动脉内CT值达到阈值(120 HU)后,触发肝动脉期扫描,间隔25 s后行门静脉期扫描,注入对比剂后约100 s行平衡期扫描。
扫描参数:管电压120 kV,管电流200 mA,层厚5 mm,层间距5 mm。图像传送至外部工作站(Syngo Multi-Modality Workplace VE36A,Siemens Medical Solutions,德国)用于接收和重建图像。
1.4 CT图像分析两位腹部影像学的放射科医师(> 10年工作经验高年资医师)独立阅片。肝内胆管癌的影像学定位参考手术记录肿瘤定位以及增强CT轴位和冠状面重建图像的典型特征[16]。此后,经2位放射科医师一致同意,选择每例患者最大肿瘤的代表性影像层面进行测量。通过数字工作站绘制图像ROI测量肿瘤衰减值(HU值),ROI选择在肿瘤边缘无明显坏死区,避开其内穿行的血管结构,远离空气肿瘤界面以避免测量误差(图 1)。通过测量3个代表性层面的肿瘤衰减值,计算其平均值。分别计算三期增强CT的肿瘤衰减值平均值,取最大值除以CT平扫期衰减值,该比值作为肿瘤增强比(tumor enhancement ratio,TER)值。
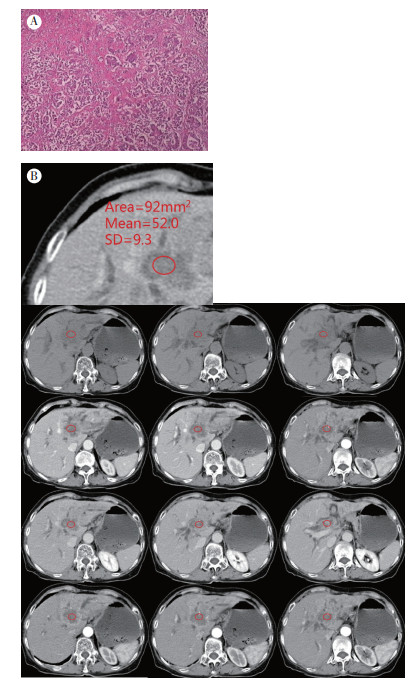
|
| 注A:典型肝内胆管癌组织病理图片(HE×100);B:典型肝内胆管癌CT图像TER值测量方法示例,肝内胆管癌的影像学定位参考手术记录肿瘤定位以及增强CT轴位和冠状面重建图像的典型特征,选择每一病例最大肿瘤的代表性影像层面进行测量 图 1 肝内胆管癌CT图像TER测量方法典型图例 Fig.1 Typical example of TER measurement procedure in CT images for intrahepatic cholangiocarcinoma |
手术标本经切割、固定和HE染色,由胃肠道病理专科医师(> 10年工作经验)根据AJCC病理原则记录肿瘤大小、肿瘤浸润、组织学类型和分级、脉管侵犯、神经侵袭、淋巴结转移以及pTNM分期[15]。
1.6 统计学分析采用SPSS 22版软件进行数据分析。通过X-tile软件计算临界值(cut-off value)方法[17],获取TER与肝内胆管癌5年OS率的最佳临界值。根据该临界值将肝内胆管癌病例分为低增强组(≤临界值)及高增强组(> 临界值)。计数资料以频数(百分比)表示,采用χ2检验比较组间差异,必要时根据样本量(n)及期望频数(T)选择连续性校正χ2检验或Fisher精确检验。计数资料中若为等级变量,则采用Mann-Whitney U非参数检验比较组间差异。计量资料需进行正态性检验,符合正态分布的数据以均数±标准差(x±s)表示,采用独立样本t检验比较组间差异;不符合正态分布的数据以中位数(四分位间距)表示,采用Mann-Whitney U非参数检验比较组间差异。生存分析采用Kaplan-Meier法,并绘制OS和DFS的生存曲线,采用log-rank检验比较组间生存差异。采用单因素Cox生存分析对结直肠癌的预后因素进行分析,选取P < 0.1及临床上有意义的变量进入多因素Cox风险回归模型,以逐步回归的方式确定独立预后因素。所有数据采用双边检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 病例基线特征从2011年1月至2017年12月,共有234例连续登记的Ⅰ~Ⅲ期肝内胆管癌病例回顾性纳入本研究。入组排除如下患者:管周浸润型或管内生长型肝内胆管癌未在肝实质形成肿块者(n=39);既往肝切除术或胆管手术史(n=33);外院行术前评估无法提供CT数字图像(n=30);围手术期死亡(n=3);无法行根治性切除术(n=3);失访(n=11)。最终排除87例,入组109例(图 2)。入组病例年龄26~83岁,(59.23±10.16)岁;其中男性50例(45.8%),女性59例(54.2%);据AJCC第八版pTNM分期[15],Ⅰ期17例(15.5%),Ⅱ期25例(22.9%),Ⅲa期20例(18.3%),Ⅲb期56例(51.4%);TER值临界值取1.91。低TER组(TER值≤1.91)与高TER组(TER值> 1.91)年龄、性别、pTNM分期、血清糖类抗原199水平、肿瘤神经侵犯、肿瘤脉管侵犯、淋巴结阳性和肿瘤术后辅助化疗等主要临床特征比较,差异均无统计学意义(均P > 0.05,表 1)。
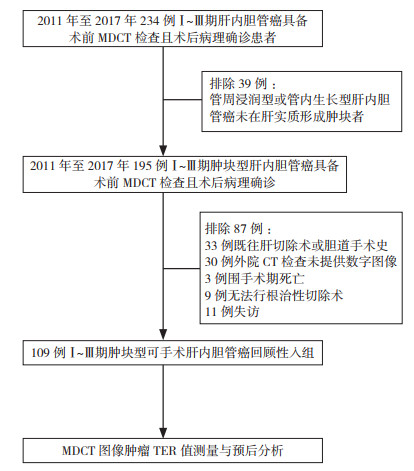
|
| 注MDCT:多排螺旋CT(multi-detector CT);TER:肿瘤增强比(tumor enhancement ratio) 图 2 纳入本研究病例回顾性入组流程图 Fig.2 The flow chart of the cases retrospectively enrolled in this study |
| 临床特征 | 低TER组(n=64) | 高TER组(n=45) | P值 |
| 中位年龄(范围,岁) | 59(26~86) | 61(40~79) | 0.130 |
| 年龄 | 0.990 | ||
| > 70岁 | 9 | 18 | |
| ≤70岁 | 55 | 27 | |
| 性别 | 0.210 | ||
| 男性 | 32 | 18 | |
| 女性 | 32 | 29 | |
| pTMN分期 | 0.291 | ||
| Ⅰ期 | 8 | 9 | |
| Ⅱ期 | 14 | 12 | |
| Ⅲa期 | 12 | 8 | |
| Ⅲb期 | 30 | 16 | |
| CA199 | 0.220 | ||
| > 37 U/mL | 44 | 26 | |
| ≤37 U/mL | 20 | 19 | |
| 神经侵犯 | 0.650 | ||
| 阴性 | 38 | 31 | |
| 阳性 | 26 | 14 | |
| 脉管侵犯 | 0.099 | ||
| 阴性 | 46 | 39 | |
| 阳性 | 18 | 6 | |
| 术后淋巴结转移 | 26 | 14 | 0.290 |
| 行辅助化疗 | 16/26 | 9/14 | 0.740 |
| 注TER:肿瘤增强比(tumor enhancement ratio);CA199:糖类抗原199(carbohydrate antigen 199) | |||
109例肿块型肝内胆管癌中,59例死亡。低TER组和高TER组5年OS率为35.2%和67.2% 组(P=0.003,图 3A)。低TER组5年DFS率为35.6%,复发率为64.4%,高TER组5年DFS率为53.1%,复发率为46.9%(P=0.015,图 3B),低TER与死亡率的增加密切相关。单因素分析提示,与肿块型肝内胆管癌预后相关的高危因素是pTNM分期(P < 0.01)、淋巴结转移(P < 0.01)和TER值≤1.91(P=0.004),其余因素如年龄 > 70岁、性别、脉管侵犯、神经侵犯和CA199 > 37 U/mL等对生存无影响。多因素Cox回归提示,影响肿块型肝内胆管癌生存的独立预后因素包括pTNM分期和TER值(均P < 0.05,表 2)。
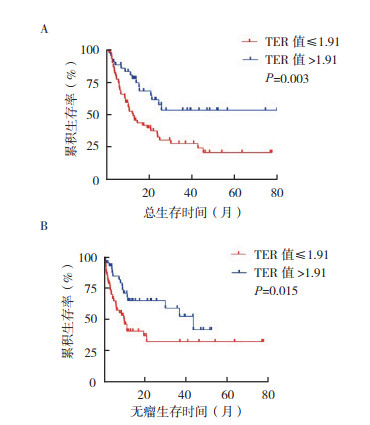
|
| 注A:总生存曲线;B:无瘤生存曲线 图 3 TER值> 1.91和TER值≤1.91的Ⅰ~Ⅲ期肿块型肝内胆管癌患者生存曲线 Fig.3 Survival curves of stage Ⅰ-Ⅲ mass-forming intrahepatic cholangiocarcinoma patients with TER ≤1.91 and TER > 1.91 |
| 因素 | 单因素分析 | 多因素分析 | |||
| HR(95% CI) | P值 | HR(95% CI) | P值 | ||
| 年龄 | 0.154 | ||||
| ≤70岁 | 1 | ||||
| > 70岁 | 1.545(0.846~2.820) | ||||
| 性别 | 0.943 | ||||
| 男性 | 1 | ||||
| 女性 | 0.981(0.587~1.640) | ||||
| 淋巴结转移 | < 0.01 | 0.606 | |||
| 阴性 | 1 | 1 | |||
| 阳性 | 2.835(1.684~4.775) | 0.799(0.340~1.876) | |||
| 脉管侵犯 | 0.483 | ||||
| 阴性 | 1 | ||||
| 阳性 | 1.24(0.679~1.201) | ||||
| 神经侵犯 | 0.207 | ||||
| 阴性 | 1 | ||||
| 阳性 | 0.718(0.430~2.266) | ||||
| pTNM分期 | < 0.01 | < 0.01 | |||
| Ⅰ期 | 1 | 1 | |||
| Ⅱ期 | 0.911(0.324~2.562) | 0.002 | 0.896(0.318~2.522) | 0.006 | |
| Ⅲa期 | 1.367(0.496~3.768) | < 0.01 | 1.208(0.436~3.347) | < 0.01 | |
| Ⅲb期 | 3.978(1.662~9.522) | 0.003 | 3.459(1.435~8.342) | 0.004 | |
| TER值 | 0.004 | 0.024 | |||
| > 1.91 | 1 | 1 | |||
| ≤1.91 | 2.317(1.303~4.119) | 1.908(1.063~3.426) | |||
| CA199 | 0.997 | ||||
| ≤37 U/mL | 1 | ||||
| > 37 U/mL | 1.001(0.509~1.698) | ||||
| 注TER:肿瘤增强比(tumor enhancement ratio);CA199:糖类抗原199(carbohydrate antigen 199) | |||||
肿瘤血管生成是肿瘤发生和发展过程的一个重要步骤,与肿瘤进展、侵袭和转移密切相关[18]。MDCT造影剂增强成像技术为评估全身大血管与微血管系统提供了一种独特的方法。实体肿瘤在MDCT图像上的对比增强是一项重要参数,因为其反映了肿瘤内部血供[9]。胃癌增强CT图像动脉期肿瘤与正常胃壁的密度比值可预测肿瘤预后状态。胃癌多排螺旋CT(multi-slice spiral CT,MSCT)影像动态增强方式-持续性强化方式与胃癌人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达相关[19]。本课题组前期分析548例Ⅰ~Ⅲ期可手术结肠癌术前增强CT图像发现,肿瘤TER值是Ⅰ~Ⅲ期可手术结肠癌的独立预后标志[14]。本研究假设增强CT图像肿瘤TER值可以判断肿块型肝内胆管癌预后状态。对于具有多个子病灶的病例,本研究选取最大肿瘤进行CT图像分析和数据采集,共纳入Ⅰ~Ⅲ期行根治性切除的肿块型肝内胆管癌109例,按TER值分为低TER组和高TER组。生存分析提示,低TER组的预后OS及DFS均差于高TER组。Cox回归分析提示,TER值是上述病例的一个独立预后因素(P < 0.05)。有研究在2017年通过采集47例肿块型肝内胆管癌的增强CT图像发现,动脉期增强程度较低的肿瘤预后较差[13]。该研究结论与本研究均提示影像学增强程度较低(影像学乏血供肿瘤)的肝内胆管癌预后较差。与该研究比较[13],本研究在设计上入组病例更多。纳入病例为Ⅰ~Ⅲ期可行根治性切除的肿块型肝内胆管癌,病例同质性高,故研究结论更具可推广性。
胆管细胞癌按照病理大体分类可分为肿块型、管周浸润型和管内生长型,各类型存在肿瘤起源、影像学特征、组织学和基因背景的差异,其中肿块型占60%以上,是最常见的胆管癌类型[20]。肝内胆管癌是一类原发于肝脏和胆管上皮来源的恶性肿瘤,具备高度侵袭性和致死性[21-23]。只有约35%的病例能够接受根治性切除手术,其余病例因多灶肿瘤造成切除后残余肝脏体积不足,局部晚期肿瘤包绕大血管或转移性疾病而被认为是不可切除[1-2]。然而,即使接受R0切除术的病例,5年OS率仅为30%~40%,而伴有淋巴结转移病例的5年OS率约为20%。肿瘤复发是影响生存率的主要因素,复发率为43%~66%,淋巴结转移、大血管侵袭和多灶性疾病被认为是影响复发和生存的独立危险因素[24]。
外科治疗是能够治愈肝内胆管癌的唯一有效手段。肝内胆管癌肝切除的方式选择上,建议行宽切缘的解剖性肝切除术,因其可以完整切除肿瘤和潜在的卫星结节以及任何微门静脉侵犯,以降低局部复发率[25]。与其生存获益相对的,解剖性肝切除增加残肝储备不足的可能。在慢性肝病的基础上,术后残肝体积比不足,可造成术后肝衰竭。通过建立预后模型,能够帮助识别高危复发人群并谨慎把握手术适应证,同时选择潜在获益人群进行有效的外科干预。
本研究是近年来样本量最大的探索增强CT图像特征与肿块型肝内胆管癌预后的相关性研究之一。胆管癌术前增强CT分期在多数医学中心常规开展,CT图像的肿瘤密度测量方法简便易行。与基因检测等方法比较,本研究采用的研究方法医疗效费比更高。与传统的肿瘤pTNM分期比较,本研究采用术前CT图像评估肿瘤预后,实现术前精准预测肿瘤预后,为制定手术策略提供肿瘤生物学依据。除以上优势,本研究尚存在一些局限性:(1)客观上肝内胆管癌发病率低,可研究病例少,本研究纳入109例可手术Ⅰ~Ⅲ期病例,统计学效力仍有待进一步提高;(2)这项研究是一项单中心回顾性研究,需要设计多中心的前瞻性研究来进一步验证研究结论的可重复性和准确性;(3)随着CT成像技术的进步,各种能量CT逐渐应用于临床。双源CT基于不同能量的X线穿过不同物质时其衰减特性存在差异的原理,实现物质分离,利用双能后处理软件可获得碘图。碘图碘浓度值反映了组织内血流灌注情况,是一个评价病变或组织强化特征的新指标,较CT值更为敏感地反映了组织或病变的血供情况。限于本研究是回顾性研究,所有入组病例来自2011年1月至2017年12月本中心接受根治性手术的Ⅰ~Ⅲ期肝内胆管癌,无法采用双能CT碘图评估肝内胆管癌的预后价值。本课题组拟在后续研究中开展双能CT对包括肝内胆管癌在内多种肝脏恶性肿瘤的碘图及其他影像学特征展开对比分析。
综上所述,本研究揭示,增强CT图像中肿瘤TER值可作为Ⅰ~Ⅲ期肿块型肝内胆管癌根治术后生存和复发相关一项独立的预后因素,增强CT低TER值肿瘤OS及DFS低于高TER值肿瘤。该研究使用影像学技术提供了一种术前无创的方法来评估肝内胆管癌预后,为AJCC pTNM分期预后评估提供了有力的补充。研究结论有待后续大样本多中心前瞻性研究进一步验证。
| [1] |
Sirica AE, Gores GJ, Groopman JD, et al. Intrahepatic cholangiocarcinoma: continuing challenges and translational advances[J]. Hepatology, 2019, 69(4): 1803-1815. DOI:10.1002/hep.30289 |
| [2] |
de Jong MC, Nathan H, Sotiropoulos GC, et al. Intrahepatic cholangiocarcinoma: an international multi-institutional analysis of prognostic factors and lymph node assessment[J]. J Clin Oncol, 2011, 29(23): 3140-3145. DOI:10.1200/JCO.2011.35.6519 |
| [3] |
Saha SK, Zhu AX, Fuchs CS, et al. Forty-year trends in cholangiocarcinoma incidence in the U.S.: Intrahepatic disease on the rise[J]. Oncologist, 2016, 21(5): 594-599. DOI:10.1634/theoncologist.2015-0446 |
| [4] |
Park HM, Yun SP, Lee EC, et al. Outcomes for patients with recurrent intrahepatic cholangiocarcinoma after surgery[J]. Ann Surg Oncol, 2016, 23(13): 4392-4400. DOI:10.1245/s10434-016-5454-2 |
| [5] |
Machairas N, Lang H, Jayant K, et al. Intrahepatic cholangiocarcinoma: Limitations for resectability, current surgical concepts and future perspectives[J]. Eur J Surg Oncol, 2020, 46(5): 740-746. DOI:10.1016/j.ejso.2020.01.028 |
| [6] |
Ginat DT, Gupta R. Advances in computed tomography imaging technology[J]. Annu Rev Biomed Eng, 2014, 16: 431-453. DOI:10.1146/annurev-bioeng-121813-113601 |
| [7] |
Miles KA. Tumour angiogenesis and its relation to contrast enhancement on computed tomography: a review[J]. Eur J Radiol, 1999, 30(3): 198-205. DOI:10.1016/S0720-048X(99)00012-1 |
| [8] |
Salvaggio G, Furlan A, Agnello F, et al. Hepatocellular carcinoma enhancement on contrast-enhanced CT and MR imaging: response assessment after treatment with sorafenib: preliminary results[J]. Radiol Med, 2014, 119(4): 215-221. DOI:10.1007/s11547-013-0332-5 |
| [9] |
Choi H, Charnsangavej C, Faria SC, et al. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria[J]. J Clin Oncol, 2007, 25(13): 1753-1759. DOI:10.1200/JCO.2006.07.3049 |
| [10] |
Wang SH, Sun YF, Liu Y, et al. CT contrast enhancement correlates with pathological grade and microvessel density of pancreatic cancer tissues[J]. Int J Clin Exp Pathol, 2015, 8(5): 5443-5449. |
| [11] |
Komori M, Asayama Y, Fujita N, et al. Extent of arterial tumor enhancement measured with preoperative MDCT gastrography is a prognostic factor in advanced gastric cancer after curative resection[J]. AJR Am J Roentgenol, 2013, 201(2): W253-261. DOI:10.2214/AJR.12.9206 |
| [12] |
Zhu YH, Wang X, Zhang J, et al. Low enhancement on multiphase contrast-enhanced CT images: an independent predictor of the presence of high tumor grade of clear cell renal cell carcinoma[J]. AJR Am J Roentgenol, 2014, 203(3): W295-300. DOI:10.2214/AJR.13.12297 |
| [13] |
Fujita N, Asayama Y, Nishie A, et al. Mass-forming intrahepatic cholangiocarcinoma: Enhancement patterns in the arterial phase of dynamic hepatic CT - Correlation with clinicopathological findings[J]. Eur Radiol, 2017, 27(2): 498-506. DOI:10.1007/s00330-016-4386-3 |
| [14] |
Wang Z, Ye Y, Hu Y, et al. Extent of enhancement on multiphase contrast-enhanced CT images is a potential prognostic factor of stage Ⅰ-Ⅲ colon cancer[J]. Eur Radiol, 2019, 29(3): 1114-1123. DOI:10.1007/s00330-018-5689-3 |
| [15] |
Amin MB, Edge S, Greene F, et al. American Joint Committee on Cancer staging manual[M]. 8th edition. New York: Springer, 2017.
|
| [16] |
Kartalis N, Brehmer K, Loizou L. Multi-detector CT: Liver protocol and recent developments[J]. Eur J Radiol, 2017, 97: 101-109. DOI:10.1016/j.ejrad.2017.10.026 |
| [17] |
Camp RL, Dolled-Filhart M, Rimm DL. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization[J]. Clin Cancer Res, 2004, 10(21): 7252-7259. DOI:10.1158/1078-0432.CCR-04-0713 |
| [18] |
Folkman J. Tumor angiogenesis: therapeutic implications[J]. N Engl J Med, 1971, 285(21): 1182-1186. DOI:10.1056/NEJM197111182852108 |
| [19] |
赵瑾, 陈海燕, 丁信法, 等. 胃癌MSCT表现和临床病理特征与HER2表达的相关性研究[J]. 实用肿瘤杂志, 2020, 35(3): 201-207. |
| [20] |
Banales JM, Marin JJG, Lamarca A, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(9): 557-588. DOI:10.1038/s41575-020-0310-z |
| [21] |
Lee SH, Simoneau EB, Karpinets T, et al. Genomic profiling of multifocal intrahepatic cholangiocarcinoma reveals intraindividual concordance of genetic alterations[J]. Carcinogenesis, 2021, 42(3): 436-441. DOI:10.1093/carcin/bgaa124 |
| [22] |
Saleh M, Virarkar M, Bura B, et al. Intrahepatic cholangiocarcinoma: pathogenesis, current staging, and radiological findings[J]. Abdom Radiol (NY), 2020, 45(11): 3662-3680. DOI:10.1007/s00261-020-02559-7 |
| [23] |
Utuama O, Permuth JB, Dagne G, et al. Neoadjuvant chemotherapy for intrahepatic cholangiocarcinoma: a propensity score survival analysis supporting use in patients with high-risk disease[J]. Ann Surg Oncol, 2021, 28(4): 1939-1949. DOI:10.1245/s10434-020-09478-3 |
| [24] |
Jutric Z, Johnston WC, Hoen HM, et al. Impact of lymph node status in patients with intrahepatic cholangiocarcinoma treated by major hepatectomy: a review of the National Cancer Database[J]. HPB (Oxford), 2016, 18(1): 79-87. DOI:10.1016/j.hpb.2015.07.006 |
| [25] |
Lafaro K, Grandhi MS, Herman JM, et al. The importance of surgical margins in primary malignancies of the liver[J]. J Surg Oncol, 2016, 113(3): 296-303. DOI:10.1002/jso.24123 |
 2022, Vol. 37
2022, Vol. 37


