文章信息
- 焦文云, 曹新广, 刘靓, 张婧文, 郭长青
- Jiao Wenyun, Cao Xinguang, Liu Liang, Zhang Jingwen, Guo Changqing
- 多层螺旋CT与超声胃镜在贲门部及胃底部间质瘤诊断中的比较
- Comparison of multi-slice spiral CT and endoscopic ultrasonography in diagnosis of gastric stromal tumors located in cardia and fundus
- 实用肿瘤杂志, 2022, 37(3): 258-262
- Journal of Practical Oncology, 2022, 37(3): 258-262
-
通信作者
- 郭长青,E-mail:1807872711@qq.com
-
文章历史
- 收稿日期:2021-08-26
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)多起源于胃肠道管壁黏膜下神经丛间叶组织的Cajal间质细胞,是胃肠道最常见的间叶源性肿瘤,可发生于消化道的任何部位,以胃底和胃体最为常见, 约占51%,其次为小肠和结直肠,而食管发生率仅占1%[1]。GIST具有非定向分化及恶变倾向性,其中20%~50%的患者复发和转移风险极高,可发展为恶性肿瘤,临床预后差,约占胃肠道恶性肿瘤的2%[2]。多数直径 < 2 cm的GIST是良性的,没有转移风险,Ki-67一般 < 5/50 HPF;而对于2~5 cm的GIST,高Ki-67者比低Ki-67者更易恶变及转移,转移率差异可达10倍[3],故采取有效的检查手段,早期发现可疑的GIST患者并对其尽早干预治疗,将显著改善预后。
早期GIST患者多无特异性临床表现,内镜下多呈隆起性病变,表面被覆正常黏膜组织,对于较小的或特殊部位的GIST与胃肠道内的其他黏膜下病变如神经源性肿瘤和平滑肌瘤等不易鉴别[4]。近年来食管贲门间质瘤的发病数逐年增多,而位于贲门部的间质瘤,由于自身解剖结构的特点使得其对多层螺旋CT(multi-slice spiral CT,MSCT)与超声胃镜(endoscopic ultrasonography,EUS)的敏感度较胃内其他部位间质瘤存在差异。本文回顾性分析比较MSCT与EUS诊断贲门部及胃底部间质瘤的差异,从而为相应患者恰当选择检查方式提供相关依据,并对相关患者尽可能做到早发现、早诊断和早治疗。
1 资料与方法 1.1 一般资料收集郑州大学第一附属医院2018年9月至2020年9月收治的经病理及免疫组织化学确诊的67例贲门部间质瘤和229例胃底部间质瘤患者。对其中满足纳入标准的35例贲门部间质瘤和78例胃底部间质瘤患者进行回顾性分析。35例贲门部间质瘤患者均表现出不同程度的临床症状,其中腹痛16例(45.7%),腹胀11例(31.4%),腹部不适7例(20.0%),烧心反酸5例(14.3%),咳嗽2例(5.7%)。78例胃底部间质瘤患者中腹胀27例(34.6%),腹痛23例(29.5%),腹部不适13例(16.7%),纳差9例(11.5%),乏力5例(6.4%),烧心反酸4例(5.1%),咳嗽2例(2.6%),另有15例(19.2%)无明显临床症状,于体检时发现。35例贲门部间质瘤患者中,男性20例,女性15例;年龄32~69岁,(50.9±11.0)岁。78例胃底部间质瘤患者中,男性47例,女性31例;年龄45~81岁,(57.4±9.5)岁。两组在性别和年龄方面比较,差异均无统计学意义(均P > 0.05)。
纳入标准:(1)同时有上腹部或全腹部16层MSCT及EUS检查结果;(2)肿瘤直径 < 5 cm(排除肿瘤大小不均对影像学结果的影响[5]);(3)经病理及免疫组织化学确诊为GIST;(4)无其他遗传性疾病、肿瘤性疾病和心肝肾等重要脏器疾病;(5)临床资料完整;(6)患者及其家属知情且签署相关知情同意书。
1.2 设备与方法 1.2.1 CT使用德国西门子16层MSCT,螺距约1.5 mm,层厚约1.5 mm,连续无间断扫描包括贲门部在内的腹部CT平扫+增强。检查前告知患者禁止使用对影像学结果有影响的任何食物或药物(如二甲双胍类药物需停药≥48 h),嘱患者禁食水 > 4 h,在检查前15 min嘱患者饮适量的水,饮水量应能使位于上腹部的胃部及小肠黏膜充盈扩张,平躺前再次嘱患者饮水400~600 mL以确保胃部充盈。造影剂选取碘海醇(50 mL)。
1.2.2 胃镜使用电子胃镜(日本奥林巴斯公司Olympus-290型)、超声内镜主机(Olympus-EU-ME2)和超声微探头(Olympus-UM-3R)。超声内镜频率范围为12~20 MHz。为确保内镜检查过程安全,避免检查时胃内容物反流误吸等,嘱被检者禁食 > 8 h和禁水 > 4 h,并严密监测患者的生命体征。术前完善心电图和传染病等相关检查。检查前30 min嘱患者吞服达克罗宁胶浆,采取静脉全身麻醉(即无痛胃镜),患者取左侧卧位,双下肢稍屈曲,麻醉师确认麻醉显效后,内镜医师将胃镜从受检者口中所含的塑胶器口深入。检查过程中当发现贲门部或胃底部黏膜异常时,先在白光胃镜下观察局部黏膜情况,再用超声微探头探查病变部位,采用水囊法+脱气水充盈法,观察并记录病变处表面特征、瘤体直径、边界、起源层次及内部回声等影像学征象。
1.3 观察指标以局部组织活检或术后病理结果结合细胞免疫组织化学结果为金标准,比较MSCT和EUS对于贲门部及胃底部间质瘤检查结果的准确度。
1.4 统计学分析采用SPSS 22.0统计学软件分析数据。计量资料满足正态分布者,以均数±标准差(x±s)表示,组间比较采用两独立样本t检验。计数资料采用频数(百分比)表示,组间比较采用χ2检验,同一部位两种检查方法诊断差异的比较采用配对设计的χ2检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 MSCT检查结果比较所有患者中,MSCT检查示,病变形态以局部黏膜增厚、圆形或结节状软组织影为主,行增强扫描可见病变部位轻~中度强化;其中3例强化不均匀,内可见囊性影;106例病灶边界清楚,7例病灶边界不清。胃底部间质瘤MSCT诊断的敏感度优于贲门部间质瘤,差异具有统计学意义[85.9%(67/78) vs 51.4%(18/35),P=0.001]。
2.2 EUS检查结果比较所有患者EUS下病变形态以类圆形和半球形黏膜下隆起为主;表面多光滑,3例黏膜表面可见凹陷;病变长径介于0.4~4 cm;病变均起源于固有肌层,其中固有肌浅层者2例;回声表现为均匀或不均匀低回声。EUS检查诊断贲门部及胃底部间质瘤的敏感度比较,差异无统计学意义[94.3%(33/35) vs 89.7%(70/78),P=0.669]
2.3 MSCT与EUS检查诊断贲门部间质瘤比较35例贲门部间质瘤患者中,MSCT检查阳性18例,阴性17例;EUS检查阳性33例,阴性2例(该2例患者首次EUS检查未发现异常,在3~6个月后复查EUS时出现阳性表现且病变大小均呈“米粒”大小)。EUS检查诊断贲门部间质瘤的敏感度优于MSCT检查(P < 0.01)。
2.4 MSCT与EUS检查诊断胃底部间质瘤比较78例胃底部间质瘤患者中,MSCT检查阳性67例,阴性者11例;EUS检查阳性70例,阴性8例(此8例患者首次EUS检查未发现病灶,在3~6个月后复查EUS时出现阳性表现且病变大小均约呈“米粒”大小)。MSCT检查和EUS检查诊断胃底部间质瘤的敏感度比较,差异无统计学意义(P=0.453)。
3 讨论GIST是消化道最常见的间叶源性肿瘤,最好发部位为胃,最少见部位为食管和贲门[6]。GIST的诊断有赖于组织病理活检及免疫组织化学检查,依据病理结果,目前认为GIST有3种组织学形态,其中梭形细胞型最常见,约占70%,其次为上皮样细胞型(20%)和混合细胞型(10%)。如今随着分子生物学的研究进展及免疫组织化学技术的进步,发现酪氨酸激酶生长因子受体c-Kit的分化簇酪氨酸激酶受体CD117、CD34和discovered on GIST 1(DOG-1)对于GIST的诊断有着高敏感度及高特异度[7],也是最具价值的免疫组织化学标志物。其中CD117和DOG-1因具有高敏感度及高特异度,临床中更有意义[8]。本研究显示,113例间质瘤患者CD117和DOG-1表达均阳性,其中27例贲门部和61例胃底部间质瘤患者CD34表达阳性,间质瘤患者中CD34阳性表达率为77.9%。随着分子遗传学的进步,目前认为血小板衍生生长因子受体-α(platelet-derived growth factor receptor alpha, PDGFRA)和c-Kit的基因获得性突变是GIST发生的重要机制,这也是目前针对GIST靶向治疗的主要靶点[9-11]。
随着人们安全意识的提升和内镜技术的提高,无症状GIST患者的检出率明显提高,约占总数的10%~30%,其中小间质瘤者更多见,往往于体检查腹部CT、消化内镜或行其他外科手术时被无意发现[12]。GIST早期临床表现通常缺乏特异性,多表现为腹痛、腹胀、恶心和纳差等,当病变较大时可能出现腹部包块、便血、继发性肠道梗阻、吞咽困难、黄疸和便秘等,具体症状与病变部位相关[13]。因GIST具有恶性分化潜能,且可发生血行转移及种植转移。有研究报道,即使是极低危险度的间质瘤也有早期转移的可能,且呈现逐渐年轻化趋势[14]。故早发现、早诊断和早干预对于疾病的治疗及预后有重大意义。
白光胃镜、EUS和MSCT检查均是GIST的常用检查方法。贲门部与胃底部间质瘤患者MSCT表现相似:阳性者MSCT平扫可见壁内圆形、卵圆形和类圆形等形态尚规则、边界尚清、密度较均匀且较高的软组织团块影,增强扫描动脉期可见富血供现象,肿块呈显著强化,静脉期强化更显著,伴有液化、坏死和囊性变时,可见强化不均匀,往往提示恶行程度较高(图 1A)。白光胃镜下贲门部及胃底部间质瘤多呈现为圆形、梭形、类球形和不规则形隆起性病变,病变部位表面黏膜多光滑、界清、色泽与周围正常黏膜一致,基底较广,恶性程度较高者可出现病变部位黏膜粗糙、小点状糜烂出血或浅溃疡形成(图 1B)。EUS下贲门部及胃底部间质瘤多表现为起源于固有肌层或黏膜肌层的圆形、类圆形与周围分界清楚的均匀低回声肿物影,当出现边界不清、内部回声不均或强回声等征象,多提示肿物恶性程度较高(图 1C)。
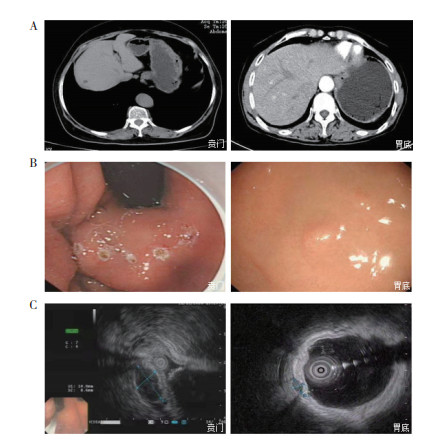
|
| 注A:MSCT检查示,贲门部及胃底部间质瘤呈类圆形或结节状软组织影,增强扫描可见病变部位轻度强化;B:白光胃镜检查示,贲门部及胃底部间质瘤呈半球形隆起性病变,表面黏膜光滑,边界清楚;C:超声胃镜检查示,贲门部及胃底部间质瘤呈椭圆形黏膜下隆起,边界清楚,病变起源于固有肌层,内部呈均匀低回声 图 1 贲门部及胃底部间质瘤MSCT、白光胃镜及超声胃镜下表现 Fig.1 MSCT, white light gastroscope and EUS findings of cardiac and fundus gastric stromal tumors |
MSCT可显示病变部位肿物的大小、边界、内部结构、与邻近组织的关系、强化类型及程度、淋巴结转移及远处转移等情况,且具有相对较高的空间与时间分辨率,后期还可进行图像重建,故可以更清晰显示病变部位,通过分析这些影像学征象可对肿物作出初步诊断[15]。此外,MSCT检查不仅耗时短,覆盖范围广,且为无创性的非侵入性操作,故被检者依从性多较高。然而,由于贲门部位本身解剖结构复杂,且仅有1%的GIST好发于此部位,MSCT检查对于此部位微小病变不易显示,故易造成漏诊。白光胃镜检查作为一种侵入性操作,可直视下对胃肠道黏膜病变部位做出观察判断,但多数GIST起源于消化道黏膜层以下,故完整的胃肠黏膜将影响白光胃镜观察黏膜下病变。而EUS通过超声微探头直接贴附在消化道黏膜表面,排除了胃肠内气体的干扰,避免了腹壁回声衰减,其充分结合了白光胃镜与超声的优势,可清晰显示胃肠道管壁的各层结构,如消化道管壁超声内镜图像上表现为5层“夹心饼干”样:(1)黏膜层呈现高回声;(2)黏膜肌层(黏膜固有层)呈现低回声;(3)黏膜下层呈现高回声;(4)固有肌层呈现低回声;(5)浆膜层呈现高回声[16]。本研究结果显示,113例患者均起源于固有肌层,其中2例起源于固有肌浅层,以低回声为主,可为均匀性或不均匀回声,伴有出血和坏死时可见内部混有高回声影。故EUS对于黏膜下病变的诊断有着独特优势,可准确定位及显示黏膜下病变与管壁以及周围邻近器官或组织的关系,还可显示病变范围、大小、起源层次、回声及边界等情况,故对于贲门部位间质瘤,其较少受解剖结构影响。而对于胃底部间质瘤病变,因局部胃底黏膜相对平整,MSCT与EUS检查均较少受局部解剖结构影响,故两者检查结果多无明显差异。这与本研究结果发现相符,即EUS检查对于贲门部间质瘤的诊断敏感度优于MSCT(94.3% vs 51.4%,P < 0.05),而对于胃底部间质瘤的诊断MSCT与EUS均表现出较高的敏感度(85.9% vs 89.7%,P > 0.05)。故临床工作中,对于可疑贲门部位肿物者,建议首选EUS检查来早期发现病变,对EUS检查结果阳性者,可加做包括贲门部在内的MSCT,来评估病变的良恶性、远处转移及周围淋巴结转移情况,从而为临床治疗方案的制定及预后评估等提供依据[17]。本研究因样本量少、选择偏倚和属于回顾性研究等存在不足,结论尚需要来自多个机构的更大样本的多中心前瞻性研究来证实。
| [1] |
Nishida T, Yoshinaga S, Takahashi T, et al. Recent progress and challenges in the diagnosis and treatment of gastrointestinal stromal tumors[J]. Cancers (Basel), 2021, 13(13): 3158. DOI:10.3390/cancers13133158 |
| [2] |
Nishida T, Cho H, Hirota S, et al. Clinicopathological features and prognosis of primary GISTs with tumor rupture in the real world[J]. Ann Surg Oncol, 2018, 25(7): 1961-1969. DOI:10.1245/s10434-018-6505-7 |
| [3] |
Chen ZY, Yang JJ, Sun JL, et al. Gastric gastrointestinal stromal tumours (2-5 cm): correlation of CT features with malignancy and differential diagnosis[J]. Eur J Radiol, 2020, 123: 108783. DOI:10.1016/j.ejrad.2019.108783 |
| [4] |
王小娟, 施育鹏, 梁树辉, 等. 胃神经鞘瘤33例临床病理分析[J]. 实用肿瘤杂志, 2021, 36(4): 320-323. |
| [5] |
Wang J, Zhou X, Xu F, et al. Value of CT imaging in the differentiation of gastric leiomyoma from gastric stromal tumor[J]. Can Assoc Radiol J, 2021, 72(3): 444-451. DOI:10.1177/0846537119885671 |
| [6] |
Akahoshi K, Oya M, Koga T, et al. Current clinical management of gastrointestinal stromal tumor[J]. World J Gastroenterol, 2018, 24(26): 2806-2817. DOI:10.3748/wjg.v24.i26.2806 |
| [7] |
Arshad J, Costa PA, Barreto-Coelho P, et al. Immunotherapy strategies for gastrointestinal stromal tumor[J]. Cancers (Basel), 2021, 13(14): 3525. DOI:10.3390/cancers13143525 |
| [8] |
麦日耶木姑丽·艾山, 陈志芬. 胃肠间质瘤的临床特征及其内镜下治疗的疗效研究[J]. 实用肿瘤杂志, 2020, 35(6): 559-563. |
| [9] |
李亚鸿, 解红霞, 王华, 等. 内蒙古地区胃肠道间质瘤804例临床数据分析[J]. 实用肿瘤杂志, 2021, 36(2): 118-124. |
| [10] |
Chantharasamee J, Adashek JJ, Wong K, et al. Translating knowledge about the immune microenvironment of gastrointestinal stromal tumors into effective clinical strategies[J]. Curr Treat Options Oncol, 2021, 22(1): 9. DOI:10.1007/s11864-020-00806-z |
| [11] |
Gómez-Peregrina D, García-Valverde A, Pilco-Janeta D, et al. Liquid biopsy in gastrointestinal stromal tumors: ready for prime time?[J]. Curr Treat Options Oncol, 2021, 22(4): 32. DOI:10.1007/s11864-021-00832-5 |
| [12] |
Nishida T, Goto O, Raut CP, et al. Diagnostic and treatment strategy for small gastrointestinal stromal tumors[J]. Cancer, 2016, 122(20): 3110-3118. DOI:10.1002/cncr.30239 |
| [13] |
Joensuu H, Hohenberger P, Corless CL. Gastrointestinal stromal tumour[J]. Lancet, 2013, 382(9896): 973-983. DOI:10.1016/S0140-6736(13)60106-3 |
| [14] |
Jo VY, Doyle LA. Refinements in sarcoma classification in the current 2013 World Health Organization classification of tumours of soft tissue and bone[J]. Surg Oncol Clin N Am, 2016, 25(4): 621-643. DOI:10.1016/j.soc.2016.05.001 |
| [15] |
Kane WJ, Friel CM. Diagnosis and treatment of rectal gastrointestinal stromal tumors[J]. Dis Colon Rectum, 2019, 62(5): 537-540. DOI:10.1097/DCR.0000000000001376 |
| [16] |
谢欣茹, 丁震, 韩超群, 等. 小探头内镜超声在消化道隆起性病变中的诊断价值[J]. 中华消化内镜杂志, 2020, 37(11): 833-836. DOI:10.3760/cma.j.cn321463-20191211-00684 |
| [17] |
Ao WQ, Cheng GH, Lin B, et al. A novel CT-based radiomic nomogram for predicting the recurrence and metastasis of gastric stromal tumors[J]. Am J Cancer Res, 2021, 11(6): 3123-3134. |
 2022, Vol. 37
2022, Vol. 37


