文章信息
- 陆一丹, 郑松, 柏玉蓉, 孙杨承
- Lu Yidan, Zheng Song, Bai Yurong, Sun Yangcheng
- 腹腔热灌注化疗联合全身化疗治疗胃癌腹膜转移的meta分析
- Hyperthermic intraperitoneal chemotherapy combined with systemic chemotherapy for gastric cancer peritoneal carcinomatosis: A meta-analysis
- 实用肿瘤杂志, 2020, 35(2): 159-165
- Journal of Practical Oncology, 2020, 35(2): 159-165
基金项目
- 国家自然科学基金面上项目(81372660);浙江省科技计划公益技术应用研究计划项目(2017C33200);浙江省医药卫生科技计划(2013KYA157);浙江省中医药科技计划(2013ZA104)
-
作者简介
- 陆一丹(1993-), 女, 浙江嘉兴人, 住院医师, 硕士, 从事消化道肿瘤发病机制研究.
-
通信作者
- 郑松, E-mail:tztree@126.com
-
文章历史
- 收稿日期:2020-01-23
2. 杭州市肿瘤医院肿瘤内科, 浙江 杭州 310006;
3. 浙江中医药大学附属杭州市第一人民医院肿瘤内科, 浙江 杭州 310006;
4. 浙江大学医学院附属杭州市第一人民医院肿瘤内科, 浙江 杭州 310006;
5. 南京医科大学附属杭州医院肿瘤内科, 浙江 杭州 310006
2. Department of Medical Oncology, Hangzhou Cancer Hospital, Hangzhou 310006, China;
3. Department of Medical Oncology, Affiliated Hangzhou First Hospital, Zhejiang University of Traditional Chinese Medicine, Hangzhou 310006, China;
4. Department of Medical Oncology, Affiliated Hangzhou First People's Hospital, Zhejiang University School of Medicine, Hangzhou 310006, China;
5. Department of Medical Oncology, Affiliated Hangzhou First People's Hospital, Nanjing Medical University, Hangzhou 310006, China
胃癌是严重影响人类健康的重大疾病, 我国胃癌发病率和死亡率均居恶性肿瘤第2位, 每年约有68万例新发病例数, 占世界胃癌发病例数的42%[1]。胃癌异质性强, 病情进展快, 多数胃癌患者初诊时即为进展期, 60%左右为胃癌腹膜转移(gastric cancer peritoneal carcinomatosis, GCPC)[2], 预后差, 临床诊疗挑战性大, 5年生存率低, 是一个亟待解决的严重公共卫生问题[3]。腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)在胃癌根治术伴高危因素的患者上对预防腹膜转移有一定疗效[4], 在腹膜转移治疗上, 可改善卵巢癌和结直肠癌患者生存[5-6], 常与细胞减灭术(cytoreductive surgery, CRS)联合, 应用在胃癌根治术的新辅助和辅助治疗[7]。目前GCPC采用以化疗为主的综合治疗模式, HIPEC治疗GCPC的循证医学证据尚为有限, 所以本文对近10年HIPEC联合全身化疗对比单纯全身化疗在GCPC治疗中的疗效和安全性进行荟萃分析。
1 资料与方法 1.1 纳入与排除标准 1.1.1 研究类型临床对照试验, 包括随机对照研究(randomized controlled trials, RCTs)和非随机对照研究(non-randomized controlled trials, NRCTs)。
1.1.2 研究对象病理确诊为胃腺癌/胃食管结合部腺癌伴腹膜转移, 排除包含胃癌以外的其他原发恶性肿瘤且无具体分组数据的研究。
1.1.3 干预措施纳入标准:对HIPEC明确定义, 对研究使用的药物以及采用的灌注技术有描述。试验组:HIPEC+全身化疗±CRS。对照组:全身化疗±CRS。
1.1.4 排除标准(1) 无法获取全文或数据不全; (2)非临床、单臂研究或对照设置不合理; (3)无远期生存数据; (4)概念有交叉的研究, 如"术后早期腹腔内化疗"、"腹腔化疗"、"腹腔化疗联合热疗"、"腹腔灌注化疗(无加温)"、"腹腔化疗(无液体循环无加温)"和"腹腔热灌注(无化疗药物)"等; (5)Cochrane偏倚风险评估为高度偏倚的RCTs; (6)非随机研究量表(methodological index for non-randomized studies, MINORS)[8]分数 < 12分的NRCTs。
1.1.5 结局指标长期生存指标:1年总生存率(1- year overall survival rate, 1y-OS)、中位无进展生存时间(median progression-free survival, mPFS)、中位总生存时间(median overall survival time, mOS)。安全性:治疗相关不良反应数据。
1.2 资料检索在MEDLINE、Cochrane Library和EMbase外文数据库中检索从2009年7月1日至2019年7月1日发表的有关HIPEC治疗GCPC的临床对照研究, 纳入采用HIPEC+全身化疗±CRS对比全身化疗±CRS治疗GCPC的临床研究。MeSH检索关键词包括:"hyperthermic intraperitoneal chemotherapy"、"stomach"、"gastric cancer"、"carcinosis"和"comparative study", "peritoneal carcinomatosis"并进行扩展检索。相应数据库、软件及经费由浙江大学医学院附属杭州市第一人民医院(杭州市肿瘤医院)浙江省临床肿瘤药理与毒理学研究重点实验室支持。
1.3 文献筛选、质量评价和数据提取文献筛选、质量评价和数据提取经2位独立研究人员进行, 对于分歧研究, 交予第三方裁定。数据提取内容:(1)基本信息:题目、作者和发表时间; (2)研究设计类型; (3)研究对象基本特征:匹配信息、对照设置、HIPEC组例数、对照组例数、化疗方案、mOS、mPFS、1年生存例数和安全性资料; (4)干预措施具体细节。RCTs采用Cochrane偏倚风险评估工具进行评价[9], 排除高度偏倚RCTs, 即质量标准完全不满足(高风险)条目≥ 1个, 或质量标准完全满足(低风险)条目≤ 1个。NRCTs采用MINORS方法进行定量质量评估[8]。评分标准:未报道0分; 报道但不充分1分; 报道且充分2分。纳入评分≥ 12分的高质量NRCTs(表 1)[10-20]。
| 作者 | 年份 | 连续纳入 患者 |
随访数据 采集 |
记录临床 终点 |
结果评价 无偏倚 |
对照设置 合理 |
现代团队 | 团队设备 | 样本规模 | 分数 |
| 纳入 | ||||||||||
| Yuan等[10] | 2016 | 2 | 0 | 2 | 2 | 2 | 2 | 2 | 1 | 13 |
| Lu等[11] | 2016 | 2 | 1 | 2 | 2 | 2 | 1 | 2 | 1 | 13 |
| Yarema等[12] | 2014 | 2 | 1 | 2 | 2 | 2 | 2 | 1 | 1 | 13 |
| Hultman等[13] | 2012 | 2 | 1 | 2 | 2 | 2 | 2 | 2 | 0 | 13 |
| 排除 | ||||||||||
| Hall等[14] | 2004 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 2 | 10 |
| Akiyama等[15] | 2002 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 2 | 7 |
| Konno等[16] | 1991 | 0 | 0 | 1 | 1 | 0 | 1 | 1 | 2 | 6 |
| Fujimoto等[17] | 1996 | 2 | 1 | 0 | 1 | 1 | 1 | 0 | 2 | 8 |
| Kim等[18] | 2014 | 2 | 0 | 2 | 2 | 2 | 2 | 1 | 0 | 11 |
| Zhao等[19] | 2012 | 2 | 1 | 2 | 1 | 1 | 2 | 1 | 1 | 11 |
| Kunisaki等[20] | 2006 | 2 | 0 | 2 | 2 | 0 | 2 | 1 | 1 | 10 |
采用Cochrane协作网提供的RevMan 5.3软件进行统计学分析。异质性评价采用异质性指标I2值。I2 < 25%时, 表示无异质性; 25% ≤ I2 < 50%时, 表示轻度异质性; 50% ≤ I2 < 75%时, 表示存在中度异质性; I2≥ 75%时, 表示存在高度异质性[21]。考虑到HIPEC的药物选择可能存在不同, NRCTs研究异质性较大, 拟选择随机效应模型进行分析。对计量资料(mOS和mPFS)采用风险比(hazard ratio, HR)及其95%可信区间(confidence interval, CI)为效应分析统计量, 对于计数资料(1y-OS)采用计算相对危险度(relative risk, RR)进行合并统计量, 各效应量均给出其点估计值及95% CI。以P < 0.05为差异具有统计学意义。当无充分数据时, 采用描述性分析。采用漏斗图判断潜在的发表偏倚。
2 结果 2.1 文件检索结果和评估结果检索2009年7月1日至2019年7月1日相关文献, 筛去重复后得到460篇。阅读题目和摘要, 排除单臂研究、非临床试验、疾病混合、非GCPC、没有生存数据和无法得到全文, 剩余85篇。阅读全文, 排除单臂研究、疾病混合、设计不合适和没有生存数据, 剩余12篇(图 1)。其中RCTs 1篇[22], 经过Cochrane偏倚风险评估工具评价后纳入(图 2), 共16例(HIPEC组9例, 对照组7例); NRCTs 11篇, 经过MINORS进行质量评估后排除7篇(< 12分), 纳入4篇[10-13], 共141例(HIPEC组71例, 对照组70例), 均为回顾性分析。共计纳入GCPC患者157例(HIPEC组79例, 对照组78例)。
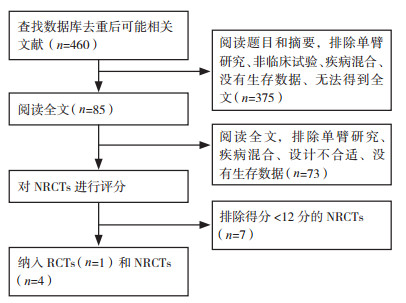
|
| 注 RCTs:随机对照研究(randomized controlled trials);NRCTs:非随机对照研究(non-randomized controlled trials) 图 1 纳入文献筛选流程图 Fig.1 Flow chart of trial selection process |
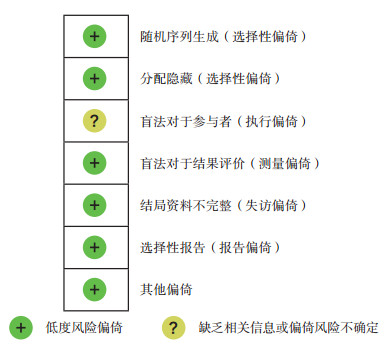
|
| 图 2 随机对照研究质量评估 Fig.2 Quality assessment of randomized controlled studies |
对照设置均匹配, 研究对象均为GCPC, HIPEC所用药物如下:RCT采用奥沙利铂[22], NRCTs中有1项采用顺铂+多柔比星方案[13], 1项采用丝裂霉素[12]。有3项研究采用腹膜肿瘤评分(peritoneal cancer index, PCI)[12-13, 22], 有3项研究通过腹腔镜探查[12-13, 22]。
2.3 远期疗效分析HIPEC组和对照组1y-OS分别为68.4%和26.9%。异质性评价, χ2=6.97, I2=43%, 选择随机效应模型[RR=0.51(95% CI:0.33~0.78), P=0.002; 图 3]。mOS从4.3~11.1个月[13, 22]延长到11.3~21个月[11, 22], χ2=0.54, I2=0%, 选择随机效应模型[HR=0.78 (95% CI:0.68~0.88), P < 0.01; 图 4]。mPFS方面异质性评价, χ2=1.81, I2=45%, 选择随机效应模型[HR=0.64 (95% CI:0.36~1.51), P=0.14; 图 5]。HIPEC组在1y-OS和mOS方面均优于对照组。
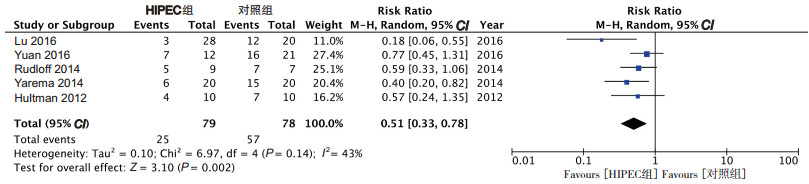
|
| 图 3 胃癌腹膜转移患者1年生存率分析 Fig.3 Analysis of one-year survival of GCPC patients |

|
| 图 4 胃癌腹膜转移患者中位总生存期分析 Fig.4 Analysis of mOS of GCPC patients |

|
| 图 5 胃癌腹膜转移患者中位无进展生存期分析 Fig.5 Analysis of mPFS of GCPC patients |
有1项研究涉及安全性研究[11], HIPEC组的恶心/呕吐、骨髓抑制、腹泻便秘和肝/肾损害的发生率与对照组比较, 差异无统计学意义(P>0.05)。
2.5 发表偏倚分析HIPEC组与对照组的倒漏斗图分析提示研究分布较为对称, 落在95% CI界限内, 未见明显发表偏倚, 各研究间无异质性(图 6)。
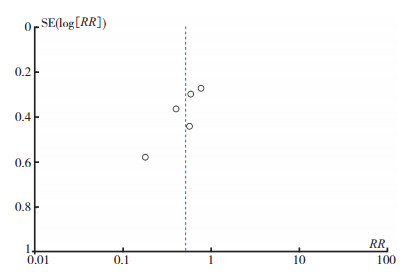
|
| 图 6 纳入研究的漏斗图 Fig.6 Funnel plot for the results from all included studies |
对于失去根治手术机会的晚期胃癌患者, 目前公认采取以姑息化疗为主的治疗手段, 能将中位生存期延长至6~10个月[23], 但总体生存改善十分有限。胃癌最易转移至腹膜, 肿瘤细胞脱落后种植到腹膜表面, 腹膜增厚阻塞腹腔静脉和(或)淋巴管, 导致回流障碍, 形成恶性腹腔积液, 影响患者生活质量, 腹膜转移患者mOS仅为6~7.5个月[3]。由于腹膜屏障的存在, 腹腔内难以达到有效的药物浓度而对转移灶的疗效欠佳。
根据腹膜转移的特性, HIPEC结合腹腔灌注化疗、热疗和机械冲刷作用3个特性, 指将含化疗药物的灌注液精准恒温、持续循环灌注、充盈腹腔并维持一定时间, 能够清除腹腔游离癌细胞和微小的转移病灶。目前多采用高精度持续循环热灌注法, 通过内循环管路实现含有化疗液循环流动, 外循环管路实现腹腔内温度的恒定[24]。在治疗结直肠癌和卵巢癌等腹腔恶性肿瘤的腹膜种植转移方面具有独特的疗效, 可改善患者生存[5-6]。HIPEC在胃癌中可预防腹膜转移, 延长生存[4, 25]。CRS可以清除肉眼可见的肿瘤病灶, 降低肿瘤负荷, 两者联合可以延长GCPC患者生存期, 尤其在局限性腹膜转移的患者[26]。
本荟萃分析结果显示, HIPEC联合全身化疗治疗GCPC在1y-OS和mOS上均优于单纯全身化疗, 并且可控制腹膜转移进展, 控制恶性腹腔积液[11-12], 改善患者生活质量[11, 27]。其中有3项研究采用PCI评分系统[12-13, 22], 在手术探查时评估侵袭性肿瘤的腹膜转移状况。Rudloff等[22]的RCT研究显示, 术后生存期>12个月的都是达到PCI ≤ 15的患者。Yarema等[12]的研究选择在PCI < 14的患者中采用CRS + HIPEC +化疗的三联疗法, 提高患者生存率, 提示选择人群的重要性, 建议在GCPC患者中尽可能在广泛播散前应用该疗法。HIPEC药物方案尚未完全标准化, 研究中的方案各异(表 2)[10-13, 22]。最近一项体外研究显示, 最佳方案是在42℃下5-FU、顺铂和丝裂霉素联合治疗30 min, 抑制细胞生长[28], 该结论有待进一步临床证实。
| 作者 | 年份 | 样本量 | 观察组 | 对照组 | 匹配因素* | 对照设置 | HIPEC药物 | PCI评分 | mOS (月) | |
| (例) | (例) | (例) | HIPEC+SC | SC | ||||||
| RCTs | ||||||||||
| Rudloff等[22] | 2014 | 16 | 9 | 7 | 1,2, 3, 4, 5 | CRS+HIPEC+化疗vs化疗 | 奥沙利铂 | 有 | 11.3 | 4.3 |
| NRCTs | 141 | 70 | 71 | |||||||
| Yuan等[l0] | 2016 | 33 | 12 | 21 | 1,2, 3, 4, 5 | HIPEC+化疗vs化疗 | 未统一 | - | 16.2 | 7.3 |
| Lu等[11] | 2016 | 48 | 28 | 20 | 1,2, 3, 4 | HIPEC+化疗vs化疗 | 奥沙利铂/多西他赛+替加氟 | - | 21 | 9 |
| Yarema等[12] | 2014 | 40 | 20 | 20 | 1,2, 3, 4 | CRS+HIPEC+化疗vs化疗 | 丝裂霉素 | 有 | 12 | 8 |
| Hultman等[13 | 2012 | 20 | 10 | 10 | 1,2, 4 | CRS+HIPEC+化疗vs化疗 | 顺铂+多柔比星 | 有 | 17.4 | 11.1 |
| 总计 | 157 | 79 | 78 | |||||||
| 注 *1为年龄,2为性别,3为组织学分型,4为分期,5为淋巴结分期;RCTs:随机对照研究(randomized controlled trials);NRCTs:非随机对照研究(non-randomized controlled trials);CRS:细胞减灭术(cytoreductive surgery);HIPEC:腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy);PCI:腹膜肿瘤评分(peritoneal cancer index);mOS:中位总生存时间(median overall survival time);SC:全身化疗(systemic chemotherapy) | ||||||||||
HIPEC对腹膜转移有较好的疗效是由于其有热疗、腹腔直接给药和循环灌注这三大特征。热疗主要是运用癌细胞和正常细胞对温度耐受的特殊性差异原理[29], 靶向热敏肿瘤细胞, 增强癌细胞的坏死和凋亡[30]。热疗联合化疗有协同作用, 高温使化疗药物渗透性和吸收率提高, 药物活性大大增强[31]。体外实验表明, 与结肠癌细胞系和胰腺癌细胞系比较, 胃癌细胞系在高温时对顺铂更敏感[32], 再次提示HIPEC在胃癌治疗中的地位。腹腔直接给药可以增加药物浓度及与游离肿瘤细胞接触的概率, 最大限度地杀伤肿瘤细胞, 又由于腹膜-血液屏障的存在, 药物可以从腹膜弥散或吸收或通过腹膜脏层而被吸收进入胃的血供, 减少化疗引起的不良反应, 延长药物半衰期[33]。持续循环灌注的机械性冲刷作用, 有利于清除腹腔游离癌细胞和腹膜微小转移病灶。
HIPEC的并发症主要分为化疗相关和腹腔穿刺相关。前者包括骨髓抑制、胃肠道反应、化学性腹膜炎以及腹胀腹痛。研究证明HIPEC骨髓抑制和胃肠道反应等的发生率低于全身化疗的对照研究组, 但主要仍是血液毒性反应(0%~31%)[34]。腹腔穿刺及置管相关并发症发生率很低, 包括腹腔出血、导管相关感染和肠穿孔等。本研究纳入的1篇涉及安全性的研究中, HIPEC组的3~4级不良反应发生率与对照组比较差异无统计学意义(P>0.05), 安全性好。
与单独的全身化疗比较, HIPEC联合全身化疗可以延长GCPC患者生存, 安全可耐受, 因此值得进一步的临床研究。本研究也有一定的局限性, 纳入研究较少, 且以NRCTs为主, 多数研究未提及盲法及分配隐藏, 安全性数据采用描述性分析, 还需要进一步开展高质量、大样本、多中心的涉及安全性的RCT研究。
目前正在招募中的临床试验:HIPEC、CRS和化疗三联治疗对比CRS联合化疗治疗GCPC的Ⅲ期RCT研究, 预计入组88例(NCT03179579)。HIPEC联合化疗对比单纯化疗治疗晚期胃癌的Ⅱ期RCT研究, 预计入组56例患者(NCT03604614)。相信能进一步完善HIPEC理论和提高技术水平, 推动GCPC的综合治疗发展。
| [1] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. |
| [2] |
Coccolini F, Montori G, Ceresoli M, et al. Advanced gastric cancer:What we know and what we still have to learn[J]. World J Gastroenterol, 2016, 22(3): 1139. |
| [3] |
朱志. 胃癌腹膜转移的诊治研究进展[J]. 实用肿瘤杂志, 2018, 33(3): 204-208. |
| [4] |
Golse N, Bakrin N, Passot G, et al. Iterative procedures combining cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for peritoneal recurrence:postoperative and long-term results[J]. J Surg Oncol, 2012, 106(2): 197-203. |
| [5] |
Deraco M, Kusamura S, Virzì S, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy as upfront therapy for advanced epithelial ovarian cancer:Multi-institutional phase-Ⅱ trial[J]. Gynecol Oncol, 2011, 122(2): 215-220. |
| [6] |
黄思澔, 杨朝纲, 姜军, 等. 腹腔热灌注化疗治疗结直肠癌腹膜转移癌临床疗效的meta分析[J]. 实用肿瘤杂志, 2018, 33(6): 43-47. |
| [7] |
Gamboa A, Winer J. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for gastric cancer[J]. Cancers, 2019, 11(11): 1662. |
| [8] |
Slim K, Nini E, Forestier D, et al. Methodological index for non-randomized studies (minors):development and validation of a new instrument[J]. ANZ J Surg, 2003, 73(9): 712-716. |
| [9] |
Higgins JP, Altman DG, Gotzsche PC, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials[J]. BMJ, 2011, 343(2): 5928-5928. |
| [10] |
Yuan M, Wang Z, Hu G, et al. A retrospective analysis of hyperthermic intraperitoneal chemotherapy for gastric cancer with peritoneal metastasis[J]. Mol Clin Oncol, 2016, 5(2): 395-399. |
| [11] |
Lu C, Li L, Luo Z, et al. Clinical efficacy of type-B ultrasound-guided intraperitoneal hyperthermic chemoperfusion combined with systemic chemotherapy in advanced gastric cancer patients with malignant ascites[J]. Neoplasma, 2016, 63(2): 299-303. |
| [12] |
Yarema RR, Ohorchak MA, Zubarev GP, et al. Hyperthermic intraperitoneal chemoperfusion in combined treatment of locally advanced and disseminated gastric cancer:results of a single-centre retrospective study[J]. Int J Hyperthermia, 2014, 30(3): 159-65. |
| [13] |
Hultman B, Lundkvist J, Glimelius B, et al. Costs and clinical outcome of neoadjuvant systemic chemotherapy followed by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in peritoneal carcinomatosis from gastric cancer[J]. Acta Oncol, 2012, 51(1): 112-21. |
| [14] |
Hall JJ, Loggie BW, Shen P, et al. Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for advanced gastric cancer[J]. J Gastrointest Surg, 2004, 8(4): 454-463. |
| [15] |
Akiyama H, Kunisaki C, Nomura M, et al. Effectiveness of continuous hyperthermic peritoneal perfusion for the peritoneal dissemination of gastric cancer[J]. Gan To Kagaku Ryoho, 2002, 29(12): 2168-2173. |
| [16] |
Konno C, Fujimoto S, Shrestha RD, et al. Clinical evaluation of intra-peritoneal hyperthermic perfusion under hypothermic general anesthesia for advanced gastric cancer[J]. Gan To Kagaku Ryoho, 1991, 18(11): 1804-1807. |
| [17] |
Fujimoto S, Takahashi M, Mutou T, et al. Survival time and prevention of side effects of intraperitoneal hyperthermic perfusion with mitomycin C combined with surgery for patients with advanced gastric cancer[J]. Cancer Treat Res, 1996, 81: 169-176. |
| [18] |
Kim KW, Chow O, Parikh K, et al. Peritoneal carcinomatosis in patients with gastric cancer, and the role for surgical resection, cytoreductive surgery, and hyperthermic intraperitoneal chemotherapy[J]. Am J Surg, 2014, 207(1): 78-83. |
| [19] |
Zhao C, Dai C, Chen X. Whole-body hyperthermia combined with hyperthermic intraperitoneal chemotherapy for the treatment of stage Ⅳ advanced gastric cancer[J]. Int J Hyperthermia, 2012, 28(8): 735-741. |
| [20] |
Kunisaki C, Shimada H, Akiyama H, et al. Therapeutic outcomes of continuous hyperthermic peritoneal perfusion against advanced gastric cancer with peritoneal carcinomatosis[J]. Hepatogastroenterology, 2006, 53(69): 473-478. |
| [21] |
Higgins JP, Thompson SG, Deeks JJ, et al. Measuring inconsistency in meta-analyses[J]. BMJ, 2003, 327(7414): 557-560. |
| [22] |
Rudloff U, Langan RC, Mullinax JE, et al. Impact of maximal cytoreductive surgery plus regional heated intraperitoneal chemotherapy (HIPEC) on outcome of patients with peritoneal carcinomatosis of gastric origin:results of the GYMSSA trial[J]. J Surg Oncol, 2014, 110(3): 275-284. |
| [23] |
Wang FH, Shen L, Li J, et al. The Chinese Society of Clinical Oncology (CSCO):clinical guidelines for the diagnosis and treatment of gastric cancer[J]. Cancer Commun (Lond), 2019, 39(1): 10. |
| [24] |
杨肖军, 熊斌. 腹腔热灌注化疗在胃肠道恶性肿瘤腹膜转移中的应用[J]. 临床外科杂志, 2019, 27(5): 443-446. |
| [25] |
Brenkman H, Päeva M, Van-Hillegersberg R, et al. Prophylactic hyperthermic intraperitoneal chemotherapy (HIPEC) for gastric cancer-a systematic review[J]. J Clin Med, 2019, 8(10): 1685. |
| [26] |
Bonnot PE, Piessen G, Kepenekian V, et al. Cytoreductive surgery with or without hyperthermic intraperitoneal chemotherapy for gastric cancer with peritoneal metastases (CYTO-CHIP study):a propensity score analysis[J]. J Clin Oncol, 2019, 37(23): 2028-2040. |
| [27] |
袁红, 刘钟钊, 曾海刚. 晚期胃癌术后腹腔热灌注与全身静脉联合化疗的效果分析[J]. 中国现代普通外科进展, 2017, 20(10): 822-824. |
| [28] |
Murata S, Yamamoto H, Shimizu T, et al. 5-fluorouracil combined with cisplatin and mitomycin C as an optimized regimen for hyperthermic intraperitoneal chemotherapy in gastric cancer[J]. J Surg Oncol, 2018, 117(4): 671-677. |
| [29] |
Garofalo A, Valle MJ, Sugarbaker PH. Laparoscopic intraperitoneal hyperthermic chemotherapy for palliation of debilitating malignant ascites[J]. Eur J Surg Oncol, 2006, 32(6): 682-685. |
| [30] |
Cavaliere R, Ciocatto EC, Giovanella BC, et al. Selective heat sensitivity of cancer cells. Biochemical and clinical studies[J]. Cancer, 1967, 20(9): 1351-81. |
| [31] |
Cui SZ, Ba MC, Tang YQ, et al. B ultrasound-guided hyperthermic intraperitoneal perfusion chemotherapy for the treatment of malignant ascites[J]. Oncol Rep, 2012, 28(4): 1325. |
| [32] |
Cesna V, Sukovas A, Jasukaitiene A, et al. Narrow line between benefit and harm:Additivity of hyperthermia to cisplatin cytotoxicity in different gastrointestinal cancer cells[J]. World J Gastroenterol, 2018, 24(10): 1072-1083. |
| [33] |
Ze L, Jie W, M Guillaume W, et al. Intraperitoneal therapy for peritoneal cancer[J]. Future Oncol, 2010, 6(10): 1625-1641. |
| [34] |
Sugarbaker PH, Mora JP, Stuart OA, et al. Update on chemotherapeutic agents utilized for perioperative intraperitoneal chemotherapy[J]. Oncologist, 2005, 10(2): 112. |
 2020, Vol. 35
2020, Vol. 35


