文章信息
- 张丹娅, 李飞, 徐汉杰, 奚玲, 赵璨
- Zhang Danya, Li Fei, Xu Hanjie, Xi Ling, Zhao Can
- XPNPEP2在乳腺癌组织中的表达及其临床意义
- Expression and clinical signifi cance of XPNPEP2 in breast cancer tissues
- 实用肿瘤杂志, 2022, 37(5): 389-396
- Journal of Practical Oncology, 2022, 37(5): 389-396
基金项目
- 国家自然科学基金面上项目(81472444);国家自然科学青年基金项目(81802608)
-
通信作者
- 赵璨, E-mail: 373583984@qq.com
-
文章历史
- 收稿日期:2021-08-20
2. 华中科技大学同济医学院附属同济医院病理研究所, 湖北 武汉 430030
2. Institute of Pathology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
乳腺癌是女性最常见的恶性肿瘤,也是世界上最常见的癌症之一[1-2]。近年来乳腺癌的治疗方法也在不断完善[3], 但是,乳腺癌作为恶性肿瘤依然极大地威胁着女性健康,因此从分子机制寻找更佳的干预措施和治疗方案仍是极大的挑战。氨肽酶P2(aminopeptidase P2,XPNPEP2)是相对分子量为75 000的膜结合型的金属蛋白酶,由位于Xq25染色体上的XPNPEP2基因编码[4],可催化去除氨基酸序列中脯氨酸N端P1位点的氨基酸残基[5]。既往研究表明,XPNPEP2在缓激肽失活过程中具有重要的生理作用,并且可以减轻血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor, ACEI)药物引起的血管性水肿[6]。因此其常作为心血管系统疾病方面用来设计新型心血管药物的潜在靶点而为人们熟知[7]。此外,还有研究表明,XPNPEP2基因是卵巢功能不全和卵巢早衰的标记基因之一[8]。近年来研究发现,XPNPEP2在某些恶性肿瘤中的表达也具有重要意义。一系列相关研究表明,XPNPEP2在胃癌[9]、子宫颈癌[10]、结直肠癌[11]和前列腺癌[12]中异常表达,且其在肿瘤中的高表达与患者不良预后密切相关[9, 11]。本课题组在既往研究中发现,高侵袭性前列腺癌患者肿瘤组织高表达XPNPEP2蛋白,血清XPNPEP2水平升高,并且研究证实,血清XPNPEP2水平与淋巴结转移有关,并预示着患者的不良预后[12]。因此合理推测XPNPEP2在前列腺癌中可以作为高侵袭性恶性肿瘤淋巴结转移的分子标志。此外还有研究证明,XPNPEP2在子宫颈鳞癌中高表达,并且与其淋巴结转移相关,通过诱导癌细胞发生上皮-间质转化(epithelial-mesenchymal transition,EMT)而促进癌细胞的迁移和侵袭,因此患者总生存率较差[10]。
女性乳腺癌最常见的扩散方式为淋巴转移,扩散部位是区域淋巴结,因此,区域淋巴结是否转移仍然是判断乳腺癌患者预后的重要指标[13]。此外,还有一种分子水平上定义为特殊类型的乳腺癌,即三阴性乳腺癌(triple negative breast cancer,TNBC)。TNBC即雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达均为阴性的乳腺癌,是侵袭性癌的一种亚型,其病理分期更差,患者生存率更低,并且对多种靶向药物不敏感,缺乏标准化的TNBC治疗方案[14-15],尚需寻找新的分子标志物为其提供诊断和治疗的有效靶点。然而,关于XPNPEP2在乳腺癌组织中的表达情况及其临床意义尚未报道。基于此,本研究利用组织芯片技术,运用免疫组织化学方法对69例乳腺癌组织及19例癌旁组织中XPNPEP2蛋白的表达水平进行检测,并分析其表达水平与区域淋巴结及相关肿瘤分子标志物,希望能为乳腺癌的诊断和治疗提供新的分子标志物。
1 资料与方法 1.1 临床资料附有相关临床病理信息的孔径1.5 mm的乳腺癌组织芯片1张购于美国Biomax公司,包含60例浸润性导管癌、9例髓样癌和3例癌旁正常组织共72例女性乳腺癌患者。69例乳腺癌组织均来源于捐赠者,在其知情同意的条件下,对其样本进行分析鉴定,年龄28~79岁,中位年龄48岁。3例癌旁正常组织来源的患者年龄分别为38、43和49岁。69例乳腺癌患者相关临床特征包括性别、年龄、病理诊断、TNM分期、分级和分子生物标志物等指标见表 1。收集2013年3月至6月华中科技大学同济医学院附属同济医院病理科16例癌旁正常乳腺组织用于对照研究XPNPEP2表达水平,年龄30~56岁,中位年龄43岁,均为女性病例。所有标本均经病理检查确诊为乳腺癌,其临床分期根据美国癌症分期委员会制定的乳腺癌TNM分期标准[16]。标本经4%甲醛溶液固定,脱水,石蜡包埋。本次标本使用经华中科技大学同济医学院附属同济医院伦理委员会批准。
| 临床病理特征 | 例数(%) |
| 年龄 | |
| < 50岁 | 37(53.6) |
| ≥50岁 | 32(46.4) |
| 肿瘤大小 | |
| ≤5 cm(T1~2) | 43(62.3) |
| > 5 cm(T3~4) | 26(37.7) |
| 区域淋巴结 | |
| N0 | 44(63.8) |
| N1~3 | 25(36.2) |
| 分级* | |
| 1级 | 14(25.0) |
| 2级 | 30(53.6) |
| 3级 | 12(21.4) |
| ER* | |
| 阴性 | 23(42.6) |
| 阳性 | 31(57.4) |
| PR* | |
| 阴性 | 32(59.3) |
| 阳性 | 22(40.7) |
| HER2* | |
| 阴性 | 39(72.2) |
| 阳性 | 15(27.8) |
| TNM分期 | |
| Ⅰ期 | 3(4.3) |
| Ⅱ期 | 46(66.7) |
| Ⅲ期 | 19(27.5) |
| Ⅳ期 | 1(1.5) |
| 注 ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterne receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor 2);*部分患者数据不足 | |
兔抗人XPNPEP2多克隆抗体(GTX109995,1∶250),通用SP试剂盒购自北京中杉金桥生物技术有限公司,DAB显色试剂盒和苏木精染色剂购自武汉塞维尔生物科技有限公司。
1.3 免疫组织化学染色将组织芯片蜡块以5 μm连续切片,筛选完整样本切片先做HE染色,再严格按照免疫组织化学SP法试剂盒说明进行操作。切片置于恒温箱中烘烤1~2 h脱蜡;再置于二甲苯中脱蜡2次;乙醇梯度水化、抗原修复内源性过氧化物酶阻断和山羊血清室温封闭;加入兔抗人XPNPEP2一抗4℃孵育过夜;次日封生物素标记山羊抗小鼠/兔IgG二抗聚合物10~15 min,辣根酶标记链霉卵白素工作液10~15 min,DAB显色,显微镜下控制显色时间;苏木精对比染色细胞核,盐酸乙醇分化,氨水反蓝;乙醇水化及二甲苯透明;中性树脂封固,光学显微镜(奥林巴斯,日本)下阅片和结果判定。以PBS代替一抗作为阴性对照。
1.4 免疫组织化学评分采用双盲法由2名华中科技大学同济医学院附属同济医院病理科医师对免疫组织化学结果阅片并评分。XPNPEP2阳性结果为细胞出现棕黄色至深褐色。按阳性染色强度和阳性细胞百分比进行评分[15]:阳性染色强度定为0分(阴性)、1分(弱阳性,浅黄色)、2分(中等阳性,棕黄色)和3分(强阳性,褐色);阳性细胞百分比定为0分(0%)、1分(1%~25%)、2分(26%~50%)、3分(51%~75%)和4分(76%~100%);免疫染色总分=阳性染色强度×阳性细胞百分比评分。总分范围0~12分,0~4分视为低表达,5~12分视为高表达[17]。
1.5 Kaplan-Meier Plotter数据库作生存分析2021年6月采用Kaplan-Meier Plotter数据库分析XPNPEP2 mRNA的表达与乳腺癌患者无复发生存(relapse-free survival,RFS)的关系。根据淋巴结状态和乳腺癌肿瘤分子标志物(ER、PR和HER2)表达情况对患者进行分组分析。
1.6 统计学分析应用SPSS23.0统计学软件及GraphPad Prism 7.0软件进行数据分析。计量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验。Kaplan-Meier Plotter数据库作生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 XPNPEP2在乳腺癌组织及癌旁组织中的表达水平XPNPEP2蛋白阳性表现为细胞内出现浅黄色至棕褐色颗粒, 在乳腺癌组织中呈不同强度表达,而癌旁正常组织中几乎不表达此蛋白(图 1)。
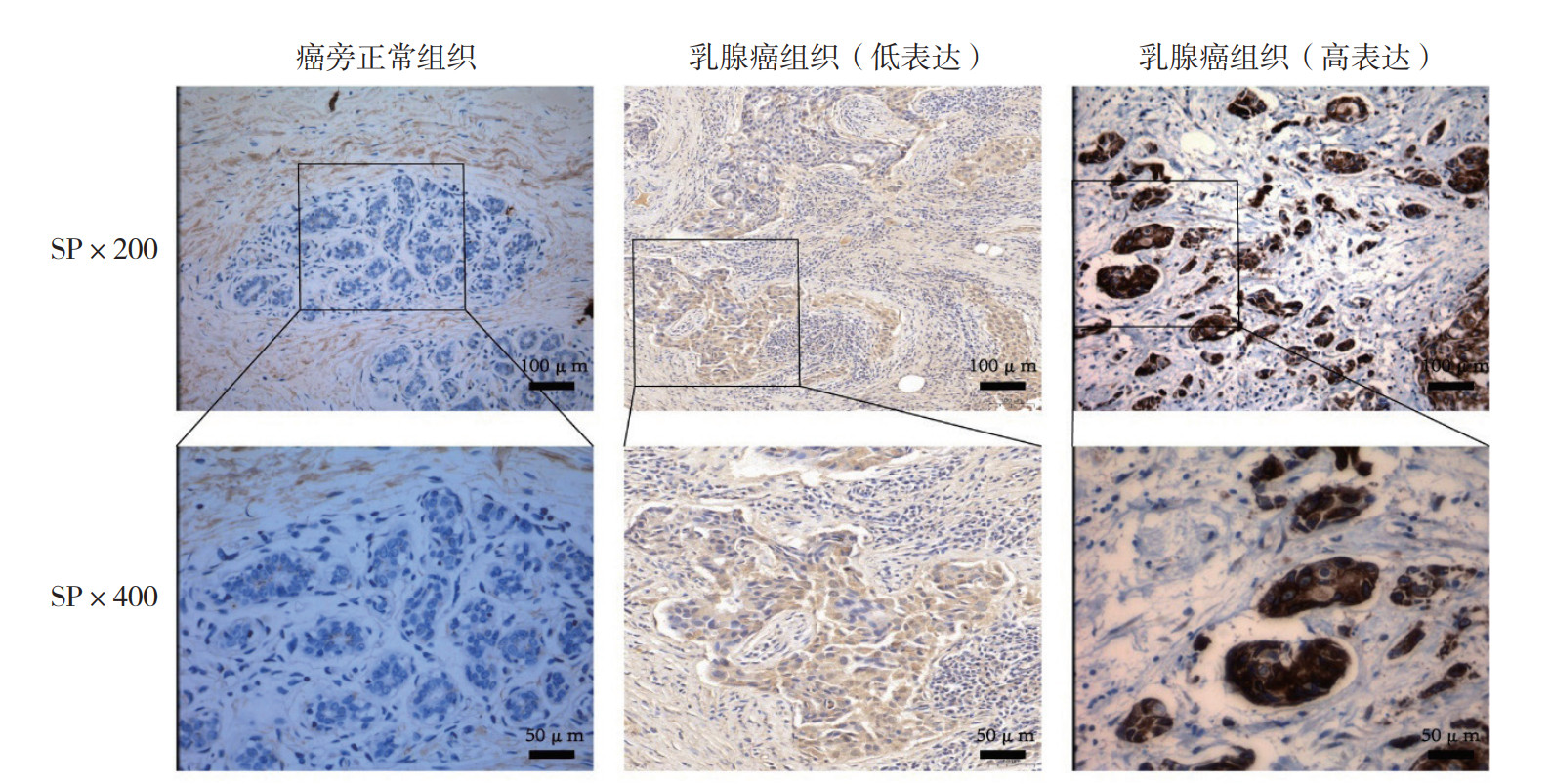
|
| 图 1 免疫组织化学检测XPNPEP2在乳腺癌组织和癌旁正常组织中的表达 Fig.1 Expression of XPNPEP2 in breast cancer tissues and adjacent normal tissues detected by immunohistochemistry |
69例乳腺癌组织中XPNPEP2低表达17例,高表达52例。乳腺癌患者XPNPEP2表达水平在TNM分期、肿瘤分级和区域淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05,图 2A~2C),而在病理类型(是否为TNBC)以及ER、PR和HER2表达情况方面比较,差异均无统计学意义(均P > 0.05,图 2D,图 3)。
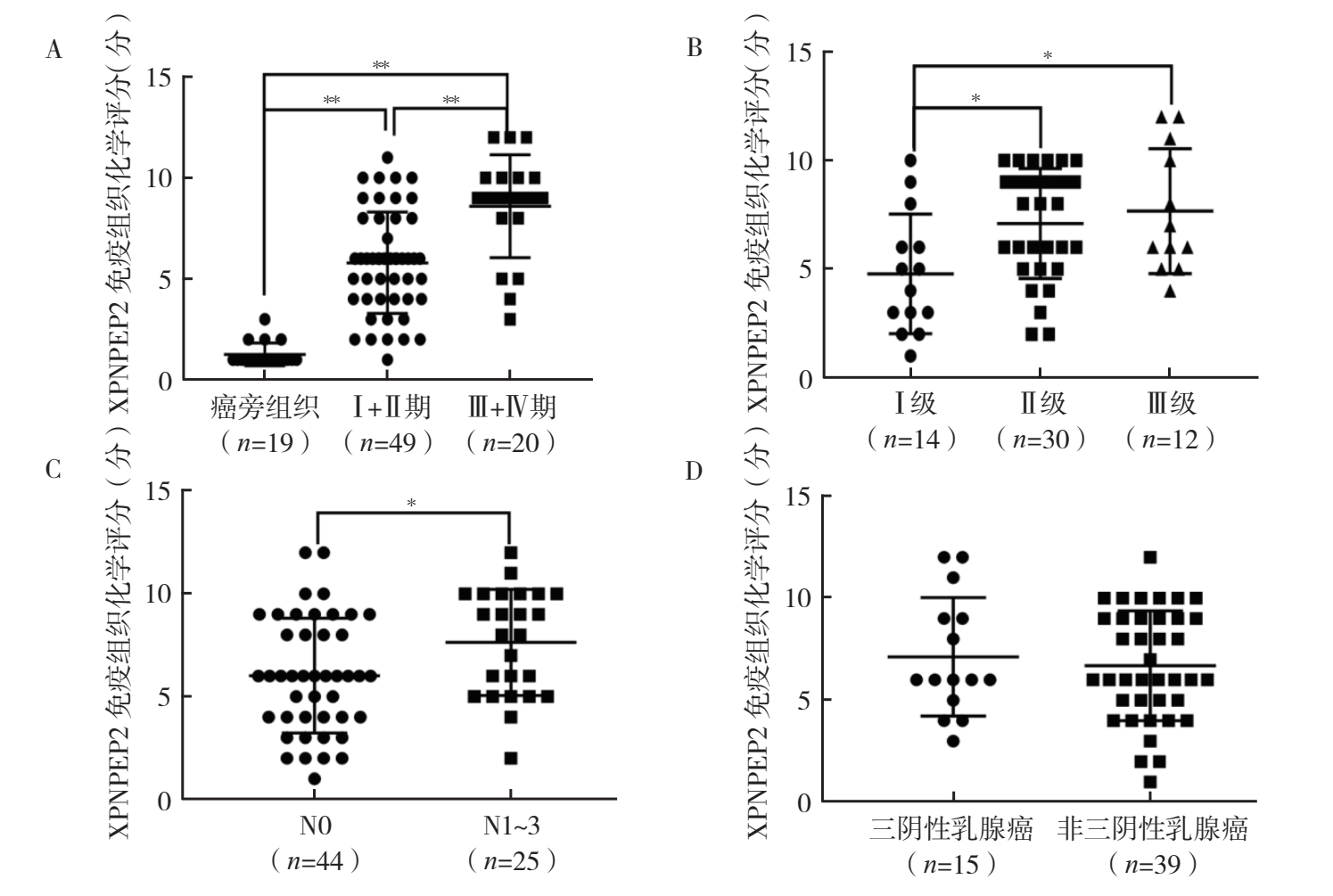
|
| 注 A:乳腺癌组织中XPNPEP2表达免疫组织化学染色评分与患者TNM分期的关系;B:乳腺癌组织中XPNPEP2表达免疫组织化学染色评分与患者乳腺癌分级的关系;C:乳腺癌组织中XPNPEP2表达免疫组织化学染色评分与患者区域淋巴结转移情况的关系;D:三阴性乳腺癌及非三阴性乳腺癌组织中XPNPEP2表达免疫组织化学染色评分比较;*P < 0.05;**P < 0.01 图 2 乳腺癌组织中XPNPEP2表达免疫组织化学染色评分与患者临床病理参数的关系 Fig.2 Relationship between the immunohistochemical staining score of XPNPEP2 in breast cancer tissues and the clinicopathological parameters of the patients |
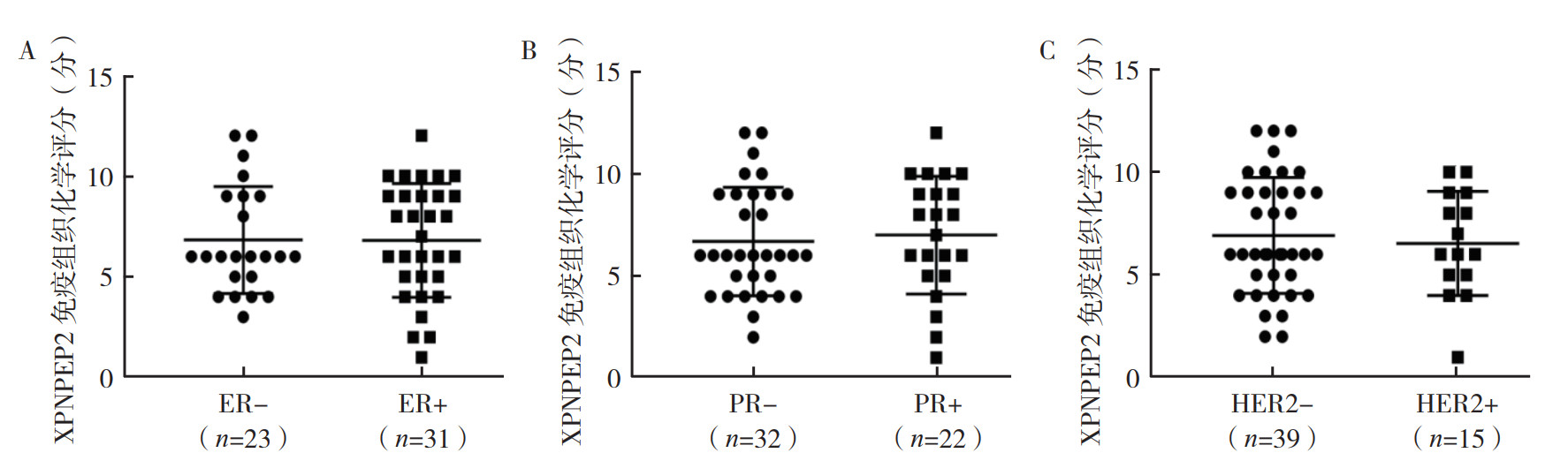
|
| 注 A:乳腺癌组织中XPNPEP2免疫组织化学染色评分与ER表达的关系;B:乳腺癌组织中XPNPEP2免疫组织化学染色评分与PR表达的关系;C:乳腺癌组织中XPNPEP2免疫组织化学染色评分与HER2表达的关系;ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterne receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor 2) 图 3 XPNPEP2在乳腺癌组织中免疫组织化学染色评分与生物标志物表达的关系 Fig.3 Relationship between the immunohistochemical staining score of XPNPEP2 and biomarker expressions in breast cancer tissues |
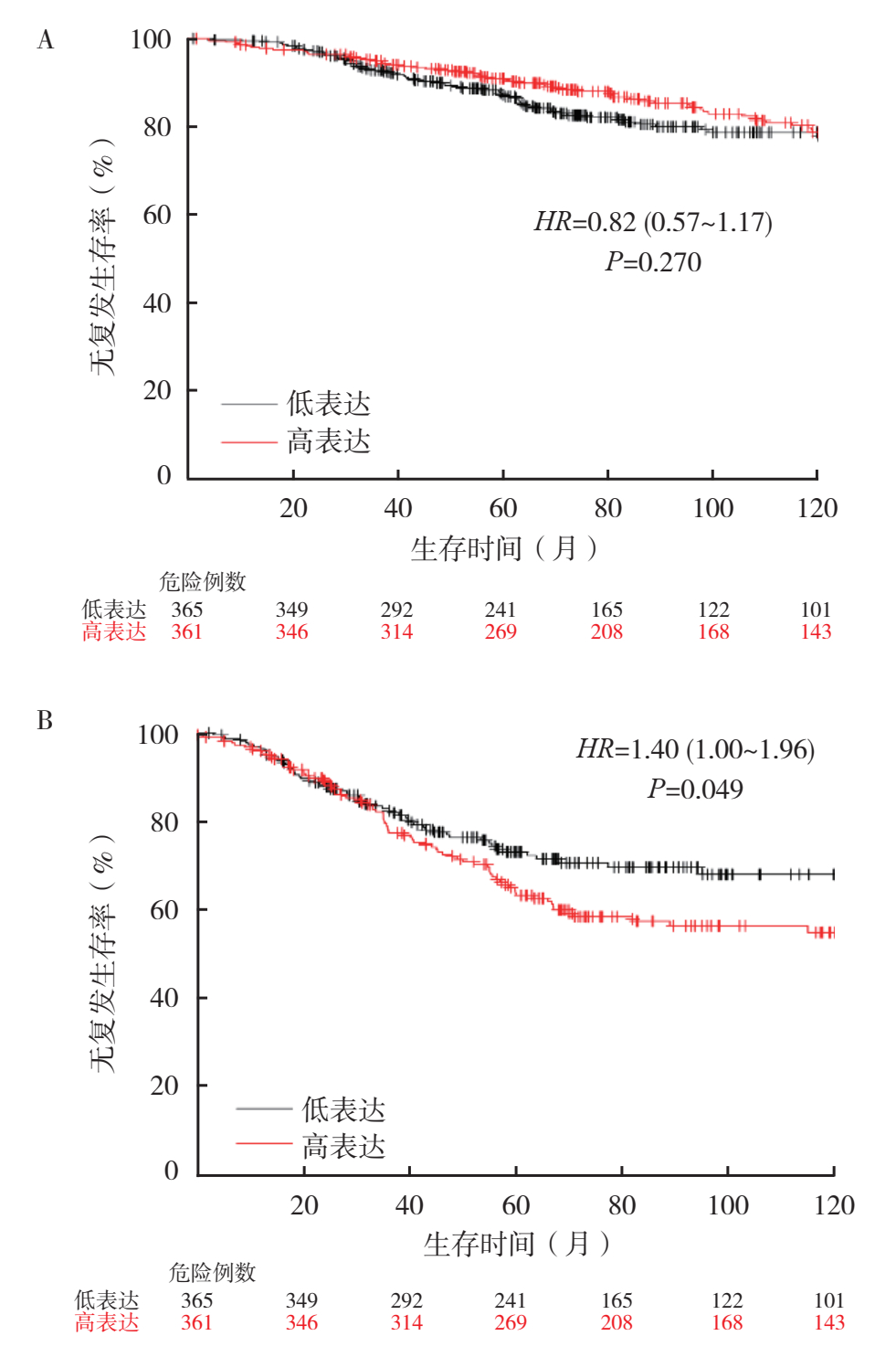
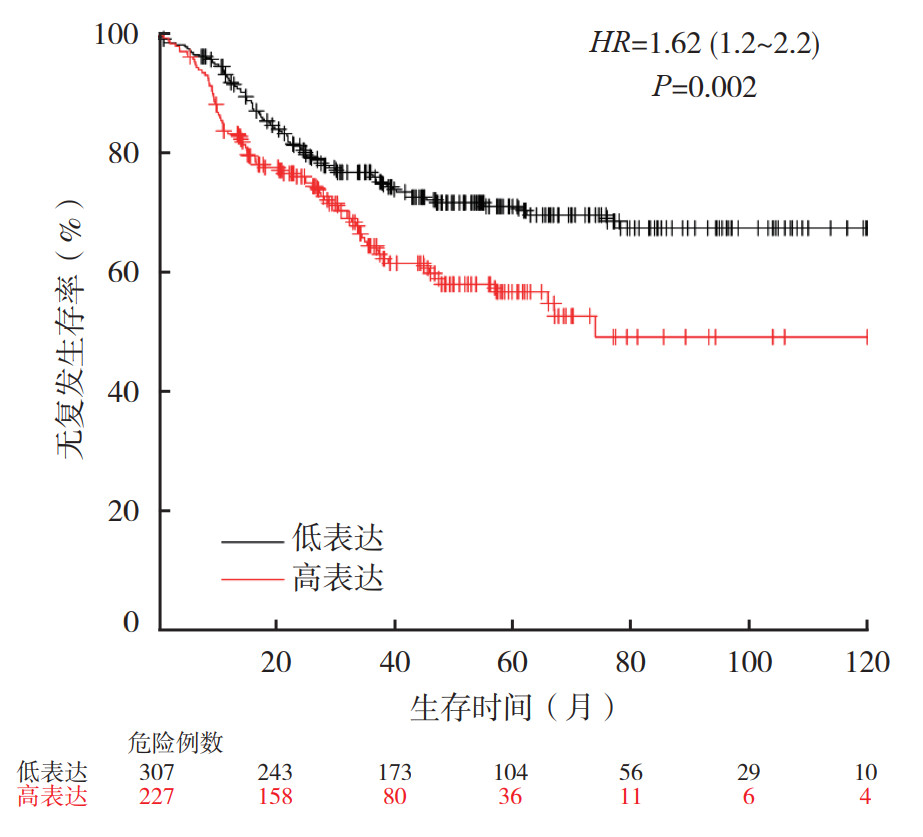
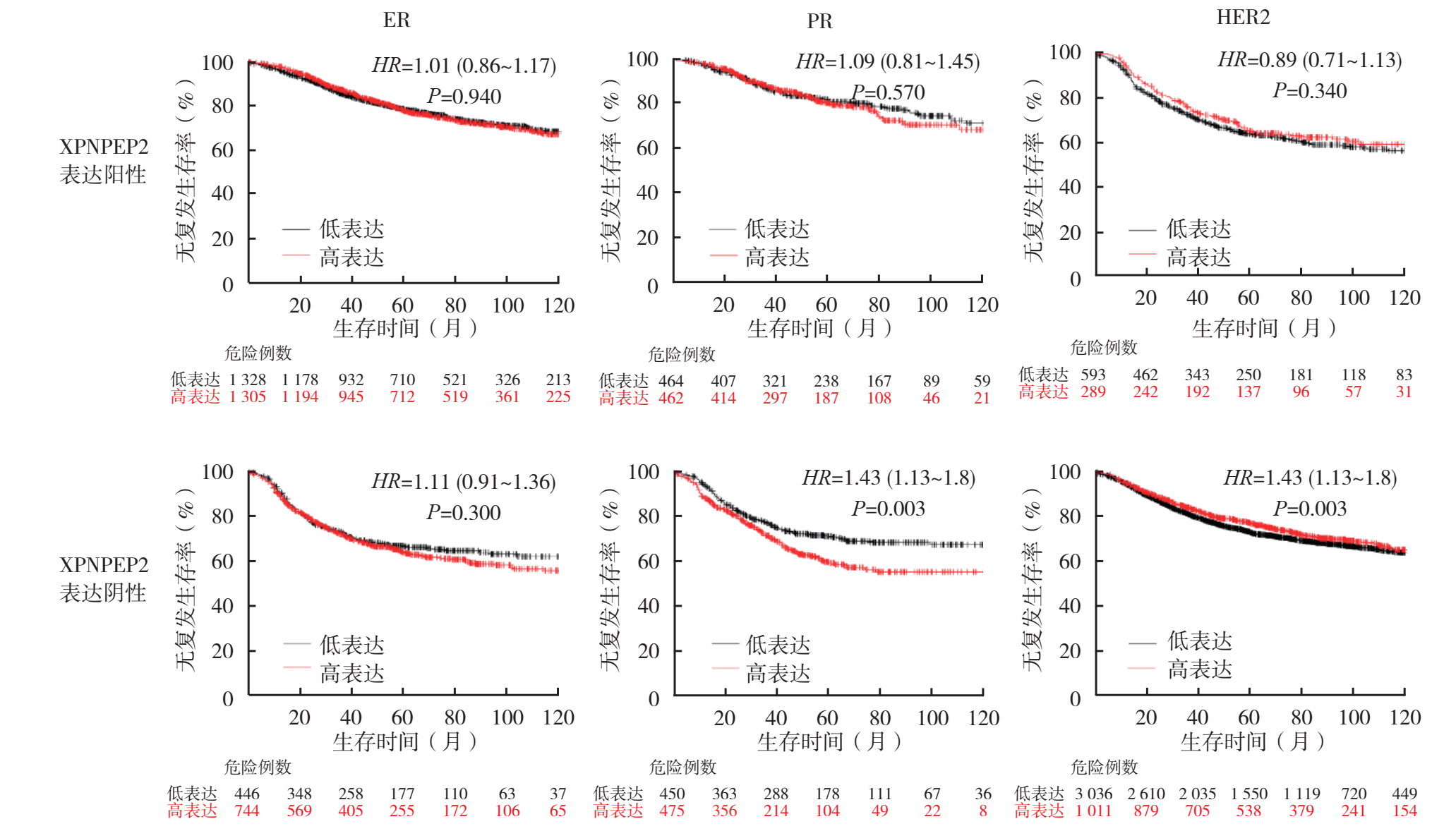
根据乳腺癌组织芯片的临床病理参数分析,对Kaplan-Meier Plotter数据库中XPNPEP2 mRNA表达水平对乳腺癌预后的影响进行分析。XPNPEP2 mRNA高表达(n=509)和低表达(n=516)乳腺癌患者的10年RFS率比较,差异无统计学意义(P > 0.05,图 4)。区域淋巴结阴性的乳腺癌患者中,XPNPEP2 mRNA高表达和低表达患者的10年RFS率比较,差异无统计学意义(P > 0.05);而在区域淋巴结阳性的患者中,XPNPEP2 mRNA高表达者10年RFS率较低(P < 0.05,图 5)。在TNBC患者中,XPNPEP2 mRNA高表达患者10年RFS率低于低表达患者(P < 0.05,图 6)。分别针对ER、PR和HER2阴性和阳性表达的各组乳腺癌患者分析XPNPEP2 mRNA表达水平对RFS的影响显示,仅在PR阴性的乳腺癌患者中,XPNPEP2高表达和低表达患者10年RFS率比较,差异具有统计学意义(P < 0.05,图 7)。
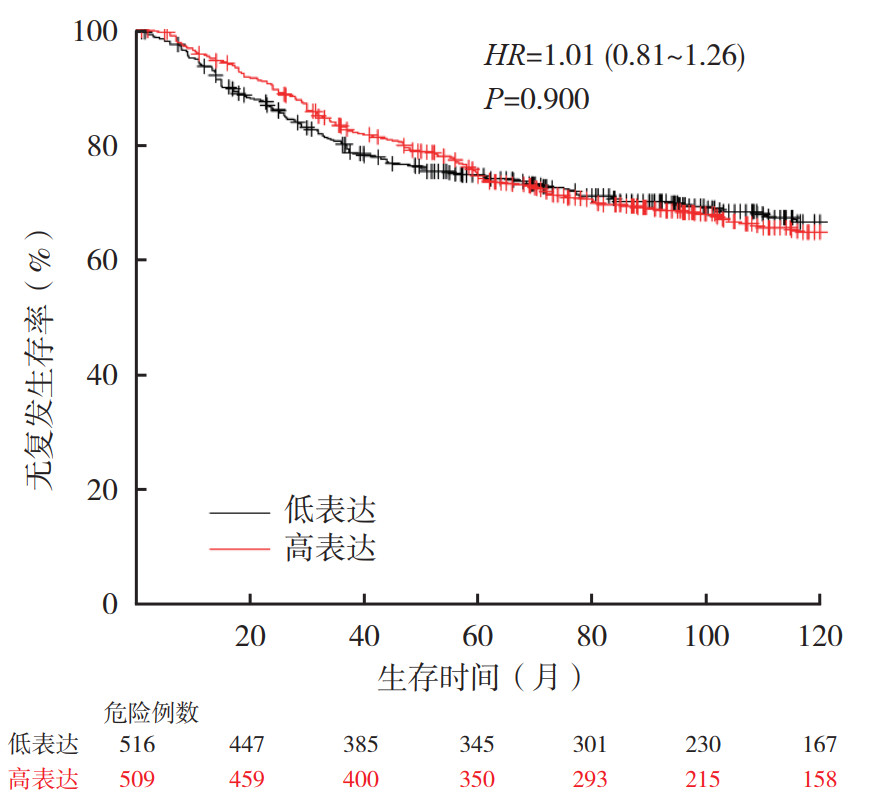
|
| 图 4 Kaplan-Meier Plotter数据库中XPNPEP2 mRNA高表达和低表达乳腺癌患者的无复发生存曲线比较 Fig.4 Comparison of RFS curves of breast cancer patients with high and low expression of XPNPEP2 mRNA in Kaplan-Meier Plotter database |
|
| 注 A:XPNPEP2 mRNA表达水平对淋巴结阴性乳腺癌患者无复发生存的影响;B:XPNPEP2 mRNA表达水平对淋巴结阳性乳腺癌患者无复发生存的影响 图 5 Kaplan-Meier Plotter数据库中乳腺癌患者区域淋巴结状态与XPNPEP2 mRNA表达水平对无复发生存的影响 Fig.5 Effects of regional lymph node status and XPNPEP2 mRNA level on the RFS of breast cancer patients in Kaplan-Meier Plotter database |
|
| 图 6 Kaplan-Meier Plotter数据库中三阴性乳腺癌患者XPNPEP2 mRNA表达水平对RFS的影响 Fig.6 Effect of XPNPEP2 mRNA level on the RFS of triple negative breast cancer patients in Kaplan-Meier Plotter database |
|
| 注 ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterne receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor 2) 图 7 Kaplan-Meier Plotter数据库中乳腺癌患者分子生物标志物表达与XPNPEP2 mRNA表达水平对RFS的影响 Fig.7 Effect of molecular biomarker expressions and XPNPEP2 mRNA level on the RFS of breast cancer patients in Kaplan-Meier Plotter database |
乳腺癌是当今女性最常见的恶性肿瘤[18]。全世界每年有160万新增病例,其发病率还在持续上升。在过去的几十年里,不断完善的癌症治疗方法使乳腺癌死亡率不断下降,但乳腺癌仍然是许多女性死亡的主要原因[19],尤其是区域淋巴结阳性或是ER、PR和HER2均表达阴性的乳腺癌患者,其病理分期更差,临床治疗更加困难,生存率更低,还需寻找新的临床诊断以及治疗的分子靶点[20]。
XPNPEP2蛋白由XPNPEP2基因编码,广泛存在于人体各个组织器官,因其在缓激肽失活过程中起重要作用而在心血管领域为人所知[6],而很少有人探究其在肿瘤组织中的表达水平及其功能。近年来,有研究报道其在胃癌[9]、子宫颈癌[10]、结直肠癌[11]和前列腺癌[12]等肿瘤中的表达情况,并对该蛋白在各类肿瘤中的功能进行了初步探究显示,其在不同的肿瘤组织中表达水平各有差异并可能扮演着不同却又相似的角色。研究发现,XPNPEP2高表达于高侵袭性肿瘤细胞,可以通过snail介导EMT的生成进而促进子宫颈癌细胞及前列腺癌细胞的侵袭和迁移,并且XPNPEP2高表达与区域淋巴结转移密切相关,这预示着XPNPEP2可能是治疗癌症迁移及侵袭的一个有前途的靶点[10, 12]。曾瑶等[11]的研究发现,XPNPEP2在结直肠癌中表达上调,并与肿瘤浸润深度、脉管浸润及TNM分期相关,可能成为评估结直肠癌患者预后的潜在分子生物标志物。
研究表明,乳腺癌区域淋巴结诊断阴性(N0)与阳性(N1~3)的患者总生存率和无进展生存率均有差异,而N1、N2和N3期患者间却无差异[21];另有研究指出,腋窝淋巴结受累是乳腺癌最可靠的预后因素之一[20]。但目前关于XPNPEP2影响乳腺恶性肿瘤发生和发展的具体机制研究仍较为有限,XPNPEP2在乳腺癌中的研究也尚未报道。因此本研究用免疫组织化学方法和组织芯片技术检测并比较69例乳腺癌组织及19例癌旁正常组织中XPNPEP2蛋白的表达水平,并结合患者区域淋巴结病理诊断结果进行统计学分析。结果显示,乳腺癌患者XPNPEP2蛋白的表达水平总体高于癌旁组织,并且高表达的XPNPEP2蛋白与乳腺癌组织中肿瘤区域淋巴结转移相关。接着笔者通过Kaplan-Meier Plotter数据库对区域淋巴结状态和XPNPEP2表达水平对乳腺癌患者预后的影响进行分析显示,在452例区域淋巴结阳性的乳腺癌患者中,XPNPEP2 mRNA的高表达与不良预后相关。
TNBC是侵袭性癌的一种亚型,比其他乳腺肿瘤更具侵袭性,肿瘤体积通常更大,具有更高的组织学分级和发病年龄更小等病理特征[22],并且其由于缺乏ER、PR和HER2的表达而对激素治疗不敏感,因此通常在确诊后5年内复发或死亡的风险很高[20]。本研究采用免疫组织化学法分析发现,TNBC与非TNBC组织中XPNPEP2蛋白的表达水平比较,差异无统计学意义(P > 0.05),考虑到样本量较少,本研究采用Kaplan-Meier Plotter数据库分析显示,534例TNBC患者中高表达XPNPEP2 mRNA的患者RFS较差。本研究还显示,PR阴性乳腺癌患者中XPNPEP2 mRNA高表达患者RFS较差。
综上所述,本研究初步验证XPNPEP2蛋白在乳腺癌组织中表达水平升高,且其高水平与肿瘤TNM分期、分级和区域淋巴结状态密切相关。Kaplan-Meier Plotter数据库分析显示,区域淋巴结阳性乳腺癌患者、TNBC患者和PR阴性乳腺癌患者中XPNPEP2 mRNA高表达均预示较低的RFS。为更深一步探究XPNPEP2在乳腺癌中的分子机制和潜在功能奠定了部分基础。但本研究仅检测了69例乳腺癌组织中XPNPEP2的蛋白表达水平,样本量较小,分析结果可能有所偏倚,后期还需扩大样本量,进行临床标本采集,收集更为完整的临床病例资料作进一步研究。
| [1] |
Harbeck N, Gnant M. Breast cancer[J]. Lancet, 2017, 389(10074): 1134-1150. DOI:10.1016/S0140-6736(16)31891-8 |
| [2] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [3] |
Trayes KP, Cokenakes SEH. Breast cancer treatment[J]. Am Fam Physician, 2021, 104(2): 171-178. |
| [4] |
Banu SK, Stanley JA, Sivakumar KK, et al. Identifying a novel role for X-prolyl aminopeptidase (Xpnpep) 2 in CrVI-induced adverse effects on germ cell nest breakdown and follicle development in rats[J]. Biol Reprod, 2015, 92(3): 67. |
| [5] |
Sprinkle TJ, Stone AA, Venema RC, et al. Assignment of the membrane-bound human aminopeptidase P gene (XPNPEP2) to chromosome Xq25[J]. Genomics, 1998, 50(1): 114-116. DOI:10.1006/geno.1998.5302 |
| [6] |
Cilia La Corte AL, Carter AM, Rice GI, et al. A functional XPNPEP2 promoter haplotype leads to reduced plasma aminopeptidase P and increased risk of ACE inhibitor-induced angioedema[J]. Hum Mutat, 2011, 32(11): 1326-1331. DOI:10.1002/humu.21579 |
| [7] |
Erşahin C, Szpaderska AM, Orawski AT, et al. Aminopeptidase P isozyme expression in human tissues and peripheral blood mononuclear cell fractions[J]. Arch Biochem Biophys, 2005, 435(2): 303-310. DOI:10.1016/j.abb.2004.12.023 |
| [8] |
Jedidi I, Ouchari M, Yin QN. Sex chromosomes-linked single-gene disorders involved in human infertility[J]. Eur J Med Genet, 2019, 62(9): 103560. DOI:10.1016/j.ejmg.2018.10.012 |
| [9] |
王伟, 周颖, 蒋桂英, 等. XPNPEP2在胃癌组织中的表达及其临床意义[J]. 实用医学杂志, 2019, 35(9): 1393-1396. DOI:10.3969/j.issn.1006-5725.2019.09.008 |
| [10] |
Cheng T, Wei R, Jiang GY, et al. XPNPEP2 is overexpressed in cervical cancer and promotes cervical cancer metastasis[J]. Tumour Biol, 2017, 39(7): 1010428317717122. |
| [11] |
曾瑶, 徐惠丽, 王梦漪, 等. 氨肽酶P2在结直肠癌组织中的表达及其与临床病理特征和预后的关系[J]. 实用医学杂志, 2020, 36(2): 210-215. DOI:10.3969/j.issn.1006-5725.2020.02.016 |
| [12] |
Li F, Dai Y, Xu H, et al. XPNPEP2 is associated with lymph node metastasis in prostate cancer patients[J]. Sci Rep, 2019, 9(1): 10078. DOI:10.1038/s41598-019-45245-5 |
| [13] |
To B, Isaac D, Andrechek ER. Studying lymphatic metastasis in breast cancer: current models, strategies, and clinical perspectives[J]. J Mammary Gland Biol Neoplasia, 2020, 25(3): 191-203. DOI:10.1007/s10911-020-09460-5 |
| [14] |
Zhu YX, Zhu XD, Tang CJ, et al. Progress and challenges of immunotherapy in triple-negative breast cancer[J]. Biochim Biophys Acta Rev Cancer, 2021, 1876(2): 188593. DOI:10.1016/j.bbcan.2021.188593 |
| [15] |
Yin L, Duan JJ, Bian XW, et al. Triple-negative breast cancer molecular subtyping and treatment progress[J]. Breast Cancer Res, 2020, 22(1): 61. DOI:10.1186/s13058-020-01296-5 |
| [16] |
Cserni G, Chmielik E, Cserni B, et al. The new TNM-based staging of breast cancer[J]. Virchows Arch, 2018, 472(5): 697-703. DOI:10.1007/s00428-018-2301-9 |
| [17] |
许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志, 1996, 6(4): 229-231. |
| [18] |
肖文铉, 江一舟, 邵志敏. 人工智能在乳腺癌精准诊疗中的应用[J]. 实用肿瘤杂志, 2022, 37(2): 112-116. |
| [19] |
黄佳欢, 雷蕾, 王晓稼. 白蛋白结合型紫杉醇治疗晚期乳腺癌的研究进展[J]. 实用肿瘤杂志, 2021, 36(6): 496-501. |
| [20] |
丰锦春, 李宇翔, 李丹, 等. 乳腺癌组织GFRα1、RET及NCAM表达水平与淋巴结转移关系的研究[J]. 实用肿瘤杂志, 2021, 36(3): 247-251. |
| [21] |
Min SK, Lee SK, Woo J, et al. Relation between tumor size and lymph node metastasis according to subtypes of breast cancer[J]. J Breast Cancer, 2021, 24(1): 75-84. |
| [22] |
He M, Zhang JX, Jiang YZ, et al. The lymph node ratio as an independent prognostic factor for node-positive triple-negative breast cancer[J]. Oncotarget, 2017, 8(27): 44870-44880. |
 2022, Vol. 37
2022, Vol. 37


