文章信息
- 金娜, 姜婷婷, 邹晓影
- Jin Na, Jiang Tingting, Zou Xiaoying
- 非小细胞肺癌术后早期发热相关预测因素分析
- Analysis of predictive factors of early postoperative fever in non-small-cell lung cancer patients
- 实用肿瘤杂志, 2023, 38(1): 54-58
- Journal of Practical Oncology, 2023, 38(1): 54-58
-
通信作者
- 邹晓影, E-mail: J18041394522@163.com
-
文章历史
- 收稿日期:2021-10-03
根据世界卫生组织国际癌症研究机构发布的2020年全球癌症统计数据,在发病率方面,肺癌位居中国第一和世界第二;在死亡率方面,无论是在中国还是世界,肺癌均为第一[1-2]。肺癌是一种常见的呼吸道恶性肿瘤,严重危害人们的身体健康。彻底切除肺部原发病灶及行肺门纵隔淋巴结廓清术是目前治疗肺癌的有效手段[3]。随着医疗技术的发展,胸腔镜下肺叶切除术和肺段切除术广泛应用于临床。此类手术切口较前明显缩小,具有术后疼痛显著减轻、术后恢复快和并发症发生率低等优点[4-8]。其中发热是手术患者术后住院期间的常见并发症之一,根据手术类型的不同,其发生率差异较大,在14%~91%之间[9]。而术后发热的发生会增加患者的不适感,延长术后住院时间,并且用于诊断发热相关原因的实验室及物理检查无异会增加患者的总体住院费用负担[10-11]。因此,本研究回顾性分析术后早期发热在肺癌患者中的影响,并分析其相关预测因素。
1 资料与方法 1.1 临床资料收集纳入2020年7月1日至2020年12月31日于中国医科大学肿瘤医院胸外科因非小细胞肺癌行手术治疗的254例患者。收集的临床资料包括年龄、性别、吸烟史、术式、术后病理类型、手术时间、术中出血量、体温、血常规、胸腔引流管引流时间、术后抗生素使用时间、术后住院时间和住院总费用。根据世界卫生组织对肺癌组织学类型的分类标准[12],将术后病理类型分为腺癌、鳞癌和其他类型。本研究经本院伦理委员会批准通过(审批号20220801k)。本研究为回顾性研究,所有研究对象均已出院,不会对患者的后续治疗带来不良影响,不会暴露患者隐私及相关数据,已申请免知情同意书。
1.2 纳入及排除标准纳入标准:(1)2020年7月1日至2020年12月31日期间因肺癌行手术治疗者;(2)术后病理诊断为非小细胞肺癌者;(3)临床资料完整者。排除标准:(1)术后病理诊断为良性或小细胞肺癌者;(2)术后出现严重并发症需转入重症监护病房(intensive care unit,ICU)治疗者;(3)术后30 d内死亡者;(4)临床资料不全者。
1.3 术后早期发热的定义将手术患者住院期间和术后7 d内任意1次的体温≥38.0℃定义为术后早期发热,并以此标准将术后患者分为发热组和非发热组。
1.4 统计学分析采用SPSS 22.0软件进行数据分析。计数资料以频数(百分比)表示,组间比较采用χ2检验。计量资料以均数±标准差(x±s)表示,组间比较采用非配对t检验或Mann-Whitney U检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般临床资料通过严格筛选(图 1),共254例患者纳入研究。患者以女性为主(58.3%,表 1);平均年龄为60.1岁(31~80岁),69.7%(177/254)的患者 < 65岁;无吸烟史患者占71.7%(182/254);以标准肺叶切除术(185例,72.8%)为主要手术方式,少数行亚肺叶切除术(69例,27.2%);在术后病理方面,腺癌患者(212例,83.5%)占多数。
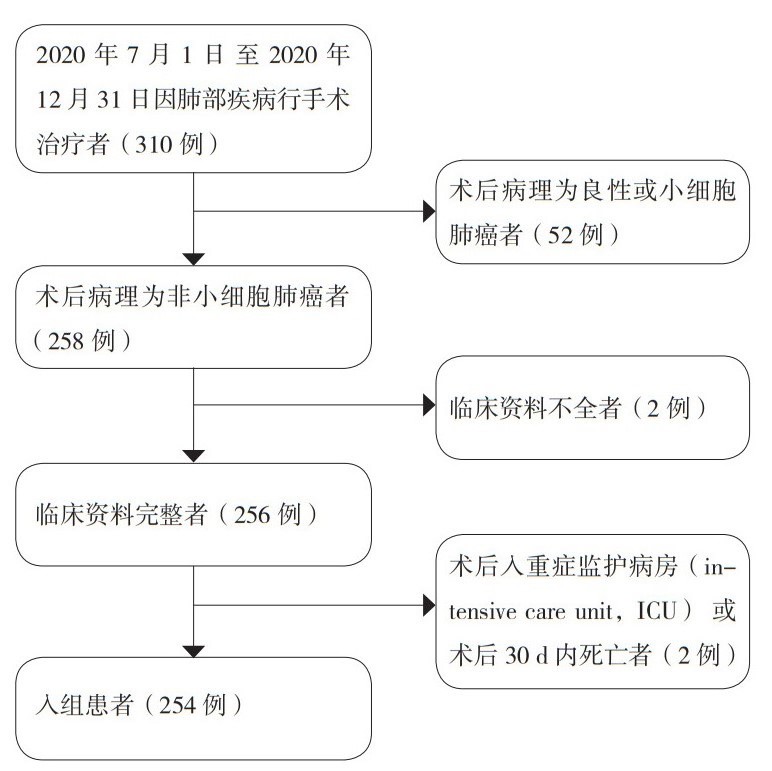
|
| 图 1 筛选合适患者纳入本研究的流程图 Fig.1 Flowchart of screening suitable patients for inclusion in this study |
| 临床特征 | 例数(%) |
| 性别 | |
| 男性 | 106(41.7) |
| 女性 | 148(58.3) |
| 年龄 | |
| < 65岁 | 177(69.7) |
| ≥65岁 | 77(30.3) |
| 有无吸烟史 | |
| 有 | 72(28.3) |
| 无 | 182(71.7) |
| 术后病理 | |
| 腺癌 | 212(83.5) |
| 鳞癌 | 24(9.4) |
| 其他 | 18(7.1) |
254例非小细胞肺癌患者中,55例住院期间和术后7 d内出现发热(体温≥38.0℃; 发热组),其余199例未出现发热(非发热组)。发热组中吸烟患者比例较高(40.0% vs 25.1%,P=0.030;表 2)。在性别、年龄和术后病理方面,两组间比较,差异均无统计学意义(均P > 0.05)。
| 临床特征 | 发热组(n=55) | 未发热组(n=199) | P值 |
| 性别 | 0.119 | ||
| 男性 | 28(50.9) | 78(39.2) | |
| 女性 | 27(49.1) | 121(60.8) | |
| 年龄 | 0.060 | ||
| < 65岁 | 44(80.0) | 133(66.8) | |
| ≥65岁 | 11(20.0) | 66(33.2) | |
| 有无吸烟史 | 0.030 | ||
| 有 | 22(40.0) | 50(25.1) | |
| 无 | 33(60.0) | 149(74.9) | |
| 术后病理 | 0.489 | ||
| 腺癌 | 43(78.2) | 169(84.9) | |
| 鳞癌 | 7(12.7) | 17(8.5) | |
| 其他 | 5(9.1) | 13(6.5) |
将患者术前1 d全天所测量的体温加上手术当天术前测量的体温的平均值定义为患者的基础体温。在基础体温及手术当天术前体温方面,两组间比较,差异均无统计学意义(均P > 0.05,表 3)。发热组在术后第1天首次体温(P=0.030)、术后第1天最高体温(P < 0.01)及术后第1天平均体温(P < 0.01)方面均高于未发热组。发热组在术后第1天首次体温与基础体温的差值(P=0.012)、术后第1天最高体温与基础体温的差值(P < 0.01)和术后第1天平均体温与基础体温的差值(P < 0.01)方面也均高于未发热组。
| 体温 | 发热组 | 未发热组 | P值 |
| 基础体温* | 36.35±1.94 | 36.32±0.15 | 0.618 |
| 手术当天术前体温 | 36.27±0.23 | 36.22±0.21 | 0.164 |
| 术后第1天首次体温 | 36.97±0.57 | 36.73±0.43 | 0.030 |
| 术后第1天最高体温 | 37.65±0.63 | 37.12±0.39 | < 0.01 |
| 术后第1天平均体温 | 37.05±0.46 | 36.71±0.29 | < 0.01 |
| 术后第1天首次体温-基础体温 | 0.62±0.60 | 0.40±0.45 | 0.012 |
| 术后第1天最高体温-基础体温 | 1.31±0.64 | 0.80±0.43 | < 0.01 |
| 术后第1天平均体温-基础体温 | 0.70±0.49 | 0.39±0.32 | < 0.01 |
| 注 *术前1 d体温和手术当天术前体温的平均值定义为基础体温 | |||
发热组和非发热组在术前血常规检查数据方面比较,差异均无统计学意义(均P > 0.05,表 4)。在术后第1天,发热组白细胞数目[(12.38±3.70)×109/L vs(11.22±3.06)×109/L,P=0.035]及中性粒细胞数目[(10.60±3.31)×109/L vs(9.96±6.43)×109/L,P=0.041]均高于非发热组,而两组在中性粒细胞百分比方面比较,差异则无统计学意义(P > 0.05)。发热组手术前后白细胞数目差值(P=0.022)和手术前后中性粒细胞数目差值(P=0.007)均高于未发热组。发热组手术前后中性粒细胞百分比差值也略高于未发热组,但差异无统计学意义(P=0.066)。
| 血常规 | 发热组 | 未发热组 | P值 |
| 术前白细胞数目(×109/L) | 6.14±1.81 | 5.89±1.79 | 0.337 |
| 术前中性粒细胞数目(×109/L) | 3.83±1.38 | 3.79±1.47 | 0.796 |
| 术前中性粒细胞百分比(%) | 61.87±8.70 | 63.40±9.07 | 0.236 |
| 术后第1天白细胞数目(×109/L) | 12.38±3.70 | 11.22±3.06 | 0.035 |
| 术后第1天中性粒细胞数目(×109/L) | 10.60±3.31 | 9.96±6.43 | 0.041 |
| 术后第1天中性粒细胞百分比(%) | 85.42±4.22 | 84.53±5.21 | 0.391 |
| 手术前后白细胞数目差值*(×109/L) | 6.20±2.81 | 5.33±2.75 | 0.022 |
| 手术前后中性粒细胞数目差值*(×109/L) | 7.38±5.39 | 6.17±6.45 | 0.007 |
| 手术前后中性粒细胞百分比差值*(%) | 23.55±8.36 | 21.16±9.25 | 0.066 |
| 注 *手术前后差值指术后第1天数值减去术前数值 | |||
与非发热组比较,发热组行肺叶切除术的患者比例更高(83.6% vs 69.8%,P=0.042)、手术时间更长[(147.05±45.96)min vs(132.51±43.92)min,P=0.032)且出血量更大[(54.27±40.86)mL vs(44.44±69.58)mL,P=0.010;表 5]。
| 手术相关因素 | 发热组 | 未发热组 | P值 |
| 术式(例,%) | 0.042 | ||
| 肺叶切除 | 46(83.6) | 139(69.8) | |
| 亚肺叶切除 | 9(16.4) | 60(30.2) | |
| 手术时间(min,x±s) | 147.05±45.96 | 132.51±43.92 | 0.032 |
| 术中出血量(mL,x±s) | 54.27±40.86 | 44.44±69.58 | 0.010 |
发热组和非发热组在术后带管时间和总住院费用方面比较,差异均无统计学意义(均P > 0.05,表 6)。发热组术后抗生素使用时间有延长的趋势,但组间比较,差异无统计学意义(P=0.082)。发热组的抗生素使用时间 > 4 d的患者比例高于非发热组(94.6% vs 75.8%,P=0.021)。发热组术后住院时间长于未发热组[(8.56±2.67)d vs(7.45±2.09)d,P=0.001]。
| 医疗成本相关因素 | 发热组 | 未发热组 | P值 |
| 术后带管时间(d) | 5.87±2.17 | 5.64±2.32 | 0.336 |
| 术后抗生素使用时间(d) | 6.46±1.88 | 5.88±1.89 | 0.082 |
| 术后住院时间(d) | 8.56±2.67 | 7.45±2.09 | 0.001 |
| 总住院费用(元) | 91 827.17±16 969.81 | 90 874.22±14 798.97 | 0.602 |
肺癌是目前全球范围内死亡率最高的恶性肿瘤[1]。外科手术是治疗早期非小细胞肺癌的主要手段,然而肺癌术后并发症一直困扰着临床医师。其中发热是肺癌术后常见的并发症之一,约72%的术后发热发生在术后48 h内[9],但也有研究将术后72 h内体温 > 38℃定义为术后早期发热[13]。不过在临床实践中,常常发现部分患者术后1周内都有可能会出现发热,而且这些发热不一定是跟术后新发感染有关,可能还是与手术有关。因此为了将这部分患者也纳入在研究范围内,本研究将肺癌患者术后1周内的发热定为术后早期发热。术后发热的原因包括对组织损伤和手术应激产生的促炎反应,组织损伤会导致细胞膜磷脂的破坏,从而导致前列腺素和细胞因子的级联反应[14]。术后发热并不一定表示患者术后并发感染,但是如果不能得到有效处理和控制的话,可能会延长手术切口愈合时间等[15]。本研究也发现,术后发热对术后带管时间、术后抗生素使用时间和总住院费用方面无影响,但是与未发热患者比较,其术后住院时间更长,抗生素使用时间 > 4 d的比例更大。因此分析及查找肺癌术后发热的相关预测因素对临床探索预防术后发热的措施和治疗具有重要意义。
吸烟可增加肺癌的发病风险,吸烟人群的肺癌发病和死亡风险高于不吸烟人群,既往吸烟人群的肺癌发病和死亡风险亦显著升高。吸烟剂量和肺癌发病也呈线性正相关趋势,起始吸烟年龄越小、每天吸烟量越大和持续时间越长引发肺癌的相对危险度越大[12]。吸烟不仅是肺癌发生的危险因素,同时也是肺癌术后早期发热的危险因素之一。吸烟能够损伤肺组织结构,是诸多呼吸系统疾病发生的独立危险因素。病理学研究发现,吸烟者体内存在炎性介质释放现象,导致呼吸道分泌物增加,增加术后肺部并发症发生的风险[16]。本研究也发现,发热组中吸烟患者的比例高于未发热组。因此对于有吸烟习惯的患者,积极做好术前戒烟宣教的同时,要加强对此类患者的术后护理,加强体温监控管理,做好术后发热管控。
对手术相关因素的研究发现,手术时长和术中出血量与术后发热密切相关。国内一些研究也报道相似的结果,随着手术时间的延长或术中出血量的增多,术后发热发生的可能性增加[15, 17-18]。本研究也发现,不同手术切除方式引起术后发热的发生率不同。肺叶切除术后发热的患者多于亚肺叶切除的患者。有研究显示,对早期非小细胞肺癌患者行胸腔镜下肺段切除术与肺叶切除术后,肺段切除组的手术时长及术中出血量均少于肺叶切除组[19]。这有可能是亚肺叶切除组患者术后恢复好和发热等并发症出现少的原因之一。
本研究还探索了术后第1天血常规情况对肺癌术后早期发热的预测作用。研究发现,发热组患者术后第1天血常规检查中的白细胞数目与中性粒细胞数目及其手术前后数目差值均高于未发热组。因此,有理由认为肺癌患者术后第1天血常规的检验有助于发现肺癌术后早期发热的患者。但仍需进一步研究来分析这些数值的变化规律与术后早期发热的发生和发展间的潜在关系。如果可以确定的话,将有助于未来临床中肺癌术后早期发热患者的筛选、甄别及术后护理工作,并对此及早采取积极的预防措施与治疗方案,从而减轻患者的痛苦。
本文存在以下不足之处:(1)本研究是单中心、小样本的回顾性研究,仍需前瞻性、多中心的大样本数据进行深入研究;(2)其他炎症检测因子,例如C反应蛋白,并未被纳入研究,这些因子可能也是肺癌术后早期发热的预测因素之一。
综上所述,本研究显示,有无吸烟史、是否行肺叶切除术、手术时长、术中出血量和术后第1天白细胞及中性粒细胞数目的多寡是预测肺癌术后早期发热发生的因素。目前仍需要大样本量的前瞻性、多中心研究对这些术后发热预测因素进行全方位和多层次的深入研究。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
赵颖馨, 沈虹, 袁瑛. 晚期非小细胞肺癌的免疫治疗再挑战[J]. 实用肿瘤杂志, 2021, 36(3): 202-208. |
| [3] |
李平, 沈宇, 沈思雯, 等. 肺康复路径对肺癌根治术病人术后呼吸功能恢复及运动耐力的影响[J]. 全科护理, 2019, 17(31): 3919-3922. DOI:10.12104/j.issn.1674-4748.2019.31.020 |
| [4] |
刘军, 张雷, 李洪林, 等. 单孔胸腔镜与三孔胸腔镜在肺癌肺叶切除术中临床应用比较[J]. 临床军医杂志, 2021, 49(7): 813-814. |
| [5] |
郭瑾. 常规开胸肺叶切除术与胸腔镜辅助治疗肺癌患者的临床疗效对比[J]. 中国医药指南, 2021, 19(6): 35-36. |
| [6] |
徐志强. 电视胸腔镜肺叶切除术治疗早期肺癌的临床研究[J]. 中国医药指南, 2021, 19(9): 41-42. |
| [7] |
毕磊, 吕忠柱, 邓意平, 等. 电视胸腔镜肺叶切除术治疗老年周围型非小细胞肺癌的疗效[J]. 医学信息, 2021, 34(7): 6-9, 14. |
| [8] |
邱瑶, 夏冰, 江洪, 等. EGFR突变阳性肺腺癌患者多学科诊疗一例[J]. 实用肿瘤杂志, 2021, 36(5): 387-392. |
| [9] |
Maday KR, Hurt JB, Harrelson P, et al. Evaluating postoperative fever[J]. J Am Acad Physician Assist, 2016, 29(10): 23-28. |
| [10] |
de la Torre SH, Mandel L, Goff BA. Evaluation of postoperative fever: usefulness and cost-effectiveness of routine workup[J]. Am J Obstet Gynecol, 2003, 188(6): 1642-1647. |
| [11] |
Walid MS, Sahiner G, Robinson C, et al. Postoperative fever discharge guidelines increase hospital charges associated with spine surgery[J]. Neurosurgery, 2011, 68(4): 945-949. |
| [12] |
中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)[J]. 中华医学杂志, 2021, 101(23): 1725-1757. |
| [13] |
Lesperance R, Lehman R, Lesperance K, et al. Early postoperative fever and the"routine"fever work-up: results of a prospective study[J]. J Surg Res, 2011, 171(1): 245-250. |
| [14] |
Alfallaj TH, Aljaafary RAM, Alqahtani NA. Causes and management of postoperative fever[J]. Egypt J Hospital Med, 2017, 69(7): 2771-2776. |
| [15] |
朱红芬. 外科术后发热预防措施与对策研究[J]. 中外医学研究, 2016, 14(25): 163-164. |
| [16] |
车强, 汪林宝, 王孝彬, 等. 胸腔镜肺癌根治术后肺部并发症发生风险分析[J]. 医学临床研究, 2020, 17(11): 1667-1670. |
| [17] |
陈登, 张亚鑫, 戴纪杭, 等. 人工髋关节置换后发热的相关因素分析[J]. 中国组织工程研究, 2021, 25(18): 2846-2850. |
| [18] |
张伟, 姜盟盟, 孙其志. 腰椎术后非感染性发热的相关因素分析[J]. 中国矫形外科杂志, 2020, 28(18): 1716-1718. |
| [19] |
刘刚, 汪令伟, 董林, 等. 两孔胸腔镜下肺段切除和肺叶切除治疗早期非小细胞肺癌疗效比较[J]. 同济大学学报: 医学版, 2020, 41(2): 235-239. |
 2023, Vol. 38
2023, Vol. 38


