文章信息
- 陈思婷, 魏媛, 斯热努尔·艾合买提, 逯宋梅, 热米拉·艾海提, 张瑞丽
- Chen Siting, Wei Yuan, Sirenuer Aihemaiti, Lu Songmei, Remila Aihaiti, Zhang Ruili
- 吉西他滨联合顺铂新辅助化疗在肌层浸润性膀胱癌中的疗效分析
- Efficacy of gemcitabine combined with cisplatin neoadjuvant chemotherapy in patients with muscularinfi ltrating bladder cancer
- 实用肿瘤杂志, 2022, 37(5): 457-464
- Journal of Practical Oncology, 2022, 37(5): 457-464
基金项目
- 新疆维吾尔自治区自然科学基金项目(2019D01B49)
-
通信作者
- Zhang Ruili, E-mail: 58419098@qq.com
-
文章历史
- 收稿日期:2021-08-27
2. 新疆医科大学第一附属医院昌吉分院肿瘤内科, 新疆 昌吉 831100;
3. 新疆医科大学第一附属医院健康管理学院, 新疆 乌鲁木齐 830000
2. Department of Oncology, Changji Branch of the First Affiliated Hospital of Xinjiang Medical University, Changji 831100, China;
3. School of Health Management, the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830000, China
据2018年国际癌症中心报道,膀胱癌仍为泌尿生殖系统常见癌症之一;同年全球膀胱癌新发病例约为54.9万例,死亡约19.9万例,且呈逐年上升趋势[1]。2019年欧洲泌尿外科协会年会再次提倡肿瘤综合治疗模式,并提出新辅助化疗联合根治性膀胱切除+扩大淋巴结清扫术依旧是肌层浸润性膀胱癌患者的标准治疗方式[2]。新辅助化疗(neoadjuvant chemotherapy,NAC)作为根治性手术或者放疗前的辅助性化疗,以缩小肿瘤、消灭微转移灶、降低肿瘤分期和提高总生存率等优势广泛用于肌层浸润性膀胱癌的综合治疗[3-4]。然而,新辅助化疗的实施也面临着潜在获益人群的精准筛选、化疗药物对脏器的毒害、患者的不耐受和耽误患者最佳手术时机等诸多挑战。本研究通过比较本院接受吉西他滨联合顺铂(GC方案)新辅助化疗联合膀胱癌根治术治疗的与仅接受膀胱癌根治术治疗的肌层浸润性膀胱癌患者的生存资料,分析新辅助化疗前后肿瘤局部控制、病理缓解及不良反应发生情况,综合评估治疗效果及安全性。
1 资料与方法 1.1 一般资料收集2016年1月至2020年5月新疆医科大学第一附属医院收治的接受膀胱癌根治术治疗的101例肌层浸润性膀胱癌患者完整的临床病理资料进行回顾性分析。参考国际抗癌联盟(International Union Against Cancer,UICC)第7版TNM分期标准[5],根据患者临床分期结合患者术前CT和MRI检查是否膀胱浸润、外侵和淋巴结转移以及膀胱镜检査结果判定,所有患者分期均在(T2~4,N0/N+,M0)范围内。经随访最终获得101例患者完整的临床病理资料及生存数据。纳入标准:(1)综合术前病理活检结果、影像学检查及经膀胱镜检査结果,临床分期评估为(T2~4,N0/N+,M0)的患者,且病理类型为尿路上皮癌;(2)术前肿瘤未发生远处转移;排除标准:(1)合并其他肿瘤或严重基础疾病患者;(2)手术前后临床病理及随访资料不完善的患者;(3)研究对象有远处肿瘤转移。本研究经过新疆医科大学第一附属医院伦理委员会审批通过。患者均签署知情同意书。
1.2 分组101例患者中,39例术前接受2~3个周期GC方案新辅助化疗,62例仅接受根治术治疗(表 1)。新辅助化疗具体方案:吉西他滨1.0 g/m2,第1和8天静脉滴注;顺铂70 mg/m2,于第1天起分2~3 d连续静脉滴注;21 d为1个周期。化疗期间每周监测血常规、肝肾功能和电解质。化疗结束2~3周后接受膀胱癌根治术治疗。采用倾向得分匹配法(propensity score matching,PSM;1∶1匹配)方法对新辅助化疗与单纯手术患者进行性别、年龄、T分期和N分期的匹配,成功匹配39对,分别为新辅助化疗组和单纯手术组。匹配后两组在性别、年龄、T分期和N分期方面比较,差异均无统计学意义(均P > 0.05, 表 2)。
| 临床特征 | 所有患者(n=101) | 新辅助化疗(n=39) | 单纯手术(n=62) |
| 性别 | |||
| 男性 | 88(87.1) | 35(89.7) | 53(85.5) |
| 女性 | 13(12.9) | 4(10.3) | 9(14.5) |
| 年龄(x±s,岁) | 62.34±9.90 | 60.03±11.44 | 63.79±8.57 |
| 中位年龄(岁) | 60 | 60 | 64 |
| 范围(岁) | 28~75 | 28~75 | 28~75 |
| 肿瘤最大径(x±s,cm) | 2.71±1.90 | 2.92±1.65 | 2.58±2.05 |
| T分期 | |||
| T2 | 75(74.3) | 32(82.1) | 43(69.4) |
| T3 | 18(17.8) | 4(10.3) | 14(22.5) |
| T4 | 8(7.9) | 3(7.6) | 5(8.1) |
| N分期 | |||
| N0 | 87(87.1) | 31(79.5) | 56(90.3) |
| N+ | 14(12.9) | 8(20.5) | 6(9.7) |
| 临床特征 | 所有患者(n=78) | 新辅助化疗组(n=39) | 单纯手术组(n=39) | P值 |
| 性别 | 0.498 | |||
| 男性 | 68(87.2) | 35(89.7) | 33(84.6) | |
| 女性 | 10(12.8) | 4(10.3) | 6(15.4) | |
| 年龄(x±s,岁) | 61.28±10.51 | 60.03±11.44 | 62.54±9.46 | 1.000 |
| 中位年龄(岁) | 64 | 60 | 64 | |
| 范围(岁) | 28~75 | 28~75 | 28~75 | |
| 肿瘤最大径(x±s,cm) | 2.73±1.98 | 2.92±1.65 | 2.54±2.27 | 0.366 |
| T分期 | 0.558 | |||
| T2 | 60(76.9) | 32(82.1) | 28(71.8) | |
| T3 | 10(12.8) | 4(10.3) | 6(15.4) | |
| T4 | 8(10.3) | 3(7.6) | 5(12.8) | |
| N分期 | 0.362 | |||
| N0 | 65(83.3) | 31(79.5) | 34(87.2) | |
| N+ | 13(16.7) | 8(20.5) | 5(12.8) | |
比较两组总生存(overall survival,OS)和无进展生存(progression-free survival,PFS)进行长期疗效评估。
1.3.2 短期疗效根据RECIST1.0评价标准[6],计算新辅助化疗组临床缓解率(CR+PR)和pCR率、病理降期率和淋巴结阳性率,比较新辅助化疗前后肿瘤最大径及最小径。
1.3.3 安全性不良反应评价标准依据美国国立癌症研究所通用毒性标准(NCI-CTC 3.0版)[7],将毒性反应分为0~Ⅳ级。
1.4 随访采用门诊随访、住院随访及电话短信等方式对患者进行随访。随访日期截止到2021年5月31日。随访内容包括治疗后的全身情况、局部复发或远处转移情况、治疗并发症、不良反应和生存情况。总生存时间(overall survival,OS)以膀胱镜或膀胱肿物电切术后病理诊断当天为生存起点,以死亡日期作为终点。无进展生存时间(progression-free survival,PFS)指患者从接受治疗开始到观察到疾病进展或者发生因为任何原因的死亡之间的这段时间。若随访截止患者仍生存,按随访截尾数据处理。
1.5 统计学分析采用SPSS 26.0软件进行数据分析。计量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验。计数资料采用频数(百分比)表示,组间比较采用χ2检验。临床病理特征与疗效的关系采用χ2检验行单因素分析,多因素分析采用二分类Logistic回归模型。采用Kaplan-Meier法作生存曲线,生存比较采用Log-rank检验。预后因素采用Kaplan-Meier法及Cox回归模型依次进行单因素及多因素分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 长期疗效新辅助化疗组随访(24.00±16.28)个月,单纯手术组随访(26.06±13.60)个月。截止随访时间,新辅助化疗组3例死亡,3例术后出现复发转移(2例骨转移,1例肝转移),失访3例;单纯手术组3例死亡,3例术后出现复发转移(2例骨转移,1例多发盆腹腔转移),失访4例。新辅助化疗组和单纯手术组1年OS率为97.0%和100.0%,2年OS率为91.6%和91.6%,3年OS率为91.6%和91.6%(图 1)。新辅助化疗组和单纯手术组1年PFS率分别为88.9%和92.3%,2年PFS率为82.5%和84.6%,3年PFS率为82.5%和84.6%(图 2)。两组OS和PFS比较,差异均无统计学意义(均P > 0.05)。
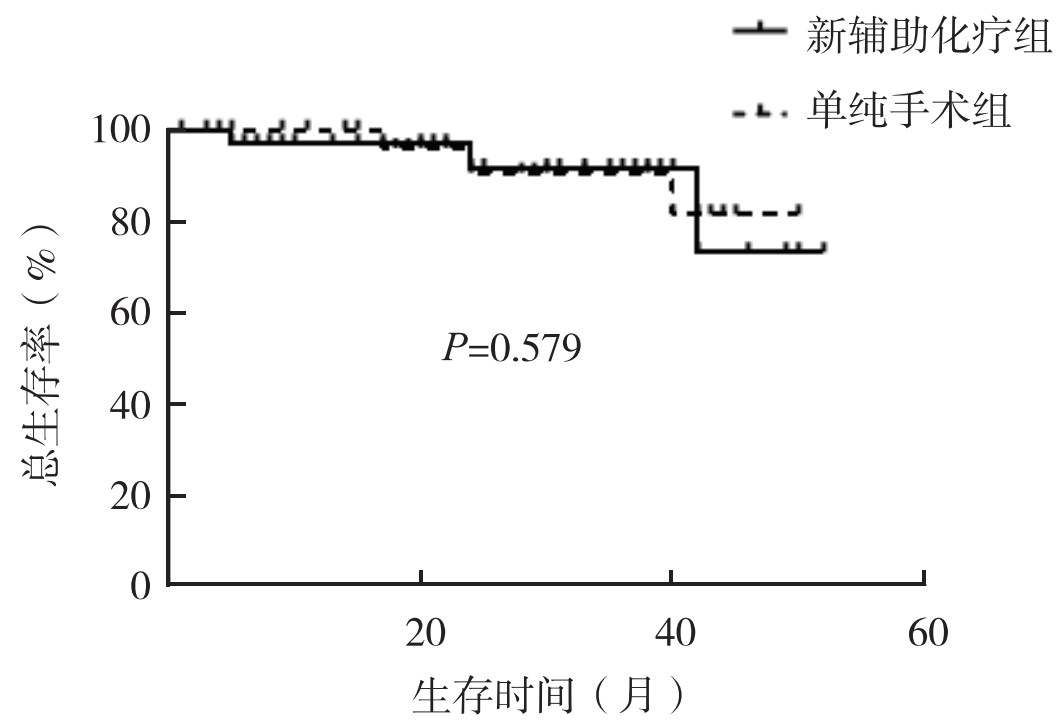
|
| 图 1 新辅助化疗组和单纯手术组肌层浸润性膀胱癌患者总生存曲线比较 Fig.1 Comparison of overall survival curves between the neoadjuvant chemotherapy group and surgery alone group in patients with muscular-infiltrating bladder cancer |
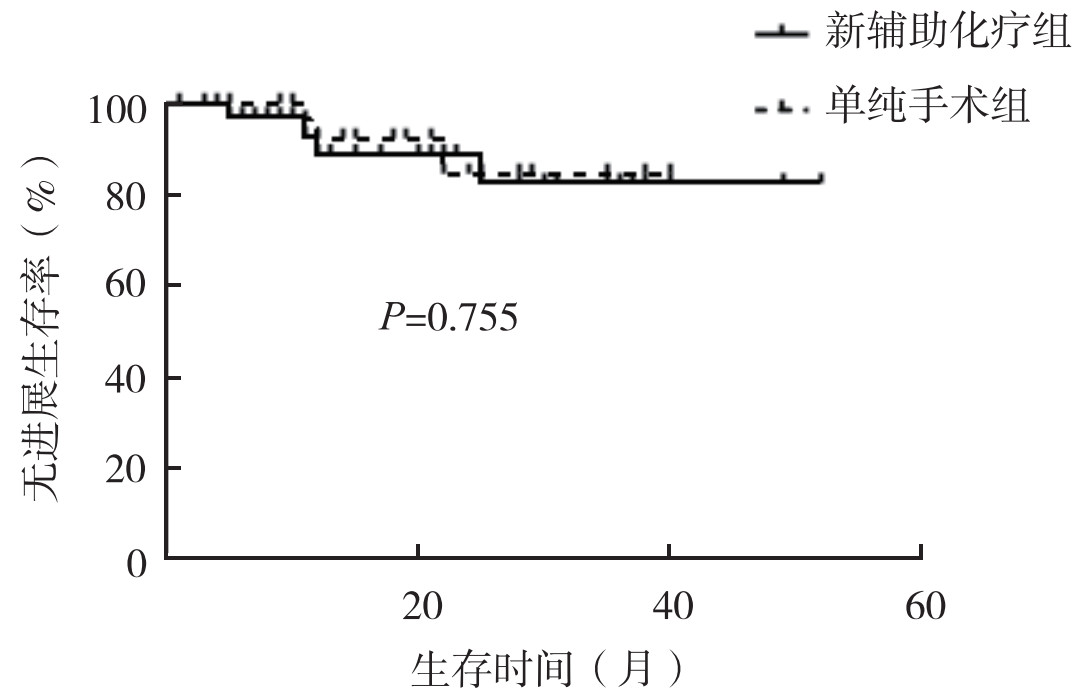
|
| 图 2 新辅助化疗组和单纯手术组肌层浸润性膀胱癌患者无进展生存曲线比较 Fig.2 Comparison of progression-free survival curves of patients with muscular-infiltrating bladder cancer in the neoadjuvant chemotherapy and surgery alone groups |
单因素分析显示,肌层浸润性膀胱癌患者OS和PFS在肿瘤浸润膀胱三角区和肿瘤浸润淋巴脉管方面比较,差异均具有统计学意义(均P < 0.05,表 3), 而PFS在T分期方面比较,差异也具有统计学意义(P < 0.05)。
| 临床病理因素 | 例数(%) | 总生存 | 无进展生存 | |||
| χ2值 | P值 | χ2值 | P值 | |||
| 性别 | 1.740 | 0.187 | 1.289 | 0.256 | ||
| 男性 | 68(87.2) | |||||
| 女性 | 10(12.8) | |||||
| 年龄 | 1.689 | 0.194 | 3.291 | 0.070 | ||
| ≥70岁 | 20(25.6) | |||||
| < 70岁 | 58(74.4) | |||||
| 吸烟 | 1.823 | 0.177 | 2.760 | 0.097 | ||
| 是 | 18(23.1) | |||||
| 否 | 60(76.9) | |||||
| 肿瘤数目 | 0.128 | 0.721 | 0.007 | 0.933 | ||
| 单发 | 66(84.6) | |||||
| 多发 | 12(15.4) | |||||
| 肿瘤发生 | 1.109 | 0.292 | 1.136 | 0.287 | ||
| 初发 | 40(51.3) | |||||
| 复发 | 38(48.7) | |||||
| 肿瘤浸润膀胱三角区 | 6.965 | 0.008 | 16.916 | < 0.01 | ||
| 是 | 4(5.1) | |||||
| 否 | 74(94.9) | |||||
| 肿瘤浸润输尿管 | 0.749 | 0.387 | 0.876 | 0.349 | ||
| 是 | 7(9.0) | |||||
| 否 | 71(91.0) | |||||
| 肿瘤浸润淋巴脉管 | 15.841 | < 0.01 | 30.050 | < 0.01 | ||
| 是 | 6(7.7) | |||||
| 否 | 72(92.3) | |||||
| 肾积水 | 0.051 | 0.822 | 0.004 | 0.947 | ||
| 是 | 16(20.5) | |||||
| 否 | 62(79.5) | |||||
| T分期 | 4.503 | 0.105 | 6.650 | 0.036 | ||
| T2 | 60(76.9) | |||||
| > T2 | 18(23.1) | |||||
| 淋巴结转移 | 1.677 | 0.195 | 0.626 | 0.429 | ||
| N+ | 13(16.7) | |||||
| N0 | 65(83.3) | |||||
| 术前膀胱灌注化疗 | 1.862 | 0.172 | 1.972 | 0.160 | ||
| 是 | 18(23.1) | |||||
| 否 | 60(76.9) | |||||
| 术后辅助化疗 | 0.308 | 0.579 | 0.097 | 0.755 | ||
| 是 | 39(50.0) | |||||
| 否 | 39(50.0) | |||||
| 新辅助化疗 | 0.308 | 0.579 | 0.097 | 0.755 | ||
| 是 | 39(50.0) | |||||
| 否 | 39(50.0) | |||||
将差异具有统计学意义(P < 0.05)的单因素纳入多因素分析显示,肿瘤浸润淋巴脉管是OS和PFS的独立预后因素(均P < 0.05,表 4~5)。
| 变量 | B | S.E | Walds | df | P值 | OR | 95%CI |
| 肿瘤浸润淋巴脉管 | 3.337 | 1.309 | 6.496 | 1 | 0.011 | 28.146 | 2.162~366.441 |
| 肿瘤浸润膀胱三角区 | -0.919 | 1.336 | 0.473 | 1 | 0.492 | 0.399 | 0.029~5.476 |
| 变量 | B | S.E | Walds | df | P值 | OR | 95%CI |
| 肿瘤浸润淋巴脉管 | 3.734 | 1.425 | 6.870 | 1 | 0.009 | 41.850 | 2.565~682.923 |
| 肿瘤浸润膀胱三角区 | -0.593 | 1.259 | 0.222 | 1 | 0.638 | 0.553 | 0.047~6.517 |
| T分期 | 0.476 | 0.574 | 0.687 | 1 | 0.407 | 1.610 | 0.522~4.961 |
新辅助化疗组PR+CR为46.2%(18/39),病理完全缓解(pT0)率和降期(< pT2)率分别为12.8%(5/39)和38.5%(15/39,表 6)。所有达到pT0的患者中没有出现疾病复发。新辅助化疗组化疗前肿瘤最大径为(2.92±1.65)cm,化疗后为(2.34±2.29)cm,最小径为(1.68±1.23)cm,化疗后为(1.42±1.69)cm,肿瘤体积缩小(t=2.056,P=0.047;t=1.110,P=0.274)。化疗前8例(20.5%)淋巴结阳性,化疗后5例(12.8%)淋巴结阳性,化疗前后淋巴结阳性率比较,差异具有统计学意义(P=0.019)。
| 短期疗效 | 例数(%) |
| 临床缓解 | |
| 完全缓解 | 9(23.1) |
| 部分缓解 | 9(23.1) |
| 疾病稳定 | 16(41.0) |
| 疾病进展 | 5(12.8) |
| 病理降期 | |
| pT0 | 5(12.8) |
| pT1 | 15(38.5) |
| ≥pT2 | 19(48.7) |
单因素分析显示,39例接受新辅助化疗的患者病理降期及pCR在性别、年龄、肿瘤数目、肿瘤发生情况、肿瘤浸润膀胱三角区、肿瘤浸润输尿管下段、肿瘤浸润淋巴脉管、肿瘤T分期和淋巴结转移方面比较,差异均无统计学意义(均P > 0.05,表 7)。
| 临床病理因素 | 例数(%) | 病理降期 | pCR | |||||
| 例数 | χ2值 | P值 | 例数 | χ2值 | P值 | |||
| 性别 | 1.232 | 0.267 | 0.009 | 0.923 | ||||
| 男性 | 35(89.7) | 19 | 8 | |||||
| 女性 | 4(10.3) | 1 | 1 | |||||
| 年龄 | 0.009 | 0.925 | 1.296 | 0.255 | ||||
| ≥70岁 | 10(25.6) | 5 | 1 | |||||
| < 70岁 | 29(74.4) | 15 | 8 | |||||
| 肿瘤数目 | 1.761 | 0.184 | 0.164 | 0.685 | ||||
| 单发 | 33(84.6) | 18 | 8 | |||||
| 多发 | 6(15.4%) | 2 | 1 | |||||
| 肿瘤发生 | 0.268 | 0.605 | 0.286 | 0.593 | ||||
| 初发 | 23(59.0) | 11 | 6 | |||||
| 复发 | 16(41.0) | 9 | 3 | |||||
| 肿瘤浸润膀胱三角区 | 2.003 | 0.157 | 0.632 | 0.426 | ||||
| 是 | 2(5.1) | 2 | 0 | |||||
| 否 | 37(94.9) | 18 | 9 | |||||
| 肿瘤浸润输尿管下段 | 1.232 | 0.267 | 1.820 | 0.177 | ||||
| 是 | 4(10.3) | 1 | 2 | |||||
| 否 | 35(89.7) | 19 | 7 | |||||
| 肿瘤浸润淋巴脉管 | 0.001 | 0.970 | 0.632 | 0.426 | ||||
| 是 | 2(5.1) | 1 | 0 | |||||
| 否 | 37(94.9) | 19 | 9 | |||||
| 肾积水 | 1.761 | 0.184 | 0.145 | 0.703 | ||||
| 是 | 7(18.0) | 2 | 2 | |||||
| 否 | 32(82.0) | 18 | 7 | |||||
| T分期 | 3.477 | 0.176 | 0.975 | 0.614 | ||||
| T2 | 32(82.1) | 18 | 8 | |||||
| > T2 | 7(17.9) | 2 | 1 | |||||
| N分期 | 0.007 | 0.935 | 0.021 | 0.855 | ||||
| N+ | 8(20.5) | 4 | 2 | |||||
| N0 | 31(79.5) | 16 | 7 | |||||
| 注 pCR:病理完全缓解(pathological complete response) | ||||||||
39例肌层浸润型膀胱癌接受顺铂为主的新辅助化疗方案治疗常见的不良反应为骨髓抑制、胃肠道反应及肝肾功损害等(表 8)。总体显示患者Ⅲ~Ⅳ度不良反应率低。其中骨髓抑制主要表现是白细胞、中性粒和血小板减少,其中Ⅲ~Ⅳ度4例(10.3%)。胃肠道反应主要表现为恶心、呕吐和食欲不振,均为Ⅰ~Ⅱ度。肝功能损害2例(5.1%)。肾功能损害1例(2.6%)。泌尿道毒性反应4例(10.3%),表现为尿频、尿急和尿痛等,无治疗相关性死亡。
| 不良反应 | Ⅰ度 | Ⅱ度 | Ⅲ度 | Ⅳ度 |
| 骨髓抑制 | ||||
| 中性粒降低 | 6 | 2 | 3 | 0 |
| 白细胞降低 | 6 | 4 | 2 | 0 |
| 血小板降低 | 5 | 2 | 2 | 1 |
| 消化道反应 | ||||
| 恶心 | 22 | 1 | 0 | 0 |
| 呕吐 | 22 | 2 | 0 | 0 |
| 食欲不振 | 26 | 0 | 0 | 0 |
| 肝功能损害 | 2 | 0 | 0 | 0 |
| 肾功能损害 | 1 | 0 | 0 | 0 |
| 泌尿道毒性反应 | 3 | 1 | 0 | 0 |
多项研究数据显示,新辅助化疗可以改善肌层浸润性膀胱癌患者的生存期[8-11]。多数临床研究均使用以铂类为基础的化疗方案,2013年欧洲泌尿协会正式推荐以顺铂为基础的新辅助化疗用于T2~4aN0M0期浸润性膀胱癌[体力状态≥2和(或)肾功能损害者除外][12]。
本研究从长期疗效、短期疗效及安全性方面评价GC方案新辅助化疗对肌层浸润性膀胱癌患者的疗效。为了尽可能消除混杂因素的影响,本文采用了PSM法对39例新辅助化疗患者与62例单纯行根治术患者进行1:1匹配。结果匹配成功39对患者。一项976例肌层浸润性膀胱癌患者的国际多中心试验结果来看,接受新辅助化疗以后3年OS率从50%增加到56%,10年OS率从30%增加到36%[13]。而本研究显示,从1、2和3年OS率以及1、2和3年PFS率来看,新辅助化疗组与单纯手术组比较,差异均无统计学意义(均P > 0.05)。分析其原因为多数患者的随访时间较短和样本量受限。今后还需更大样本的前瞻性研究进一步分析。
本研究从病理降期率和临床缓解率来分析新辅助化疗疗效。结果显示,39例接受新辅助化疗的患者肿瘤最大径经2~3个周期化疗后较化疗前缩小,临床缓解率为46.2%,病理完全缓解率为12.8%。可见新辅助化疗对肿瘤有降期作用,提示GC方案短期疗效较为肯定。国内学者在回顾性分析研究中亦得出新辅助化疗治疗肌层浸润性膀胱癌可改善患者预后,使肿瘤通过化疗降期,延长了患者的无瘤生存期及OS[14-15]。一项回顾性研究显示,接受新辅助化疗的上尿路上皮癌患者经根治性肾输尿管切除术治疗后高级病理分期(pT2或更高)低于未接受新辅助化疗的患者,且有9.4%为病理完全缓解[16]。另一项回顾性分析得出在接受根治性手术的患者中,术前新辅助化疗的患者在病理降期上显示更好的优越性[17]。然而也有研究报道,存在患者未能从新辅助化疗中获益,有过度医疗和延误手术时机的现象[18]。还有研究提示肌层浸润性膀胱癌患者新辅助化疗后行根治术联合辅助化疗更好改善生存结局[19]。但是大量循证医学证据提示,新辅助化疗在肌层浸润性膀胱癌的综合治疗中,短期疗效及长期疗效均得到国内外多数学者的肯定[20-21]。
探讨新辅助化疗疗效的影响因素,临床病理特征有很好的指导作用。本研究经Cox回归模型得出肿瘤浸润淋巴脉管是长期疗效的独立预测因子(P < 0.05)。考虑与以下原因有关:肿瘤浸润淋巴脉管的患者多数处于疾病的中晚期,肿瘤细胞长期伴随于体内,导致机体免疫功能低下,预后较差[22]。国内已有研究分析了膀胱癌术后患者预后现状和影响因素, 提示高龄、肿瘤组织学分级、淋巴结转移、膀胱癌组织学类型、是否合并肾积水和吸烟是影响膀胱癌患者预后的独立因素[23-25]。但对于其他可能影响因素,肿瘤浸润输尿管下段对预后影响暂无支持证据,术前膀胱灌注以及术后辅助化疗受治疗方案不一致,样本量小未得到结论。近年膀胱癌病理分型来预测新辅助化疗敏感性研究众多,肌层浸润性膀胱癌最新分型系统包括TCGA2017和BOLD2018分型[26],如基底鳞状细胞型和管腔非特异型对新辅助化疗敏感。
新辅助化疗后肿瘤微环境中的免疫微环境发生相应变化,相关免疫标志物可以为难治性膀胱癌患者免疫治疗指导方向。近几年除了已知的CD3、CD8和FoxP3等免疫分子标志物,影响膀胱癌的预后分子标志物越来越多,如成纤维细胞生长因子受体3(fibroblast growth factor receptor 3,FGFR3)、依赖ATP的P糖蛋白(P-glycoprotein,P-gp)、多药耐药蛋白(multidrug resistance protein,MRP)、血浆纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio,FAR)、Schlafen 11和p53等[27-30]。肠道微生物在系统免疫反应中也扮演重要角色。在肿瘤环境中,肠道微生物能够影响诸如奥沙利铂和顺铂化疗的疗效,而肠道微生物与免疫检查点的关系非常密切[31],或许今后针对膀胱癌患者肠道生物群在新辅助化疗的前后变化可以进一步研究。
本研究中,主要毒性反应为骨髓抑制以及恶心和呕吐等消化道毒性反应。全组患者未出现化疗相关严重不良反应而导致疗程中断或化疗相关性死亡。所有患者的血液学不良反应与以往的报道[21]基本相似,表现出GC方案可观的耐受性及较轻的不良反应。近年国内外有更多学者致力于研究出疗效及安全性双重保障的吉西他滨等化疗药物, 故未来该方案疗效更加值得期待。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA a Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
关有彦, 邢念增. 2019年欧洲泌尿外科协会年会膀胱癌研究热点[J]. 中华泌尿外科杂志, 2019, 40(6): 405-407. DOI:10.3760/cma.j.issn.1000-6702.2019.06.002 |
| [3] |
Veskimäe E, Espinos EL, Bruins HM, et al. What is the prognostic and clinical importance of urothelial and nonurothelial histological variants of bladder cancer in predicting oncological outcomes in patients with muscle-invasive and metastatic bladder cancer? A European association of urology muscle invasive and metastatic bladder cancer guidelines panel systematic review[J]. Eur Urol Oncol, 2019, 2(6): 625-642. DOI:10.1016/j.euo.2019.09.003 |
| [4] |
Nitta M, Kuroda S, Nagao K, et al. Effect of neoadjuvant chemotherapy in patients undergoing radical cystectomy for muscle-invasive bladder cancer: a retrospective, multi-institutional study[J]. Jpn J Clin Oncol, 2020, 50(1): 73-79. DOI:10.1093/jjco/hyz137 |
| [5] |
Edge SB, Byrd DR, Compton CC, et al. AJCC cancer staging manual[M]. 7th ed. New York: Springer, 2010.
|
| [6] |
Duffaud F, Therasse P. New guidelines to evaluate the response to treatment in solid tumors[J]. Bull Cancer, 2000, 87: 881-886. |
| [7] |
Trotti A, Bentzen SM. The need for adverse effects reporting standards in oncology clinical trials[J]. J Clin Oncol, 2004, 22(1): 19-22. DOI:10.1200/JCO.2004.10.911 |
| [8] |
Sagaster P, Flamm J, Flamm M, et al. Neoadjuvant chemotherapy (MVAC) in locally invasive bladder cancer[J]. Eur J Cancer, 1996, 32A(8): 1320-1324. |
| [9] |
Matsui Y, Nishiyama H, Watanabe J, et al. The current status of perioperative chemotherapy for invasive bladder cancer: a multiinstitutional retrospective study in Japan[J]. Int J Clin Oncol, 2005, 10(2): 133-138. |
| [10] |
Russell B, Sherif A, Häggström C, et al. Neoadjuvant chemotherapy for muscle invasive bladder cancer: a nationwide investigation on survival[J]. Scand J Urol, 2019, 53(4): 206-212. DOI:10.1080/21681805.2019.1624611 |
| [11] |
Hamid ARAH, Ridwan FR, Parikesit D, et al. Meta-analysis of neoadjuvant chemotherapy compared to radical cystectomy alone in improving overall survival of muscle-invasive bladder cancer patients[J]. BMC Urol, 2020, 20(1): 158. DOI:10.1186/s12894-020-00733-z |
| [12] |
Witjes JA, Bruins HM, Cathomas R, et al. European association of urology guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2020 guidelines[J]. Eur Urol, 2021, 79(1): 82-104. DOI:10.1016/j.eururo.2020.03.055 |
| [13] |
Wood DP. Re: international phase Ⅲ trial assessing neoadjuvant cisplatin, methotrexate, and vinblastine chemotherapy for muscle-invasive bladder cancer: long-term results of the BA0630894 trial[J]. J Urol, 2012, 187(2): 473. |
| [14] |
Cao M, Zhao H, Mu XY, et al. Gemcitabine plus cisplatin neoadjuvant chemotherapy with radical cystectomy for the treatment of muscle invasive bladder cancer: 9 years retrospective analysis[J]. Chin J Urol, 2014, 35: 49-53. |
| [15] |
冯能卓, 何京伟, 梁其炎, 等. 新辅助化疗联合根治性手术治疗肌层浸润性膀胱癌的近远期效果观察[J]. 医学理论与实践, 2019, 32(13): 2057-2059. DOI:10.19381/j.issn.1001-7585.2019.13.045 |
| [16] |
Liao RS, Gupta M, Schwen ZR, et al. Comparison of pathological stage in patients treated with and without neoadjuvant chemotherapy for high risk upper tract urothelial carcinoma[J]. J Urol, 2018, 200(1): 68-73. DOI:10.1016/j.juro.2017.12.054 |
| [17] |
Meeks JJ, Taylor JM, Matsushita K, et al. Pathological response to neoadjuvant chemotherapy for muscle-invasive micropapillary bladder cancer[J]. BJU Int, 2013, 111(8): E325-E330. DOI:10.1111/j.1464-410X.2012.11751.x |
| [18] |
Martinez Chanza N, Werner L, Plimack E, et al. Incidence, patterns, and outcomes with adjuvant chemotherapy for residual disease after neoadjuvant chemotherapy in muscle-invasive urinary tract cancers[J]. Eur Urol Oncol, 2020, 3(5): 671-679. DOI:10.1016/j.euo.2018.12.013 |
| [19] |
Ploussard G, Pradere B, Beauval JB, et al. Survival outcomes of patients with pathologically proven positive lymph nodes at time of radical cystectomy with or without neoadjuvant chemotherapy[J]. J Clin Med, 2020, 9(6): 1962. DOI:10.3390/jcm9061962 |
| [20] |
Hosogoe S, Hatakeyama S, Kusaka A, et al. Platinum-based neoadjuvant chemotherapy improves oncological outcomes in patients with locally advanced upper tract urothelial carcinoma[J]. Eur Urol Focus, 2018, 4(6): 946-953. DOI:10.1016/j.euf.2017.03.013 |
| [21] |
Zargar H, Espiritu PN, Fairey AS, et al. Multicenter assessment of neoadjuvant chemotherapy for muscle-invasive bladder cancer[J]. Eur Urol, 2015, 67(2): 241-249. DOI:10.1016/j.eururo.2014.09.007 |
| [22] |
Wan S, Lee APW, Jin CN, et al. The choice of mitral annuloplastic ring-beyond "surgeon's preference"[J]. Ann Cardiothorac Surg, 2015, 4(3): 261-265. |
| [23] |
Okabe K, Shindo T, Maehana T, et al. Neoadjuvant chemotherapy with gemcitabine and cisplatin for muscle-invasive bladder cancer: multicenter retrospective study[J]. Jpn J Clin Oncol, 2018, 48(10): 934-941. DOI:10.1093/jjco/hyy122 |
| [24] |
王一哲, 黄后宝. 应用Cox模型分析119例膀胱癌患者术后预后因素[J]. 沈阳医学院学报, 2018, 20(1): 23-25, 29. |
| [25] |
毛士玉, 黄天宝, 熊大波, 等. 吸烟影响非肌层浸润性膀胱癌预后的研究进展[J]. 现代泌尿外科杂志, 2016, 21(1): 73-76. |
| [26] |
孔家瑾, 张璐, 等. 膀胱癌分子机制及分子分型的研究进展[J]. 临床泌尿外科杂志, 2021, 36(3): 236-241. |
| [27] |
孔家瑾, 张璐. 膀胱癌分子机制及分子分型的研究进展[J]. 临床泌尿外科杂志, 2021, 36(3): 236-241. |
| [28] |
胡海峰, 杨进. FAR对恶性膀胱尿路上皮肿瘤的预测效果分析[J]. 实用肿瘤杂志, 2020, 35(5): 445-449. DOI:10.13267/j.cnki.syzlzz.2020.05.012 |
| [29] |
Taniyama D, Sakamoto N, Takashima T, et al. Prognostic impact of Schlafen 11 in bladder cancer patients treated with platinum-based chemotherapy[J]. Cancer Sci, 2022, 113(2): 784-795. |
| [30] |
Park S, Rong LJ, Owczarek TB, et al. Novel mouse models of bladder cancer identify a prognostic signature associated with risk of disease progression[J]. Cancer Res, 2021, 81(20): 5161-5175. |
| [31] |
赵颖馨, 沈虹, 袁瑛. 晚期非小细胞肺癌的免疫治疗再挑战[J]. 实用肿瘤杂志, 2021, 36(3): 202-208. DOI:10.13267/j.cnki.syzlzz.2021.043 |
 2022, Vol. 37
2022, Vol. 37


