文章信息
- 于镓锐, 杨森, 钟洪波, 张立新, 孙国贵
- Yu Jiarui, Yang Sen, Zhong Hongbo, Zhang Lixin, Sun Guogui
- 藤黄酸通过抑制JAK-STAT通路对食管癌细胞KYSE450增殖和凋亡的影响
- Effect of gambogic acid on proliferation and apoptosis of esophageal cancer cell KYSE450 by inhibiting JAK-STAT pathway
- 实用肿瘤杂志, 2021, 36(3): 228-233
- Journal of Practical Oncology, 2021, 36(3): 228-233
基金项目
- 河北省杰出青年科学基金(H2019105026);唐山市人民医院院士工作站建设专项(199A77119H); 京津冀基础研究合作专项(H2019105143)
-
通信作者
- 孙国贵, E-mail: guogui_sun2013@163.com
-
文章历史
- 收稿日期:2019-11-26
2. 秦皇岛市第一医院放疗科, 河北 秦皇岛 066000
2. Department of Radiotherapy, the First Hospital of Qinhuangdao City, Qinhuangdao 066000, China
食管癌是危害人类健康的恶性肿瘤之一,居于全球人类癌症死亡的第6位[1]。食管鳞状细胞癌是食管癌的主要组织学类型。其恶性程度高,预后差,对放疗不敏感,患者死亡率高。目前食管癌的研究有诸多突破性进展,放疗和化疗仍是治疗食管癌的主要手段,但部分化疗药物的严重不良反应降低了患者的生活质量[2-3]。食管癌术后存在一定的复发率,因此研发治疗食管癌的有效化疗药物意义重大。藤黄酸(gambogic acid)是由藤黄分泌的主要活性成分,具有抗感染、抗癌和抗氧化等多种功效[4-6]。藤黄酸可通过多种机制抑制肿瘤细胞的活性,包括抑制肿瘤细胞的增殖、侵袭、迁移以及诱导细胞的凋亡[7]。尽管藤黄酸在各种癌症中均显示较强的抗肿瘤活性,但其诱导食管癌细胞凋亡是否与Janus激酶(Janus kinase,JAK)-信号转导与转录激活子(signal transducer and activator of transcription,STAT)信号通路有关尚不明确。为此,本研究目的在于探讨藤黄酸对食管癌细胞增殖、侵袭、迁移和凋亡的影响,探讨其可能的作用机制,为临床应用提供实验基础。
1 材料与方法 1.1 细胞株和试剂藤黄酸购自上海蓝木化工有限公司,溶解于二甲基亚砜(dimethyl sulfoxide,DMSO)配置成储存液体(50 mmol/L),分装后于-20℃冰箱保存,食管癌细胞株KYSE450由中国医学科学院肿瘤医院重点实验室友情提供;JAK2、STAT3、磷酸化的Janus激酶2(phosphorylated Janus kinase 2,P-JAK2)、P-STAT3、Bax、Bcl2、Cleaved PARP1、Cleaved Caspase-3和Cleaved Caspase-9购自武汉三鹰生物技术有限公司,β-actin、抗鼠二抗和抗兔二抗购自美国Sigma公司;凋亡试剂盒购自上海碧云天生物有限公司;蛋白质印迹试剂购自广州康为生物科技有限公司;CCK-8试剂购上海碧云天生物有限公司;RPMI 1640细胞培养液、胎牛血清和胰蛋白酶均购自美国Gibco公司。
1.2 细胞培养细胞采用含有10%胎牛血清、青霉素(100 U/mL)和链霉素(100 μg/mL)的RPMI 1640培养液,在37℃ 5%CO2细胞培养箱中无菌培养。每隔24 h换液1次。细胞生长至大皿密度的70%左右,用胰酶消化传代。待细胞贴壁后,取对数生长期的细胞进行相关实验。
1.3 细胞增殖抑制试验取对数生长的食管癌细胞KYSE450,胰酶消化后计数,分别以每孔2 000个细胞均匀接种在96孔板里。待24 h细胞贴壁去除培养液,分别加入浓度为0.5、1.0和2 µmol/L的藤黄酸和DMSO进行对照,每个浓度6个副孔。分别培养24、48和72 h后,每孔100 μL培养液加入CCK-8 10 μL,在培养箱培养2 h后,酶标仪上测定450 nm吸光度(absorbance,A)值,根据A值通过公式计算细胞抑制率(%)=(1-实验组A值/对照组A值)×100%,实验重复3次取平均值。
1.4 细胞克隆形成实验取对数生长期的食管癌细胞KYSE450均匀接种在6孔板内,分别加入浓度为0.5 µmol/L和1 µmol/L的藤黄酸,DMSO进行对照。24 h后应用电子显微镜观察细胞形态和数目。用胰酶进行消化后,离心计数,以每孔300个细胞均匀接种在12孔板上,于培养箱中继续培养14 d,去除培养液,甲醇固定后,用结晶紫染色并于显微镜下进行集落计数。
1.5 细胞侵袭和迁移实验细胞侵袭实验提前6 h将含2% Matrigel的100 μL无血清RPMI 1640加入transwell上室,放置于37℃培养箱;取对数生长的食管癌细胞KYSE450,胰酶消化均匀接种在6孔板里,待24 h贴壁后分别加入浓度为0.5 µmol/L和1 µmol/L的藤黄酸以及DMSO进行对照。24 h后消化细胞离心,用不含血清的RPMI 1640重悬后计数;每孔100 000个细胞重新悬浮在无血清培养液中,并均匀地接种到transwell板的上室中。将700 μL含30%胎牛血清的培养液加入下室。培养24 h后,取出上室甲醇固定10 min,然后用0.5%结晶紫染色10 min。使用显微镜对侵袭和迁移的细胞进行拍照和定量。
1.6 细胞凋亡实验使用膜联蛋白V-FITC凋亡检测试剂盒通过流式细胞术测定细胞凋亡。分别用浓度为0.5 µmol/L和1.0 µmol/L藤黄酸以及DMSO进行对照,处理48 h后收集贴壁细胞和漂浮细胞,并用5 μL膜联蛋白V-FITC(0.5 mg/mL)孵育15 min,避光加入5 μL PI(0.5 mg/mL)染色15 min。用BDTM LSRⅡ流式细胞仪进行上机分析。计算膜联蛋白阳性细胞并定义为凋亡细胞。
1.7 Western blot实验用0.5 µmol/L和1.0 µmol/L藤黄酸以及DMSO进行对照处理食管癌KYSE450细胞24 h。用PBS洗涤1次后,使用含有40 μg/mL蛋白酶抑制剂和磷酸酶抑制剂的NP-40裂解缓冲液提取细胞样品的总蛋白。使用BCA蛋白质测定试剂盒(上海碧云天生物技术有限公司)根据制造商的说明书测定蛋白浓度。将等量40 μg蛋白质在SDS-PAGE 10%凝胶中进行电泳,然后转移到PVDF膜(Millipore,USA)上。用5%脱脂乳封闭1 h后,在4℃下与一抗孵育过夜。TBST洗膜3次每次10 min,在室温下与辣根过氧化物酶缀合的二抗孵育1 h后,TBST洗膜3次每次10 min后通过ECL测定试剂盒观察蛋白质条带,并使用ChemiDoc TM XRS + System进行分析。
1.8 统计学分析使用SPSS13.0和GraphPad Prism 7软件进行数据分析及作图。数据采用均数±标准差(x±s)表示,两组间比较采用t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 藤黄酸抑制食管癌KYSE450细胞的增殖藤黄酸的化学分子结构见图 1。用不同浓度的藤黄酸(0、0.5、1.0和2 µmol/L)处理食管癌细胞株KYSE450 24、48和72 h,通过CCK-8测定法评估每种浓度和时间点的细胞抑制率发现,藤黄酸以浓度依赖性和时间依赖性方式抑制细胞增殖(均P < 0.05,图 2)。
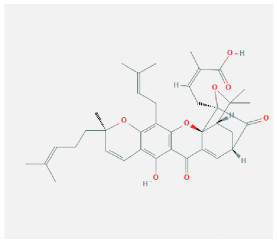
|
| 图 1 藤黄酸的化学结构式 Fig.1 Chemical structual formula of gambogic acid |
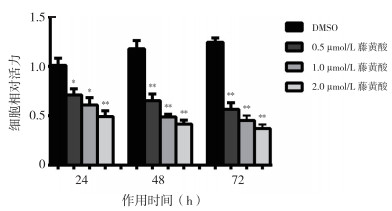
|
| 注 *与DMSO(对照组)比较,P < 0.05;**与DMSO(对照组)比较,P < 0.01 图 2 藤黄酸抑制食管癌KYSE450细胞增殖 Fig.2 Inhibition of the proliferation of KYSE450 cells by gambogic acid |
用不同浓度的藤黄酸(0、0.5和1 µmol/L)处理食管癌KYSE450细胞24 h后,克隆形成试验表明,藤黄酸以剂量依赖性方式抑制食管癌KYSE450细胞的克隆形成(均P < 0.05,图 3)。
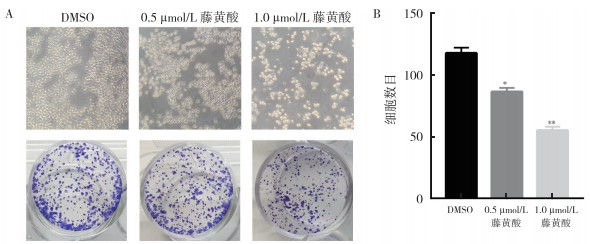
|
| 注 A:电子显微镜下藤黄酸(0.5和1.0 µmol/L)和DMSO(对照组)对KYSE450细胞形态和克隆形成数目的影响;B:克隆计数统计直方图;*与DMSO(对照组)比较,P < 0.05;**与DMSO(对照组)比较,P < 0.01 图 3 藤黄酸处理细胞24 h后对食管癌KYSE450细胞克隆形成的抑制作用 Fig.3 Inhibition of colony formation in esophageal cancer cell KYSE450 treated with gambogic acid for 24 h |
不同浓度的藤黄酸(0、0.5和1.0 µmol/L)处理KYSE450细胞24 h后,transwell小室实验中,在荧光倒置显微镜下观察到0.5和1.0 µmol/L藤黄酸处理的KYSE450细胞的迁移和侵袭的细胞数少于对照组(均P < 0.05,图 4)。
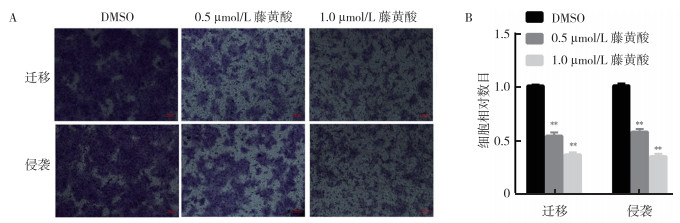
|
| 注 A:Transwell实验检测藤黄酸(0.5和1.0 µmol/L)和DMSO(对照组)对KYSE450细胞迁移和侵袭的影响;B:细胞迁移和侵袭结果的直方图;**与DMSO(对照组)比较,P < 0.01 图 4 藤黄酸处理细胞24 h后对食管癌KYSE450细胞的迁移和侵袭的抑制作用 Fig.4 Inhibition of the migration and invasion of esophageal cancer cell KYSE450 treated with gambogic acid for 24 h |
流式细胞仪结果显示用不同浓度的藤黄酸(0、0.5和1.0 µmol/L)处理KYSE450细胞48 h,基于膜联蛋白V-FITC/PI双重染色和流式细胞仪检测细胞凋亡的比例分别为(2.1±0.18)%、(5.8±0.49)%和(7.7±0.37)%,对照组与另两组比较,差异均具有统计学意义(均P < 0.05,图 5)。
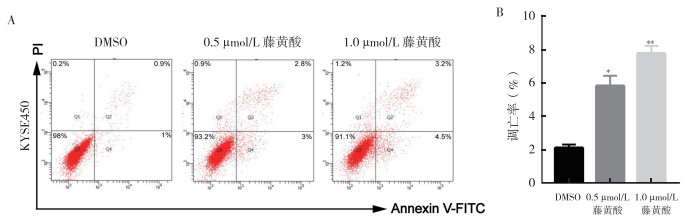
|
| 注 A:流式细胞仪检测藤黄酸(0.5和1.0 µmol/L)和DMSO(对照组)对KYSE450细胞凋亡的影响;B:凋亡率结果统计直方图;*与DMSO(对照组)比较,P < 0.05;**与DMSO(对照组)比较,P < 0.01 图 5 藤黄酸处理细胞24 h后诱导食管癌KYSE450细胞凋亡 Fig.5 Increased apoptosis of esophageal cancer cell KYSE450 treated with gambogic acid for 24 h |
Western blot结果显示,用不同浓度的藤黄酸(0、0.5和1 µmol/L)处理的KYSE450细胞48 h后,与对照组(0 µmol/L)比较,其他两组的抗凋亡蛋白Bcl2的表达降低,凋亡相关蛋白Bax、促凋亡因子Cleaved PARP1、Cleaved Caspase-3和Cleaved Caspase-9蛋白表达量均逐渐增加(均P < 0.05,图 6A)。进一步验证藤黄酸通过抑制JAK-STAT信号通路诱导食管癌KYSE450细胞凋亡,与对照组比较,P-JAK2和P-STAT3蛋白表达量降低呈剂量依赖性(均P < 0.05),而JAK2和STAT3蛋白表达量基本不变(图 6B),表明藤黄酸通过JAK-STAT信号通路诱导食管癌细胞凋亡。
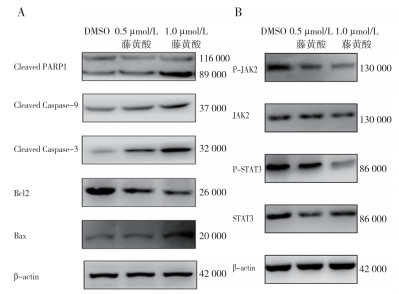
|
| 注 A:凋亡相关蛋白的Western blot检测结果;B:JAK-STAT通路相关蛋白的Western blot检测结果 图 6 藤黄酸处理细胞48 h后食管癌KYSE450细胞凋亡相关蛋白和JAK-STAT信号通路相关蛋白的水平变化 Fig.6 Expression levels of apoptosis-related proteins and JAK-STAT signaling pathway-related proteins in esophageal cancer cell KYSE450 treated with gambogic acid for 48 h |
食管癌的5年生存率较低(10%~30%)。多数中晚期食管癌伴有远处转移,部分已错失手术机会,然而化疗是治疗中晚期食管癌的有效方案之一,但化疗不良反应大,影响患者生活质量[8]。天然小分子药物具有很强的抗癌效果,并且不良反应小,有可能为一种治疗癌症的新方法[9]。藤黄酸是藤黄分泌的天然成分,具有抗感染、抗微生物和抗肿瘤的活性[10]。虽然藤黄酸在某些肿瘤中具有极有效的抗肿瘤作用,但对食管癌的作用机制仍不十分明确。本研究表明,藤黄酸能抑制食管癌细胞KYSE450的增殖、迁移和侵袭,且随着藤黄酸浓度的增加以及作用时间的延长,藤黄酸对食管癌细胞KYSE450的作用增加。进一步研究发现,藤黄酸能抑制JAK-STAT信号通路并诱导食管癌KYSE450细胞凋亡。
浸润生长和远处转移是恶性肿瘤的基本特性之一。肿瘤转移是指恶性肿瘤细胞从原发部位、淋巴管、血管或体腔继续生长到其他部位的过程,这与癌症进展密切相关[11-12]。藤黄酸在多种肿瘤细胞中均具备抑制和杀伤肿瘤细胞的作用。本研究表明,藤黄酸可以有效抑制食管癌细胞的增殖、迁移和侵袭能力,随着藤黄酸浓度的增加和作用时间的延长,这种抑制效果更明显。
本研究发现,与对照组细胞学形态比较,藤黄酸处理组的细胞形态学均有异常改变,且呈现剂量依赖性和时间依赖性,可证明藤黄酸能够促使食管癌细胞株KYSE450发生形态学的变化,这也为藤黄酸具有抑制恶性肿瘤细胞的增殖奠定基础。并且本次实验证明,藤黄酸具备抑制食管癌细胞的克隆形成能力,进一步也验证了抑制食管癌细胞增殖的能力。
细胞凋亡是指由基因控制以维持体内平衡的细胞的有序死亡。凋亡检测是药物抗肿瘤机制研究中的重要手段[13-14]。本研究证明,藤黄酸可以促进食管癌细胞KYSE450的凋亡,并且以剂量依赖性方式增加细胞凋亡中早期和晚期细胞的比例。由抗凋亡蛋白和促凋亡蛋白组成的Bcl2家族蛋白是线粒体功能的重要调节剂。Bcl2属于抗凋亡蛋白,抑制细胞凋亡,而Bax作为促凋亡蛋白起作用并激活细胞凋亡。Bax/Bcl2比率对细胞存活和凋亡有一定意义。增加的Bax/Bcl2比率导致细胞色素c从线粒体释放和Caspase-3激活,然后剪切体的PARP在内的细胞内底物诱导细胞凋亡[15]。实验结果显示,藤黄酸处理导致Cleaved Caspase-3、Cleaved Caspase-9和Cleaved PARP1上调,藤黄酸处理增加Bax蛋白水平并降低Bcl2蛋白水平,导致Bax/Bcl2比率增加。因此,本研究结果表明,藤黄酸通过线粒体相关的凋亡途径诱导食管癌细胞KYSE450产生凋亡。
JAK-STAT信号通路是调节细胞增殖、分化、迁移和凋亡的重要信号通路之一[16]。研究表明,突变的JAK蛋白可能是抗肿瘤治疗的有效靶点[17]。在本研究中,藤黄酸抑制食管癌细胞KYSE450 JAK2和STAT3的磷酸化,提示藤黄酸的抗肿瘤作用是通过抑制JAK-STAT信号通路而实现的,提示藤黄酸通过抑制JAK-STAT信号通路诱导食管癌KYSE450细胞凋亡。
目前随着临床治疗方案的不断创新与发展,肿瘤的靶向治疗和研发新的分子靶向药物成为肿瘤治疗的热点方案[18]。本研究再次证明,藤黄酸具有良好的抗癌作用。本研究首次发现藤黄酸可以通过JAK-STAT信号诱导食管癌细胞凋亡并且有抑制其增殖的能力,然而藤黄酸的实际临床效果还需进一步的体内实验验证。
综上所述,藤黄酸能抑制食管癌细胞的增殖、迁移和侵袭,并且通过抑制JAK-STAT信号通路诱导食管癌细胞凋亡,揭示该药物的新抗癌机制,为今后的临床应用提供了实验基础。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Pennathur A, Gibson MK, Jobe BA, et al. Oesophageal carcinoma[J]. Lancet (London, England), 2013, 381(9864): 400-412. DOI:10.1016/S0140-6736(12)60643-6 |
| [3] |
邰宵辉, 赵达, 关泉林, 等. 同步放化疗与序贯放化疗治疗食管癌的Meta分析[J]. 实用肿瘤杂志, 2013, 28(6): 605-611. |
| [4] |
Pandey MK, Karelia D, Amin SG. Gambogic acid and its role in chronic diseases[J]. Adv Exp Med Biol, 2016, 928(10): 375-395. |
| [5] |
Fu Q, Li C, Yu L. Gambogic acid inhibits spinal cord injury and inflammation through suppressing the p38 and Akt signaling pathways[J]. Mol Med Rep, 2018, 17(1): 2026-2032. |
| [6] |
Banik K, Harsha C, Bordoloi D, et al. Therapeutic potential of gambogic acid, a caged xanthone, to target cancer[J]. Cancer Lett, 2017, 10(416): 75-86. |
| [7] |
王勇, 陈燕. 藤黄酸的抗肿瘤作用及机制[J]. 临床血液学杂志, 2008, 21(4): 395-398. DOI:10.3969/j.issn.1004-2806.2008.04.023 |
| [8] |
Adenis A, Crehange G, Conroy T. Definitive chemoradiotherapy for esophageal squamous cell cancer: a matter of standard[J]. J Clin Oncol, 2019, 37(26): 2379. DOI:10.1200/JCO.19.00963 |
| [9] |
Huang MY, Zhang LL, Ding J, et al. Anticancer drug discovery from Chinese medicinal herbs[J]. Chin Med, 2018, 13: 35. DOI:10.1186/s13020-018-0192-y |
| [10] |
侯文洁, 萧伟. 藤黄酸的研究进展[J]. 中草药, 2011, 42(3): 617-620. |
| [11] |
于敬坤, 陈俊卯, 孙雅涵, 等. 3-溴丙酮酸对人乳头瘤状甲状腺癌TPC-1细胞迁移和侵袭能力的影响[J]. 实用肿瘤杂志, 2020, 35(3): 24-30. |
| [12] |
Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges[J]. Nat Med, 2006, 12(8): 895-904. |
| [13] |
Burgess DJ. Apoptosis: Refined and lethal[J]. Nat Rev Cancer, 2013, 13(2): 79. DOI:10.1038/nrc3462 |
| [14] |
李明辉, 赵静雅, 闫蕴力, 等. 外源性白介素24促进C6细胞凋亡的体外研究[J]. 实用肿瘤杂志, 2016, 31(2): 122-126. |
| [15] |
Czabotar PE, Lessene G, Strasser A, et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1): 49-63. |
| [16] |
Heim MH. The Jak-STAT pathway: cytokine signalling from the receptor to the nucleus[J]. J Recept Signal Transduct Res, 1999, 19(1-4): 75-120. |
| [17] |
Yu H, Jove R. The STATs of cancer-new molecular targets come of age[J]. Nat Rev Cancer, 2004, 4(2): 97-105. |
| [18] |
黄泽坚, 吕萍, 于宝丹, 等. 靶向CD24单克隆抗体增强肝癌化疗敏感性的实验研究[J]. 实用肿瘤杂志, 2019, 34(3): 215-218. |
 2021, Vol. 36
2021, Vol. 36


