文章信息
- 黄婷, 潘敏强, 黄品同
- 肝上皮样血管内皮细胞瘤超声造影表现
- 实用肿瘤杂志, 2021, 36(3): 272-276
-
通信作者
- 黄品同, E-mail: huangpintong@zju.edu.cn
-
文章历史
- 收稿日期:2020-11-22
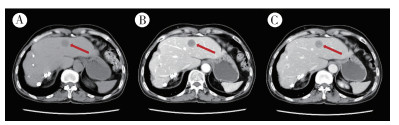
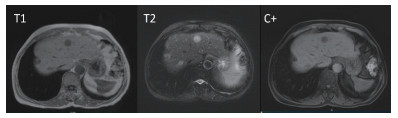
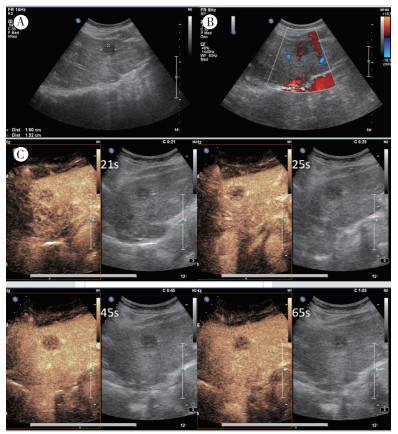
病例1,患者女性,75岁,因反复腹痛及腹胀十余年并加重10 d于2016年5月23日收治本院。患者腹痛以中上腹明显,伴恶心,无呕吐,无畏寒发热。查体,中上腹压痛,无反跳痛。实验室检查示,血常规、尿粪常规、肝功能和肿瘤标志物无殊。2016年5月12日全腹增强CT检查示(图 1),肝Ⅳ段见一低密度结节影,边界清,增强可见强化,直径约20 mm,肝Ⅳ段结节,恶性肿瘤?2016年5月18日肝脏增强MRI检查示,肝Ⅳ段见结节状病灶,T1加权成像(T1-weighted image, T1WI)低信号,T2WI高信号,增强扫描渐进性向心强化,肝Ⅳ段结节灶,胆管细胞癌可能,炎性结节不完全除外(图 2)。2016年5月25日超声造影示,肝Ⅳ段可见一低回声肿块,大小约1.9 cm×1.5 cm,注射造影剂,肿块呈不均匀低增强,消退早于周边组织;造影提示胆管细胞癌首先考虑,必要时建议穿刺活检(图 3)。患者于2016年5月30日行左半肝切除术,术中所见:肝脏萎缩,左右肝可见多发肝脏白色质硬结节,多位于右肝。肝Ⅳ段实质内可扪及直径2 cm的肿块,质地硬。完整切除肝Ⅳ段肿块,送冰冻病理检查提示(左肝):梭形细胞肿瘤,考虑肝脏炎性假瘤,待免疫组织化学检查进一步明确。术后常规病理检查示,上皮样血管内皮细胞瘤(epithelioid hemangioendothelioma,EHE),肿瘤大小约1.8 cm×1.5 cm。免疫组织化学检查结果示:AFP-,HepPar-1-,CK8-,CK18-,CK(AE1/AE3)-,S-100散在+,HMB45-,melan-A-,SMA-,Desmin-,ALK-,CD31+,CD34+,Ki-67 5%+,CD163散在+,CD21-,CD23-,CD35-,EMA-,(ISH)EBER-。
|
| 注 A:肝Ⅳ段见一低密度结节影,边界清;B:增强扫描病灶周围可见轻度强化;C:门脉期病灶由边缘向中央递进强化;箭头示肝Ⅳ段病灶 图 1 病例1肝上皮样血管内皮细胞瘤增强CT表现 |
|
| 注 肝Ⅳ段见结节状病灶,T1WI低信号,T2WI高信号,增强扫描渐进性向心强化 图 2 病例1肝上皮样血管内皮细胞瘤增强MRI表现 |
|
| 注 A:肝Ⅳ段低回声结节,边界清晰,内部回声不均;B:彩色多普勒超声检查示,肿块内未见明显血流信号;C:超声造影示,肿块呈不均匀低增强,消退早于周边组织 图 3 病例1肝上皮样血管内皮细胞瘤常规超声及超声造影表现 |
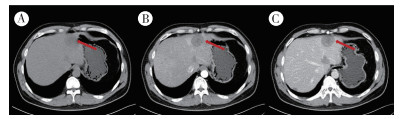
病例2,患者男性,39岁,因发现肝脏肿物1个月于2019年1月21日收治本院。患者无腹痛,无恶心/呕吐等不适。查体:腹平软,全腹无压痛及反跳痛。实验室检查示血常规和尿粪常规正常。肝功能检查提示,谷草转氨酶55 U/L,轻度升高。肿瘤标志物检查提示,糖类抗原199(carbohydrate antigen 199,CA 199)轻度升高(39.0 U/mL)。2019年1月14日行肝脏增强MRI检查示,肝内见散在分布大小不一类圆形异常信号影,呈长T1长T2信号影改变,弥散受限,肝多发异常信号影,考虑转移瘤。2019年1月21日超声造影示,肝实质内见多个低回声结节,部分结节呈片状,较大约6.4 cm×4.2 cm,位于肝Ⅴ段,边界及周边清晰,内部回声不均匀,彩色多普勒血流显像(colour Doppler flow imaging,CDFI)示其周围可见少许血流信号,注射造影剂,结节呈周边环状增强,内部不均匀高增强,整体呈快进快退。造影提示肝内多发转移瘤(图 4)。患者于2019年1月22日局麻下行超声引导下肝脏肿块穿刺活检术,术后组织送检病理。2019年1月24日肝脏增强CT检查示,肝实质内可见多发类圆形低密度影,增强扫描不均匀强化,部分酷似牛眼,肝脏多发占位,转移瘤首先考虑(图 5)。常规病理检查示,见异型细胞,部分胞质空泡状,结合免疫组织化学染色符合上皮样血管内皮瘤。免疫组织化学检查示:CK(AE1/AE3)+,CD31+,CD34+,ERG+,D2-40+,Ki-67 10%,Muc-1-,Muc-5AC-。
|
| 注 A:肝Ⅴ段低回声结节,呈片状,边界可辨,内部回声不均;B:彩色多普勒检查示,肿块周边可见少许血流信号;C:超声造影示,结节呈周边环状增强,内部不均匀高增强,整体呈“快进快退”模式;箭头示肝Ⅴ段病灶 图 4 病例2肝上皮样血管内皮细胞瘤常规超声及超声造影表现 |
|
| 注 A:肝实质内多发类圆形低密度影,较大位于肝Ⅴ段,边界可辨;B:增强扫描病灶不均匀强化,部分酷似牛眼;C:门脉期病灶不均匀强化;箭头示肝V段病灶 图 5 病例2肝上皮样血管内皮细胞瘤增强CT表现 |
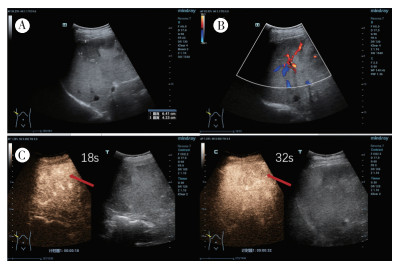
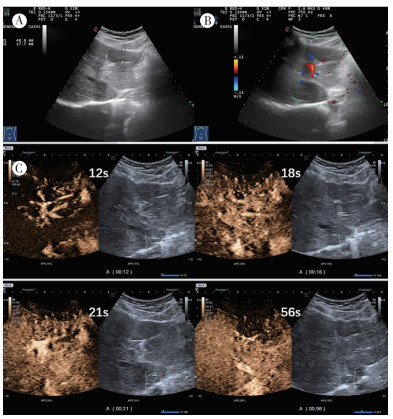
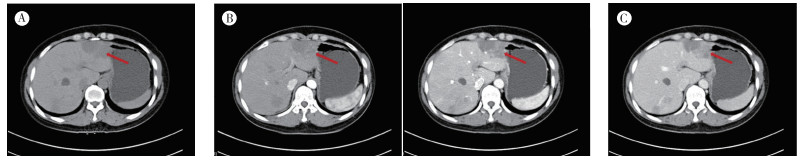
病例3,患者女性,47岁,因体检发现肝占位1个月余于2019年3月20日收治本院。患者无腹痛和恶心/呕吐等不适。2019年3月1日于外院肝脏增强CT检查示,肝多发占位,血管内皮细胞瘤可能大。入院查体:腹平软,未触及包块,无明显压痛及反跳痛。实验室检查示,血常规和肝功能未见明显异常。乙肝三系检查提示,乙肝表面抗原阳性。肿瘤标志物检查提示,鳞状细胞癌相关抗原(squamous cell carcinoma antigen,SSC-Ag)轻度升高(1.7 ng/mL)。2019年3月13日本院常规超声检查示,左肝可见多个偏低回声结节,较大者位于肝Ⅲ段,大小约4.9 cm×1.8 cm,边界及周边清晰,有包膜,内部回声不均匀,CDFI边缘可见血流信号,提示左肝内多发偏低回声结节,血管瘤?建议声学造影(图 6)。2019年3月19日肝脏增强CT检查示,肝内多发低密度灶,最大者位于Ⅱ~Ⅲ段,大小约38 mm×59 mm边缘欠规则低密度灶,呈渐进性强化,肝内多发异常强化灶,可符合上皮样血管内皮瘤改变,建议MRI明确(图 7)。2019年3月20日超声造影检查示,左肝可见多个偏低回声结节,较大者位于肝Ⅲ段,大小约4.9 cm×1.8 cm,边界及周边清晰,有包膜,内部回声不均匀,CDFI示边缘可见血流信号,注入造影剂,肝Ⅲ段病灶动脉期快速高增强,周边向内充填,消退早于周边实质,呈“快进快出”模式。超声造影检查提示,肝Ⅲ段结节,恶性不除外,建议粗针穿刺(图 6)。患者于2019年3月21日局麻下行超声引导下肝脏肿块穿刺活检术,术后组织送检病理。穿刺活检病理检查示,梭形细胞及上皮样细胞肿瘤,部分细胞胞质可见空泡,结合免疫组织化学染色符合上皮样血管内皮瘤。免疫组织化学检查示,CK(AE1/AE3)弱+,CD31+,CD34+,ERG+,Fli-1+,EMA-,CAM5.2-,TFE3+,Ki-67 5%,CK20-。2019年3月25日行肺部CT检查示,两肺见散在多发结节影,以支气管血管束分布为主,较大者位于右肺上叶前段,直径约为9 mm,两肺散在多发结节,结合临床首先考虑上皮样血管内皮瘤。经疑难病例讨论,认为患者肝脏多发病灶伴远处转移,无外科手术切除及肝移植指征,予出院随访。患者出院1年后于本院复查胸部CT和肝脏增强MRI。2020年5月胸部CT检查示,两肺多发结节,较前片部分结节新发,部分结节增大,提示转移瘤。2020年6月肝脏增强MRI检查示,肝内多发占位,符合上皮样血管内皮瘤改变,较前片部分结节略增大。
|
| 注 A:左肝可见多发低回声结节,较大者位于Ⅲ段,边界清,有包膜,内部回声不均;B:彩色多普勒检查示,肿块边缘可见少许血流信号;C:超声造影示,病灶动脉期快速高增强,周边向内填充,消退早于周边实质,呈“快进快退”模式 图 6 病例3肝上皮样血管内皮细胞瘤常规超声及超声造影表现 |
|
| 注 A:肝实质内多发边缘欠规则低密度影,较大位于肝Ⅲ段;B:增强扫描病灶呈渐进性强化;C:门脉期病灶不均匀强化;箭头示肝Ⅲ段病灶 图 7 病例3肝上皮样血管内皮细胞瘤增强CT表现 |
EHE是一类来源于血管内皮细胞的临床罕见肿瘤,生物学行为介于血管瘤和血管肉瘤之间,为低度恶性肿瘤;多发生于浅表软组织、脑、肺、骨、小肠和四肢,来源于肝脏者少见,人群发病率小于1/100万[1]。
肝脏上皮样血管内皮细胞瘤(hepatic epithelioid hemangioendothelioma,HEH)于1984年被首次报道,其临床症状无特征性,多数患者因体检发现,少数有症状者多以上腹部不适、黄疸或者右腹痛、胸闷等就诊,实验室检查多正常[2]。本文中1例表现为中上腹痛腹胀,2例因体检发现,无不适症状;1例CA199轻度升高,1例SSC-Ag轻度升高,1例肝功能轻度升高。鉴于以上特点,影像学检查在术前检查中显得尤为重要。HEH总体转移率为27%~45%,最常见转移到肺脏、骨、腹膜和淋巴结[3]; 因EHE具有多中心起源特点[4],即多器官同时或相继出现病灶,因此临床上难以区分是多个原发病灶还是转移灶。本文3例患者中有1例肺部影像高度疑似多发转移灶,出院后1年随访,肺部病灶较前增大,并出现新发病灶,提示转移瘤。
目前针对HEH的超声造影特点的报道罕见。本文3例病灶在动脉期增强方式上表现各有不同,1例呈树枝状增强,1例呈周边环状增强,1例呈整体高增强;在增强强度上,病灶与造影过程中增强达峰时周围正常肝实质增强比较,1例呈低增强,2例呈高增强;在增强模式上,1例呈“慢进快出”,2例呈“快进快出”;全部病灶在门脉期或延迟期造影剂快速消退,这与之前的报道相一致[5-6]。HEH的超声造影特点与病灶病理组织特点密切相关[7]。HEH的典型病理表现为病灶中心少细胞多纤维,周围可见丰富肿瘤细胞,随病程进展,病灶中心出现广泛纤维化及钙化。疾病早期轻度纤维化,肿瘤细胞分布相对均匀,此时病灶表现为整体向心性高增强,由周边逐步向内填充。随着病灶内部广泛纤维化,造影剂进入困难,外周肿瘤细胞相对丰富,逐渐过渡为动脉期枯枝状增强和环状增强,内部呈低增强。而病灶在门脉期和延迟期均表现为低增强。HEH增强模式与肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)、肝细胞癌(hepatocellular carcinoma, HCC)和肝转移瘤相似,且超声医师对HEH的认识不足及疾病在人群中发病率极低,导致HEH在临床中极易被误诊。本文中1例被误诊为ICC,1例误诊为肝脏转移瘤。
通过对本文3例病灶超声造影表现及既往的报道分析,笔者认为HEH可与ICC、HCC和肝转移瘤相鉴别。(1)HEH与ICC鉴别:HEH在动脉期多为轻度增强,ICC病灶动脉期增强达峰值时强度高于HEH,且ICC增强达峰时间早于HEH;此外,ICC病灶部分伴有肝硬化、肝内胆管结石和周边胆管扩张等征象,可与HEH相鉴别。(2)HEH与HCC鉴别: 部分HEH病灶造影增强模式可表现为“同进快出”或“慢进快出”,因此HCC动脉期增强达峰时增强强度高于HEH,且HCC达峰时呈高增强,而HEH有时表现为低增强或等增强;另外,HCC消退时间晚于HEH,HEH可在动脉晚期或门脉早期消退,而HCC通常在60 s(门脉中期)后,而在延迟期HCC消退不如HEH明显;此外,HCC患者多伴有乙肝、肝硬化和脾肿大等表现,血甲胎蛋白(alpha fetal protein, AFP)水平升高,HEH患者无上述表现。(3)HEH与肝转移瘤鉴别:与HEH比较,肝转移瘤病灶在注射造影剂后动脉期达峰时强度更高,两者造影剂廓清时间均较早,可在动脉晚期或门脉早期开始消退,因此两者主要鉴别点在动脉期达峰时增强强度;另外肝转移瘤患者既往肿瘤病史可帮助增强诊断信心。
HEH在CT和MRI影像学表现有一定特征,可帮助诊断。CT特征性表现为“包膜回缩征”,因包膜下病灶纤维牵拉和肝包膜内陷所致;增强后病灶呈渐进性强化,周边表现为高密度, 病灶中心呈低密度, 形似靶状; 部分病灶周边可见低密度带, 形成“晕征”[8]。MRI表现为T1WI稍低信号,T2WI稍高信号,增强后呈向心性轻度强化[9]。然而,CT检查辐射强,造影剂易引起患者不良反应,不适用于肾功能不全患者;MRI价格昂贵,检查耗时长,金属植入患者不适用,对诊断对象均有一定局限性。
超声造影是临床上成熟有效的影像新技术,通过对比病变与周围肝脏组织增强模式的差异实现对病变的准确诊断。超声造影能清晰显示组织内微血管结构,且对病灶有无增强、增强强度及增强模式的观察是动态连续的,具有较好的时间分辨率[10]。超声造影剂是一种血池示踪剂,造影过程中存在于病变组织的血管腔内,造影剂通过肺组织代谢,不存在肝肾毒性,对肝肾功能不全者依然适用,过敏及超敏反应发生率低,与其他造影剂比较具备更高的耐受性及安全性。此外,造影剂可间隔较短时间重复注射,以便观察病灶灌注情况。
HEH疾病较罕见,目前并无统一标准治疗方案。治疗措施包括肝叶切除、肝移植、经导管肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)、免疫治疗和化疗等[11]。对于肝内局灶性病变,可行肝脏根治性切除手术, 患者术后预后良好[12]。但多数患者发现病变时肝内已有多发病灶甚至肝外转移,无法行肝脏部分切除术。本文中2例多发病灶,1例单发病灶,1例伴肺内多发转移。对此类患者可行肝移植术,术后复发率低,有研究报道其术后1、5和10年生存率分别为89%、80%和74%[13]。
| [1] |
Ellueuch N, Dahmani W, Aida Ben S, et al. Hepatic epithelioid hemangioendothelioma: A misdiagnosed rare liver tumor[J]. Presse Medicale, 2018, 47(2): 182-185. DOI:10.1016/j.lpm.2017.10.026 |
| [2] |
Ishak KG, Sesterhenn IA, Goodman ZD, et al. Epithelioid hemangioendothelioma of the liver: a clinicopathologic and follow-up study of 32 cases[J]. Hum Pathol, 1984, 15(9): 839-852. DOI:10.1016/S0046-8177(84)80145-8 |
| [3] |
Makhlouf HR, Ishak KG, Goodman ZD. Epithelioid hemangioendothelioma of the liver: A clinicopathologic study of 137 cases[J]. Cancer, 1999, 85(3): 562-582. DOI:10.1002/(SICI)1097-0142(19990201)85:3<562::AID-CNCR7>3.0.CO;2-T |
| [4] |
葛荣, 陈金平, 陈海仁, 等. 肺上皮样血管内皮细胞瘤的临床病理特征和预后[J]. 实用肿瘤杂志, 2019, 34(2): 160-163. |
| [5] |
徐亚丹, 王文平, 王群, 等. 超声造影与增强磁共振在诊断肝上皮样血管内皮细胞瘤中的联合应用[J]. 中华超声影像学杂志, 2018, 27(8): 692-697. DOI:10.3760/cma.j.issn.1004-4477.2018.08.013 |
| [6] |
Christoph K, Gerhard S, Christoph FD, et al. Contrast-enhanced imagine in hepatic epithelioid hemangioendothelioma: retrospective study of 10 patients[J]. Zeitschrift fur Gastroenterologie, 2019, 57(6): 753-766. DOI:10.1055/a-0886-0081 |
| [7] |
Miller WJ, Dodd GD, Federle MP, et al. Epithelioid hemangioendothelioma of the liver: imaging findings with pathologic correlation[J]. Am J Roentgenol, 1992, 159(7): 53-57. |
| [8] |
聂国军. 肝脏上皮样血管内皮瘤的影像特征分析[J]. 中国医疗器械信息, 2019, 25(8): 70-71. |
| [9] |
陈芳, 毛丹丹, 吴海, 等. 肝上皮样血管内皮瘤的MRI表现特征分析[J]. 中华肝胆外科杂志, 2020, 26(5): 356-359. DOI:10.3760/cma.j.cn113884-20190511-00147 |
| [10] |
杨学莲. 超声造影应用于肝脏占位性病变的价值研究进展[J]. 中国医疗器械信息, 2020, 26(1): 41-42. |
| [11] |
Rosenbeng A, Agulnik M. Epithelioid hemangioendothelioma: update on diagnosis and treatment[J]. Curr Treat Options Oncol, 2018, 19(4): 19. DOI:10.1007/s11864-018-0536-y |
| [12] |
温浩祥, 巫林伟, 何晓顺. 肝移植治疗肝上皮样血管内皮瘤的进展[J]. 中华肝胆外科杂志, 2019, 25(11): 875-878. |
| [13] |
Quirino L, Estelle F, Vincent K, et al. Hepatic epithelioid hemangioendothelioma and adult liver transplantation: proposal for a prognostic score based on the analysis of the ELTR-ELITA registry[J]. Transplantation, 2017, 101(3): 555-564. DOI:10.1097/TP.0000000000001603 |
 2021, Vol. 36
2021, Vol. 36


