文章信息
- 黄泽坚, 吕萍, 于宝丹, 方昶, 程庆
- Huang Zejian, Lv Ping, Yu Baodan, Fang Chang, Cheng Qing
- 靶向CD24单克隆抗体增强肝癌化疗敏感性的实验研究
- Monoclonal antibody targeting CD24 enhances chemotherapy sensitivity of hepatocellular carcinoma
- 实用肿瘤杂志, 2019, 34(3): 215-218
- Journal of Practical Oncology, 2019, 34(3): 215-218
基金项目
- 广东省省级科技计划项目(2014A020212235)
-
作者简介
-
黄泽坚(1980-), 男, 广东广州人, 主治医师, 硕士, 从事肝胆肿瘤基础与临床研究;
吕萍(1975-), 女, 广东广州人, 主治医师, 博士, 从事肝胆肿瘤基础与临床研究. -
通信作者
- 吕萍, E-mail: lvping75@163.com
-
文章历史
- 收稿日期:2018-05-12
2. 南方医科大学皮肤病医院临床与 实验研究中心, 广东 广州 510095;
3. 广州医科大学附属第一医院检验科, 广东 广州 510120;
4. 中山大学孙逸仙纪念医院心内科, 广东 广州 510120
2. Clinical and Experimental Research Center, Dermatology Hospital, Southern Medical University, Guangzhou 510095, China;
3. Department of Clinical Laboratory, The First Affiliated Hospital of Guangzhou Medical University, Guangzhou 510120, China;
4. Department of Cardiology, The Sun Yat-sen Memorial Hospital of Sun Yat-sen University, Guangzhou 510210, China
肝癌是我国常见的恶性肿瘤之一,占全球癌症发病率的6%和病死率的9%,是仅次于肺癌的第二大致死性癌症。中国肝癌的新增病例数和死亡病例数占全球的50%以上,发病率是欧美大部分地区的4倍[1]。分化抗原簇蛋白24(cluster of differentiation-24,CD24)是肝癌干细胞(cancer stem cells,CSCs)的功能性分子标志[2],CD24在调节肿瘤细胞的生长、增殖及迁移能力方面具有重要作用。CD24的表达量和表达模式与患者生存率和预后等密切相关[3-4]。
3E10是抗人CD24的特异性单克隆抗体。前期研究结果显示,3E10可以降低HuH-7细胞的耐药性、肿瘤干性和Janus激酶(Janus kinase,JAK)/信号转录与激活因子3(signal transducer and activator of transcription 3,STAT3)以及磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB或AKT)信号通路活性,进而增强HuH-7细胞对化疗药顺铂的敏感性[5]。本研究通过细胞及动物治疗实验进一步检测3E10对肝癌细胞侵袭和成瘤能力的影响,检测3E10联合顺铂对肝癌的治疗作用。
1 材料与方法 1.1 材料 1.1.1 细胞株人肝癌细胞HuH-7购自中国科学院细胞库。
1.1.2 实验动物CD-1®Nude无胸腺裸鼠购自北京维通利华公司。动物实验条件及过程符合国际实验动物评估和认可委员会(Association for Assessment and Accreditation of Laboratory Animal Care,AAALAC)相关标准[6]。
1.1.3 主要试剂和耗材DMEM培养液、胎牛血清、100×GlutaMax和100×青霉素-链霉素均购自美国ThermoFisher Scientific公司。抗CD24单克隆抗体(克隆号3E10)购自广州沃维公司。小鼠Normal IgG购自美国Merck公司。顺铂购自美国Sigma公司。Matrigel胶和transwell小室均购自美国Corning公司。
1.2 方法 1.2.1 细胞培养HuH-7细胞培养液为含10%胎牛血清、1×GlutaMax和1×青霉素-链霉素的DMEM培养液,培养条件为37 ℃、5% CO2恒温培养箱。状态良好的HuH-7细胞培养至80%融合度,0.25%胰蛋白酶消化,培养液终止、离心、重悬,用于后续实验。
1.2.2 侵袭实验和迁移实验采用Transwell实验(Matrigel侵袭检测法)检测HuH-7细胞的侵袭能力。采用8.0 μm孔径PET膜的小室,将小室放于24孔板内,冰浴条件下加入100 μL Matrigel,37 ℃、5% CO2温箱中包被30 min。每个小室内加入100 μL 3×105细胞/mL的无血清HuH-7细胞悬液,加入终浓度1 μg/mL的3E10抗体(3E10实验组)或终浓度为1 μg/mL的小鼠normal IgG(IgG对照组),下层5%血清/DMEM培养液诱导,37 ℃、5% CO2培养24 h或48 h后刮除PET膜上层未穿过的细胞,100%甲醇固定5 min,结晶紫染色,200倍显微镜下拍照并计数侵袭细胞数。迁移实验无需对小室进行Matrigel包被,其他步骤同侵袭实验。
1.2.3 成球实验HuH-7细胞用10%血清/DMEM培养液重悬细胞500个/mL,每孔接种细胞500个/mL至6孔板。加入终浓度1 μg/mL的3E10抗体(3E10实验组)或终浓度为1 μg/mL的小鼠normal IgG(IgG对照组),37 ℃、5% CO2培养2周。每2天更换1次培养液,同时加入相应抗体。统计克隆形成数。
1.2.4 治疗实验采用4~6周龄CD-1®Nude裸鼠,分为3组,每组5只。每只小鼠背部皮下注射HuH-7细胞2×106/0.1 mL PBS,接种后第5天开始治疗。3E10实验组为顺铂加3E10,尾静脉注射3E10(5 mg/kg),腹腔注射顺铂(1 mg/kg)。无治疗对照组(注射生理盐水)和IgG对照组[顺铂(腹腔注射1 mg/kg)加小鼠normal IgG(静脉注射5 mg/kg)]作为对照组。每周注射3次,共4周。每7天量取肿瘤大小,体积计算公式为V=4π ab2/3,其中V为体积,a为长半径,b为短半径。
1.3 统计学分析采用GraphPad Prism 6软件进行统计学分析。数据以均数±标准差(x±s)表示,组间比较采用配对t检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 靶向CD24抗体3E10下调HuH-7细胞的侵袭能力采用Matrigel侵袭检测法检验3E10对肝癌细胞HuH-7侵袭能力的影响(图 1)。3E10与HuH-7细胞共培养24 h可见细胞侵袭现象,与IgG对照组比较,3E10实验组侵袭细胞数量减少,抑制率为(68.36±4.28)%(P=0.002)。培养至48 h,3E10实验组侵袭细胞数低于IgG对照组,3E10对HuH-7细胞侵袭的抑制率为(36.40±6.95)%(P < 0.01)。
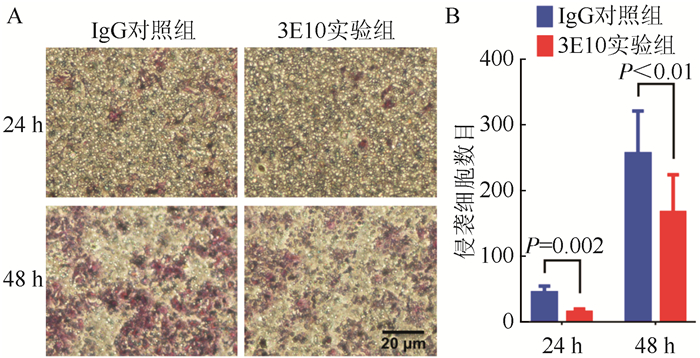
|
| 注A:Transwell实验图片(结晶紫染色×40);B:3E10抑制HuH-7肝癌细胞侵袭数目 图 1 靶向CD24抗体3E10对HuH-7细胞侵袭能力的影响 Fig.1 Effect of 3E10 on invasion of HuH-7 cells |
采用无Matrigel包被的Transwell法检测3E10对肝癌细胞HuH-7迁移能力的影响(图 2)。3E10与HuH-7细胞共培养48 h观察细胞迁移情况,与IgG对照组比较,3E10实验组迁移细胞数量减少,3E10对HuH-7细胞迁移的抑制率为(41.45±2.79)%(P=0.013)。
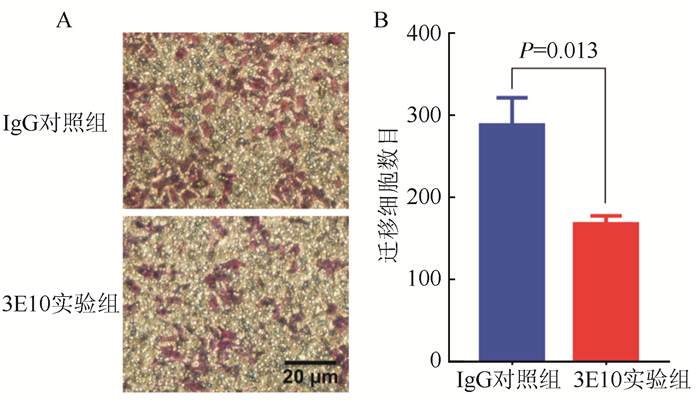
|
| 注A:共培养48 h后transwell实验图片(结晶紫染色×40);B:共培养48 h后3E10抑制HuH-7肝癌细胞迁移数目 图 2 3E10对HuH-7细胞迁移能力的影响 Fig.2 Effect of 3E10 on the migration of HuH-7 cells |
采用低密度细胞培养检测3E10对肝癌细胞HuH-7成球能力的影响(图 3)。3E10与HuH-7细胞共培养48 h观察细胞克隆形成情况,与IgG对照组比较,3E10实验组克隆数减少。3E10对HuH-7细胞成球的抑制率为(40.33±8.17)%(P=0.024)。
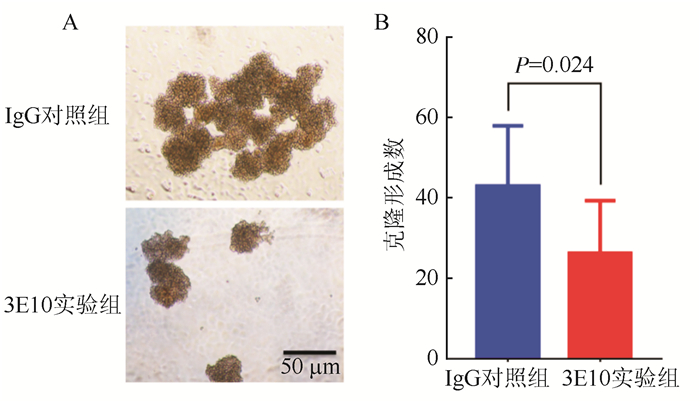
|
| 注A:共培养48 h后成球实验图片(×20);B:共培养48 h后3E10抑制HuH-7肝癌细胞克隆形成数目 图 3 3E10对HuH-7细胞成球能力的影响 Fig.3 Effect of 3E10 on the sphere formation of HuH-7 cells |
为进一步检测CD24抗体3E10在肝癌治疗上的应用价值,利用CD-1®Nude裸鼠构建肝癌皮下移植瘤动物模型,3E10联合化疗药顺铂给药治疗4周,记录分析肿瘤发展情况(图 4)。与IgG对照组比较,3E10实验组肿瘤大小下降,28 d抑制率由(37.50±6.48)%提高至(68.75±9.83)%(P=0.006)。
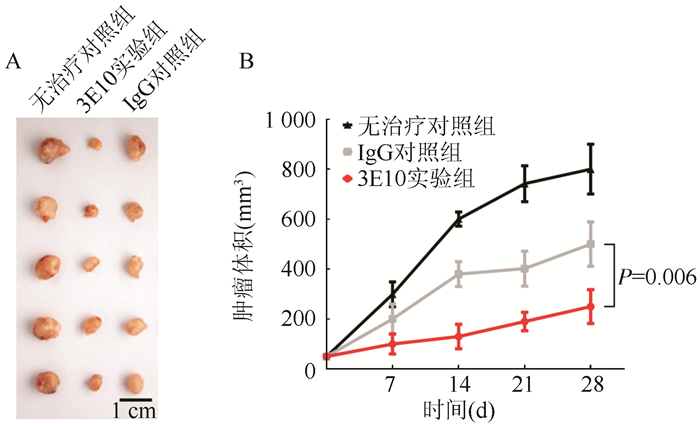
|
| 注A:第28天皮下移植瘤;B:3E10提高顺铂对裸鼠皮下肝癌移植瘤的抑制率 图 4 3E10联合顺铂对肝癌移植瘤化疗效果的影响 Fig.4 Effect of 3E10 on the chemotherapy efficacy of implanted hepatocellular carcinoma |
强耐药性的CSCs是肿瘤难以彻底治愈的重要原因,以杀伤CSCs为目的的治疗策略是目前肿瘤治疗的重要研究方向[5]。美国癌症研究协会建议成功的癌症治疗应该清除CSCs,包括抑制CSCs的自我更新能力或诱导CSCs分化为对常规化疗药物更敏感的非肿瘤起源细胞。
CD24是肝癌CSCs的功能性分子标志物[2]。CD24的表达量和表达模式与患者生存率和预后等密切相关。CD24在调节肿瘤细胞的生长、增殖及迁移能力方面也具有重要作用[3-4]。因此,CD24被越来越多地作为肿瘤靶向治疗的靶标来设计和研究新的药物,针对CD24分子对膀胱癌、结肠癌和胰腺癌进行的治疗研究均获得正面的结果[7-8],但是尚未见到针对肝癌CD24分子治疗的报道。
单克隆抗体药是肿瘤靶向治疗的主要药物之一[9]。自1997年以来由美国FDA批准的有30余个。3E10是靶向CD24的单克隆抗体,前期报道3E10可以通过降低肝癌HuH-7细胞的耐药性和肿瘤干性等增强HuH-7细胞对顺铂的敏感性,使顺铂对HuH-7细胞的增殖抑制率提高2倍以上[10]。在此基础上,本研究进一步探究3E10联合顺铂在肝癌治疗上的应用价值。
超过90%的恶性肿瘤患者最终死于肿瘤转移或复发。肿瘤转移是一个复杂的过程,肿瘤细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT),进入淋巴或血液循环系统,再出循环系统定位到其他组织器官位置并增殖。这一过程与肿瘤细胞的侵袭能力、迁移能力和克隆形成能力等密切相关,是肿瘤细胞恶性的重要生物学指标,同时也是评价抗肿瘤药物有效性的重要指标[11-12]。结果表明,靶向CD24抗体3E10可降低HuH-7细胞的这些能力。进一步,在裸鼠皮下肝癌移植瘤治疗实验中,3E10可以提高肝癌对顺铂的化疗敏感性,增强顺铂抑制和治疗小鼠肝癌移植瘤的效果。
本研究提示CD24可以作为肝癌治疗的新靶点,体现了靶向CD24抗体3E10在肝癌治疗上的潜在应用价值。这为理解和阐述肝癌致病机制和开发更为有效的肝癌治疗方法提供了实验依据。
| [1] |
Stewart BW, Wild CP. World Cancer Report 2014[M]. WHO: International Agency for Research on Cancer, 2014: 403-413.
|
| [2] |
Castelli G, Pelosi E, Testa U. Liver cancer:Molecular characterization, clonal evolution and cancer stem cells[J]. Cancers (Basel), 2017, 9(9): E127. |
| [3] |
Muinao T, Deka Boruah HP, Pal M. Diagnostic and prognostic biomarkers in ovarian cancer and the potential roles of cancer stem cells-An updated review[J]. Exp Cell Res, 2018, 362(1): 1-10. |
| [4] |
Liu G, Liu GX, Fang Y, et al. Clinicopathological and prognostic value of CD24 expression in breast cancer:a meta-analysis[J]. Int J Biol Markers, 2017, 32(2): 182-189. DOI:10.5301/jbm.5000254 |
| [5] |
Snyder V, Reed-Newman TC, Arnold L, et al. Cancer stem cell metabolism and potential therapeutic targets[J]. Front Oncol, 2018, 8: 203. DOI:10.3389/fonc.2018.00203 |
| [6] |
National Research Council. Guide for the care and use of laboratory animals[M]. 8th Ed. Washington: The National Academies Press, 2011: 161-167.
|
| [7] |
van Kessel KE, Zuiverloon TC, Alberts AR, et al. Targeted therapies in bladder cancer:an overview of in vivo research[J]. Nat Rev Urol, 2015, 12(12): 681-694. DOI:10.1038/nrurol.2015.231 |
| [8] |
Shapira S, Pleban S, Kazanov D, et al. Terpinen-4-ol:A novel and promising therapeutic agent for human gastrointestinal cancers[J]. PLoS One, 2016, 11(6): e0156540. DOI:10.1371/journal.pone.0156540 |
| [9] |
Hafeez U, Gan HK, Scott AM. Monoclonal antibodies as immunomodulatory therapy against cancer and autoimmune diseases[J]. Curr Opin Pharmacol, 2018, 5(41): 114-121. |
| [10] |
黄泽坚, 方昶, 于宝丹, 等. 靶向CD24分子增强肝癌细胞HuH-7的化疗敏感度[J]. 肿瘤防治研究, 2018, 45(8): 540-544. DOI:10.3971/j.issn.1000-8578.2018.17.1484 |
| [11] |
Steeg PS. Targeting metastasis[J]. Nat Rev Cancer, 2016, 16(4): 201-218. DOI:10.1038/nrc.2016.25 |
| [12] |
Fidler IJ, Kripke ML. The challenge of targeting metastasis[J]. Cancer Metastasis Rev, 2015, 34(4): 635-641. DOI:10.1007/s10555-015-9586-9 |
 2019, Vol. 34
2019, Vol. 34


