文章信息
- 李鹤, 赵燕, 何婧, 邓欣雨
- Li He, Zhao Yan, He Jing, Deng Xinyu
- 非小细胞肺癌患者Th22细胞水平及临床意义
- Th22 cell level in patients with non-small-cell lung cancer and its clinical significance
- 实用肿瘤杂志, 2020, 35(6): 495-500
- Journal of Practical Oncology, 2020, 35(6): 495-500
基金项目
- 国家自然科学基金(81600060)
-
作者简介
- 李鹤(1984-),男,四川自贡人,住院医师,硕士,从事非小细胞肺癌临床诊治研究.
-
通信作者
- 邓欣雨, E-mail:sinvee@126.com
-
文章历史
- 收稿日期:2019-10-11
根据国家癌症中心发布的最新全国癌症统计资料显示,肺癌是我国居民发病率和病死率最高的恶性肿瘤,并且随着人口老年化和环境因素的变化,发病率和死亡例数呈逐年升高趋势[1]。在肺癌类型中,非小细胞肺癌(non-small-cell lung cancer,NSCLC)占80%~85%,5年生存率 < 15%。因此,明确NSCLC发生及进展的相关机制和有效评估NSCLC病情严重程度是提高NSCLC治疗效果及预后的关键。肿瘤作为一类炎性反应疾病,其发生及进展与肿瘤局部免疫微环境和机体免疫功能紊乱密切相关,而不同类型的CD4+T细胞亚群在其中扮演重要作用[2-3]。已有研究表明,辅助型T细胞17(T helper cell 17, Th17)细胞在NSCLC患者外周血中高表达,可促进白细胞介素-6(interleukin-6, IL-6)和IL-17等炎性因子合成与分泌,过度的炎性反应促进肿瘤细胞的浸润与血行转移[4]。与Th17细胞同类型的Th22细胞,通过特异度分泌IL-22,参与多种炎性反应疾病的发生和发展过程[5-6]。然而,NSCLC患者体内Th22细胞表达水平仍不明确。本研究通过检测与分析NSCLC患者中Th22细胞及相关细胞因子的表达水平,评估其与NSCLC患者病理特征和临床分期的相关性。
1 资料与方法 1.1 研究对象选取2017年1月至2019年5月于重庆医科大学附属第二医院呼吸与危重症医学科收治的经病理确诊的250例NSCLC患者作为研究对象(NSCLC组)。其中,男性138例,女性112例;年龄45~78岁,(62.5±9.8)岁。根据肿瘤组织学分型,鳞癌110例,腺癌105例,腺鳞癌20例,其他15例。根据临床分期,Ⅰ期65例,Ⅱ期70例,Ⅲ期64例,Ⅳ期51例。所有患者均未接受过放化疗及相关手术治疗。排除标准:各种急慢性感染及合并自身免疫性疾病的患者;近期使用过激素或免疫抑制剂的患者;存在其他部位恶性肿瘤患者。同时选取50例同期行健康体检者为对照组。两组间在性别、年龄和吸烟史等方面比较,差异均无统计学意义(均P > 0.05,表 1)。
| 组别 | 性别(例) | 年龄(岁,x±s) | 吸烟史(例) | ||
| 男性 | 女性 | 吸烟 | 不吸烟 | ||
| 对照组(n=50) | 27 | 23 | 61.9±9.2 | 26 | 24 |
| NSCLC组(n=250) | 138 | 112 | 62.5±9.8 | 131 | 119 |
| χ2/t值 | 0.024 | 0.399 | 0.003 | ||
| P值 | 0.876 | 0.690 | 0.959 | ||
| 注 NSCLC:非小细胞肺癌(non-small-cell lung cancer) | |||||
荧光激活细胞分选(fluorescent-activated cell sorting, FACS)型流式细胞仪购自美国BD公司。RPMI-1640细胞培养液、离子霉素、莫能霉素、佛波酯、淋巴细胞分离液、细胞固定液及细胞破膜剂均购自美国eBioscience公司。胎牛血清购自美国HyClone公司。单克隆抗体[白细胞分化抗原4(leukocyte differentiation antigen 4, CD4)和IL-22]购自美国Invitrogen公司。IL-22和IL-6酶联免疫试剂盒购自中国武汉博士德公司。
1.3 方法 1.3.1 标本采集与处理抽取各组患者静脉血4 mL,置于肝素抗凝管中,加入等体积人淋巴细胞分离液,经1 831 r/min离心15 min后,得到外周血单个核细胞(peripheral blood mononuclear cell, PBMC)。采用纤支镜收集NSCLC患者组织标本包括癌灶组织和癌旁组织。取上述组织标本500 mg,采用机械分离及酶消化后,梯度离心制备肺组织单个核细胞悬液,用于流式细胞仪检测。同时取100 mg肺组织标本,经研磨后,肺组织匀浆用于行酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)检测炎性细胞因子。
1.3.2 外周血及肺组织样本Th22细胞水平检测抽取各组患者200 μL外周血单个核细胞或NSCLC组患者肺组织样本单个核细胞悬液,加入等体积的RPMI-1640培养液,接种于培养板,同时加入1 μg/mL佛波酯30 μL、50 μg/mL离子霉素16 μL及0.1 mg/mL莫能霉素16 μL,培养箱中孵育4 h。取100 μL上述培养液,加入抗人CD4单克隆抗体10 μL,震荡混匀后室温避光孵育15 min,加入100 μL细胞固定液。再次室温避光孵育15 min后,经1 831 r/min离心5 min,弃上清后,加入100 μL破膜液,同时加入IL-22单克隆抗体10 μL,震荡混匀后,待上机检测。
1.3.3 炎性细胞因子的检测采用ELISA试剂盒测定两组患者外周血上清液及肺组织(癌灶组织和癌旁组织)上清液IL-22及IL-6的水平。
1.4 统计学分析采用SPSS 19.0统计学软件进行数据分析与处理。计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,而多组间比较采用单因素方差分析。采用Spearman相关法分析Th22细胞与IL-22和IL-6水平的相关性。运用Graphpad软件作受试者工作特征(receiver operating characteristic, ROC)曲线分析,计算Th22细胞的ROC曲线下面积(area under curve, AUC)、最佳工作点(optimal operating point, OOP)、敏感度及特异度。以P < 0.05为差异具有统计学意义。
2 结果 2.1 NSCLC组与对照组外周血Th22细胞比例及相关细胞因子水平比较与对照组比较,NSCLC组患者外周血Th22细胞比例以及IL-22和IL-6水平均升高(均P < 0.05,表 2,图 1)。
| 组别 | Th22 (%) | IL-22 (pg/mL) | IL-6 (pg/mL) |
| 对照组(n=50) | 1.6±0.8 | 15.1±5.8 | 11.5±7.0 |
| NSCLC组(n=250) | 8.7±2.6 | 38.2±12.1 | 29.7±8.6 |
| t值 | 19.110 | 13.190 | 14.060 |
| P值 | < 0.01 | < 0.01 | < 0.01 |
| 注 Th22:辅助型T细胞22(T helper cell 22);IL-22:白细胞介素-22(interleukin-22);NSCLC:非小细胞肺癌(non-small-cell lung cancer) | |||
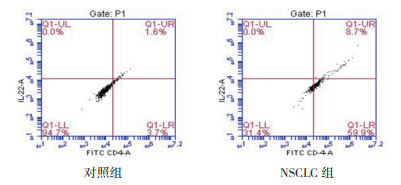
|
| 图 1 NSCLC组与对照组外周血Th22细胞比例水平比较 Fig.1 Comparison of the proportion of Th22 cells in peripheral blood in the NSCLC and control groups |
NSCLC组不同组织间Th22细胞比例以及IL-22和IL-6水平比较显示,癌灶组织Th22细胞比例、IL-22水平及IL-6水平均高于外周血和癌旁组织(均P < 0.05),而外周血与癌旁组织间上述指标水平比较,差异均无统计学意义(均P > 0.05),见表 3。
| 组织类型 | Th22 (%) | IL-22 (pg/mL) | IL-6 (pg/mL) |
| 外周血(n=250) | 8.7±2.6 | 38.2±12.1 | 29.7±8.6 |
| 癌旁组织(n=250) | 8.4±2.9 | 40.5±13.2 | 31.2±7.9 |
| 癌灶组织(n=250) | 14.2±3.0 | 58.6±10.3 | 45.1±7.1 |
| F值 | 330.900 | 219.400 | 289.500 |
| P值 | < 0.01 | < 0.01 | < 0.01 |
| 注 Th22:辅助型T细胞22(T helper cell 22);IL-22:白细胞介素-22(interleukin-22) | |||
NSCLC组不同病理类型鳞癌、腺癌、腺鳞癌及其他类型患者外周血、癌旁组织及癌灶组织中Th22细胞比例、IL-22水平及IL-6水平比较,差异均无统计学意义(均P > 0.05,表 4)。
| 病理类型 | Th22 (%) | IL-22 (pg/mL) | IL-6 (pg/mL) | ||||||||
| 外周血 | 癌旁组织 | 癌灶组织 | 外周血 | 癌旁组织 | 癌灶组织 | 外周血 | 癌旁组织 | 癌灶组织 | |||
| 鳞癌(n=110) | 8.3±2.8 | 8.3±2.2 | 13.8±3.7 | 36.9±11.8 | 42.1±12.5 | 57.0±12.1 | 28.8±9.2 | 32.5±8.3 | 43.5±8.0 | ||
| 腺癌(n=105) | 8.5±3.0 | 8.2±2.0 | 14.5±4.1 | 38.7±12.6 | 40.2±10.7 | 58.7±11.5 | 30.6±8.1 | 30.8±7.6 | 45.2±7.8 | ||
| 腺鳞癌(n=20) | 9.0±2.1 | 8.9±2.6 | 14.1±3.5 | 40.1±10.8 | 39.8±12.1 | 57.2±10.2 | 28.9±9.0 | 31.3±7.3 | 44.6±7.4 | ||
| 其他(n=15) | 9.1±2.2 | 8.8±2.5 | 14.7±3.9 | 37.3±10.1 | 41.2±11.4 | 58.8±10.6 | 29.9±8.5 | 30.3±7.1 | 45.7±8.0 | ||
| F值 | 0.623 | 0.826 | 0.685 | 0.648 | 0.728 | 1.176 | 1.402 | 0.985 | 0.980 | ||
| P值 | 0.601 | 0.481 | 0.562 | 0.585 | 0.536 | 0.320 | 0.243 | 0.400 | 0.403 | ||
| 注 Th22:辅助型T细胞22(T helper cell 22);IL-22:白细胞介素-22(interleukin-22) | |||||||||||
Ⅲ~Ⅳ期NSCLC患者外周血、癌旁组织及癌灶组织Th22细胞比例、IL-22水平及IL-6水平较Ⅰ~Ⅱ期NSCLC患者升高,差异均具有统计学意义(均P < 0.05,表 5)。
| 临床分期 | Th22 (%) | IL-22 (pg/mL) | IL-6 (pg/mL) | ||||||||
| 外周血 | 癌旁组织 | 癌灶组织 | 外周血 | 癌旁组织 | 癌灶组织 | 外周血 | 癌旁组织 | 癌灶组织 | |||
| Ⅰ~Ⅱ期(n=135) | 7.5±2.1 | 7.3±1.5 | 13.0±2.3 | 34.6±9.7 | 35.0±8.7 | 50.2±9.3 | 24.1±7.6 | 29.2±7.4 | 39.8±6.8 | ||
| Ⅲ~Ⅳ期(n=115) | 9.0±2.0 | 8.8±1.6 | 16.8±2.4 | 43.1±9.5 | 44.2±9.1 | 60.5±8.3 | 33.2±8.0 | 36.7±6.6 | 48.1±7.0 | ||
| t值 | 5.753 | 7.642 | 12.760 | 6.971 | 8.159 | 9.167 | 9.210 | 8.391 | 9.489 | ||
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | ||
| 注 Th22:辅助型T细胞22(T helper cell 22);IL-22:白细胞介素-22(interleukin-22) | |||||||||||
NSCLC组患者外周血Th22细胞比例与IL-22(r=0.815,P < 0.01)和IL-6(r=0.662,P=0.012)水平均呈正相关;癌灶组织Th22细胞比例与IL-22(r=0.864,P < 0.01)和IL-6(r=0.710,P=0.008)水平也均呈正相关;而癌旁组织Th22细胞比例与IL-22(r=0.168,P=0.211)和IL-6(r=0.104,P=0.308)水平均无相关性。
2.6 Th22细胞比例对NSCLC患者临床分期预测的ROC曲线分析通过以Th22细胞比例来评估NSCLC患者临床分期绘制ROC曲线显示,癌灶组织Th22细胞比例的AUC为0.864(95%CI:0.776~0.953),OOP为15.2%,提示癌灶组织Th22细胞比例 > 15.2 %,此时预测NSCLC患者临床分期严重程度的敏感度为79.5%,特异度为83.1%,均高于外周血及癌旁组织(图 2)。
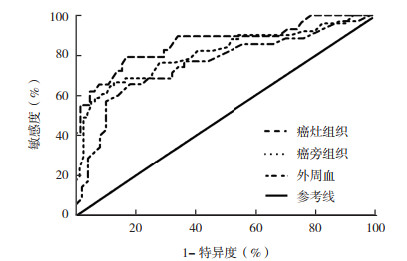
|
| 图 2 NSCLC患者外周血及不同组织中Th22细胞比例的ROC曲线 Fig.2 ROC curves of Th22 cell proportion in peripheral blood and different tissues of NSCLC patients |
肿瘤患者机体免疫功能异常与肿瘤的发生、发展及预后密切相关[7]。NSCLC患者早期无明显症状,但随着病情的进展,其生存率呈现进行性降低。目前,对于NSCLC患者病情严重程度,临床常采用肿瘤分期进行评估,该方法虽特异度较高,但往往存在一定的滞后性,无法提前进行评估。CD4+ T淋巴细胞作为细胞免疫的重要组分,在特定细胞因子如转化生长因子-β及IL-6的调控下可分化为Th1、Th2、Th17及Th22等辅助性T细胞亚群。其中,Th1、Th2及Th17均参与肿瘤的发生和发展过程,上述辅助性T细胞亚群的升高,可过度分泌相关细胞因子如IL-1β和IL-17等,进一步促进肿瘤局部血管新生及肿瘤增殖与转移[8]。作为新型的T淋巴细胞亚群Th22细胞,其在NSCLC患者中的表达水平以及在NSCLC发生和发展中的作用尚不明确。
机体免疫功能的异常在肿瘤的发生和发展中扮演重要作用[9]。肿瘤小鼠模型及肿瘤患者外周血和相应组织中均高表达Th17细胞及特异性细胞因子IL-17,表达水平与肿瘤的分期、治疗效果及预后密切相关[10-11]。在NSCLC患者中,高表达的Th17细胞与肿瘤的早期转移相关,可能与Th17细胞分泌相关细胞因子、激活下游炎性通路和促进肿瘤血管新生有关[12]。Th22细胞也是CD4+淋巴细胞亚群,促进炎性反应的作用与Th17细胞类似。在脓毒症情况下,Th22特异性分泌的IL-22可促进炎性细胞如中性粒细胞及单核巨噬细胞向靶器官聚集,损伤靶器官功能[13]。外周血Th22细胞参与多种自身免疫性疾病的发展过程,可作为影响患者病情严重程度及预后的独立危险因素[5-6]。本研究发现,与对照组比较,NSCLC患者外周血Th22细胞和相关细胞因子IL-22及IL-6水平升高,表明NSCLC的发生可能与Th22细胞活化和触发炎性反应有关。进一步根据NSCLC患者病理类型及分期进行分组研究显示,虽然不同病理类型的NSCLC患者外周血、癌灶组织和癌旁组织Th22细胞及相关细胞因子IL-22及IL-6水平相近,但随着NSCLC患者病情严重程度(临床分期)的增加,上述Th22细胞及相关细胞因子水平增加,表明Th22细胞参与NSCLC的进展过程。本研究还显示,癌灶组织Th22细胞ROC AUC较大,高于外周血及癌旁组织,表明Th22细胞水平在一定程度上可反映NSCLC患者病情严重程度。Th22细胞是机体炎性反应持续放大的重要环节。抑制Th22细胞分化可降低炎性反应,改善自身免疫性疾病及相关恶性肿瘤患者临床治疗效果及预后[14-15]。检测外周血、癌灶组织及癌旁组织Th22细胞及相关细胞因子水平不仅可用于评估NSCLC患者临床分期,同时还可为NSCLC患者的治疗提供新的靶点。
综上所述,Th22细胞水平与NSCLC的发生及病情的进展密切相关,通过检测Th22细胞水平,可为进一步探索NSCLC的发病机制及相关治疗提供新的思路和靶点。
| [1] |
邢辰. 国家肿瘤防控机制初步形成[J]. 中华医学信息导报, 2018, 33(20): 9. |
| [2] |
汤井双, 徐为. 术后肠内外营养支持对食管癌患者免疫力与炎性反应的影响[J]. 实用肿瘤杂志, 2019, 34(2): 155-159. |
| [3] |
姜怡, 蔡雨晴, 刘苓霜. sCTLA-4与恶性肿瘤关系的研究进展[J]. 实用肿瘤杂志, 2019, 34(1): 94-98. |
| [4] |
Song L, Ma S, Chen L, et al. Long-term prognostic significance of interleukin-17-producing T cells in patients with non-small cell lung cancer[J]. Cancer Sci, 2019, 110(7): 2100-2109. DOI:10.1111/cas.14068 |
| [5] |
唐艳, 朱良琼, 周丽, 等. 外周血Th22细胞在类风湿性关节炎中的作用及临床意义[J]. 河北医学, 2019, 25(6): 1027-1030. |
| [6] |
甄瑾, 马翔凌, 田晓艳, 等. 外周血Th22/Treg细胞在多发性硬化患者中的水平及与严重程度的关系[J]. 中国老年学杂志, 2018, 38(19): 4701-4703. |
| [7] |
Racioppi L, Nelson ER, Huang W, et al. CaMKK2 in myeloid cells is a key regulator of the immune-suppressive microenvironment in breast cancer[J]. Nat Commun, 2019, 10(1): 2450. DOI:10.1038/s41467-019-10424-5 |
| [8] |
Saleh ME, Gadalla R, Hassan H, et al. The immunomodulatory role of tumor Syndecan-1 (CD138) on ex vivo tumor microenvironmental CD4+ T cell polarization in inflammatory and non-inflammatory breast cancer patients[J]. PLoS One, 2019, 14(5): e0217550. DOI:10.1371/journal.pone.0217550 |
| [9] |
Bottomley MJ, Thomson J, Harwood C, et al. The role of the immune system in cutaneous squamous cell carcinoma[J]. Int J Mol Sci, 2019, 20(8): 2009. DOI:10.3390/ijms20082009 |
| [10] |
Pastille E, Wasmer MH, Adamczyk A, et al. The IL-33/ST2 pathway shapes the regulatory T cell phenotype to promote intestinal cancer[J]. Mucosal Immunol, 2019, 12(4): 990-1003. DOI:10.1038/s41385-019-0176-y |
| [11] |
胡云双, 周旺展, 张颖. Th22和Th17细胞在宫颈癌患者外周血中的表达[J]. 温州医科大学学报, 2019, 49(3): 210-213. |
| [12] |
周国忠, 余诗怡, 钟波. Th1/Th2/Th17型细胞因子在非小细胞肺癌治疗过程中的临床意义[J]. 中华临床实验室管理电子杂志, 2019, 7(2): 71-74. |
| [13] |
杨英, 马春茂, 兰德彬. Th22细胞在评估脓毒症病情及预后中的临床意义[J]. 医学研究杂志, 2018, 47(5): 161-163, 187. |
| [14] |
Rahimi K, Ahmadi A, Hassanzadeh K, et al. Targeting the balance of T helper cell responses by curcumin in inflammatory and autoimmune states[J]. Autoimmun Rev, 2019, 18(7): 738-748. DOI:10.1016/j.autrev.2019.05.012 |
| [15] |
Chen X, Wang Y, Wang J, et al. Accumulation of T-helper 22 cells, interleukin-22 and myeloid-derived suppressor cells promotes gastric cancer progression in elderly patients[J]. Oncol Lett, 2018, 16(1): 253-261. |
 2020, Vol. 35
2020, Vol. 35


