文章信息
- 孟磊, 潘晓芳, 张博, 刘琳, 王坤, 王晶, 赵俊军
- Meng Lei, Pan Xiaofang, Zhang Bo, Liu Lin, Wang Kun, Wang Jing, Zhao Junjun
- 剪切波弹性成像评估乳腺良恶性肿瘤及其与乳腺癌预后因素的相关性
- Evaluation of shear wave elastography for benign and malignant breast tumors and its correlation with prognostic factors of breast cancer
- 实用肿瘤杂志, 2022, 37(6): 566-571
- Journal of Practical Oncology, 2022, 37(6): 566-571
-
通信作者
- 潘晓芳,E-mail:xfpan801@163.com
-
文章历史
- 收稿日期:2021-07-22
2. 大连理工大学附属大连市中心医院乳腺外科, 辽宁 大连 116033;
3. 大连理工大学附属大连市中心医院病理科, 辽宁 大连 116033
2. Department of Breast Surgery, Central Hospital of Dalian University of Technology, Dalian 116033, China;
3. Department of Pathology, Central Hospital of Dalian University of Technology, Dalian 116033, China
乳腺癌作为女性最常见的恶性肿瘤,发病率逐年攀升且趋于年轻化,严重威胁女性的身心健康。随着超声影像技术的不断发展,更多的隐匿性乳腺癌、导管内癌及微小浸润性乳腺癌被早期发现,使得超声检查成为乳腺疾病早期筛查的首选影像学手段。传统超声通常将无法排除恶性可能的肿块归为乳腺影像报告及数据系统(Breast Imaging Reporting And Data System,BI-RADS)4类,指南建议此类肿块需进行穿刺活检或手术切除。为弥补传统超声不能客观量化评估肿块组织软硬度的不足,二维剪切波弹性成像(two-dimensional shear wave elastography,2D-SWE)作为一种新兴的弹性成像技术, 在乳腺疾病良恶性诊断中具有独特的优势,由于弹性参数及其界值尚未建立统一标准,目前仍为国内外超声医学领域研究热点[1-2]。乳腺癌的早期发现与治疗对患者的生活质量及生存预后至关重要,而预后因素决定其生物学行为、组织病理学改变以及临床治疗方向等。乳腺癌作为异质性疾病,在组织学分级、腋窝淋巴结转移情况和分子亚型等方面存在差异。国内外多项研究证实,超声特征与乳腺癌的组织学分级和分子亚型有关。然而,使用定量的SWE参数作为预测乳腺癌预后的研究较少。本研究旨在确定定量SWE参数[平均弹性(mean elasticity,Emean)、最大弹性(maximum elasticity,Emax)和弹性比(elasticity ratio,Eratio; 为Emean与脂肪组织平均值的比值)]的诊断效能、确定具有最高判别性能的参数以及SWE定量参数与组织学预后因素之间的关系。
1 资料与方法 1.1 一般资料选取本院自2019年11月至2020年4月期间罹患乳腺肿瘤的女性患者158例共184个结节,年龄14~84岁,(51.3±12.2)岁;结节最大直径5.0~83.0 mm,(16.7±11.9)mm。入组标准:(1)全部于术前接受超声及实时SWE检查;(2)乳腺病灶经手术或穿刺活检已获得完整病理结果(乳腺癌患者有免疫组织化学检查结果);(3)所有患者在检查前未接受任何形式的治疗。排除标准:(1)结节内存在超声可视粗大钙化;(2)做过乳腺假体植入或脂肪填充;(3)病理结果资料不完整。所有入选患者均经本院伦理委员会审核通过并签署知情同意书。
1.2 仪器与方法 1.2.1 仪器选择传统超声及2D-SWE检查均采用法国SuperSonic公司Aixplorer超声诊断系统。常规二维超声和2D-SWE检查使用线阵探头(频率4~15 MHz)。
1.2.2 乳腺传统超声检查患者取仰卧位,充分暴露双侧乳房及腋窝。平静呼吸,选择乳腺检查条件,顺时针方向扫查乳腺,调整仪器参数以取得最佳图像效果,存储相应超声图像并记录数据。由具有>10年工作经验的高年资超声医师根据BI-RADS[3]对病变进行分类。
1.2.3 乳腺2D-SWE超声检查启动SWE成像程序,SWE成像观察区域包括乳腺病变组织及周边部分正常乳腺或脂肪组织。观察区域中硬度分布显示为彩色图,利用定量测量工具“Q-BoxRatio”选取感兴趣区域(region of interest,ROI),将2 mm取样框置于病灶最硬处及正常脂肪组织处,记录观察区域中Emax、Emean和Eratio。同一病灶重复测量3次,记录并计算平均值(图 1)。
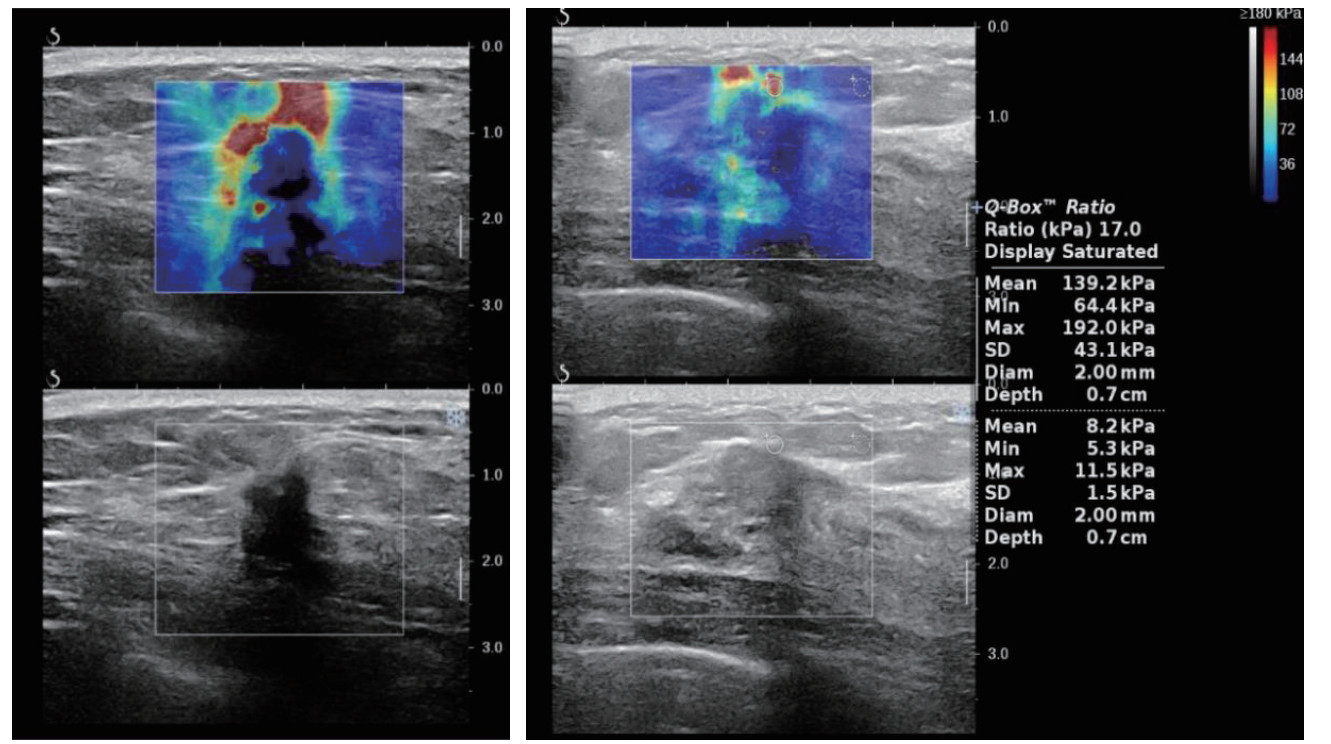
|
| 注 二维剪切波弹性横断面显示,病灶及周围Emax为192.0 kPa,Emean为139.2 kPa,Eratio为17.0;病理证实为浸润性癌;Emax:最大弹性(maximum elasticity);Emean:平均弹性(mean elasticity);Eratio:弹性比(elasticity ratio;Emean与脂肪组织平均值的比值) 图 1 乳腺癌患者剪切波弹性成像图 Fig.1 Shear wave elastography of a breast cancer patient |
将2D-SWE检查获得的Emax、Emean和Eratio定量参数对传统超声分类进行优化,低于截断值的将BI-RADS分类进行降低1类处理,降低类别下限为BI-RADS 3类;定量参数值高于截断值的将BI-RADS分类进行升高1类处理,升高类别上限为BI-RADS 5类。
1.2.5 乳腺癌病理结果病理组织学分级依据2012年世界卫生组织(World Health Organization,WHO)乳腺肿瘤分级标准[4],采用全自动免疫组织化学及原位杂交染色机对雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)及Ki-67表达进行检测。分子亚型标准依据2015版《中国抗癌协会乳腺癌诊治指南与规范》将乳腺癌分为4型[5]:Luminal A型[ER和(或)PR阳性,HER2阴性,Ki-67低表达]、Luminal B型(不满足Luminal A型条件的Luminal样肿瘤)、Erb-B2过表达型(HER2蛋白过表达,ER和PR阴性)和Basal-like型(ER阴性,PR阴性,HER2阴性)。组织分级采用改良的Scarff-Bloom-Richardson分级系统,根据癌组织中小管或腺体形成、细胞核多形性和核分裂象技术进行分级。每项指标都分别评分1~3分,将这3项指标得分相加:3~5分为Ⅰ级;6~7分为Ⅱ级;8~9分为Ⅲ级。
1.3 统计学分析使用SPSS22.0软件及MedCalc15.8软件分析数据。计量资料采用中位数(四分位间距)[M(Q1~Q3)]表示,组间比较使用Mann-Whitney U检验。以病理结果为金标准,绘制各参数值的受试者工作特征(receiver operating characteristic,ROC)曲线, 根据最佳诊断截断值调整BI-RADS分类,并比较曲线下面积(area under the curve,AUC)、敏感度、特异度和准确度等指标,评价诊断效能。以P<0.05为差异具有统计学意义。
2 结果 2.1 基本临床特征184个乳腺肿瘤中,恶性肿瘤85个,良性肿瘤99个。恶性肿瘤包括浸润性导管癌70个、导管内癌7个和黏液癌8个。良性肿瘤包括纤维腺瘤44个、腺病40个、导管内乳头状瘤13个和肉芽肿性乳腺炎2个。恶性肿瘤中,Luminal A型26个(32.5%),Luminal B型40个(50.0%),Erb-B2过表达型10个(12.5%),Basal-like型4个(5.0%),5例未查到明确免疫组织化学结果在预后因素分析中被排除。
2.2 2D-SWE定量参数鉴别乳腺肿瘤良恶性的诊断效能乳腺恶性肿瘤2D-SWE定量参数Emax、Emean和Eratio均高于良性肿瘤(均P<0.05)。由ROC曲线得出的Emax、Emean和Eratio的AUC分别为0.943、0.929和0.875,其中Emax的AUC最大,最优截断值为55.13 kPa。以Emax最佳截断值校正BI-RADS分类后,根据ROC最大约登指数判定2种BI-RADS分类良恶性最佳分界点均为4A-4B类;与优化前比较,敏感度(95.3% vs 87.1%)、特异度(88.9% vs 63.6%)和准确度(91.8% vs 74.5%)均提高(均P<0.05),阴性预测值(95.7% vs 85.1%)和阳性预测值(88.0% vs 67.3%)也有所提高(表 1)。Emax、Emean和Eratio的ROC曲线有交叉,应用MATLAB统计软件进行统计学分析后,得出三组参数效能最高的为Emax。
| 诊断效能指标 | 常规超声BI-RADS分类 | 经2D-SWE Emax优化的BI-RADS分类 | P值 |
| AUC | 0.843 | 0.921 | <0.05 |
| 标准差 | 0.029 | 0.023 | |
| 95%CI | 0.783~0.893 | 0.876~0.966 | |
| 敏感度(%) | 87.1 | 95.3 | <0.01 |
| 特异度(%) | 63.6 | 88.9 | <0.01 |
| 约登指数 | 0.507 | 0.842 | |
| 阳性预测值(%) | 67.3 | 88.0 | |
| 阴性预测值(%) | 85.1 | 95.7 | |
| 准确度(%) | 74.5 | 91.8 | <0.01 |
| 注 BI-RADS:乳腺影像报告与数据系统(Breast Imaging Reporting And Data System);2D-SWE:二维剪切波弹性成像(two-dimensional shear wave elastography);Emax: 最大弹性(maximum elasticity);AUC:曲线下面积(area under the curve) | |||
85例乳腺癌患者中25例伴有腋窝淋巴结转移。腋窝淋巴结转移阳性组与阴性组Emax(P=0.001)、Emean(P=0.002)和Eratio(P=0.030)组间比较,差异均具有统计学意义(表 2)。分子分型Luminal A型、Luminal B型、Erb-B2过表达型和Basal-like型Emax(P=0.384)、Emean(P=0.540)和Eratio(P=0.414)组间比较,差异均无统计学意义。乳腺癌组织分级Ⅰ级、Ⅱ级和Ⅲ级Eratio组间比较,差异具有统计学意义(P=0.009);而Emax(P=0.150)和Emean(P=0.211)组间比较,差异均无统计学差异。应用Eratio定量参数进行组织分级组间比较,组织分级Ⅰ级、Ⅱ级与Ⅲ级组间比较,差异均具有统计学意义(均P<0.05);Ⅰ级与Ⅱ级之间组间比较,差异无统计学意义(P=0.106)。
| 组织病理学特征 | 总数 | Emax | P值 | Emean | P值 | Eratio | P值 |
| 病理性质 | <0.01 | <0.01 | <0.01 | ||||
| 恶性 | 85 | 142.4±69.3 | 100.8±59.4 | 9.9±7.6 | |||
| 良性 | 99 | 37.3±31.9 | 27.3±24.9 | 3.1±4.2 | |||
| 病理类型 | 0.234 | 0.139 | 0.046 | ||||
| 原位癌 | 7 | 112.4±59.9 | 68.9±51.6 | 4.5±2.9 | |||
| 浸润性癌 | 78 | 145.1±69.8 | 103.6±59.5 | 10.5±7.8 | |||
| 组织分级 | 0.150 | 0.211 | 0.009 | ||||
| Ⅰ级 | 31 | 116.8±68.3 | 84.6±58.1 | 8.0±6.3 | |||
| Ⅱ级 | 23 | 128.4±72.5 | 84.2±56.7 | 5.8±3.9 | |||
| Ⅲ级 | 26 | 162.4±70.0 | 113.6±61.3 | 12.8±8.0 | |||
| 腋窝淋巴结转移 | 0.001 | 0.002 | 0.030 | ||||
| 阳性 | 25 | 186.6±62.4 | 133.2±63.1 | 12.4±7.6 | |||
| 阴性 | 55 | 125.7±64.7 | 88.8±53.3 | 9.1±7.6 | |||
| 分子分型 | 0.384 | 0.540 | 0.414 | ||||
| LuminalA型 | 26 | 130.8±70.0 | 94.2±61.7 | 8.8±6.9 | |||
| LuminalB型 | 40 | 151.7±69.0 | 105.9±58.0 | 10.6±7.9 | |||
| Erb-B2过表达 | 10 | 130.3±71.9 | 88.7±55.9 | 7.9±6.9 | |||
| Basal-like型 | 4 | 178.9±71.6 | 127.2±82.9 | 15.4±10.8 | |||
| 注 Emax:最大弹性(maximum elasticity);Emean:平均弹性(mean elasticity);Eratio:弹性比(elasticity ratio;Emean与脂肪组织平均值的比值) | |||||||
SWE是新兴的弹性成像技术,通过对结节硬度的量化评估以提高超声诊断乳腺癌的准确度。国内外多项研究结果证实,SWE对鉴别乳腺良恶性病变具有重要价值,但界值尚未达成统一标准,近年来成为超声领域的研究热点[6]。本研究结果显示,在鉴别乳腺肿瘤良恶性中,恶性肿瘤的SWE定量参数均高于良性肿瘤,究其原因可能可由肿瘤病理异质性解释,肿瘤细胞增殖及部分坏死引起促纤维增生反应或肿瘤浸润到邻近间质组织所致[7]。定量SWE参数在鉴别乳腺良恶性肿瘤方面表现出较高的诊断性能,尽管在本研究中采用了不同的截断值,但与以往研究报道相似[8]。Youk等[9]使用了更高的截断值,Emax截断值为46.7~93.8 kPa,但具有相似的诊断性能结果,其中Emax具有最佳诊断效能。这个结果与Song等[10]研究结果相匹配。Emax作为最具诊断性能参数原因在于肿瘤最高硬度通常均位于ROI内,相较而言,Emean代表肿瘤平均硬度,会受ROI大小的影响。除此之外,Eratio会受到邻近腺体硬度变化而出现显著变化。
在本研究中,单纯使用BI-RADS分级鉴别乳腺肿瘤良恶性的假阴性率为14.9%,而使用定量SWE参数Emax来鉴别时,假阴性率下降到8.2%。在假阴性病例中,1例为导管内癌,4例为微浸润性癌。值得注意的是,导管内癌、微小肿瘤和低分级肿瘤是影响定量SWE参数鉴别乳腺肿瘤良恶性的关键危险因素。本研究结果中,假阴性肿瘤的危险因素与李玉双等[11]的研究结果相似。本研究发现,与其他SWE参数比较,Emax具有更高阴性预测值和更低的假阴性率。因此,笔者建议使用Emax将BI-RADS 4A类降至3类。研究表明,96.2%的BI-RADS 4A类正确降级至BI-RADS 3类,从而避免不必要的活检。本研究中有2例恶性肿瘤被错误的从BI-RADS 4A类降级为BI-RADS 3类,因此,本研究提出当病变级别降至3类时,应定期随访病灶≥2年,以确认肿瘤的稳定性。鉴于BI-RADS 4B类以上的结节有较大的恶性可能,笔者不建议使用SWE定量参数替代组织病理诊断来降低这些高度可疑的乳腺肿瘤分级。以上结果表明,部分乳腺良恶性肿瘤的弹性值可能会出现交叉重叠现象[12-13]。虽然ROC曲线证实Emax的诊断效能最大,但也不能忽略其他测量值的效能,本研究中有5例恶性肿瘤的Eratio均大于截断值,因此应结合全部参数进行综合性优化使效果达到最佳。
本研究探讨了乳腺癌预后因素与SWE的各种定量参数之间的关系,其中Eratio参数与乳腺癌组织分级及腋窝淋巴结转移情况具有相关性。这与Chang等[14]的研究结果相符,显示乳腺癌组织分级高时,其Eratio较高。病理分级越高的肿块微血管密度更大且细胞结构更致密,也可能与肿瘤促结缔组织增生及促血管形成等因素有关。本研究表明,Eratio可在术前有效区分组织分级为Ⅲ级的乳腺癌。Evans等[15]的研究表明,乳腺肿瘤的弹性参数可有效预测其组织病理学严重程度,可以在术前确定更良好更积极的治疗方案。但针对组织分级Ⅰ级和Ⅱ级的乳腺癌无法区分,可能与样本量较少有关,亦可能存在人为因素;Eratio参数与腋窝淋巴结转移呈线性相关,即肿瘤与邻近腺体的Eratio越大,肿瘤异质性越高,腋窝淋巴结转移阳性率越高,预示预后不良原因可能为更具侵袭性的肿瘤表现出不同阶段的组织学异质性,从而导致与周围组织之间的硬度差异较大。2D-SWE定量参数均与乳腺癌分子肿瘤亚型无相关性,与Au等[16]研究认为的SWE参数与肿瘤分子亚型无相关的结论一致。
本研究存在一些局限性:(1)本研究为回顾性研究,可能存在选择偏倚,且为单中心研究;(2)操作人员的可变性及主观性可能为影响因素;(3)总样本量和分组后的组内样本量偏小, 有待扩大样本量从而得到较客观的结论。
综上所述,2D-SWE的定量参数对鉴别乳腺肿瘤良恶性提供了较好的诊断效能,其中Emax最佳。2D-SWE定量参数使用定量参数优化BI-RADS分级方案可以有效减少不必要的活检。2D-SWE定量参数可有效预测乳腺癌腋窝淋巴结转移情况。Eratio在乳腺癌组织分级中有一定预测价值。这些为乳腺癌的预后提供重要的参考价值。
| [1] |
Kim HJ, Kim SM, Kim B, et al. Comparison of strain and shear wave elastography for qualitative and quantitative assessment of breast masses in the same population[J]. Sci Rep, 2018, 8(1): 6197. DOI:10.1038/s41598-018-24377-0 |
| [2] |
冯景, 王洲, 刘芳欣, 等. 声触诊组织成像定量技术联合超声造影对BI-RADS 4类乳腺肿瘤的鉴别诊断价值[J]. 实用肿瘤杂志, 2021, 36(2): 145-148. |
| [3] |
American College of Radiology (ACR). Breast imaging reporting and data system (BI-RADS) ultrasound[M]. Reston: American College of Radiology, 2003: 71-79.
|
| [4] |
Frank GA, Danilova NV, Andreeva Ⅱ, et al. WHO classification of tumors of the breast, 2012[J]. Arkh Patol, 2013, 75(2): 53-63. |
| [5] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2008版)[J]. 中国癌症杂志, 2009, 19(6): 448-474. DOI:10.3969/j.issn.1007-3639.2009.06.012 |
| [6] |
张会萍, 周毓青. 乳腺癌超声弹性诊断新进展[J]. 中华乳腺病杂志: 电子版, 2021, 15(1): 1-3. DOI:10.3877/cma.j.issn.1674-0807.2021.01.001 |
| [7] |
林敏, 侯刚, 宋璐, 等. 乳腺浸润性乳头状癌的临床病理学特征分析[J]. 实用肿瘤杂志, 2021, 36(2): 163-166. DOI:10.13267/j.cnki.syzlzz.2021.034 |
| [8] |
Huang YN, Li F, Han J, et al. Shear wave elastography of breast lesions: quantitative analysis of elastic heterogeneity improves diagnostic performance[J]. Ultrasound Med Biol, 2019, 45(8): 1909-1917. DOI:10.1016/j.ultrasmedbio.2019.04.019 |
| [9] |
Youk JH, Gweon HM, Son EJ. Shear-wave elastography in breast ultrasonography: the state of the art[J]. Ultrasonography, 2017, 36(4): 300-309. DOI:10.14366/usg.17024 |
| [10] |
Song EJ, Sohn YM, Seo M. Diagnostic performances of shear-wave elastography and B-mode ultrasound to differentiate benign and malignant breast lesions: the emphasis on the cutoff value of qualitative and quantitative parameters[J]. Clin Imaging, 2018, 50: 302-307. |
| [11] |
李玉双, 胡中倩, 叶新华, 等. 剪切波弹性成像对乳腺导管原位癌的诊断价值及漏诊的潜在因素[J]. 东南大学学报: 医学版, 2021, 40(2): 183-188. |
| [12] |
Yoon JH, Jung HK, Lee JT, et al. Shear-wave elastography in the diagnosis of solid breast masses: what leads to false-negative or false-positive results?[J]. Eur Radiol, 2013, 23(9): 2432-2440. DOI:10.1007/s00330-013-2854-6 |
| [13] |
Liu H, Wan J, Xu G, et al. Conventional US and 2-D shear wave elastography of virtual touch tissue imaging quantification: correlation with immunohistochemical subtypes of breast cancer[J]. Ultrasound Med Biol, 2019, 45(10): 2612-2622. DOI:10.1016/j.ultrasmedbio.2019.06.421 |
| [14] |
Chang JM, Park IA, Lee SH, et al. Stiffness of tumours measured by shear-wave elastography correlated with subtypes of breast cancer[J]. Eur Radiol, 2013, 23(9): 2450-2458. DOI:10.1007/s00330-013-2866-2 |
| [15] |
Evans A, Sim YT, Pourreyron C, et al. Pre-operative stromal stiffness measured by shear wave elastography is independently associated with breast cancer-specific survival[J]. Breast Cancer Res Treat, 2018, 171(2): 383-389. DOI:10.1007/s10549-018-4836-5 |
| [16] |
Au FW, Ghai S, Moshonov H, et al. Diagnostic performance of quantitative shear wave elastography in the evaluation of solid breast masses: determination of the most discriminatory parameter[J]. AJR Am J Roentgenol, 2014, 203(3): W328-W336. DOI:10.2214/AJR.13.11693 |
 2022, Vol. 37
2022, Vol. 37


