文章信息
- 马海玥, 华威, 赵琳琳, 王聪, 孙悦, 郭会芹, 赵焕, 张智慧
- Ma Haiyue, Hua Wei, Zhao Linlin, Wang Cong, Sun Yue, Guo Huiqin, Zhao Huan, Zhang Zhihui
- ERCP形态学联合影像学及血清学评估胆管狭窄的临床价值
- Clinical value of ERCP morphology combined with imaging and serology in evaluating biliary stricture
- 实用肿瘤杂志, 2021, 36(4): 336-341
- Journal of Practical Oncology, 2021, 36(4): 336-341
基金项目
- 中国医学科学院医学与健康科技创新工程(2017-12M-1-006);自然资源部生态地球化学重点实验室开放基金项目(ZSDHJJ201801)
-
通信作者
- 张智慧, E-mail: zhangzhh9@163.com
-
文章历史
- 收稿日期:2020-10-22
2. 哈尔滨医科大学附属第一医院病理科, 黑龙江 哈尔滨 150001
2. Department of Pathology, the First Affi liated Hospital of Harbin Medical University, Harbin 150001, China
胆管狭窄可由多种病因引起,其病理类型有良性、恶性和非典型性。但是临床上仅15%~24%的胆管狭窄为良性[1],有高达2/3的非典型性病例最终诊断为恶性,约1/4的手术患者最终病理诊断为良性[1-2]。胆总管远端恶性狭窄常见的原因有胰腺癌、胆管癌和十二指肠壶腹癌等[1, 3]。但是有些炎性反应病变甚至胆结石等良性病变也会引起胆管狭窄。因此,所有胆管狭窄都应引起高度重视和详细评估。
胆管狭窄的初步评估包括体格检查和实验室标记。肿瘤标志物最常用的是糖类抗原199 (carbohydrate antigen 199,CA199)。影像学研究在肿瘤的可视化、分型和手术计划中也起着至关重要的作用。影像学检查可分为非侵入性和侵入性,多数情况下需要侵入性成像来获取组织学及细胞学样本从而作出明确诊断,包括内镜下逆行胰胆管造影(endoscopic retrograde cholangiopeacreatography, ERCP)、内镜超声细针穿刺(endoscopic ultrasound-guided fine-needle aspiration biospy,EUS-FNA)、经皮肝穿刺胆管造影(percutaneous transhepatic cholangiography,PTC)和胆管镜等。目前,临床应用最多的是ERCP,通过ERCP可以获取比较多的细胞和组织标本进行诊断,并通过引流减轻患者梗阻,起到诊断和治疗的作用。细胞学刷检的敏感度为15.0%~66.1%[4-7],仅依靠ERCP刷检细胞学检查并不能满足临床需求。因此本文探讨ERCP刷检液基细胞学诊断,联合ERCP活检、无创影像学检查以及血清肿瘤标志物等,评估其对胆管狭窄的诊断价值。
1 资料与方法 1.1 一般资料随机选取2017年2月至2019年6月间因胆管梗阻就诊中国医学科学院北京协和医学院肿瘤医院并行ERCP细胞学刷检的患者352例,其中恶性297例,良性55例;男性194例,女性158例;年龄22~81岁,中位年龄62岁。194例行组织学、血清学或影像学检查且病例资料完整,其中恶性152例,良性42例;男性112例,女性82例;年龄22~78岁,中位年龄60岁。194例患者均符合相关胆管梗阻临床诊断标准:(1)141例患者进行影像学检查,包括CT、腹部超声或MRI检查等;(2)135例患者ERCP前应用免疫电化学发光方法进行血清癌胚抗原(carcino-embryonic antigen,CEA)和CA199等标志物的浓度检测;(3)所有患者通过ERCP检查获取胆管刷检细胞学,且135例获取组织学活检标本。
1.2 细胞学及组织学活检检查 1.2.1 胆管刷检细胞学在导丝引导下,由十二指肠镜活检孔道胆管细胞刷接近患者胆管梗阻位置,毛刷在梗阻狭窄部位刷5次后,将胆管细胞刷取出,将细胞刷在Cytolyt消化液涮洗后消化15 min,离心,倾其上清液,将标本移入Cytyc固定液中,15 min后,TP2000(Hologic公司,美国)制备液基薄层涂片,95%乙醇固定。
1.2.2 胆管组织活检采用胆管活检钳在梗阻部位可疑病变处钳取,4%甲醛固定,制备组织切片。
1.3 细胞学评价标准刷检细胞学结果按照经典巴氏Ⅴ级进行评估:Ⅰ级,正常,未见异常细胞;Ⅱ级,发现异常细胞,但均为良性,即非典型细胞;Ⅲ级,发现可疑恶性细胞;Ⅳ级,发现高度可疑恶性细胞;Ⅴ级,发现恶性细胞(图 1)。
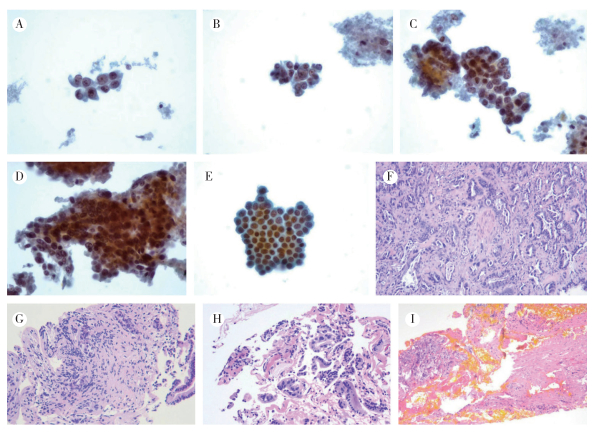
|
| 注 A:ERCP细胞学刷检诊断为腺癌细胞(×400);B:ERCP细胞学刷检诊断为高度可疑腺癌细胞(×400);C:ERCP细胞学刷检诊断为可疑腺癌细胞(×400);D:ERCP细胞学刷检诊断为发现异常细胞, 但均为良性, 即非典型细胞(×400);E:ERCP细胞学刷检诊断为正常腺上皮细胞(×400);F:ERCP组织学活检诊断为胆管腺癌(×200);G:ERCP组织学活检诊断为可疑腺癌(×200);H:ERCP组织学活检诊断为非典型腺体(×200);I:ERCP组织学活检诊断为未见癌(×200) 图 1 ERCP细胞学刷检及组织学活检形态学各级诊断结果 Fig.1 Morphological results of ERCP cytological brush and biopsy |
以患者活检或者手术切除后的组织病理诊断结果为金标准;若无组织病理学结果,则采用细胞学刷检结果、影像学CT或者MRI检查等结果,结合临床诊断、治疗及随访结果得出最终诊断。
1.5 统计学分析应用SPSS 23.0统计学软件进行数据分析。采用t检验、受试者工作特征(receiver operating characteristic,ROC)曲线及曲线下面积(area under curve,AUC)比较血清CA199及CEA对胆管恶性梗阻诊断的敏感度、特异度、阳性预测值和阴性预测值等诊断指标。以P < 0.05为差异具有统计学意义。
2 结果 2.1 形态学结果在研究期间共计352例患者接受ERCP刷检细胞学检查,诊断结果为巴氏Ⅴ级126例,Ⅲ级和Ⅳ级共51例,Ⅱ级为37例,Ⅰ级138例。由于诊断为Ⅲ级和Ⅳ级的病例最终均确诊为恶性肿瘤,因此将Ⅴ级、Ⅳ级和Ⅲ级的病例均归类为阳性;Ⅱ级和Ⅰ级的病例归类为阴性。以临床最终诊断结果作为对照,计算刷检细胞学的敏感度为59.6%,特异度为100.0%。261例组织学活检结果,诊断为恶性169例,良性92例,以临床最终诊断结果作为对照,其敏感度为74.8%,特异度为100.0%,刷检细胞学与组织学活检二者联合应用敏感度为82.7%,特异度为100.0%(表 1,图 1)。
| 检查方法 | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 |
| ERCP细胞学刷检(n=352) | 59.6 | 100.0 | 100.0 | 31.4 |
| ERCP组织学活检(n=261) | 74.8 | 100.0 | 100.0 | 38.0 |
| ERCP细胞学刷检+组织学活检(n=261) | 82.7 | 100.0 | 100.0 | 47.3 |
| 注 ERCP:内镜下逆行胰胆管造影(endoscopic retrograde cholangiopeacreatography) | ||||
194例患者平均年龄59.4岁,男性占57.7%,女性占42.3%。狭窄部位依次为胆总管癌(57.7%)、肝门区癌(14.9%)和肝内胆管癌(14.4%)。恶性肿瘤152例(78.4%),常见类型依次为胆管癌[70例(36.1%)]、胰腺癌[46例(23.7%)]和肝转移癌[18例(9.3%)]。细胞学刷检诊断为Ⅴ级72例,Ⅲ级和Ⅳ级共27例,Ⅱ级24例,Ⅰ级71例。刷检细胞学的敏感度为65.1%,特异度为100.0%,其中胰腺癌、中下部胆管细胞癌及肝门部胆管细胞癌的敏感度分别为72.7%、63.9%和60.0%,阴性预测值分别为44.4%、58.1%和28.6%,特异度及阳性预测值均为100.0%。
2.3 194例ERCP中135例组织活检结果分析135例组织活检结果的敏感度为76.1%,特异度为100.0%,其中胰腺癌、中下部胆管细胞癌及肝门部胆管细胞癌的敏感度分别为72.7%、76.7%和70.0%,阴性预测值分别为43.8%、58.8%和25.0%,特异度及阳性预测值均为100.0%。刷检细胞学与活检联合诊断的敏感度和特异度分别为87.6%和100.0%(表 2)。
| 检查方法 | 敏感度 | 特异度 | 阳性预测值 | 阴性预测值 |
| ERCP细胞学刷检(n=194) | 65.1 | 100.0 | 100.0 | 44.2 |
| ERCP组织学活检(n=135) | 76.1 | 100.0 | 100.0 | 44.9 |
| B型超声(n=43) | 48.5 | 83.3 | 88.2 | 38.5 |
| CT(n=115) | 76.3 | 77.3 | 93.4 | 43.6 |
| MRI(n=103) | 78.9 | 81.5 | 92.3 | 57.9 |
| ERCP细胞学刷检+组织学活检(n=135) | 87.6 | 100.0 | 100.0 | 61.1 |
| ERCP细胞学刷检+组织学活检+影像学(n=122) | 99.0 | 75.0 | 95.3 | 93.8 |
| ERCP细胞学刷检+组织学活检+肿瘤标志物(n=101) | 98.9 | 57.1 | 93.5 | 88.9 |
| ERCP细胞学刷检+组织学活检+肿瘤标志物+影像学(n=98) | 100.0 | 28.6 | 95.5 | 100.0 |
| 注 ERCP:内镜下逆行胰胆管造影(endoscopic retrograde cholangiopeacreatography) | ||||
具有影像学结果的141例患者单独超声检查的敏感度为48.5%,特异度为83.3%;单独CT检查的敏感度为76.3%,特异度为77.3%,其中胰腺癌、肝门部胆管细胞癌及肝外胆管细胞癌的敏感度分别为88.9%、76.9%和66.7%,特异度分别为70.0%、50.0%和87.5%,阳性预测值分别为91.4%、90.9%和93.3%,阴性预测值分别为63.6%、25.0%和50.0%;单独MRI检查的敏感度为78.9%,特异度为81.5%,其中胰腺癌、肝门部胆管细胞癌及肝外胆管细胞癌的敏感度分别为90.5%、86.7%和58.8%,特异度分别为83.3%、50.0%和84.6%,阳性预测值分别为95.0%、92.9%和83.3%,阴性预测值分别为71.4%、33.3%和61.1%。ERCP细胞学刷检联合组织学活检及影像学检查敏感度可达到99.0%,特异度为75.0%(表 2)。
2.5 194例ERCP中135例血清学结果分析具有血清学结果的135例患者中,恶性肿瘤患者(105例)血清CA199及CEA水平高于良性病变患者(30例),差异具有统计学意义(P < 0.01,P=0.029);但胰腺癌和胆管癌患者间比较,差异均无统计学意义(P=0.081,P=0.832)。应用SPSS计算CA199的ROC曲线,AUC为0.736(P < 0.01),由约登指数得出分界值为49.01 U/mL,CA199敏感度及特异度分别为76.2%和63.3%,恶性肿瘤患者血清中CA199阳性80例,阴性25例;良性病变患者CA199阳性11例,阴性19例(图 2)。计算CEA的ROC曲线,AUC为0.749(P < 0.01),由约登指数得出分界值为2.82 ng/mL,CEA的敏感度及特异度分别为67.6%和73.3%,恶性肿瘤患者血清中CEA阳性71例,阴性34例;良性病变患者CEA阳性8例,阴性22例(图 3)。
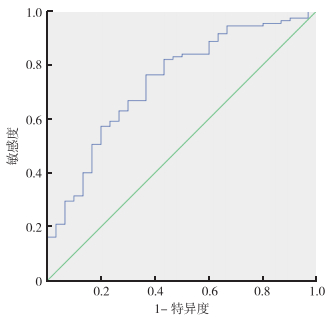
|
| 图 2 胆管狭窄患者血清CA199诊断恶性肿瘤的ROC曲线 Fig.2 ROC curve of serum CA19-9 in biliary stricture patients for diagnosis of malignant tumors |
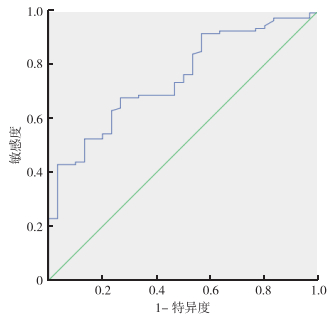
|
| 图 3 胆管狭窄患者血清CEA诊断恶性肿瘤的ROC曲线 Fig.3 ROC curve of serum CEA in biliary stricture patients for diagnosis of malignant tumors |
ERCP细胞学刷检联合组织学活检及肿瘤标志物敏感度为98.9%,特异度为57.1%。ERCP细胞学刷检联合组织学活检、影像学检查及肿瘤标志物敏感度为100.0%,特异度为28.6%(表 2)。
3 讨论胆管狭窄的评估对内镜医师来说是一个重要而富有挑战性的问题。目前ERCP仍然是胆管狭窄的一线诊断方法,由于仅凭刷检和活检的敏感度偏低,若能够结合影像学及肿瘤标志物等其他临床检测手段,提高胆管狭窄患者术前的诊断准确性,有益于患者的治疗。因此,本研究旨在评估以ERCP为基础的联合检测在改善恶性狭窄诊断方面的效用。国内研究报道传统细胞学刷检涂片的敏感度为40.7%,特异度为100%[8]。近年来液基细胞学在非妇科方面得到迅猛发展,能够有效地将病变细胞集中于1张涂片中,使细胞形态保存完好,结构清晰,分布均匀,减少重叠,易于观察,同时消化液清除标本中的一些红细胞和杂质等,有利于提高细胞学诊断的阳性率。有研究报道,液基细胞学敏感度可达66.1%[9]。本研究采用液基细胞学标本,统计352例ERCP细胞学刷检结果敏感度可达到59.6%,且特异度为100%,高于传统涂片的敏感度,与相关报道中液基细胞学的敏感度基本一致[9]。研究报道,ERCP活检的敏感度为33.0%~65.0%,若细胞学刷检与活检同时进行,敏感度为60.0%~70.0%[10]。本研究细胞学刷检和组织学活检联合应用敏感度提高至82.7%,提示ERCP同时进行刷检和活检能够大大提高诊断敏感度。
经腹部超声检查可提示胆管狭窄的位置。因为腹部超声检查是通过评估扩张的和正常的胆管口径来推断的,所以依靠其获取详细的解剖描述和准确的良恶性鉴别通常是不可能的。有研究报道,超声检查对于发现可疑病灶的敏感度有85.0%[11]。本研究中超声诊断良恶性的敏感度为48.5%。因此,腹部超声更适用于筛查,发现可疑病灶,从而进一步检查确诊。CT和MRI检查相对于超声检查敏感度提高至76.3%和78.9%,特异度为77.3%和81.5%,而且可以提供对胆管及其邻近器官和血管的综合评估。国外研究显示,影像学检查对肝门及肝内狭窄的诊断更为敏感[12]。笔者对CT和MRI的研究也显示类似的结果,肝门部应用MRI和CT的敏感度分别为86.7%和76.9%,高于中下段胆管癌的58.8%及66.7%,但二者比较,差异无统计学意义(P=0.121,P=0.529)。CT和MRI检查在中下部胆管病变诊断上表现不佳,可能由于狭窄部位的解剖结构复杂,位置不清,难以辨认。
胆管癌患者血清CEA和CA199浓度可出现不同程度增加,无论是单独使用或与其他生物标志物联合使用,都是血清中最常研究的生物标志物。其敏感度和特异度分别为47.2%~98.2%及54.0%~98.7%[13]。但其对胆管狭窄的早期诊断敏感度不高,也不是该疾病的特异度标志物,高浓度的CA199也可能出现在良性病变中[14]。本研究的血清标本中,当CA199以49.01 U/mL为临界值,其敏感度和特异度分别为76.2%和63.3%,当CEA以2.82 ng/mL为临界值时,其敏感度和特异度分别67.6%和73.3%,研究中未发现其在胰腺癌和胆管癌患者中浓度差异具有统计学意义(P=0.081,P=0.832)。国外研究发现,在硬化性胆管炎患者中,CA199值高于129 U/mL临界值时,对胆管癌诊断敏感度和特异度分别为79.0%和98.0%[15]。当存在硬化性胆管炎时,CA199的敏感度增加,恶性肿瘤的可疑程度有所增加,硬化性胆管炎对于生物标志物辅助诊断的具体影响有待于进一步研究。因此,这些肿瘤标志物应与影像学检查和ERCP形态学等其他诊断工具联合应用,也可用于筛查,对于肿瘤标志物显著升高的患者,应该考虑其患胆管系统或胰腺癌的可能性。
由于ERCP细胞学刷检及组织学活检可以直接在镜下见到肿瘤细胞,所以二者联合应用特异度高,可达到100%,但敏感度仅为82.7%,仍存在因取材不足不能作出诊断的病例。临床工作中发现影像学及血清学检查有较高敏感度,但特异度低。若四者联合应用,敏感度可提高至100%。故本研究认为四者联合应用可取长补短,提高敏感度的同时,由于影像学及血清学结果出现许多假阳性,使四者联合组特异度降低,但临床工作处理主要以细胞学刷检及组织学活检的特异度为准。因此对于细胞学刷检及组织学活检阴性但血清学或影像学提示异常的患者临床上采取建议随诊,不会出现假阳性的处理。
虽然没有一项单一的检测方法能够达到100%的敏感度和特异度,但本研究发现联合应用几种检查手段可以共同提高敏感度和特异度。此外,本研究将细胞学上的“可疑癌”作为恶性结果,并没有降低特异度。本研究还是有一定局限性:(1)部分患者在指标评估中没有接受所有检查手段,而是采用渐进的方法,且检查手段有一定先后顺序,可能对各位医师的报道产生影响,这引入了选择偏差;(2)许多可能可行的检查手段未被纳入研究中,如荧光原位杂交检测(fluorescence in situ hybridization,FISH)等分子检测手段、胆管镜检查和基于探针的共聚焦激光显微内镜等;(3)由于本机构为肿瘤专科医院,可能部分患者在其他医院已经考虑为恶性疾病,来本院进一步确诊,而在其他医院排除恶性病变的患者多数不会来本院就诊,可能使阴性预测值偏低。
总之,本研究证明,基于ERCP刷检的液基细胞学有利于阳性细胞的识别,可以提高细胞学诊断的敏感度;联合活检形态、影像学和血清学检查等多种检测手段也能够有效提高诊断的敏感度,有利于胆管狭窄的评估。
| [1] |
Tummala P, Munigala S, Eloubeidi MA, et al. Patients with obstructive jaundice and biliary stricture±mass lesion on imaging: Prevalence of malignancy and potential role of EUS-FNA[J]. J Clin Gastroenterol, 2013, 47(6): 532-537. DOI:10.1097/MCG.0b013e3182745d9f |
| [2] |
Bowlus C, Olson K, Gershwin E. Evaluation of indeterminate biliary strictures[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(1): 28-37. DOI:10.1038/nrgastro.2015.182 |
| [3] |
胡春秀, 余维, 魏启春. 肝内胆管细胞癌根治术后辅助化疗的价值[J]. 实用肿瘤杂志, 2020, 35(2): 140-144. |
| [4] |
Fogel EL, De Bellis M, McHenry L, et al. Effectiveness of a new long cytology brush in the evaluation of malignant biliary obstruction: a prospective study[J]. Gastrointest Endosc, 2006, 63(1): 71-77. |
| [5] |
De Bellis M, Sherman S, Fogel EL, et al. Tissue sampling at ERCP in suspected malignant biliary strictures (Part 2)[J]. Gastrointest Endosc, 2002, 56(5): 720-730. DOI:10.1016/S0016-5107(02)70123-5 |
| [6] |
Strongin A, Singh H, Eloubeidi MA, et al. Role of endoscopic ultrasonography in the evaluation of extrahepatic cholangiocarcinoma[J]. Endosc Ultrasound, 2013, 2(2): 71-76. DOI:10.4103/2303-9027.117690 |
| [7] |
吴宗杨, 王金波, 冯济业, 等. 经内镜胆道细胞刷检查对胆管良恶性狭窄的诊断价值[J]. 现代实用医学, 2019, 31(9): 1158-1159. DOI:10.3969/j.issn.1671-0800.2019.09.009 |
| [8] |
唐映, 陈浩军, 林树洪. ERCP胆管刷检联合血清、胆汁中CA19-9、CEA对胆管良、恶性狭窄鉴别诊断的价值[J]. 现代消化及介入诊疗, 2017, 22(1): 48-51. DOI:10.3969/j.issn.1672-2159.2017.01.016 |
| [9] |
颜云. DNA定量分析与液基细胞学在胆管良恶性病变中的应用价值[J]. 临床与病理杂志, 2019, 39(4): 820-824. |
| [10] |
Singh A, Gelrud A, Agarwal B, et al. Biliary strictures: diagnostic considerations and approach[J]. Gastroenterol Rep (Oxf), 2015, 3(1): 22-31. DOI:10.1093/gastro/gou072 |
| [11] |
Skoczylas K, Pawełas A. Ultrasound imaging of the liver and bile ducts-expectations of a clinician[J]. J Ultrason, 2015, 15(62): 292-306. DOI:10.15557/JoU.2015.0026 |
| [12] |
Saluja SS, Sharma R, Pal S, et al. Differentiation between benign and malignant hilar obstructions using laboratory and radiological investigations: a prospective study[J]. HPB (Oxford), 2007, 9(5): 373-382. DOI:10.1080/13651820701504207 |
| [13] |
Tshering G, Dorji PW, Chaijaroenkul W, et al. Biomarkers for the diagnosis of cholangiocarcinoma: a systematic review[J]. Am J Trop Med Hyg, 2018, 98(6): 1788-1797. |
| [14] |
Park JY, Jeon TJ. Factors associated with malignant biliary strictures in patients with atypical or suspicious cells on brush cytology[J]. Clin Endosc, 2019, 52(2): 168-174. |
| [15] |
Levy C, Lymp J, Angulo P, et al. The value of serum CA 19-9 in predicting cholangiocarcinomas in patients with primary sclerosing cholangitis[J]. Dig Dis Sci, 2005, 50(9): 1734-1740. DOI:10.1007/s10620-005-2927-8 |
 2021, Vol. 36
2021, Vol. 36


