文章信息
- 毕向雁, 李和根, 马恰怡, 孙建立, 周蕾, 朱立峰, 蔡浦玉, 谭翔文
- 一例肺腺鳞癌TKI治疗后病理转化报道
- 实用肿瘤杂志, 2021, 36(6): 571-574
基金项目
- 上海市卫生和计划生育委员会中医药科研专项课题(2016LP052);上海中医药大学杏林传承人才培养项目;上海市进一步加快中医药事业发展三年行动计划(2018年-2020年)项目建设;长宁区卫生健康委员会医学重点(特色)专科计划(20191004);上海市长宁区天山中医医院PI团队建设项目
-
通信作者
- 谭翔文, E-mail: wensito74@hotmail.com
-
文章历史
- 收稿日期:2020-06-27
2. 长宁区天山中医医院肿瘤科, 上海 200051
肺癌是目前全世界发病率和死亡率较高的恶性肿瘤之一[1]。世界卫生组织(World Health Organization,WHO)估计全球每年死于肺癌的患者约159万例[2]。非小细胞肺癌(non-small-cell lung cancer,NSCLC)是肺癌最常见的类型[3-4],肺腺鳞癌(adenosquamous carcinoma,ASC)是NSCLC中相对罕见的病理亚型,具有腺癌和鳞癌并见的特点,占NSCLC的2.1%~3.4%,仅占肺癌的0.4%~4%[5]。据2015年WHO肺部肿瘤分类定义肺ASC为鳞癌和腺癌成分均≥10%的肿瘤[6],其临床特征既具有鳞状细胞癌的局部侵袭性,又有腺癌的远处转移性,且恶性程度高,预后差于鳞癌或腺癌[7]。作为NSCLC的罕见亚型,手术、化疗和放疗为其主要治疗方式,部分检测出表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变的患者,酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗可获益。本文旨在分析长宁区天山中医医院1例肺ASC患者接受TKI治疗后病理类型出现转化的情况。
1 病例资料患者,男性,78岁,因咳嗽气促就诊于上海市松江区中心医院,2015年4月28日肺部CT检查示:右肺上叶及右肺门占位(3.8 mm×2.9 mm),右肺上叶支气管闭塞,伴阻塞性肺炎,右肺门淋巴结增大,符合右肺上叶表现,右肺少量积液,左肺下叶肺大泡。附见右肾上腺结节(约15 mm)。转诊上海交通大学医学院附属瑞金医院,2015年5月5日肺部CT检查示:右肺上叶恶性肿瘤后段及肺门旁占位,右上支气管狭窄,右肺上叶前段阻塞性肺炎性反应可能;右肺下叶小结节;纵隔淋巴结显示(图 1A)。结合影像学,行支气管活检术,患者因年长拒绝手术和化疗,等待正式病理报告期间,从2015年5月12日开始口服埃克替尼(125 mg,3次/d)。2015年5月19日支气管镜活检病理检查示:(右肺上叶管口支气管黏膜)非小细胞癌,提示ASC,免疫组织化学检查示:CK(+),TTF-1(+),p63(-/+),p40(个别+),Ki-67(90%),CD56(-),CgA(-),SYN(-)。2015年5月29日基因检测示:EGFR Exon19突变。口服埃克替尼5个月后肺部病灶疗效评价为部分缓解(partial response,PR;图 1B)。2016年10月复查肺CT示:右肺上叶后段肿块较前发展,疗效评价为疾病进展(progressive disease,PD;图 1C)。2016年11月停埃克替尼。2016年11月8日在全麻下行右肺上叶切除+纵隔淋巴结清扫术,术后病理检查示:非小细胞癌,大小3.8 cm×3.4 cm×3 cm。肿瘤侵犯脏层胸膜,支气管切断未见癌累及,淋巴结0/6组未见癌转移,酶标:TTF-1(-),p40(+弱),CK5/6(-),CK7(+),VIM(-),CD56(-),CK(+),结合酶标,倾向低分化鳞状细胞癌。后患者定期随访。2017年3月因右上腹隐痛就诊复旦大学附属肿瘤医院,2017年3月26日行PET-CT检查示:(1)右肺癌术后,右侧肾上腺肿块,FDG代谢增高,为转移;(2)左肺肺大泡,左肾囊肿,左肾凝结物。2017年4月13日患者于复旦大学附属肿瘤医院腹腔镜下行右肾上腺肿瘤切除术,术后病理检查示:中低分化腺癌,大小1.7 cm×1.5 cm×1 cm,免疫组织化学检查示:AE1/AE3(+),TTF-1(+),SPA(+),NapsinaA(+),癌胚抗原(carcino-embryonic antigen,CEA)(+),A103(-),CgA(-),人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)(+),Inhibin(-),p63(-),p40(-),Ki-67(30-40+),血清铁蛋白(serum ferritin,SF)(-),结果符合肺腺癌肾上腺转移,复测基因检测示:EGFR Exon19突变。2017年6月25日和7月13日行AC方案(培美曲塞880 mg d1+卡铂450 mg d1,静脉滴注,每3周1次)化疗2个周期,2017年8月2日肺CT检查示:右肺癌术后改变,右肺下叶小结节同前,左肺下叶肺大泡,右侧肾上腺转移可能,左肾囊状低密度灶。腹部MRI检查示:右肾上腺术后,右侧肾腺区团块影累及肝右叶可能(55 mm×31 mm), 复发不除外,复旦大学附属肿瘤医院疗效评价为PD。后改口服长春瑞滨(商品名:诺维本)化疗1个周期(120 mg d1,100 mg d8,3周为1个周期),2017年9月20日复旦大学附属肿瘤医院肺CT检查示:右肺癌术后改变,右肺下叶小结节同前,考虑良性,左肺下叶肺大泡同前。腹部MRI检查示:右侧肾腺区团块影较前增大(96 mm×64 mm),考虑复发转移,累及肝右叶及下腔静脉,疗效评价为PD。转诊长宁区天山中医医院。2017年9月28日肺CT检查示:右肺术后改变,两肺陈旧灶,附见肝右叶占位(图 1D)。2017年9月29日口服吉非替尼(商品名:易瑞沙;250 mg,1次/d)靶向治疗。2017年11月5日肺CT检查示:右肺癌术后改变,两肺散在陈旧灶,左肺下叶肺大泡,附见肝右叶病灶较前片明显缩小(图 1E)。腹部平扫CT检查示:肝右叶低密度灶,考虑转移灶(与下腔静脉分界不清,最大截面约30 mm×50 mm)双肾囊样病灶,左肾结石可能。右侧肾上腺未见显示。2018年1月17日肺CT检查示:右肺癌术后改变,慢性支气管炎、肺气肿,左肺下叶肺大泡,两肺散在陈旧灶,纵隔及心包少量积液,肝右叶病灶,疗效评价为PR。2018年3月17日腹部CT检查示:肝右叶病灶与前片比较明显进展伴肝内胆管轻度扩张,考虑转移(60 mm×35 mm),胆囊结石,双肾囊样病灶,双肾结石可能。右侧肾上腺未见显示。疗效评价为PD(图 1F)。随访至2018年5月患者死亡。
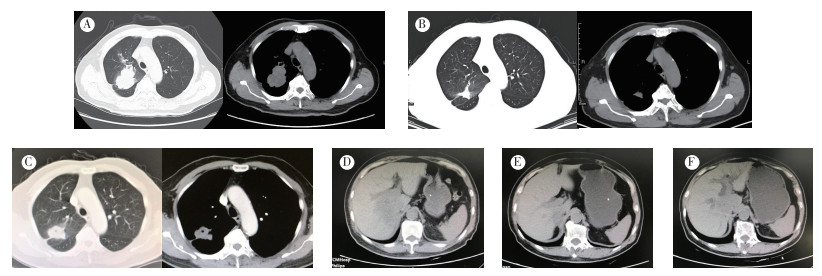
|
| 注 A:使用埃克替尼前(2015年5月5日);B:服用埃克替尼5个月后(2015年10月12日);C:服用埃克替尼17个月后(2016年10月21日);D:口服吉非替尼前(2017年9月28日);E:口服吉非替尼1个月后(2017年11月5日);F:口服吉非替尼5个月余(2018年3月17日) 图 1 肺腺鳞癌患者治疗前后的CT影像 |
肺癌是来源于支气管上皮细胞或肺泡上皮细胞的恶性肿瘤,具体类型与上皮细胞密不可分。支气管黏膜上皮细胞的基底细胞可向腺上皮或鳞状上皮细胞分化,在致癌因素的参与下,导致细胞增殖与分化的失序进而诱发癌变,形成鳞癌、腺癌或ASC。肺ASC发病率低于肺腺癌及肺鳞癌,发生率约占肺癌的4%,属于低发生率但侵袭性较强的肿瘤,与单纯的肺鳞癌及肺腺癌比较,其恶性程度更高,侵袭性更强,且较早出现血性及淋巴转移,远期生存率低,预后差。
手术和化疗是ASC的主要治疗方式,但疗效并不理想。研究发现,ASC患者较腺癌(adenocarcinoma,ADC)和鳞状细胞癌(squamous cell carcinoma,SCC)患者的预后更差,5年生存率分别为23%、58%和41%[8]。近年来随着肿瘤分子生物学的发展和精准医学观念的提出,肺癌的治疗日趋个体化,针对分子靶点的新一代抗肿瘤药物将凭借其特异性和靶向性,成为肺癌的研究及治疗热点,最具代表性的为针对肺腺癌EGFR突变的靶向治疗。多项研究报道,24%~32%的肺ASC患者存在EGFR突变[9-12];25%的肺ASC患者存在磷酯酰肌醇-3激酶(phosphatidylinositol 3 kinase,PI3K)信号通路的突变[11]。Iwanaga等[13]报道1例具有EGFR敏感突变的ASC患者,在术后接受吉非替尼作为二线治疗后取得3年无进展生存。研究显示,EGFR-TKI治疗具有EGFR突变阳性的ASC患者是有效的[14]。
肺腺癌镜下病理切片成分优势(恶性成分占 > 60%)可归纳为鳞癌成分占优势型、腺癌成分占优势型和2种成分大致相等型,不同成分优势主导肿瘤组织生物学特性。有案例报道,ASC患者首次复发为脑部纯鳞状细胞肿瘤,经手术及放疗后疾病缓解但再次复发表现为肺内的孤立纯腺癌转移[15]。
本例患者发现右肺内及右肾上腺占位后,经支气管镜活检术取得肺ASC病理,基因检测表现为EGFR 19del,口服EGFR-TKI 1年后肺内病灶进展,停服并接受胸腔镜手术切除右肺病灶,术后病理检查示鳞癌,取材数量充足,精确性高,基本排除ASC可能。随访发现右肾上腺病灶进展,复经腹腔镜行右肾上腺切除术,手术病理检查提示肺腺癌肾上腺转移,术后行静脉化疗,治疗过程中发现肝右叶转移,改姑息口服化疗。长宁区中医院就诊时根据患者肾上腺术后免疫组织化学检查结果,再次建议患者口服一代靶向药,缓解时间近半年(2017年9月29日~2018年3月19日)。观察从胸腔镜手术治疗至患者死亡,肺内无可评价病灶,治疗过程中存在ASC向鳞癌和腺癌转化的表现,国内外罕有报道。临床对EGFR-TKI的认识,主要作用于腺癌成分,对鳞癌成分作用较弱甚至无效,患者经TKI靶向药物治疗后诱发ASC向鳞癌转化,推测TKI对腺癌成分有治疗优势,直接导致腺癌成分细胞的凋零,而鳞癌细胞获得数量优势,右肺术后病理检查提示鳞状细胞癌可进一步佐证以上推测,考虑停服TKI后腺癌成分不再受到抑制并重新恢复长势,具体体现在肾上腺病灶进展。由于治疗之初,未能取得右肾上腺病理,无从得知原始情况,后续手术及靶向治疗可以推测右肾上腺起码是以腺癌为优势成分的转移灶,甚至就以单纯腺癌形式存在。临床上不乏不同病理类型之间相互转化的报道,既定方案治疗在出现疾病进展后,受限于二次活检病理组织的取得,无法客观评估不同病理相互转化的发生率。本例由于患者的积极性,先后接受1次活检及2次手术,提供确切病理及基因检测,较完整阐述ASC中腺癌和鳞癌在病程中的主导优势及相互转化。病理转化是大概率或小概率事件,有待未来进一步深究。
综上所述,ASC在治疗过程中可出现病理的相互转化,在决策治疗方案时应该充分考虑;具有EGFR敏感突变的ASC患者能够从TKI治疗中获益,推荐对ASC患者进行常规EGFR基因检测;既定治疗方案出现疾病进展时,二次活检及基因检测的存在有其必要性。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Planchard D, Popat S, Kerr K, et al. Metastatic nonsmall cell lung cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(4): 192-237. |
| [3] |
郑清月, 闫春良, 赵秋红, 等. 盐酸埃克替尼治疗肺腺癌进展后加量治疗的疗效及安全性分析[J]. 实用肿瘤杂志, 2020, 35(3): 231-235. |
| [4] |
张萍, 武晓楠, 聂鑫, 等. 晚期肺腺癌EGFR基因突变及临床特征分析[J]. 实用肿瘤杂志, 2018, 33(2): 150-153. |
| [5] |
Zhu L, Jiang L, Yang J, et al. Clinical characteristics and prognosis of patients with lung adenosquamous carcinoma after surgical resection: results from two institutes[J]. J Thorac Dis, 2018, 10(4): 2397-2402. DOI:10.21037/jtd.2018.03.186 |
| [6] |
Travis WD, Brambilla E, Burke AP, et al. Introduction to The 2015 Word Health Organization chassicotion of tumors of the lung, pleura, thymas, and heart[J]. J Thorat Onclo, 2015, 10(9): 1240-1242. DOI:10.1097/JTO.0000000000000663 |
| [7] |
Mordant P, Grand B, Cazes A, et al. Adenosquamous carcinoma of the lung: surgical management, pathologic characteristics, and prognostic implications[J]. Ann Thorac Surg, 2013, 95(4): 1189-1195. DOI:10.1016/j.athoracsur.2012.12.037 |
| [8] |
Maeda H, Matsurnura A, Kawabata T, et al. Adenosquamous carcinoma of the lung: surgical results as compared with squamous cell and adenocarcinoma cases[J]. Eur J Cardiothorac Surg, 2012, 41(2): 357-361. DOI:10.1016/j.ejcts.2011.05.050 |
| [9] |
Powrozek T, Krawczyk P, Ramlau R, et al. EGFR gene mutations in patients with adenosquamous lung carcinoma[J]. Asia Pac J Clin Oncol, 2014, 10(4): 340-345. DOI:10.1111/ajco.12177 |
| [10] |
Shiozawa T, Ishii G, Goto K, et al. Clinicopathological characteristics of EGFR mutated adenosquamous carcinoma of the lung[J]. Pathol Int, 2013, 63(2): 77-84. DOI:10.1111/pin.12033 |
| [11] |
Vassella E, Langsch S, Dettmer MS, et al. Molecular profiling of lung adenosquamous carcinoma: hybrid or genuine type[J]. Oncotarget, 2015, 6(27): 23905-23916. DOI:10.18632/oncotarget.4163 |
| [12] |
Wang R, Pan Y, Li C, et al. Analysis of major known driver mutations and prognosis in resected adenosquamous lung carcinomas[J]. Thorac Oncol, 2014, 9(6): 760-768. DOI:10.1097/JTO.0b013e3182a406d1 |
| [13] |
Iwanaga K, Sueoka-Aragane N, Nakamura T, et al. The long-term survival of a patient with adenosquamous lung carcinoma harboring EGFR-activating mutations who was treated with gefitinib[J]. Int Medi, 2012, 51(19): 2771-2774. DOI:10.2169/internalmedicine.51.7428 |
| [14] |
Song Z, Lin B, Shao L, et al. Therapeutic efficacy of gefitinib and erlotinib in patients with advanced lung adenosquamous carcinoma[J]. J Chin Medi Associ (JCMA), 2013, 76(9): 481-485. DOI:10.1016/j.jcma.2013.05.007 |
| [15] |
Burkart J, Shilo K, Zhao W, et al. Metastatic squamous cell carcinoma component from an adenosquamous carcinoma of the lung with identical epidermal growth factor receptor mutations[J]. Case Rep Pulmonol, 2015, 2015: 283875. |
 2021, Vol. 36
2021, Vol. 36


