文章信息
- 高蕾, 孙世昌, 武明娟
- 肛管直肠恶性黑色素瘤免疫检查点抑制剂治疗一例
- 实用肿瘤杂志, 2021, 36(2): 177-180
-
通信作者
- 武明娟, E-mail: 15106766216@163.com
-
文章历史
- 收稿日期:2020-02-22
恶性黑色素瘤(malignant melanoma,MM)是一种常见的恶性肿瘤,死亡率高,预后差。我国恶性黑色素瘤发病率的年增长率约为3%~5%,每年约有2万例新发病例[1]。恶性黑色素瘤根据发病部位和发病原因分为慢性阳光损伤型(chronic sun-damaged,CSD)、非慢性阳光损伤型(non-chronic sun-damaged,non-CSD)、黏膜型和肢端型4种亚型,其中黏膜型恶性黑色素瘤好发生于头颈的鼻窦、口腔、直肠肛管、生殖道、泌尿道和胃肠道[2]。黏膜黑色素瘤(mucosal malignant melanoma)占所有黑色素瘤的约1.2%,肛管直肠恶性黑色素瘤(anorectal malignant melanoma,ARMM)占所有黏膜黑色素瘤的 < 25%[3]。肛管直肠恶性黑色素瘤发病率低,诊断难度大,容易误诊,分期无统一标准,治疗方法主要为手术治疗及系统治疗,而其系统治疗相关的临床推荐及研究证据相对缺乏,目前主要为放疗、化疗、靶向治疗和免疫检查点抑制剂治疗。本文报道1例接受免疫检查点抑制剂治疗的肛管直肠恶性黑色素瘤患者,进而探讨肛管直肠恶性肿瘤的病理诊断及其治疗方法。
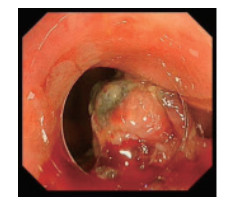
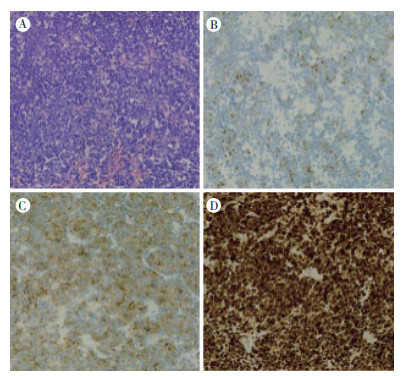
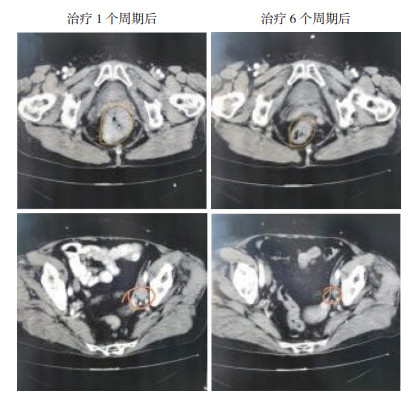
1 病例资料患者女性,67岁,既往体健。于2019年6月无明显诱因开始出现大便次数增多,为稀便,伴少量黄白色黏液,7~8次/d,伴下腹部下坠感,里急后重,对症治疗后无好转。于2019年8月开始出现大便带血,为暗红色血液,伴大便困难、变细。遂于2019年8月7日在当地医院行肠镜检查:距肛门1.0 cm见约2.0 cm×1.5 cm直肠隆起物,表面糜烂、亚蒂,质脆、易出血,直肠隆起物(癌?)见图 1。肿物活检病理示恶性黑色素瘤。免疫组织化学检查示,肿瘤细胞Melan-A(+),HMB45(+),S-100(+),细胞角蛋白(cytokeratin,CK;-),Ki-67(+)约60%(图 2)。2019年8月9日在外院行上下腹部+盆腔MRI提示直肠壁增厚,直肠癌符合;盆腔内左侧髂血管旁多发淋巴结,部分增大,考虑转移。神经元特异性烯醇化酶(neuron-specific enolase,NSE)16.53 ng/mL,甲胎蛋白(alpha fatoprotein,AFP)、糖类抗原125(carbohydrate antigen 125,CA125)、CA153、CA199、CA724、细胞角蛋白19片段(cytokeratin-19-fragment,CYFRA21-1)和癌胚抗原(carcino-embryonic antigen,CEA)均正常。外院胃肠外科会诊后排除手术指征。于2019年8月16日就诊本院,行直肠指诊:肛周未见赘生物,直肠进指1~5 cm可触及多个质硬肿物,肠腔狭窄,最大者约3.0 cm×2.5 cm,表面光滑,退指血染。患者完善相关实验室检查评估病情,未见远处转移,并多次建议患者完善B型RAF原癌基因(B-type Raf proto-oncogene,BRAF)和KIT基因检测指导治疗,患者及家属拒绝。结合患者病史、临床表现及实验室检查,临床诊断为肛管直肠恶性黑色素瘤,盆腔淋巴结转移。请上级医院会诊后仍不考虑手术治疗,于2019年8月20日开始行程序性死亡受体-1(programmed death-1,PD-1)抑制剂卡瑞利珠单抗治疗,具体用法为:卡瑞利珠单抗200 mg静脉滴注×1 d,14 d为1个周期。患者4个周期治疗后自觉症状好转,拒绝复查评估疗效,6个周期治疗后再次建议患者完善检查,复查腹盆腔CT提示,肿瘤病灶较前明显缩小(图 3),且无新发病灶,患者未出现明显不良反应。根据实体瘤疗效评价标准1.1[response evaluation criteria in solid tumors(version 1.1),RECIST1.1][4],疗效评价为部分缓解(partial response,PR),目前患者继续治疗中。
|
| 图 1 内镜下直肠肿物 |
|
| 注 A: 常规病理检查结果(HE×20);B:免疫组织化学检查示HMB-45表达阳性(SP×100);C:免疫组织化学检查示melan-A表达阳性(SP×100);D:免疫组织化学检查示S-100表达阳性(SP×100) 图 2 直肠肿物常规病理及免疫组织化学检查结果 |
|
| 注 红圈示肿瘤原发及转移病灶 图 3 患者治疗后盆腔CT检查结果 |
2讨论
肛管直肠恶性黑色素瘤是一种比较罕见的恶性肿瘤,其诊断及治疗存在一定困难。原发性肛管直肠恶性黑色素瘤通常发生在离肛门边缘6 cm的范围内[3],多数缺乏特异的临床表现,主要表现为便血、脱出、疼痛、大便习惯改变、下腹部坠胀和里急后重等[5-6]。病理活检联合免疫组织化学仍是其诊断的金标准。
肛管直肠恶性黑色素瘤组织及细胞形态多种多样,以梭形细胞和上皮样细胞为主,上皮样细胞排列成腺管样和巢团样,需注意与癌的区别,多数肿瘤细胞内可见黑色素颗粒。对于没有黑色素颗粒的需要用免疫组织化学标记鉴别[7]。免疫组织化学对黑色素瘤的诊断很有意义。HMB45是1种抗gp100抗体,标记在未成熟和活化黑色素细胞表皮内的细胞质,特异度高,敏感度为69%~93%[8]。Melan-A是1种黑色素体相关的糖蛋白,表达于黑色素细胞,可以作为黑色素细胞的标志物[8-9]。S-100蛋白是一种可溶性蛋白,在黑色素细胞及其他来源的细胞中均有表达,其敏感度较高,特异度较低[10-11]。肛管直肠恶性黑色素瘤形态变异复杂,加上部分瘤细胞内无色素及免疫表型变异,增加其诊断难度,容易出现误诊[12]。本例S-100蛋白、Melan-A和HMB45的表达均为阳性。
肛管直肠恶性黑色素瘤恶性程度高,预后差,5年总生存率 < 20%[5]。患者从诊断到死亡,平均生存时间为8.0~18.6个月[13]。外科手术治疗是其首选治疗方案,但是对于术后辅助治疗及无法手术治疗的病例,目前临床缺乏相应的诊治指南及规范,治疗尚存在一定的争议。近年来,免疫检查点抑制剂治疗在恶性肿瘤的治疗中受到越来越多的关注,其中PD-1/程序性死亡配体-1(programmed death-ligand 1,PD-L1)信号通路是参与肿瘤免疫逃逸的重要途径[14]。PD-1是1种多表达于T细胞表面的跨膜受体,属于免疫球蛋白超家族共刺激分子白细胞分化抗原28/细胞毒性T淋巴细胞相关抗原4(cluster of differentiation 28/cytotoxic T lymphocyte antigen 4,CD28/CTLA-4)亚家族,表达于T细胞、B细胞、单核细胞、自然杀伤细胞、树突状细胞和多种肿瘤浸润淋巴细胞(tumor -infiltrating lymphocytes,TILs),是抑制性受体,在调节T细胞活性过程中发挥重要作用,能够调节细胞免疫和耐受[15]。PD-L1是由9号染色体上的CD 74基因编码的跨膜蛋白,表达于自然杀伤细胞、巨噬细胞、髓样树突状细胞、B细胞、静息T细胞、上皮细胞和肿瘤细胞中[15]。为对抗免疫攻击,肿瘤细胞过度表达PD-L1,与T细胞上的PD-1受体结合,可以介导免疫反应的负调控信号,抑制T细胞的活化,诱导细胞因子的产生,从而抑制对肿瘤抗原的有效T细胞反应,是导致肿瘤细胞免疫逃逸的重要机制之一[15-16]。针对该通路的抗体(PD-1/PD-L1抑制剂)可以阻断PD-1与PD-L1的结合,阻断负向调控机制,重新激活T细胞对肿瘤的免疫应答效应从而达到抗肿瘤的作用[16]。
肛管直肠恶性黑色素瘤对放化疗并不敏感。有报道研究紫杉醇联合铂类治疗肛管直肠恶性黑色素瘤,中位生存期仅11个月[17]。中国黑色素瘤患者BRAF基因变异研究显示,BRAF的突变率为25.2%,肢端和黏膜型的突变率分别为15.5%和12.5%。c-KIT突变在黑色素瘤中仅占3%,但在慢性日光皮损相关黑色素瘤和肢端及黏膜等特定部位黑色素瘤中可占23%,因此以BRAF和c-KIT基因为靶目标的靶向治疗对中国黑色素瘤患者有一定疗效[18],但也存在临床疗效持续时间较短,爆发耐药问题[19]。目前免疫检查点抑制剂治疗是一个新的治疗方向。研究表明,免疫检查点抑制剂治疗可提高患者2年生存率[20],尤其是表达TILs及PD-L1的患者。但肛管直肠恶性黑色素瘤患者中TILs发生率低,PD-L1在肿瘤细胞中占比很低(< 10%),PD-1治疗存在局限性,治疗效果因人而异。中国晚期黏膜黑色素瘤患者对PD-1单抗治疗的客观反应率 < 20%。基于现状,中国率先开展一项PD-1单抗(JS001)联合阿昔替尼治疗黏膜型黑色素瘤的Ⅰ期临床研究,初步结果显示,两药联合的客观反应率达50%,疾病控制率为87.5%[19]。
综上所述,肛管直肠恶性黑色素瘤发病率低,恶性程度高,预后差。在诊断方面容易出现误诊,且治疗方面缺乏相应研究,免疫检查点抑制剂治疗在肛管直肠恶性黑色素瘤的治疗中有一定的局限性。但在本例患者的治疗中,PD-1抑制剂显示出一定的临床效果,其总体疗效评价仍需进一步探究。
| [1] |
Guo J, Qin S, Liang J, et al. Chinese guidelines on the diagnosis and treatment of melanoma (2015 edition)[J]. Ann Transl Med, 2015, 3(21): 322. |
| [2] |
李治, 张林梦, 斯越秀, 等. 恶性黑色素瘤的研究进展[J]. 药物生物技术, 2018, 25(1): 70-74. |
| [3] |
欧阳泽颖, 阳惠湘, 刘小伟, 等. 原发性肛管直肠恶性黑色素瘤病例1例并文献复习[J]. 中国普通外科杂志, 2019, 28(5): 641-644. |
| [4] |
Eisenhauer EA, Verweij J. New response evaluation criteria in solid tumors: RECIST GUIDELINE VERSION 1.1[J]. EJC Supplements, 2009, 7(2): 228-247. |
| [5] |
Nusrath S, Thammineedi SR, Murthy S, et al. Anorectal malignant melanoma-defining the optimal surgical treatment and prognostic factors[J]. Indian J Surg Oncol, 2018, 9(4): 519-523. DOI:10.1007/s13193-018-0791-1 |
| [6] |
Atak I. Anorectal malignant melanoma: retrospective analysis of six patients and review of the literature[J]. Prague Med Rep, 2018, 119(2/3): 97-106. |
| [7] |
沈琴芝. 16例肛管直肠恶性黑色素瘤的临床病理分析[J]. 世界最新医学信息文摘, 2019, 19(36): 83. |
| [8] |
Uguen A, Talagas M, Costa S, et al. A p16-Ki-67-HMB45 immunohistochemistry scoring system as an ancillary diagnostic tool in the diagnosis of melanoma[J]. Diagn Pathol, 2015, 10(1): 195. DOI:10.1186/s13000-015-0431-9 |
| [9] |
Song HZ, Kono M, Tomita Y. Establishment of a screening system for chemicals that upregulate a melanoma antigen, melan-A/MART-1[J]. Tohoku J Exp Med, 2009, 217(3): 231-237. DOI:10.1620/tjem.217.231 |
| [10] |
尹占东, 夏建新, 王延龙, 等. MITF、S-100蛋白、HMB45在黑素瘤以及色素痣中的表达及意义[J]. 中国实验诊断学, 2011, 15(12): 2039-2040. DOI:10.3969/j.issn.1007-4287.2011.12.019 |
| [11] |
陆爱权, 吴海清, 覃宗升, 等. S-100、HMB-45和Tyrosinase在恶性黑色素瘤中的表达及其意义[J]. 中国医药导报, 2012, 9(16): 27-28. DOI:10.3969/j.issn.1673-7210.2012.16.011 |
| [12] |
叶明福, 张哉根, 王亚丽, 等. 恶性黑色素瘤组织学变异型与鉴别诊断[J]. 临床与实验病理学杂志, 2004, 20(5): 588-591. DOI:10.3969/j.issn.1001-7399.2004.05.021 |
| [13] |
李鹏, 钟进, 刘筠. 不典型肛管直肠恶性黑色素瘤诊断并文献复习[J]. 国际医学放射学杂志, 2016, 39(2): 175-178. |
| [14] |
赵静, 苏春霞. 《CSCO免疫检查点抑制剂相关的毒性管理指南》解读: 对比NCCN免疫治疗相关毒性管理指南[J]. 实用肿瘤杂志, 2020, 35(1): 11-15. |
| [15] |
Jayaraj P, Sen S. Evaluation of PD-L1 and PD-1 expression in aggressive eyelid sebaceous gland carcinoma and its clinical significance[J]. Indian J Ophthalmol, 2019, 67(12): 1983-1987. DOI:10.4103/ijo.IJO_2056_18 |
| [16] |
鹿玉印, 郭秀丽. 靶向抑制PD-L1/PD-1的免疫治疗恶性黑色素瘤新进展[J]. 中国药学杂志, 2015, 50(22): 1931-1935. |
| [17] |
Singhal NK, Ostwal VS, Shrikhande SV, et al. Systemic therapy in anorectal melanomas: Does choice of systemic therapy matter?[J]. J Clin Oncol, 2016, 34(Suppl 4): 731. |
| [18] |
段然, 梁筱, 李青峰. 恶性黑色素瘤的分子靶向治疗进展[J]. 实用肿瘤杂志, 2017, 32(6): 563-569. |
| [19] |
齐忠慧, 斯璐. 恶性黑色素瘤治疗新进展[J]. 中国肿瘤临床, 2019, 46(5): 213-217. |
| [20] |
Dodds TJ, Wilmott JS, Jackett LA, et al. Primary anorectal melanoma: clinical, immunohistology and DNA analysis of 43 cases[J]. Pathology, 2019, 51(1): 39-45. |
 2021, Vol. 36
2021, Vol. 36


