文章信息
- 刘立, 王嘉豪, 白奇, 侯君, 郭剑明
- 肾细胞癌HER2蛋白表达的临床意义
- 实用肿瘤杂志, 2023, 38(6): 573-576
基金项目
- 国家自然科学基金(81974393)
-
通信作者
- 郭剑明, E-mail: guo.jianming@zs-hospital.sh.cn
-
文章历史
- 收稿日期:2022-03-24
2. 复旦大学附属中山医院病理科, 上海 200032
肾癌又称肾细胞癌(renal cell carcinoma, RCC),是起源于肾实质肾小管上皮的恶性肿瘤。2020年全球肾脏恶性肿瘤新发病例431 288例,死亡179 368例[1]。中国RCC发病率也逐年递增,男性发病率和病死率远高于女性[2]。RCC的药物治疗进展很快,近20年就经历了细胞因子治疗、靶向药物治疗和免疫治疗时代。但免疫治疗的客观缓解率(objective response rate,ORR)仍有限,且非透明RCC病理种类很多,针对不同病理类型没有明确的指南推荐。随着精准医学的不断发展,分子分型和分子靶向治疗被认为能够对精准治疗起指导作用。目前已有多种针对人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的抗体耦联药物上市,包括恩美曲妥珠单抗、trastuzumab deruxtecan(T-DXd)和维迪西妥单抗等。本研究通过免疫组织化学(immunohistochemistry, IHC)法检测RCC患者中HER2蛋白表达,探讨HER2表达水平与RCC临床特征的关系,为HER2阳性RCC患者的精准治疗提供依据。
1 资料与方法 1.1 一般资料选取2021年10月至12月复旦大学附属中山医院收治的78例RCC患者手术样本。其中,男性62例(79.5%),女性16例(20.5%);年龄25~80岁,中位年龄59岁。纳入标准:(1)术后病理确诊为RCC;(2)年龄 > 18岁;(3)术前未接受过新辅助治疗。排除标准:(1)合并其他恶性肿瘤;(2)临床资料缺失;(3)合并其他心、肺和肝等重要脏器疾病。本研究已获得复旦大学附属中山医院伦理委员会批准。所有纳入研究患者均已签署知情同意书。
1.2 HER2蛋白IHC检测IHC检测仪器Leica BOND Ⅲ购自徕卡显微系统(上海)贸易有限公司。一抗采用鼠抗人单克隆抗体CerbB-2(克隆号:CB11),购自福州迈新生物技术开发有限公司,稀释度为1∶300。修复条件为pH9.0 EDTA修复液20 min。二抗检测系统Leica DS9800购自徕卡显微系统(上海)贸易有限公司。组织切片后60℃烤片2 h。组织切片一侧贴上标签(切片上条形码与试剂上的特异性抗体条形码相配套),放入仪器,在仪器上放置相应的抗体(包括特异性一抗和DS9800)。输入染色程序(pH9.0 EDTA抗原修复20 min,H2O2孵育5 min,一抗孵育15 min,二抗孵育8 min,苏木精对比染色5 min),开机启动后约120 min染色完毕并报警。取出切片水洗后梯度乙醇脱水至二甲苯, 中性树胶封固。结果判定:无着色为IHC -;肿瘤细胞呈现微弱或隐约可见的细胞膜着色为IHC 1+;肿瘤细胞呈现弱至中度基底侧膜、侧膜或完整的膜着色为IHC 2+;肿瘤细胞呈现强的基底侧膜、侧膜或完整的膜着色为IHC 3+。
1.3 统计学分析采用SPSS 22.0统计学软件进行数据分析。计数资料组间比较采用χ2检验或Fisher精确检验。以P < 0.05为差异具有统计学意义。
2 结果HER2蛋白定位于细胞膜,可表现为基侧膜、侧膜或完整膜阳性表达(图 1)。78例RCC样本中,HER2蛋白阳性18例(23.1%,表 1)。其中,15例为IHC 1+,3例为IHC 2+。男性患者HER2阳性率有高于女性的趋势,但差异无统计学意义(25.8% vs 12.5%,P > 0.05)。78例RCC中,病理类型为透明细胞型者66例(84.6%),其中HER2阳性13例,占总例数的16.7%。特殊病理类型RCC 3例,分别为1例小眼症转录因子(microphthalmia-associated transcription factor,MiT)家族易位性RCC、1例透明细胞乳头状RCC以及1例组织学类型难以区分的RCC。嫌色细胞型RCC 7例。71例非嫌色细胞型RCC中,国际泌尿系统病理学会/世界卫生组织(International Society of Urological Pathology/World Health Organization,ISUP/WHO)分级Ⅱ级55例,占比最多(77.5%)。78例患者中无远处转移,T分期主要为T1期,T1a占比66.7%,T1b占比29.5%。在不同病理类型、ISUP/WHO分级和T分期方面HER2表达比较,差异均无统计学意义(均P > 0.05)。≤60岁者HER2表达比例有高于 > 60岁者的趋势,但差异无统计学意义(P=0.262)。
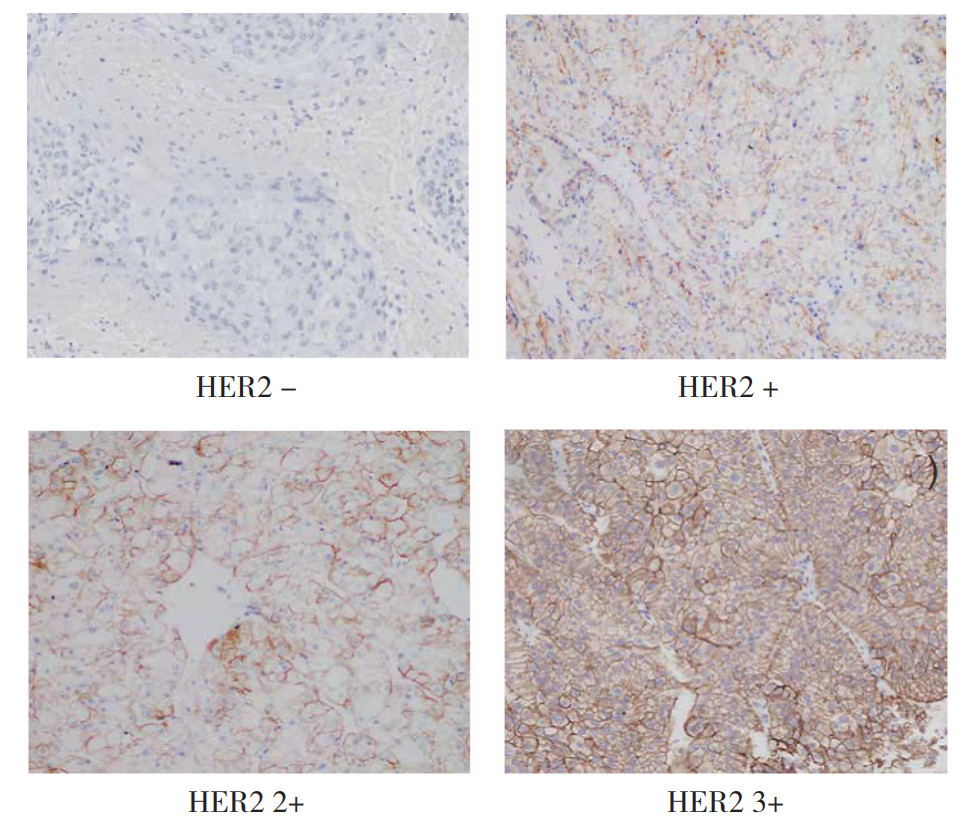
|
| 注 HER2:人表皮生长因子受体2(human epidermal growth factor receptor 2) 图 1 RCC患者不同HER2表达强度的免疫组织化学检查结果(SP×100) |
| 临床特征 | 总例数 | HER2阳性(n=18) | HER2阴性(n=60) | χ2值 | P值 |
| 年龄 | 1.259 | 0.262 | |||
| > 60岁 | 35(44.9) | 6(17.1) | 29(82.9) | ||
| ≤60岁 | 43(55.1) | 12(27.8) | 31(82.2) | ||
| 性别 | 0.630 | 0.427 | |||
| 男性 | 62(79.5) | 16(25.8) | 46(74.2) | ||
| 女性 | 16(20.2) | 2(12.5) | 14(87.5) | ||
| ISUP/WHO分级* | - | 0.897 | |||
| Ⅰ级 | 8(11.4) | 2(25.0) | 6(75.0) | ||
| Ⅱ级 | 55(77.5) | 12(21.8) | 43(78.2) | ||
| Ⅲ级 | 8(11.3) | 1(12.5) | 7(87.5) | ||
| Ⅳ级 | 0(0.0) | 0 | 0 | ||
| T分期 | - | 0.142 | |||
| TIa | 52(66.7) | 10(19.2) | 42(80.8) | ||
| T1b | 23(29.5) | 6(26.1) | 17(73.9) | ||
| T2 | 0(0.0) | 0 | 0 | ||
| T3 | 3(3.9) | 2(66.7) | 1(33.3) | ||
| T4 | 0(0.0) | 0 | 0 | ||
| 病理类型 | - | 0.187 | |||
| 透明细胞型 | 66(84.6) | 13(19.7) | 53(80.3) | ||
| 乳头状细胞型 | 2(2.6) | 1(50.0) | 1(50.0) | ||
| 嫌色细胞型 | 7(9.0) | 3(42.9) | 4(57.1) | ||
| 特殊病理类型 | 3(3.8) | 1(33.3) | 2(66.7) | ||
| 手术方式 | 0.067 | 0.796 | |||
| 肾部分切除术 | 50(60.1) | 12(24.0) | 38(76.0) | ||
| 根治性切除术 | 28(35.9) | 6(21.4) | 22(78.6) | ||
| 注 HER2:人表皮生长因子受体2(human epidermal growth factor receptor 2);ISUP/WHO:国际泌尿系统病理学会/世界卫生组织(International Society of Urological Pathology/World Health Organization);*7例嫌色细胞型RCC无ISUP/WHO分级 | |||||
近年来,我国RCC新发病例逐年上升,对于局限性RCC可采取手术治疗,但对于复发或转移的晚期RCC患者则需要系统性的全身治疗[3-4]。随着免疫治疗在RCC患者中的应用,晚期RCC患者的预后有明显改善[5]。KEYNOTE 426[6]、JAVELIN Renal 101[7]和CLEAR[8]等多项国际大型3期临床研究表明,酪氨酸激酶抑制剂与免疫检查点抑制剂联合应用较单独抗血管生成药物能提高晚期转移性RCC患者的ORR,延长患者生存期。在KEYNOTE 426研究中,研究者采用帕博丽珠单抗联合阿昔替尼对比舒尼替尼单药治疗晚期转移性RCC患者,联合用药组和舒尼替尼单药组患者中位无进展生存期分别15.1个月和11.1个月,ORR分别为59.3%和35.7%[6]。除程序性死亡受体-1(programmed death-1,PD-1)抑制剂外,程序性死亡受体配体-1(programmed death ligand-1,PD-L1)抑制剂联合抗血管生成药物同样也取得类似疗效。据JAVELIN Renal 101研究结果显示,应用阿维鲁单抗联合阿昔替尼的晚期转移性肾癌患者中位无进展生存期为13.8个月,ORR为51.4%,较舒尼替尼组提高5.4个月和25.7%[7]。除了传统的联用阿昔替尼,2021年研究显示,帕博丽珠单抗联合仑伐替尼能够延长患者生存,而且不仅是无进展生存期的获益,还有总生存期的延长[8]。使用帕博丽珠单抗联合仑伐替尼的患者中位无进展生存期可达23.9个月,几乎延长1倍,而且ORR也达到71%,远超之前的组合药物。虽然免疫联合靶向药物极大延长患者生存期,但仍有部分患者在用药一段时间后出现免疫治疗抵抗,甚至出现肿瘤超进展,预后较差[9]。考虑到RCC的高度异质性,探索新的联合用药方式或药物靶点以采取个体化治疗方案是RCC治疗的关键。
随着对疾病研究的不断深入,精准医疗日益成为肿瘤治疗的新方向。HER2作为一种具有信号转导作用的生长因子,具有跨膜酪氨酸激酶活性,在许多实体瘤中均呈现高表达状态,而在正常组织中仅微量表达[10]。针对HER2的抗体耦联药物已经在晚期胃癌[11-12]、乳腺癌[13-14]、结直肠癌和尿路上皮癌中取得令人鼓舞的疗效。HER2变异的患者在结直肠癌中有着更差的预后,并可能对表皮生长因子受体(epidermal growth factor receptor,EGFR)靶向药耐药[15]。在各项临床研究中,对于HER2表达程度的判断方式主要是IHC,必要时行荧光原位杂交(fluorescence in situ hybridization,FISH)检测。最为广泛使用的评定HER2阳性的标准主要是参照乳腺癌[14]。但不同的实体瘤中对于HER2阳性的判断标准也有一些细微差异。在结直肠癌中HER2 IHC 3+或IHC 2+且FISH检测阳性评定为HER2阳性[16]。在尿路上皮癌中HER2 IHC 3+ 或IHC 2+就可以认为HER2阳性[17]。胃癌中IHC的判定与乳腺癌相同,胃癌病理特征中的Lauren分型也是预测HER2表达的关键因素[11]。2022年发布的DESTINY-Breast04研究结果显示,HER2 IHC 2+且FISH检测阴性或IHC 1+的患者在靶向HER2的抗体耦联药物T-DXd治疗后同样延缓疾病进展[18]。因此,为了指导患者用药,HER2阳性的判定标准还需要进一步研究。目前获得美国食品药品管理局(Food and Drug Administration,FDA)批准的靶向HER2的抗体耦联药物包括恩美曲妥珠单抗、T-DXd和维迪西妥单抗,其中维迪西妥单抗在针对HER2的单克隆抗体上耦联高效的细胞毒性分子一甲基澳瑞他汀E(monomethyl auristatin E,MMAE),不仅可精准杀伤HER2阳性的肿瘤细胞,还可以产生旁杀伤效应,对HER2低表达的肿瘤细胞进行杀伤。此外,维迪西妥单抗可裂解的连接子能靶向免疫抑制细胞,改善肿瘤抑制性的免疫微环境,从而与免疫治疗药物产生协同作用。RC48-C014研究结果显示,维迪西妥单抗联合特瑞普利单抗治疗局部晚期或转移性尿路上皮癌的ORR高达94.1%;初治患者中,联合方案ORR更高达100%,为患者带来巨大临床获益[17]。HER2高表达(HER2 2+或3+)患者ORR为83.3%。而HER2低表达(HER2 1+)患者ORR仍有66.7%。
研究显示,免疫检查点抑制剂与抗体耦联药物联用能有效抑制肿瘤的生长[19]。与全身化疗或其他靶向药比较,抗体耦联药物可以高度特异性地与肿瘤细胞结合,有效减少其他健康器官的不良反应。而且免疫检查点抑制剂与抗体耦联药物联用还可以有效降低药物的最低有效剂量,减少剂量依赖的药物毒性,为RCC的后线治疗提供更多的选择。
本研究通过IHC检查探究RCC患者中HER2蛋白的表达发现,HER2蛋白表达的比例高达23.1%,而且与病理类型、ISUP/WHO分级、年龄和性别等临床特征无关。考虑到维迪西妥单抗与免疫检查点抑制剂在尿路上皮癌中的惊人疗效与RCC对免疫治疗的敏感性,对HER2阳性的RCC患者,维迪西妥单抗与免疫检查点抑制剂联合用药可能为临床医师提供新的治疗选择。
| [1] |
Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA A Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [3] |
Capitanio U, Montorsi F. Renal cancer[J]. Lancet, 2016, 387(10021): 894-906. DOI:10.1016/S0140-6736(15)00046-X |
| [4] |
Choueiri TK, Motzer RJ. Systemic therapy for metastatic renal-cell carcinoma[J]. N Engl J Med, 2017, 376(4): 354-366. DOI:10.1056/NEJMra1601333 |
| [5] |
Xu WX, Atkins MB, McDermott DF. Checkpoint inhibitor immunotherapy in kidney cancer[J]. Nat Rev Urol, 2020, 17(3): 137-150. DOI:10.1038/s41585-020-0282-3 |
| [6] |
Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus axitinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2019, 380(12): 1116-1127. DOI:10.1056/NEJMoa1816714 |
| [7] |
Motzer RJ, Penkov K, Haanen J, et al. Avelumab plus axitinib versus sunitinib for advanced renal-cell carcinoma[J]. N Engl J Med, 2019, 380(12): 1103-1115. DOI:10.1056/NEJMoa1816047 |
| [8] |
Motzer R, Alekseev B, Rha SY, et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma[J]. N Engl J Med, 2021, 384(14): 1289-1300. DOI:10.1056/NEJMoa2035716 |
| [9] |
Schoenfeld AJ, Hellmann MD. Acquired resistance to immune checkpoint inhibitors[J]. Cancer Cell, 2020, 37(4): 443-455. DOI:10.1016/j.ccell.2020.03.017 |
| [10] |
Tsurutani J, Iwata H, Krop I, et al. Targeting HER2 with trastuzumab deruxtecan: a dose-expansion, phase Ⅰ study in multiple advanced solid tumors[J]. Cancer Discov, 2020, 10(5): 688-701. DOI:10.1158/2159-8290.CD-19-1014 |
| [11] |
王妍, 刘天舒. 2021年胃癌药物治疗盘点[J]. 实用肿瘤杂志, 2022, 37(2): 107-111. |
| [12] |
Shitara K, Iwata H, Takahashi S, et al. Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive gastric cancer: a dose-expansion, phase 1 study[J]. Lancet Oncol, 2019, 20(6): 827-836. DOI:10.1016/S1470-2045(19)30088-9 |
| [13] |
Modi SN, Saura C, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer[J]. N Engl J Med, 2020, 382(7): 610-621. DOI:10.1056/NEJMoa1914510 |
| [14] |
Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer[J]. N Engl J Med, 2012, 367(19): 1783-1791. DOI:10.1056/NEJMoa1209124 |
| [15] |
米迷, 翁姗姗, 陆德珉, 等. 2021年晚期结直肠癌治疗研究进展[J]. 实用肿瘤杂志, 2022, 37(1): 23-28. |
| [16] |
Siena S, di Bartolomeo M, Raghav K, et al. Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): a multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2021, 22(6): 779-789. DOI:10.1016/S1470-2045(21)00086-3 |
| [17] |
Sheng XN, Yan XQ, Wang L, et al. Open-label, multicenter, phase Ⅱ study of RC48-ADC, a HER2-targeting antibody-drug conjugate, in patients with locally advanced or metastatic urothelial carcinoma[J]. Clin Cancer Res, 2021, 27(1): 43-51. DOI:10.1158/1078-0432.CCR-20-2488 |
| [18] |
Horisawa N, Adachi Y, Takatsuka D, et al. The frequency of low HER2 expression in breast cancer and a comparison of prognosis between patients with HER2-low and HER2-negative breast cancer by HR status[J]. Breast Cancer, 2022, 29(2): 234-241. DOI:10.1007/s12282-021-01303-3 |
| [19] |
Huang L, Wang RQ, Xie K, et al. A HER2 target antibody drug conjugate combined with anti-PD-(L)1 treatment eliminates hHER2+ tumors in hPD-1 transgenic mouse model and contributes immune memory formation[J]. Breast Cancer Res Treat, 2022, 191(1): 51-61. DOI:10.1007/s10549-021-06384-4 |
 2023, Vol. 38
2023, Vol. 38


