文章信息
- 张子辰, 谭玉培, 张董晓, 付娜, 东浩, 黄巧, 赵文洁, 孙宇建
- 巨大乳腺交界性叶状肿瘤诊治一例
- 实用肿瘤杂志, 2023, 38(1): 66-69
基金项目
- 北京市自然科学基金(7202064);北京市百千万人才工程(2019A31)
-
通信作者
- 张董晓, E-mail: morningdong@163.com
-
文章历史
- 收稿日期:2021-08-04
2. 北京中医药大学研究生院, 北京 100029
乳腺叶状肿瘤(phyllodes tumor of the breast,PTB)是由乳腺上皮组织和纤维结缔组织组成的纤维上皮性肿瘤,其主要表现为乳房无痛性肿块,临床易误诊,需与乳腺纤维腺瘤(breast fibroadenoma,BF)相鉴别。本文从首都医科大学附属北京中医医院乳腺科收治的1例巨大PTB患者入手进行分析,旨在提高对PTB的认识。
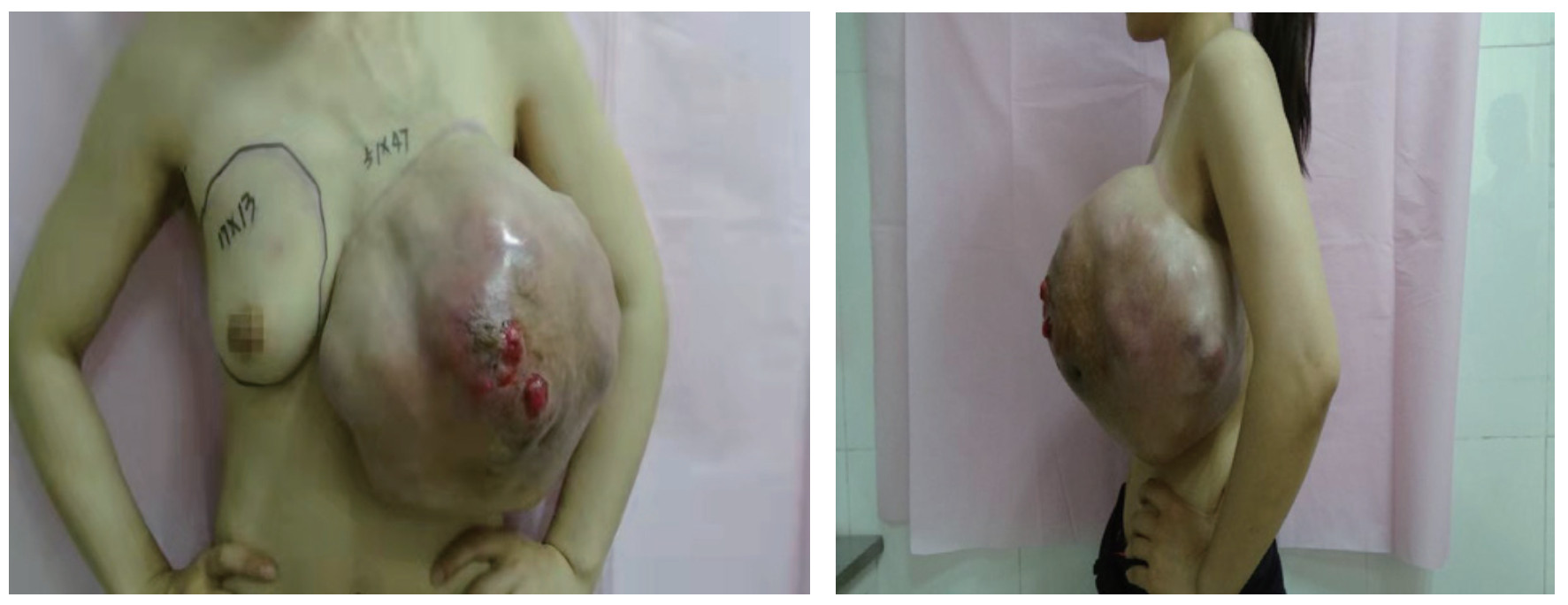
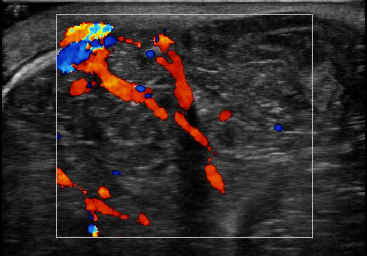
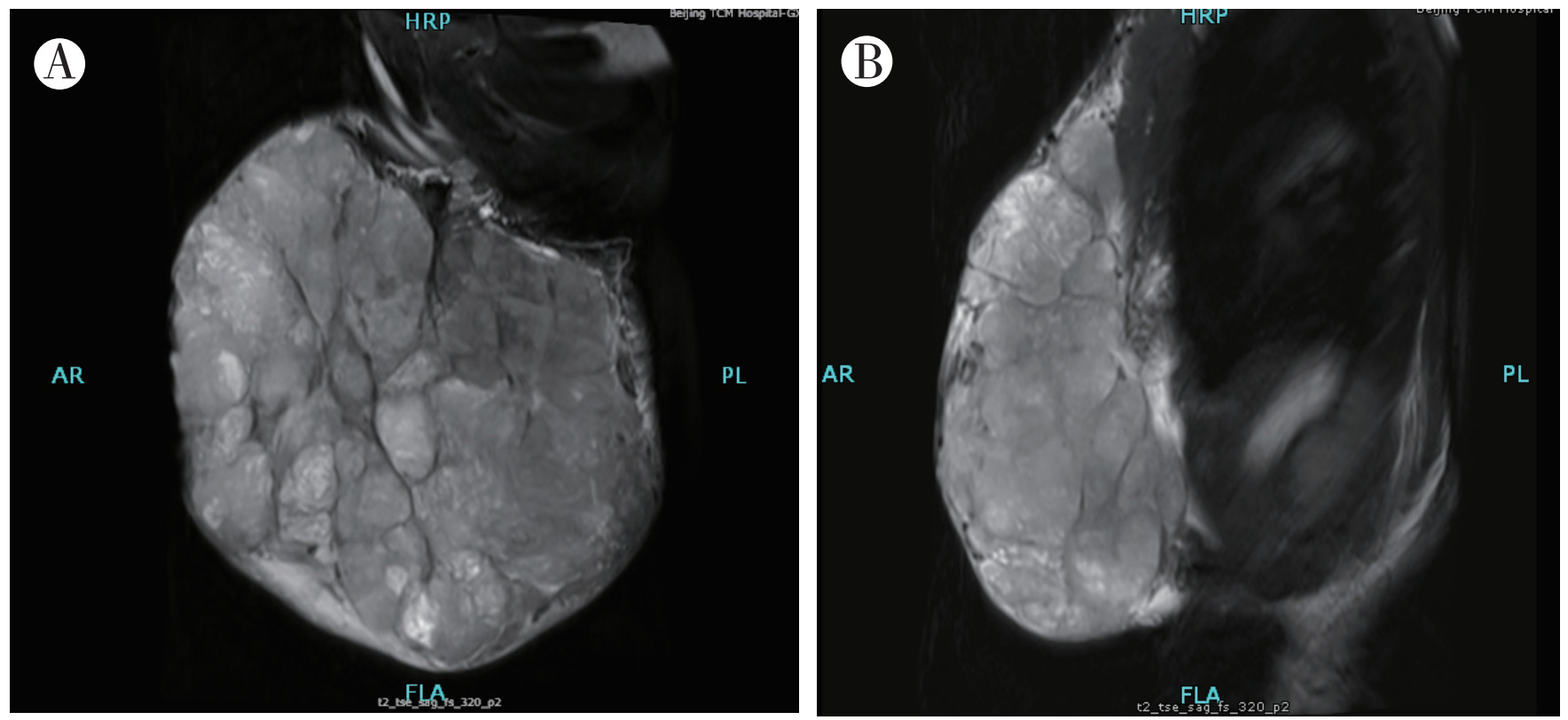
1 病例资料患者女性,31岁,主因“发现左乳肿物3年余,进行性增大1年余”于2018年7月9日入院。患者2015年3月出现左乳肿物,未予以重视。近1年来左乳肿物明显进行性增大。2018年6月下旬左乳晕附近出现局部破溃,2018年7月3日完善左乳肿物穿刺活检术,病理检查结果示:乳腺纤维上皮性肿瘤,局部间质生长较活跃。既往史:2014年9月曾因左乳肿物大小约8 cm×8 cm×5 cm,于外院行左乳肿物切除手术;术后病理检查示:左乳纤维上皮性肿瘤,部分为纤维腺瘤,部分为分叶状肿瘤,核分裂密集处达8~9个/10 HPF,考虑为交界性,需警惕低级别恶性叶状肿瘤可能。专科查体:双乳不对称,左乳头重度内陷,左乳不规则巨大肿物,内上可见多处破溃伴少量渗液,局部肉芽高突,皮色红,皮温稍高,周径约51 cm×47 cm,底围74 cm,触之多发囊性感,边界尚清晰,活动度可,压痛不明显(图 1)。乳腺彩色多普勒超声示:左乳巨大实性占位,较厚处约13 cm,内可见丰富血流信号(图 2)。乳腺MRI检查示:左侧乳腺见巨大肿物,大小约11.8 cm×19.9 cm×21.1 cm,呈混杂的等T1稍长T2信号影,内见分隔影,T1WI序列见少许斑片状高信号,压脂后未见减低,考虑出血灶;肿物与后方胸小肌、胸大肌及部分冈下肌分界不清(图 3)。
|
| 图 1 巨大乳腺叶状肿瘤患者2018年6月28日站立位正面照及侧面照 |
|
| 图 2 巨大乳腺叶状肿瘤患者2018年6月28日乳腺彩色多普勒超声图 |
|
| 注 A:乳腺MRI检查可见左侧巨大肿瘤呈叶状分隔;B:乳腺MRI检查可见左侧巨大肿瘤侵及胸肌 图 3 巨大乳腺叶状肿瘤患者2018年6月28日乳腺MRI检查影像图 |
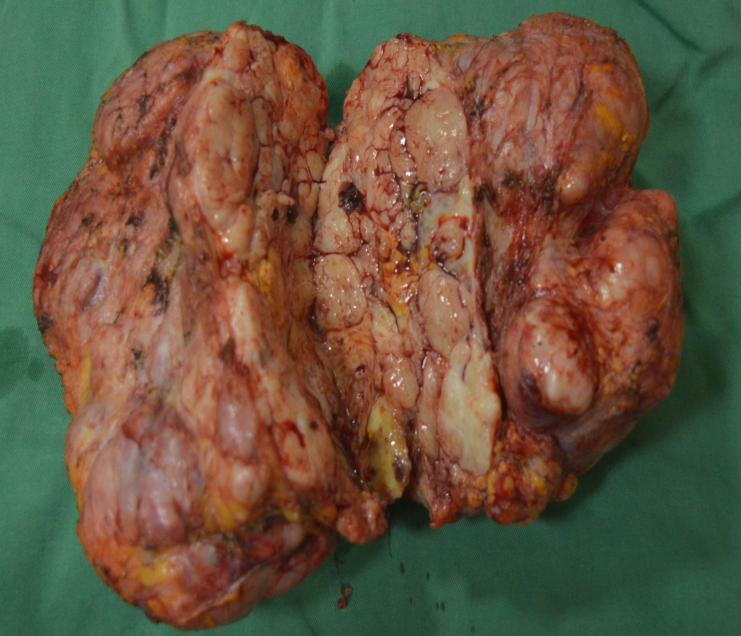
入院后完善各项相关检查,未见明确手术禁忌证,未见其他部位可疑病变。经多学科会诊讨论,为减少术中出血,2018年7月12日于介入室先行局麻数字减影血管造影(digital subtraction angiography,DSA)下经导管行选择性胸主动脉、左侧锁骨下动脉-胸廓内动脉和左侧锁骨下动脉分支造影;DSA下超选择性左侧胸廓内动脉和左侧锁骨下动脉分支栓塞术,后于手术室全麻气管插管下行左侧乳房根治性切除术,术中可见:肿物包膜完整,血供丰富,肿物直径约27 cm,移去标本称重3 kg,切开标本见肿物内部分隔,叶状生长。手术连同部分肌肉组织完整切除(图 4)。
|
| 图 4 巨大乳腺叶状肿瘤患者2018年7月12日左乳肿瘤切开外观 |
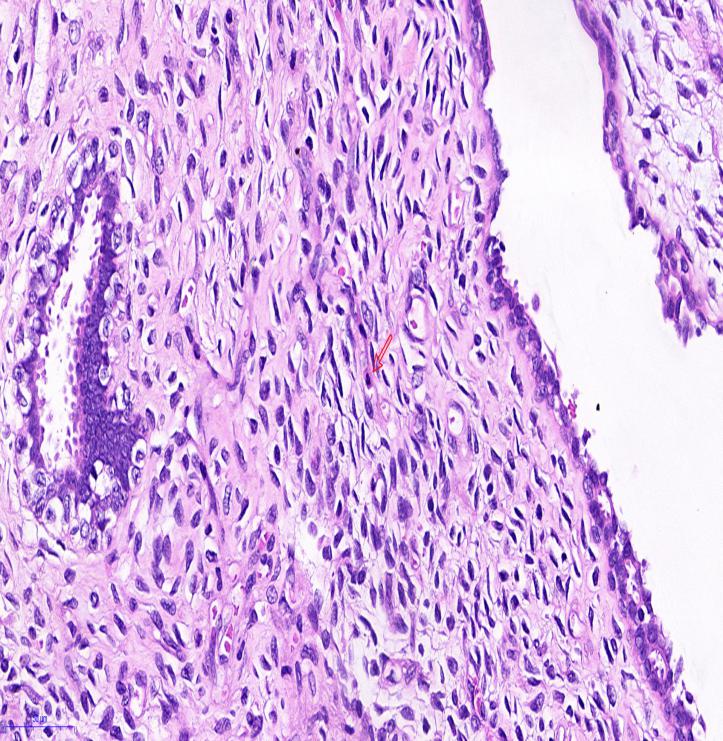
术后病理检查示:左乳乳腺交界性叶状肿瘤,核分裂密集处5个/10 HPF,局部生长活跃,部分区域间质玻璃样变伴凝固性坏死;肿瘤基底部部分区域呈浸润性生长并侵犯胸大肌组织,局灶紧邻基底切缘(图 5)。免疫组织化学检查结果:蜡块号1,ER(腺体+),CK5/6(腺体+),Ki-67(间质密集区+,10%),E-Cadherin(腺体+),CK14(腺体+);蜡块号2,CD34(间质+),Bcl-2(部分+),EMA(-),Ki-67(间质密集区+,5%),SMA(+)。术后建议患者定期随访,未行辅助放疗。
|
| 注 可见核分裂相(箭头示) 图 5 巨大乳腺叶状肿瘤患者2018年7月12日手术标本病理检查结果(HE×400) |
PTB是一种少见的纤维上皮源性肿瘤,占所有纤维上皮病变(fibroepithelial lesions,FELs)的2%~3%, 在乳腺肿瘤中占比0.2%~2%[1]。目前对巨大叶状肿瘤的定义尚无统一标准,通常将直径 > 10 cm界定为巨大PTB, 占所有PTB的20%~30%[2]。
1838年Muller首次将PTB描述为叶状囊肉瘤[3]。1982年,世界卫生组织(World Health Organization,WHO)将其规范命名为叶状肿瘤[4]。PTB常见于35~55岁的女性,任何年龄段均可发生。根据间质细胞增生程度、核分裂相、浸润边缘和细胞异型性等组织学特征,PTB分为良性、交界性和恶性。2019年WHO的PTB分型标准为:核分裂相0~4个/10 HPF为良性,5~9个/10 HPF为交界性,≥10个/10 HPF为恶性[5]。作为双向分化肿瘤,PTB通常表现为快速生长的肿块,可见明显充血的静脉,皮肤溃疡或侵犯胸壁,或可触及肿大的腋窝淋巴结。本例患者肿块明显进行性增大,其增长速度超过大部分乳腺癌,且已出现皮肤多处破溃,体表可见静脉曲张,MRI下见肿物已侵及胸肌,均符合PTB的典型特征。
虽然PTB与BF同为纤维上皮性肿瘤,但两者的特点与治疗手段截然不同。PTB常迅速增大,若不完全切除复发可能性大,且交界性或恶性PTB可能发生转移,故对于所有分型的PTB,NCCN指南均建议手术切除[6]。而相较于PTB而言,BF稳定性高,2016年我国BF诊治专家共识建议BF定期随访,除肿瘤生长迅速或乳腺影像报告和数据系统(Breast Imaging Reporting and Data System, BI-RADS)分类升高外,通常无需手术治疗[7]。两者治疗有异,预后不同,故PTB与BF的鉴别尤为重要。
乳腺彩色多普勒超声与MRI作为最常用的影像学检查手段[8-9],对PTB的术前诊断与评估有重要作用。
彩色多普勒超声图像下PTB表现为低回声肿块,或可见囊性腔或无回声区,这可能与PTB内部存在局灶性坏死和变性相关[10]。有研究证实,囊性成分是超声下PTB区别于BF的一个重要特征,尤其常见于恶性PTB[10-11]。
在MRI成像特征上,PTB区别于BF,常表现为信号不均匀,T1WI常见高信号影,提示病灶内出血,T2WI不均匀高信号,与BF由于间质广泛硬化而呈T2WI低信号有鉴别意义[12]。有研究显示,强化信号分隔现象是PTB特异于BF的特征,这与PTB内血供不均匀,肿瘤细胞代谢旺盛相关[13]。本病例MRI可见肿物与后方胸小肌、胸大肌及部分冈下肌分界不清,表明肿瘤已侵犯胸壁肌层。
然而由于乳腺彩色多普勒超声和MRI对鉴别PTB和BF并无明显特征性表现,所以影像学对本病的诊断仅具有一定的指导意义,其准确性不高。确诊PTB主要通过病理学诊断,粗针穿刺活检(core needle biopsy,CNB)可提高PTB的检出率[14]。
PTB的组织学特征为FELs,FELs包括纤维腺瘤与叶状肿瘤两类,两者均表现为上皮细胞和基质成分的增殖[15-16]。形态学上,PTB通常可见广泛的间质细胞增多伴有叶状结构。与BF不同,PTB特征性表现为肿瘤呈分叶状突入不同程度扩张延伸的管腔内从而形成明显的管内生长模式,拉长的裂隙样结构被覆良性双层上皮常常是诊断PTB的重要线索[17]。由于FELs的异质性,尤其是巨大PTB,在鉴别PTB与BF方面CNB结果与切除术后病理的一致性尚存在较大差异。本病例CNB结果提示,符合乳腺纤维上皮性肿瘤,局部间质生长较活跃,但由于穿刺取材受限,为明确肿瘤性质,尚建议完整切除送检。有研究证实,与术后病理检查结果比较,CNB诊断PTB的准确率仅有13.3%,且肿瘤越大,一致性越差[18]。因此,对于肿块较大、生长较快、具有囊性变或阳性家族史的患者,建议切除病灶组织活检准确实现其病理诊断[19]。
经导管动脉栓塞术(transcatheter arterial embolization,TAE)已广泛应用于肝胆外科和心血管外科的术前辅助治疗,其目的是减少动脉流量,提高手术可切除性,最终提高生存率[20]。目前尚无针对TAE在PTB治疗中的作用进行系统性研究的报道。本例患者肿物巨大,术前检查提示血运丰富,若直接手术切除风险较大,故经本院多学科讨论,术前行超选择性左侧胸廓内动脉和左侧锁骨下动脉分支栓塞术。介入治疗减少了后续根治性乳房切除术术中出血,为病灶完整切除提供了保障。
扩大切除术曾被认为是PTB的标准治疗方法。最新版NCCN指南建议,对于良性PTB,建议局部病灶切除,对于交界性和恶性PTB,则应进行广泛局部切除,即切缘距离正常组织 > 1 cm[6]。有研究表明,手术切缘的状态会影响PTB局部复发,具有阳性手术切缘的患者较阴性切缘具有较高的局部复发率[21],故对于交界性和恶性PTB采用广泛局部切除以保证手术切缘的阴性率。有研究对188例恶性PTB患者进行分析表明,手术切缘 < 1 cm的患者局部复发风险增加,建议恶性PTB广泛切除[22]。另一项多中心研究比较362例交界性及恶性PTB患者的局部复发情况,结果显示,阳性切缘为局部复发的危险因素[23]。对于良性PTB,部分观点认为 > 1 cm的阴性手术切缘可能是过度的,不必要的广泛切除造成更大损伤且影响外形美观。一项meta分析针对1995至2018年间的54项研究共9 234例PTB患者进行分析显示,手术切缘阳性与恶性PTB的复发率相关,但与良性或交界性PTB的复发率比较,差异无统计学意义(P > 0.05),建议对于不同分型的PTB,应实施不同的手术方案[24]。有研究比较152例手术切缘为阳性或近阳性的良性PTB患者接受再切除与随访的疾病复发率,结果显示,两者差异无统计学意义(P=0.7和P=0.21)[25],因此良性PTB手术切缘为阳性的患者建议随访观察代替二次手术。综上所述,目前较广泛的观点认为应根据PTB分型不同,选择适当手术切缘的宽度。对于恶性和交界性PTB,边缘 > 1 cm的局部扩大切除是必要的,以避免局部复发。对于生长缓慢和直径 < 3 cm的良性PTB,可适当缩小阴性手术切缘的宽度。本例患者既往同侧交界性PTB局部切除术史,不除外既往手术未获得足够阴性切缘而局部复发可能,且病灶波及全乳,故行乳房切除术。
NCCN指南不推荐将辅助放疗广泛应用于原发PTB的术后治疗,但对于术后复发导致发病率显著提高的交界性或恶性PTB病例,尽管尚无前瞻性研究,可按照肉瘤标准进行放疗[6]。一项来自美国国家癌症数据库的包含3 120例恶性PTB患者的研究中,14.3%的患者接受放疗;结果表明,放疗有助于降低恶性PTB的局部复发率[26]。Boutrus等[27]分析2005至2019年PTB切除术后患者的局部复发率和总生存率,结果表明,良性PTB预后良好,无需辅助放疗,交界性或恶性叶状肿瘤局部切除术后放疗显著改善局部复发率,而对于全乳切除术者放疗对局部复发率和总生存率均无明显影响。Zhao等[28]则认为,辅助放疗不能改善恶性PTB患者的总生存率,仅肿瘤 > 50 mm且接受保乳手术的患者放疗存在生存获益趋势。另一项回顾性研究显示,尽管放疗对总生存率的影响存在争议,但对于高级别肿瘤、手术切缘阳性或术后复发的患者仍建议辅助放疗[29]。综上所述,对于典型的恶性PTB、巨大交界性PTB且保乳治疗者以及具有明显危险因素如切缘阳性者放疗可能带来一定受益。本例患者全乳切除术后,术后病理分型为交界性,无明显高危因素,故建议定期随访,未行术后辅助放疗。
| [1] |
Mitus JW, Blecharz P, Jakubowicz J, et al. Phyllodes tumors of the breast. The treatment results for 340 patients from a single cancer centre[J]. Breast, 2019, 43: 85-90. DOI:10.1016/j.breast.2018.11.009 |
| [2] |
Fang CL, Hsu CH, Tu CW. The reconstruction choice for giant Phyllodes tumor of breast: Bi-pedicled deep inferior epigastric perforator flap[J]. Aesthetic Plast Surg, 2017, 41(4): 768-772. DOI:10.1007/s00266-017-0792-4 |
| [3] |
Muller J. Uber den feineren Ban and Die Formen der Krankaften Geschwulste[J]. Berlin Germany Reiner, 1838, 1: 54-57. |
| [4] |
The World Health Organization. Histological typing of breast tumors[J]. Neoplasma, 1983, 30(1): 113-123. |
| [5] |
WHO classification of tumours editorial board. Breast tumours[M]. 5th ed. Lyon: IARC Press, 2019: 168-176.
|
| [6] |
National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Breast Cancer. Version 7.2021[EB/OL].(2021-08-23)[2021-09-30].http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
|
| [7] |
中华预防医学会妇女保健分会乳腺保健与乳腺疾病防治学组. 乳腺纤维腺瘤诊治专家共识[J]. 中国实用外科杂志, 2016, 36(7): 752-754. |
| [8] |
李晶, 陈光弟, 豆晓锋, 等. PET/CT显像与超声成像对乳腺肿瘤良恶性诊断的价值[J]. 实用肿瘤杂志, 2021, 36(6): 502-506. |
| [9] |
冯景, 王洲, 刘芳欣, 等. 声触诊组织成像定量技术联合超声造影对BI-RADS 4类乳腺肿瘤的鉴别诊断价值[J]. 实用肿瘤杂志, 2021, 36(2): 145-148. |
| [10] |
赵丹, 董凤林, 鄢英男, 等. 不同病理分型的乳腺叶状肿瘤与纤维腺瘤超声表现的对照分析[J]. 中国超声医学杂志, 2019, 35(10): 890-893. DOI:10.3969/j.issn.1002-0101.2019.10.009 |
| [11] |
王英颖, 刘景哲, 火忠, 等. 乳腺叶状肿瘤的乳腺钼靶X线摄影、彩色多普勒超声表现与病理对照研究[J]. 实用放射学杂志, 2020, 36(5): 745-747, 771. DOI:10.3969/j.issn.1002-1671.2020.05.014 |
| [12] |
彭腾飞, 黄波, 罗娅红, 等. 乳腺良性及交界性叶状肿瘤与纤维腺瘤磁共振的差异性表现[J]. 磁共振成像, 2018, 9(11): 813-818. DOI:10.12015/issn.1674-8034.2018.11.003 |
| [13] |
陈春兵, 黄清, 徐贵川, 等. 高场MRI对乳腺叶状肿瘤与乳腺纤维腺瘤鉴别诊断价值的研究[J]. 实用放射学杂志, 2021, 37(10): 1626-1630. |
| [14] |
杨奕, 陈益定, 朱娟英, 等. 空芯针穿刺活检术与微创旋切活检术在乳腺疾病诊断中的应用比较[J]. 实用肿瘤杂志, 2019, 34(3): 261-265. |
| [15] |
Limberg J, Barker K, Hoda S, et al. Fibroepithelial lesions (FELs) of the breast: is routine excision always necessary?[J]. World J Surg, 2020, 44(5): 1552-1558. DOI:10.1007/s00268-020-05385-6 |
| [16] |
Camille M, Amelie Z, Julien S, et al. A Pre-operative score to discriminate fibroepithelial lesions of the breast: Phyllode tumor or fibroadenoma?[J]. Anticancer Res, 2020, 40(2): 1095-1100. DOI:10.21873/anticanres.14048 |
| [17] |
曾强, 蔡秀虹, 张声, 等. 首发误诊为纤维腺瘤的乳腺叶状肿瘤5例临床病理分析[J]. 临床与实验病理学杂志, 2021, 37(10): 1244-1247. |
| [18] |
Zhou ZR, Wang CC, Sun XJ, et al. Diagnostic performance of core needle biopsy in identifying breast Phyllodes tumors[J]. J Thorac Dis, 2016, 8(11): 3139-3151. DOI:10.21037/jtd.2016.10.109 |
| [19] |
Wiratkapun C, Piyapan P, Lertsithichai P, et al. Fibroadenoma versus Phyllodes tumor: distinguishing factors in patients diagnosed with fibroepithelial lesions after a core needle biopsy[J]. Diagn Interv Radiol, 2014, 20(1): 27-33. |
| [20] |
Park GC, Lee SG, Yoon YI, et al. Sequential transcatheter arterial chemoembolization and portal vein embolization before right hemihepatectomy in patients with hepatocellular carcinoma[J]. Hepatobiliary Pancreat Dis Int, 2020, 19(3): 244-251. |
| [21] |
Toussaint A, Piaget-Rossel R, Stormacq C, et al. Width of margins in Phyllodes tumors of the breast: the controversy drags on?-a systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2021, 185(1): 21-37. |
| [22] |
Li Y, Song YX, Lang RG, et al. Retrospective study of malignant Phyllodes tumors of the breast: younger age, prior fibroadenoma surgery, malignant heterologous elements and surgical margins may predict recurrence[J]. Breast, 2021, 57: 62-70. |
| [23] |
Choi N, Kim K, Shin KH, et al. Malignant and borderline Phyllodes tumors of the breast: a multicenter study of 362 patients (KROG 16-08)[J]. Breast Cancer Res Treat, 2018, 171(2): 335-344. |
| [24] |
Lu YW, Chen YB, Zhu LL, et al. Local recurrence of benign, borderline, and malignant Phyllodes tumors of the breast: a systematic review and meta-analysis[J]. Ann Surg Oncol, 2019, 26(5): 1263-1275. |
| [25] |
Moo TA, Alabdulkareem H, Tam A, et al. Association between recurrence and re-excision for close and positive margins versus observation in patients with benign Phyllodes tumors[J]. Ann Surg Oncol, 2017, 24(10): 3088-3092. |
| [26] |
Gnerlich JL, Williams RT, Yao K, et al. Utilization of radiotherapy for malignant Phyllodes tumors: analysis of the National Cancer Data Base, 1998-2009[J]. Ann Surg Oncol, 2014, 21(4): 1222-1230. |
| [27] |
Boutrus RR, Khair S, Abdelazim Y, et al. Phyllodes tumors of the breast: Adjuvant radiation therapy revisited[J]. Breast, 2021, 58: 1-5. |
| [28] |
Zhao W, Tian Q, Zhao AD, et al. The role of adjuvant radiotherapy in patients with malignant Phyllodes tumor of the breast: a propensity-score matching analysis[J]. Breast Cancer, 2021, 28(1): 110-118. |
| [29] |
Yuniandini A, Hamdani W, Prihantono P, et al. A retrospective review of Phyllodes tumors of the breast from a single institution[J]. Breast Dis, 2021, 40(S1): S63-70. |
 2023, Vol. 38
2023, Vol. 38


