文章信息
- 张丽娜, 孔祥兴, 李昕琳, 梅彦侠, 李军
- 结直肠癌pT4期诊断的难点及辅助诊断方案的研究进展
- 实用肿瘤杂志, 2021, 36(1): 6-10
基金项目
- 国家自然科学基金(81672916);国家重点研发计划(2017YFC0908200);国家自然科学基金重点项目(11932017)
-
通信作者
- 李军,E-mail:2307016@zju.edu.cn
-
文章历史
- 收稿日期:2020-07-21
2. 浙江大学医学院附属第二医院肿瘤研究所(恶性肿瘤预警与干预教育部重点实验室,浙江省医学分子生物学重点实验室),浙江 杭州 310000;
3. 中国科学院大学宁波华美医院乳腺外科,浙江 宁波 315000
结直肠癌是消化系统最常见的恶性肿瘤之一,其发病率和死亡率在全球和我国均位居所有恶性肿瘤前列[1]。目前,我国局部进展期结直肠癌的比例较高,这类患者存在较高的复发和远处转移风险。因此,结合外科手术、放疗和化疗等的多学科综合治疗是目前治疗结直肠癌的主要模式。
美国癌症联合委员会发布的TNM分期被广泛应用于结直肠癌的临床/病理分期。其中,T分期在预后预测中的权重正越来越得到重视。目前,国内外指南均建议,Ⅱ期患者如病理检查提示肿瘤突破浆膜外,即病理T4(pathological T4,pT4)期,也应接受化疗[2]。近年来,探索Ⅲ期患者辅助化疗周期的IDEA研究证实,T4期患者预后劣于T1-3期的患者,需要接受更长时间的辅助化疗[3]。因此,准确的T分期对于强化pT4期患者的辅助化疗,提升高危患者的总体生存具有重要的指导价值。
然而,对结直肠癌pT4期的准确诊断是一个全球共性难题。英国皇家病理学会指出,理论上结肠癌患者pT4期的比例应达到20%[4]。然而,两项分别纳入美国国立癌症研究所的监督、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库中168 522例结肠癌及68 736例直肠癌的研究表明,仅15.2%的结肠癌和9.2%的直肠癌患者被诊断为pT4期,而其中被诊断为浆膜浸润(pT4a期)的仅有8.6%和4.1%[5-6]。这提示,在临床实际工作中,pT4期的诊断较为困难,存在被低估的可能。基于此,本文将首先回顾结直肠癌pT4期诊断的病理学标准;之后梳理其诊断过程中的难点及原因;最后,对目前提升pT4期诊断准确率的辅助方案的研究进展进行综述。
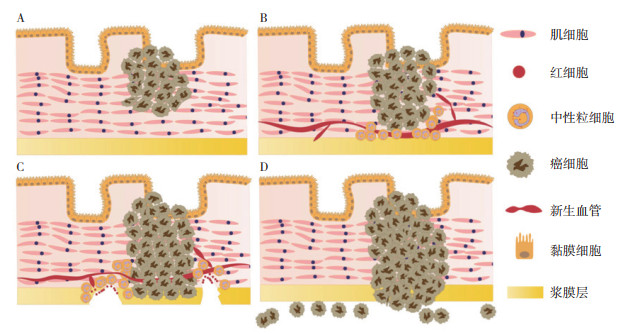
1 结直肠癌pT4期的病理诊断标准pT4期又细分为pT4a期(肿瘤侵犯浆膜)和pT4b期(肿瘤侵犯邻近脏器或结构)。其中,关于肿瘤侵犯浆膜的诊断标准目前仍不甚明确。Shepherd等[7]将局部浆膜受累(local peritoneal involvement,LPI)按组织学类型分为4类:LPI 1级,肿瘤细胞未接近浆膜;LPI 2级,肿瘤细胞接近但未出现在浆膜表面,浆膜下可见间皮炎性反应;LPI 3级,肿瘤细胞出现在浆膜表面,并伴随炎性反应、间皮增生和(或)溃疡;LPI 4级,浆膜表面存在游离的肿瘤细胞(图 1)。其中,仅LPI 3级和LPI 4级与患者的不良预后相关,应被归类为pT4期。然而,部分学者认为,LPI 2级也代表浆膜受到肿瘤细胞影响的表现,其预后与LPI 1级比较仍有差异;因此,浆膜浸润应包括LPI 2~4级[8]。Lennon等[9]对Ⅱ期结肠癌的研究表明,仅浆膜表面出现游离肿瘤细胞(LPI 4级)与不良预后相关,浆膜浸润的诊断应仅限于LPI 4级的患者。
综上所述,目前较为认可的仍是将LPI 3级和LPI 4级归类为pT4a期,而LPI 2级是否诊断为pT4a期在一定程度上取决于病理科医师的主观判断。因此,在临床工作中,确实可能出现不同病理科医师对pT4期诊断标准把握宽严不一的情况[10]。
2 结直肠癌pT4期病理诊断的难点 2.1 浆膜层的脱落与损伤横结肠、乙状结肠和直肠上三分之一的浆膜是完整的,而升、降结肠和直肠中三分之一仅腹侧面有浆膜覆盖。浆膜由脏腹膜移行而来,厚度一般≤50 μm,可能在术中操作或术后标本处理的过程中脱落[11]。此时,病理科医师对于镜下肿瘤外无浆膜层覆盖的情况,常难以辨别是由肿瘤突破浆膜层(即pT4期)还是浆膜脱落导致。
手术导致的穿孔可与真正的肿瘤穿孔混淆,外科医师需在标本送检时加以注明。在手术过程中,超声刀、电刀及抓钳等外科器械容易在正常组织表面进行烧灼、剪切和牵拉,从而造成局部结构毁损;这将导致损伤部位其肿瘤是否突破浆膜和侵犯邻近组织器官变得难以判断。
2.2 病理标本取材与阅片鉴于肿瘤可能仅点、灶状侵犯浆膜,不够细致的取材和阅片会降低浆膜浸润的检出率。我国病理取材常采用沿肠管纵轴方向每隔5~6 mm取1个肿瘤组织块的方法[12],这易导致取材过程可能遗漏肿瘤浸润最深处。然而,根据目前使用的取材方法,对整个肿瘤进行镜检的可行性较低,一定程度上的取材遗漏暂时无法避免。
细致的病理阅片也是提高pT4期诊断准确率的关键因素。一项研究中,病理学家对80例初始诊断为无浆膜浸润的Ⅱ期结肠癌标本进行回顾阅片发现,其中有近20%的标本实际上已有浆膜侵犯[13]。另一项研究邀请4位诊断标准一致的病理学家参与,其中一家中心的病理学家对肿瘤标本进行包括取材和阅片在内的更为细致的病理检查,使得其浆膜浸润的检出率始终高于其他中心[14]。
2.3 浆膜“裂隙”的干扰浆膜表面不平坦,有向肌层凹陷的“裂隙”。这些浆膜“裂隙”,在镜下较难辨认出清晰的组织结构。病理情况下,肿瘤浸润、炎性反应和纤维化等造成“裂隙”处结构的变形和紊乱,使得此处肿瘤细胞与浆膜关系的辨别变得更加困难[11]。然而,这种浆膜反折产生的“裂隙”又是结直肠癌最常见的浆膜侵犯部位。此外,肿瘤生长过程中,大量成纤维细胞、炎性反应细胞和免疫细胞等在局部聚集,肿瘤部位新血管生成,细胞外基质增生,这些均会引起肿瘤部位组织结构紊乱,使pT4期的判断更加困难。
3 结直肠癌pT4期诊断的辅助方案探索 3.1 浆膜表面细胞捕获技术为提高pT4期诊断的准确率,研究者们提出了一系列病理诊断的辅助方案。Pomeranz等[15]最初提出使用浆膜表面游离细胞涂片作为病理诊断的参考,通过2种方法获浆膜面取游离细胞:用载玻片轻刮标本病灶处浆膜面后染色检测;用无菌棉签在肿瘤浆膜面轻轻刮擦,之后将获得的细胞涂抹在第2张载玻片上染色。一项前瞻性研究在120例结直肠癌患者中发现,所有pT1和pT2期患者的浆膜表面均未检测到肿瘤细胞,19%的pT3期患者浆膜表面脱落细胞学检查阳性,但pT4期患者的阳性率仅为55%[16]。在46%的肿瘤细胞距浆膜 < 1 mm的pT3期患者的浆膜表面发现肿瘤细胞,且随访发现,肿瘤距浆膜 < 1 mm的pT3期患者的预后较肿瘤距浆膜 > 1 mm的患者差。该研究认为这类浆膜表面肿瘤细胞学检测阳性的患者应当归为pT4期。但是,此项技术可能刮破浆膜,误取到浆膜下的肿瘤细胞进行检测,存在较高的假阳性率,其诊断结果的参考价值有限。
3.2 腹腔灌洗获取肿瘤细胞有研究报道,可以利用腹腔灌洗液细胞学涂片来检测“游离”的肿瘤细胞[17]。有研究对100例胃癌手术患者进行术中腹腔灌洗,仅在48%的确认浆膜受累的患者灌洗液中发现肿瘤细胞,几乎所有阳性患者的浆膜累及面积都 > 15 cm2[18]。而临床观察表明,浆膜受累面积很少 > 5 cm2[19];因此,该技术敏感度不佳,临床应用受限。Bae等[20]对145例接受结直肠癌根治性手术的患者进行术后腹腔灌洗液的细胞学检查,其中6例(4.1%)阳性,患者分期均为pT3期以上。随访期间,5例出现腹膜复发,其中4例属于细胞学阳性组。在多变量分析中,细胞学阳性是腹膜复发的独立预测因素和总体预后不良的独立因素(P < 0.05)。因此,腹腔灌洗液肿瘤细胞检测阳性可以作为肿瘤浆膜浸润或突破浆膜的辅助参考。然而,腹腔液中的恶性细胞也可能是肿瘤转移的结果,不一定是原发肿瘤经浆膜直接穿透而来,这亟待后续研究对其在pT4期诊断的敏感度和特异度上进行提高。
3.3 间皮细胞染色浆膜由间皮细胞、基底膜和间皮下层组成[21]。当切片中的浆膜层不明显时,可采用免疫组织化学法对间皮细胞进行染色来显示浆膜层。如镜下发现由于肿瘤细胞侵袭或破坏,使得间皮层连续性中断,即可明确pT4期的诊断。目前,间皮细胞的标志物主要有钙网膜蛋白(calretinin)、肾母细胞瘤1蛋白(Wilms tumor 1 protein,WT1)、角蛋白5/6(cytokeratin 5/6,CK5/6)和CK7等[22]。其中,CK7染色通常最有效,不仅可以特异性标志间皮细胞,而不显示反应性增生的基质和肿瘤细胞,且对于诊断浆膜“裂隙”中肿瘤细胞的浸润具有极好的效果[23]。
3.4 弹力层染色弹力层存在于间皮下层,也是浆膜组成的一部分[24]。当肿瘤破坏、炎性反应增生或纤维化等使浆膜变形或不可见时,弹力层染色可用于显示浆膜。目前,弹力层显像主要使用Verhoeff-Van Gieson染色和Masson染色等方法。对564例肠癌患者标本进行弹力层染色的研究证实[24],浆膜弹力层浸润(elastic lamina invasion,ELI)与不良预后相关;ELI阳性和阴性的pT3期患者总生存比较,差异具有统计学意义(P < 0.01)。ELI是pT3期患者预后不良的高危因素之一(P < 0.01)[25],有助于进一步诊断出有强烈浆膜浸润倾向甚至隐匿浆膜侵犯的患者。然而,对于弹力层染色的应用,也有不少学者提出相左的意见。Liang等[26]对244例pT3N0M0患者进行弹力层染色,发现仅有41%的患者标本中能检测到弹力层。Knudsen[27]也提出,浆膜弹力层并不存在于所有肠壁组织。此外,浆膜弹力层受累不能完全证明浆膜浸润,炎性反应也可以导致弹力层破坏,弹力层染色这一辅助诊断方案的适用范围仍然有限。
4 结语结直肠癌的术后病理分期(尤其是pT4期的准确判断)对患者治疗方案的选择及预后预测意义重大[28]。但肿瘤浆膜浸润的准确诊断由于浆膜层的脱落与损伤、制片和阅片的难度以及浆膜“裂隙”的干扰,仍面临巨大挑战。现有的病理诊断技术尚不能精准地鉴别出所有的pT4期患者。在未来研究中,关注病理诊断辅助技术的研发和提高pT4期诊断的准确率对结直肠癌的临床诊治意义重大。
用玻片或棉签在浆膜表面获取肿瘤细胞,存在一定的误差。开发合适的取样器,在不破坏浆膜的情况下获取游离肿瘤细胞是改进此项技术的关键。磁性纳米颗粒已广泛应用于生物化学分析,如动态DNA检测、酶含量测定和细胞功能监测等领域。后续研究可以寻找结直肠癌细胞表面高表达的生物分子标志物,以此对磁性纳米颗粒进行表面修饰。将带合适抗体的纳米磁珠颗粒与浆膜表面充分作用后,回收磁珠,二次分离,检测获取的细胞。类似的改造可在不破坏浆膜层的情况下,获取浆膜表面可能存在的游离肿瘤细胞。
此外,目前使用的间皮细胞染色需另切白片进行免疫组织化学检查。这不但增加技术人员的工作强度,且手续繁琐,因此不能常规推广使用。在细胞学检查中,传统的Giemsa/Papanicolaou染色检出率仅为4%~35%[29]。为准确分辨腹腔灌洗液中获得的肿瘤细胞,研究者曾提出使用细胞免疫组织化学、PCR、反转录PCR甚至原位荧光杂交等方法来提高检出率。由此启发,后续研究可以设计一套基于表面标志物的高效原位肿瘤细胞显示程序,快速提示浆膜受累部位,指导病理科医师进行准确的病理取材。除此之外,随着生物材料研究的快速进展,利用生物辅助材料进行pT4期辅助诊断也将是未来可供探索的重要方向。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Jalaeikhoo H, Zokaasadi M, Khajeh-Mehrizi A, et al. Effectiveness of adjuvant chemotherapy in patients with Stage Ⅱ colorectal cancer: A multicenter retrospective study[J]. J Res Med Sci, 2019, 24: 39. DOI:10.4103/jrms.JRMS_106_18 |
| [3] |
Andre T, Vernerey D, Mineur L, et al. Three versus 6 months of oxaliplatin-based adjuvant chemotherapy for patients with stage Ⅲ colon cancer: disease-free survival results from a randomized, open-label, International Duration Evaluation of Adjuvant (IDEA) France, phase Ⅲ trial[J]. J Clin Oncol, 2018, 36(15): 1469-1477. DOI:10.1200/JCO.2017.76.0355 |
| [4] |
Williams G, Qurike P, Shepherd N. Dataset for colorectal cancer[M]. 2nd ed. London: Royal College of Pathologists, 2007: 2013.
|
| [5] |
Gunderson LL, Jessup JM, Sargent DJ, et al. Revised TN categorization for colon cancer based on national survival outcomes data[J]. J Clin Oncol, 2010, 28(2): 264-271. DOI:10.1200/JCO.2009.24.0952 |
| [6] |
Gunderson LL, Jessup JM, Sargent DJ, et al. Revised tumor and node categorization for rectal cancer based on surveillance, epidemiology, and end results and rectal pooled analysis outcomes[J]. J Clin Oncol, 2010, 28(2): 256-363. DOI:10.1200/JCO.2009.23.9194 |
| [7] |
Shepherd NA, Baxter KJ, Love SB. The prognostic importance of peritoneal involvement in colonic cancer: a prospective evaluation[J]. Gastroenterology, 1997, 112(4): 1096-1102. DOI:10.1016/S0016-5085(97)70119-7 |
| [8] |
Compton C, Fenoglio-Preiser CM, Pettigrew N, et al. American Joint Committee on Cancer Prognostic Factors Consensus Conference: Colorectal Working Group[J]. Cancer, 2000, 88(7): 1739-1757. DOI:10.1002/(SICI)1097-0142(20000401)88:7<1739::AID-CNCR30>3.0.CO;2-T |
| [9] |
Lennon AM, Mulcahy HE, Hyland JM, et al. Peritoneal involvement in stage Ⅱ colon cancer[J]. Am J Clin Pathol, 2003, 119(1): 108-113. DOI:10.1309/J6BDTWM2M792TN2V |
| [10] |
Karamchandani DM, Chetty R, King TS, et al. Challenges with colorectal cancer staging: results of an international study[J]. Mod Pathol, 2020, 33(1): 153-163. DOI:10.1038/s41379-019-0344-3 |
| [11] |
Dawson H, Kirsch R, Messenger D, et al. A review of current challenges in colorectal cancer reporting[J]. Arch Pathol Lab Med, 2019, 143(7): 869-882. DOI:10.5858/arpa.2017-0475-RA |
| [12] |
韩方海, 周声宁. 规范结直肠癌手术标本大体病理取材和评估[J]. 中国实用外科杂志, 2019, 39(6): 552-556. |
| [13] |
Stewart CJ, Morris M, De Boer B, et al. Identification of serosal invasion and extramural venous invasion on review of Dukes' stage B colonic carcinomas and correlation with survival[J]. Histopathology, 2007, 51(3): 372-378. DOI:10.1111/j.1365-2559.2007.02787.x |
| [14] |
Littleford SE, Baird A, Rotimi O, et al. Interobserver variation in the reporting of local peritoneal involvement and extramural venous invasion in colonic cancer[J]. Histopathology, 2009, 55(4): 407-413. DOI:10.1111/j.1365-2559.2009.03397.x |
| [15] |
Pomeranz AA, Garlock JH. Postoperative recurrence of cancer of colon due to desquamated malignant cells[J]. J Am Med Assoc, 1955, 158(16): 1434-1436. DOI:10.1001/jama.1955.02960160028007c |
| [16] |
Panarelli NC, Schreiner AM, Brandt SM, et al. Histologic features and cytologic techniques that aid pathologic stage assessment of colonic adenocarcinoma[J]. Am J Surg Pathol, 2013, 37(8): 1252-1258. DOI:10.1097/PAS.0b013e3182960e7c |
| [17] |
Stewart CJ, Hillery S, Platell C, et al. Assessment of serosal invasion and criteria for the classification of pathological (p) T4 staging in colorectal carcinoma: confusions, controversies and criticisms[J]. Cancers (Basel), 2011, 3(1): 164-181. DOI:10.3390/cancers3010164 |
| [18] |
Iitsuka Y, Kaneshima S, Tanida O, et al. Intraperitoneal free cancer cells and their viability in gastric cancer[J]. Cancer, 1979, 44(4): 1476-1480. DOI:10.1002/1097-0142(197910)44:4<1476::AID-CNCR2820440442>3.0.CO;2-R |
| [19] |
Kaibara N, Iitsuka Y, Kimura A, et al. Relationship between area of serosal invasion and prognosis in patients with gastric carcinoma[J]. Cancer, 1987, 60(1): 136-139. DOI:10.1002/1097-0142(19870701)60:1<136::AID-CNCR2820600125>3.0.CO;2-X |
| [20] |
Bae SJ, Shin US, Ki YJ, et al. Role of peritoneal lavage cytology and prediction of prognosis and peritoneal recurrence after curative surgery for colorectal cancer[J]. Ann Coloproctol, 2014, 30(6): 266-273. DOI:10.3393/ac.2014.30.6.266 |
| [21] |
Ludeman L, Shepherd NA. Serosal involvement in gastrointestinal cancer: its assessment and significance[J]. Histopathology, 2005, 47(2): 123-131. DOI:10.1111/j.1365-2559.2005.02189.x |
| [22] |
Subbarayan D, Bhattacharya J, Rani P, et al. Use of panel of markers in serous effusion to distinguish reactive mesothelial cells from adenocarcinoma[J]. J Cytol, 2019, 36(1): 28-31. DOI:10.4103/JOC.JOC_13_18 |
| [23] |
Sundling KE, Cibas ES. Ancillary studies in pleural, pericardial, and peritoneal effusion cytology[J]. Cancer Cytopathol, 2018, 126(Suppl 8): 590-598. |
| [24] |
Kojima M, Nakajima K, Ishii G, et al. Peritoneal elastic laminal invasion of colorectal cancer: the diagnostic utility and clinicopathologic relationship[J]. Am J Surg Pathol, 2010, 34(9): 1351-1360. DOI:10.1097/PAS.0b013e3181ecfe98 |
| [25] |
Liang WY, Wang YC, Hsu CY, et al. Staging of colorectal cancers based on elastic lamina invasion[J]. Hum Pathol, 2019, 85: 44-49. DOI:10.1016/j.humpath.2018.10.019 |
| [26] |
Liang WY, Chang WC, Hsu CY, et al. Retrospective evaluation of elastic stain in the assessment of serosal invasion of pT3N0 colorectal cancers[J]. Am J Surg Pathol, 2013, 37(10): 1565-1570. DOI:10.1097/PAS.0b013e31828ea2de |
| [27] |
Knudsen PJ. The peritoneal elastic lamina[J]. J Anat, 1991, 177: 41-46. |
| [28] |
潘理会, 李育庄, 李春辉. 结直肠癌中C-erbB-2基因扩增与KRAS基因突变的意义[J]. 实用肿瘤杂志, 2020, 35(1): 48-52. |
| [29] |
Fujii S, Shimada H, Yamagishi S, et al. Evaluation of intraperitoneal lavage cytology before colorectal cancer resection[J]. Int J Colorectal Dis, 2009, 24(8): 907-914. DOI:10.1007/s00384-009-0733-z |
 2021, Vol. 36
2021, Vol. 36