文章信息
- 皇甫超男, 徐沭芬, 丁洁, 李娟, 汪洋, 王科明
- Huangfu Chaonan, Xu Shufen, Ding Jie, Li Juan, Wang Yang, Wang Keming
- 安罗替尼联合5-氟尿嘧啶对结直肠癌细胞增殖和凋亡的影响
- Effect of anlotinib combined with 5-fl uorouracil on proliferation and apoptosis of colorectal cancer cells
- 实用肿瘤杂志, 2021, 36(6): 507-513
- Journal of Practical Oncology, 2021, 36(6): 507-513
基金项目
- 国家自然科学基金青年科学基金项目(81802373);北京医卫健康公益基金会医学科学研究基金资助项目(YWJKJJHKYJJ-B1850242018.1.1~2020.12.31)
-
通信作者
- 王科明, E-mail: kemingwang@njmu.edu.cn
-
文章历史
- 收稿日期:2021-01-31
结直肠癌是严重威胁全球人类健康的疾病。其发展与环境、遗传学、饮食和生活方式等各种因素密切相关。根据美国癌症协会发布的最新统计数据,结直肠癌的新发病例和死亡例数仍在上升,在欧美发达国家中排名第三[1]。尽管分子生物学飞速发展且临床诊断和治疗技术不断更新,但是由于结直肠癌患者的早期临床症状无明显特征可循,通常在疾病进展期或合并感染时就诊发现,严重影响结直肠癌患者的生存期[2]。化疗和抗血管生成是目前晚期结直肠癌治疗的主要方法,但生存期仅30个月左右,故寻找治疗结直肠癌治疗的新方向日益迫切[3]。安罗替尼是新近研发的酪氨酸激酶抑制剂,可抑制肿瘤生长和瘤体血管生成[4]。目前我国已批准安罗替尼作为晚期非小细胞肺癌患者的三线治疗[5]。已有临床试验分析安罗替尼作为晚期大肠癌的三线治疗是可行的,其疾病控制率高且不良反应小[6]。一项结直肠癌动物模型研究证实安罗替尼的抗肿瘤作用[7]。5-氟尿嘧啶(5-fluorouracil,5-FU)是结直肠癌常用的化疗药物,常与抗血管生成药物联用[8],但安罗替尼联合5-FU对结直肠癌细胞增殖的影响及潜在机制尚未完全阐明,因此本文拟对此开展研究,为晚期结直肠癌的治疗提供实验依据。
1 材料与方法 1.1 材料人结直肠癌细胞SW480和DLD-1购于中科院。DMEM高糖培养液、RPMI-1640培养液、磷酸盐缓冲液(phosphate buffer solution,PBS)、含0.25% EDTA胰酶和青链霉素混合抗生素均购于美国Gibco公司。胎牛血清购于美国Gemni公司。安罗替尼和5-FU由南京正大天晴公司提供。Cell Counting Kit-8(CCK-8)Cell Counting Kit购于南京诺维赞公司。细胞凋亡双染(AnnexiV Alexa FLlour647/PI)检测试剂盒购于南京福麦斯生物公司。Cleaved-caspase-3抗体购于南京Proteintech公司。细胞培养皿和培养板等耗材均购于美国CORNING公司。
1.2 细胞培养SW480细胞培养条件:在直径10 cm的培养皿中加入7 mL完全高糖培养液(10%胎牛血清、1%青霉素和链霉素以及89%的DMEM混合液)进行贴壁培养。结直肠癌DLD-1细胞株所用的基础培养液为RPMI-1640。所有细胞株均在37℃和5%CO2的湿润空气中的培养箱中培养。培养皿2 d更换1次培养液,并在显微镜下观察细胞形态与密度,在培养皿中细胞密度达到80%左右时,以1∶3的比例进行细胞传代。
1.3 CCK8细胞增殖分析收集对数生长期的SW480和DLD-1细胞均匀接种到96孔板中(约3 500个/孔),并设置对照组、单一用药组和联合用药组。实验分为三组:安罗替尼单药组,用不同浓度的安罗替尼(0、2、10、20、40、80、160和320 μmol/L)作用于SW480和DLD-1细胞株24和48 h,分别计算半抑制浓度(50% inhibitory concentration,IC50)值,其中0 μmol/L为对照组;5-FU单药组,用不同浓度的5-FU(0、2、10、20、40、80、160和320 μmol/L)作用于SW480及DLD-1结直肠癌细胞株24 h,计算IC50值,其中0 μmol/L为对照组;安罗替尼联合5-FU组,细胞接种24 h后预先加入2 μmol/L的5-FU作用1 h,然后按照安罗替尼单药组设置的浓度梯度添加含有不同浓度安罗替尼的培养液继续培养24 h检测。计算IC50值,其中0 μmol/L为对照组。检测前先弃旧培养液,每孔加入含10 μL CCK-8的100 μL DMEM培养液,放入培养箱避光孵育2 h,然后用酶联免疫检测仪测量450 nm的吸光度(absorbance,A)值。按照CCK-8 Cell Counting Kit说明书计算出细胞活力,并计算出相应的细胞抑制率。
1.4 集落形成实验将实验分为三组,对照组不添加任何药物干预,安罗替尼单药组(20 μmol/L)、安罗替尼(20 μmol/L)联合5-FU(2 μmol/L)组药物作用于细胞24 h后,将约1 000个细胞接种于含有10%胎牛血清的2 mL完全培养液的6孔板中并保持水平。放入培养箱每5天更换1次培养液。2周后,弃培养液,PBS清洗后用甲醇固定细胞20 min,并用0.1%结晶紫染色15 min。手动计数可见集落。
1.5 流式细胞术实验分为三组,对照组未加任何药物,安罗替尼单药组加入20 μmol/L安罗替尼,安罗替尼联合5-FU组加入20 μmol/L安罗替尼和2 μmol/L 5-FU,分别加入SW480及DLD-1细胞中,培养24 h后进行流式细胞术。将6孔板中的旧培养液收集于流式管中,并用PBS清洗细胞1次后收集于流式管中,每孔加入胰酶消化,弃胰酶后加入1 mL完全培养液终止消化并重悬细胞后收集于流式管中。离心后,弃上清,加入PBS清洗并离心,按细胞凋亡双染检测试剂盒说明书,加入300 μL的结合缓冲液重悬细胞,加入4 μL碘化丙啶和Annexin V染料进行避光15 min。运用流式细胞仪分析细胞凋亡率。
1.6 Western blot法检测蛋白用未加药物(对照组)、20 μmol/L安罗替尼(安罗替尼单药组)以及20 μmol/L安罗替尼联合2 μmol/L 5-FU(安罗替尼联合5-FU组)分别处理SW480和DLD-1细胞24 h,用含有蛋白酶抑制剂和苯甲基磺酰氟的RIPA蛋白质提取试剂处理。在确定蛋白质浓度后,通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离约50 μg蛋白质提取物,并转移至具有特异性抗体的硝酸纤维素膜使用甘油醛-3-磷酸脱氢(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为对照,通过A值测定法观察和测定条带的强度。
1.7 统计学分析采用SPSS和GraphPad Prism 7软件进行数据分析。数据描述为3次实验的均数±标准差(x±s)。组间比较采用t检验或单因素方差分析(one-way ANOVA)。以P < 0.05为差异具有统计学意义。
2 结果 2.1 安罗替尼联合5-FU对SW480和DLD-1细胞增殖的影响安罗替尼联合5-FU组在较低浓度(10、20和40 μmol/L)作用于SW480及DLD-1细胞24 h后细胞的增殖抑制率高于安罗替尼单药组,而安罗替尼联合5-FU组在较高浓度(40、80、160和320 μmol/L)作用于SW480及DLD-1细胞24 h后细胞的增殖抑制率高于5-FU单药组(均P < 0.05,图 1)。安罗替尼联合5-FU组作用于SW480及DLD-1细胞24 h后的IC50值低于安罗替尼单药组及5-FU单药组作用于SW480及DLD-1细胞24 h后的IC50值(均P < 0.01,表 1)。
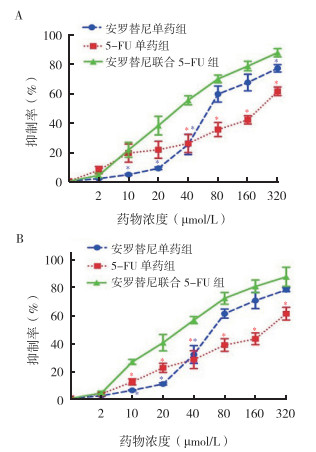
|
| 注A:不同浓度药物对SW480细胞增殖的影响;B:不同浓度药物对DLD-1细胞增殖的影响;安罗替尼联合5-FU组中5-FU浓度为2 μmol/L;*与安罗替尼联合5-FU组比较,P < 0.05 图 1 不同浓度药物作用于结直肠癌SW480和DLD-1细胞24 h对细胞增殖的影响 Fig.1 Effects of different concentrations of drugs on cell proliferation of colorectal cancer SW480 and DLD-1 cells at 24 h |
| 组别 | SW480细胞IC50值 | DLD-1细胞IC50值 |
| 安罗替尼单药组(24 h) | 52.37 | 48.29 |
| 安罗替尼单药组(48 h) | 28.37a | 24.30a |
| 5-FU单药组(24 h) | 163.50a | 152.20a |
| 安罗替尼联合5-FU组(24 h) | 27.93ab | 24.59ab |
| 注 IC50:半抑制浓度(50% inhibitory concentration);a与安罗替尼单药组(24 h)比较,P < 0.01;b与5-FU单药组(24 h)比较,P < 0.01 | ||
集落形成实验结果显示,安罗替尼单药组较对照组可以降低结直肠癌细胞的集落数量,差异均具有统计学意义[SW480细胞:(475.33±31.44)vs(2006.33±62.74),DLD-1细胞:(92.33±10.62)vs(350.00±36.67);均P < 0.01]。和安罗替尼单药组比较,安罗替尼联合5-FU组[SW480细胞:(105.87±13.89),DLD-1细胞:(49.33±6.34)]结直肠癌细胞集落形成数量降低,差异均具有统计学意义(均P < 0.01,图 2)。
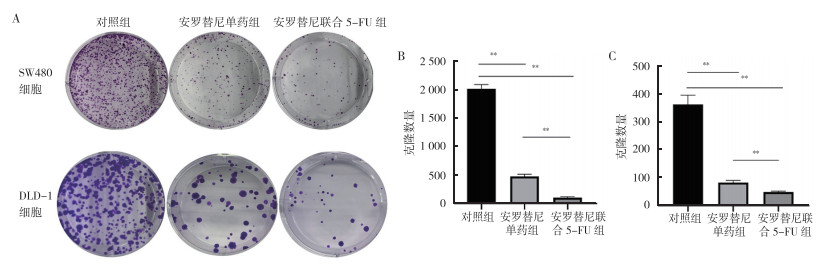
|
| 注 A:安罗替尼单药和安罗替尼联合5-FU作用SW480和DLD-1细胞24 h后的集落形成实验结果;B:安罗替尼单药和安罗替尼联合5-FU作用SW480细胞24 h后的集落形成结果统计图;C:安罗替尼单药和安罗替尼联合5-FU作用DLD-1细胞24 h后的集落形成结果统计图;**P < 0.01 图 2 安罗替尼单药及安罗替尼联合5-FU对结直肠癌SW480及DLD-1细胞集落形成的影响 Fig.2 Effect of anlotinib and anlotinib combined with 5-FU on the colony formation of colorectal cancer SW480 and DLD-1 cells |
流式细胞术检测显示,与对照组[SW480细胞:(8.13±0.76)%,DLD-1细胞:(7.59±1.21)%]比较,安罗替尼单药组[SW480细胞:(20.46±1.06)%,DLD-1细胞:(19.72±0.80)%]细胞凋亡率均增加,差异均具有统计学意义(均P < 0.01,图 3)。而与安罗替尼单药组比较,安罗替尼联合5-FU组[SW480细胞:(24.14±1.33)%,DLD-1细胞:(36.46±1.05)%]细胞凋亡率增加,差异均具有统计学意义(均P < 0.05)。
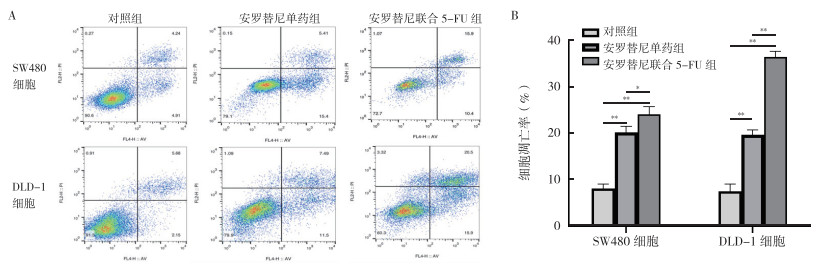
|
| 注 A:流式细胞术检测安罗替尼单药和安罗替尼联合5-FU作用SW480和DLD-1细胞24 h后的细胞凋亡情况;B:安罗替尼单药和安罗替尼联合5-FU作用SW480和DLD-1细胞24 h后的细胞凋亡率统计图;*P < 0.05;**P < 0.01 图 3 安罗替尼单药及安罗替尼联合5-FU对结直肠癌SW480及DLD-1细胞凋亡的影响 Fig.3 Effect of anlotinib and anlotinib combined with 5-FU on the apoptosis of colorectal cancer SW480 and DLD-1 cells |
Western blot法显示,与对照组比较,安罗替尼(20 μmol/L)作用结直肠癌SW480和DLD-1细胞24 h后凋亡蛋白cleaved-caspase-3的表达量均增加,差异均具有统计学意义(均P < 0.01)。与安罗替尼单药组比较,安罗替尼(20 μmol/L)联合5-FU(2 μmol/L)作用SW480和DLD-1细胞24 h后cleaved-caspase-3的表达均增加,差异均具有统计学意义(均P < 0.05,图 4)。
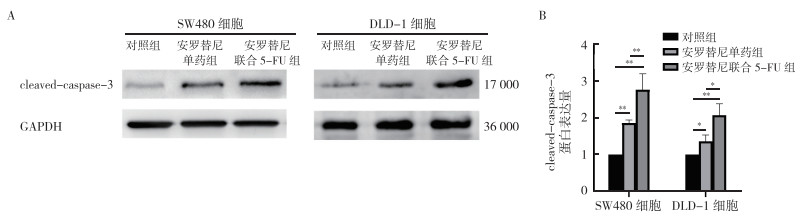
|
| 注 A:Western blot法检测安罗替尼单药和安罗替尼联合5-FU作用SW480和DLD-1细胞24 h后cleaved-caspase-3表达水平;B:安罗替尼单药和安罗替尼联合5-FU作用SW480和DLD-1细胞24 h后cleaved-caspase-3表达水平统计图;*P < 0.05;**P < 0.01 图 4 安罗替尼单药及安罗替尼联合5-FU对结直肠癌SW480及DLD-1细胞中凋亡蛋白cleaved-caspase-3表达的影响 Fig.4 Effect of anlotinib and anlotinib combined with 5-FU on the expression of apoptotic protein cleaved-caspase-3 in colorectal cancer SW480 and DLD-1 cells |
结直肠癌早期症状隐匿大量患者初诊即为转移性结直肠癌,且此类患者的预后很差,远处转移的5年生存率 < 14%[9]。肿瘤血管生成在肿瘤的转移中起着重要的作用[10]。阻断这一途径成为肿瘤临床治疗的一种策略,安罗替尼作为酪氨酸酶抑制剂可多靶点抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、c-Kit和Ret[4],对肿瘤血管生成和生长有广泛的抑制作用[11]。目前安罗替尼主要应用于非小细胞肺癌的三线治疗[6]。安罗替尼可通过Erk/Akt通路诱导肝细胞癌细胞的凋亡以及抑制增殖[12]。临床试验证实,局部晚期和转移性甲状腺髓样癌患者对安罗替尼的治疗也有良好的反应[13]。本实验中安罗替尼单药可以抑制结直肠癌细胞的增殖,促进结直肠癌细胞的凋亡。
2020年的结直肠癌诊疗指南显示,5-FU仍为非转移性结直肠癌和转移性结直肠癌的一线化疗方案,常与其他化疗药物联合使用,但其高剂量的毒性及耐药性限制其使用[3, 13-15]。结直肠癌细胞的增殖速度快、代谢旺盛和易转移是影响其预后的重要因素[16]。青藤碱联合5-FU可以抑制结直肠癌细胞的生长,通过线粒体途径促进细胞的凋亡,低剂量的青藤碱与5-FU联用时不会增加不良反应[17],当奥沙利铂联合5-FU时通过下调survivin mRNA的表达来调控或协同其他凋亡因子来诱导结直肠癌细胞凋亡[18]。安罗替尼联合第三代氟尿嘧啶衍生物,在非小细胞肺癌患者中显示出较好的疗效和较低的毒性[19]。本研究发现,安罗替尼联合5-FU用药比安罗替尼单药和5-FU单药的IC50值更低。
安罗替尼是一种新型的小分子多靶点酪氨酸酶抑制剂[4]。胰岛素样生长因子1受体(insulin-like growth factor-1 receptor,IGF-1R)是一种具有酪氨酸激酶活性的跨膜糖蛋白,与肿瘤的发生和发展有关[20-21]。5-FU是结直肠癌联合化疗的常用药物之一,其耐药性的产生与IGF-1R表达增加有关,当IGF-1R受到抑制时可以增加结直肠癌患者对5-FU的药物敏感性[22-23]。
本研究通过CCK8、集落形成和流式细胞术实验分析安罗替尼和安罗替尼联合5-FU不同处理下结直肠癌SW480和DLD-1细胞的增殖和凋亡情况。实验结果显示,安罗替尼单药处理后,SW480和DLD-1细胞的增殖受到抑制,且凋亡率增加,并且增加安罗替尼浓度和延长干预时间均可使其效用增强。与安罗替尼单药组比较,安罗替尼联合5-FU处理SW480和DLD-1细胞显示,相同安罗替尼浓度下,联合用药对细胞增殖的抑制效率更强,细胞凋亡率更高,表现出协同效应。Caspase-3是一种半胱氨酸蛋白酶,普遍认为其切割是凋亡的标志,在细胞的凋亡中起核心作用,一旦激活,转化为cleaved-caspase-3,细胞将发生不可逆的凋亡[24-26]。本研究显示,安罗替尼联合5-FU组细胞凋亡率高于安罗替尼单药组。Western blot实验结果显示,安罗替尼联合5-FU组cleaved-caspase-3的表达量也高于安罗替尼单药组,提示安罗替尼联合5-FU可以促进结直肠癌细胞发生凋亡,其机制可能通过上调凋亡蛋白cleaved-caspase-3的表达。
总之,本研究发现,安罗替尼联合5-FU可抑制结直肠癌细胞的增殖并促进其凋亡,且优于单一用药。本研究有望为安罗替尼治疗晚期结直肠癌提供新的理论基础。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
Schürmann C, Wieseler B. Validation of surrogate end points for overall survival in advanced colorectal cancer: further need for clarification: Letter to the editor on: Ciani et al., 2015, Meta-analyses of randomized controlled trials show suboptimal validity of surrogate outcomes for overall survival in advanced colorectal cancer[J]. J Clin Epidemiol, 2015, 70(2): 278-279. |
| [3] |
Ehrenberg R, Halama N. FOLFOX plus cetuximab in first-line therapy of advanced colorectal cancer[J]. Ann Transl Med, 2018, 6(Suppl 2): S96. |
| [4] |
Lin B, Song X, Yang D, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβ and FGFR1[J]. Gene, 2018, 654: 77-86. DOI:10.1016/j.gene.2018.02.026 |
| [5] |
Shao L, Wang W, Song Z, et al. The efficacy and safety of anlotinib treatment for advanced lung cancer[J]. Onco Targets Ther, 2019, 12: 6549-6554. DOI:10.2147/OTT.S205674 |
| [6] |
李娜, 黄琦, 张明军, 等. 安罗替尼三线治疗晚期转移性结直肠癌疗效分析[J]. 中华医学杂志, 2019, 99(36): 2844-2847. DOI:10.3760/cma.j.issn.0376-2491.2019.36.010 |
| [7] |
Wang Y, Zhao M, Zhao H, et al. MicroRNA-940 restricts the expression of metastasis-associated gene MACC1 and enhances the antitumor effect of Anlotinib on colorectal cancer[J]. Onco Targets Ther, 2019, 12: 2809-2822. DOI:10.2147/OTT.S195364 |
| [8] |
Siraj AK, Kumar Parvathareddy S, Pratheeshkumar P, et al. APC truncating mutations in Middle Eastern population: Tankyrase inhibitor is an effective strategy to sensitize APC mutant CRC To 5-FU chemotherapy[J]. Biomed Pharmacother, 2020, 121(1): 109572. |
| [9] |
Miller KD, Nogueira L, Mariotto AB, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363-385. DOI:10.3322/caac.21565 |
| [10] |
Kerbel RS. Tumor angiogenesis: past, present and the near future[J]. Carcinogenesis, 2000, 21(3): 505-515. DOI:10.1093/carcin/21.3.505 |
| [11] |
Strumberg D, Richly H, Hilger RA, et al. Phase Ⅰ clinical and pharmacokinetic study of the novel Raf kinase and vascular endothelial growth factor receptor inhibitor BAY 43-9006 in patients with advanced refractory solid tumors[J]. J Clin Oncol, 2005, 23(5): 965-972. DOI:10.1200/JCO.2005.06.124 |
| [12] |
He C, Wu T, Hao Y. Anlotinib induces hepatocellular carcinoma apoptosis and inhibits proliferation via Erk and Akt pathway[J]. Biochem Biophys Res Commun, 2018, 503(4): 3093-3099. DOI:10.1016/j.bbrc.2018.08.098 |
| [13] |
Sun Y, Du F, Gao M, et al. Anlotinib for the treatment of patients with locally advanced or metastatic medullary thyroid cancer[J]. Thyroid, 2018, 28(11): 1455-1461. DOI:10.1089/thy.2018.0022 |
| [14] |
Shi T, Gao M, He M, et al. 5-FU preferably induces apoptosis in BRAF V600E colorectal cancer cells via downregulation of Bcl-xL[J]. Mol Cell Biochem, 2019, 461(1/2): 151-158. DOI:10.1007/s11010-019-03598-5?utm_source=trendmd |
| [15] |
中华人民共和国国家卫生健康委员会. 中国结直肠癌诊疗规范(2020年版)[J]. 中华外科杂志, 2020, 58(8): 561-585. DOI:10.3760/cma.j.cn112139-20200518-00390 |
| [16] |
Yu F, Zhou C, Zeng H, et al. BMI1 activates WNT signaling in colon cancer by negatively regulating the WNT antagonist IDAX[J]. Biochem Biophys Res Commun, 2018, 496(2): 468-474. DOI:10.1016/j.bbrc.2018.01.063 |
| [17] |
Zhang JX, Yang ZR, Wu DD, et al. Suppressive effect of sinomenine combined with 5-fluorouracil on colon carcinoma cell growth[J]. Asian Pac J Cancer Prev, 2014, 15(16): 6737-6743. DOI:10.7314/APJCP.2014.15.16.6737 |
| [18] |
顾蔚, 蔡中瑞, 王天翔, 等. 奥沙利铂联合5-FU术前短程冲击化疗对诱导结直肠癌细胞凋亡的影响[J]. 浙江临床医学, 2014, 8: 1218-1219. |
| [19] |
Yang X, Xiang M, Geng L, et al. Anlotinib combined with S-1 in the third-line treatment of stage Ⅳ non-small cell lung cancer: study protocol for phase Ⅱ clinical trial[J]. Asian Pac J Cancer Prev, 2019, 20(12): 3849-3853. DOI:10.31557/APJCP.2019.20.12.3849 |
| [20] |
Pollak M. Insulin and insulin-like growth factor signalling in neoplasia[J]. Nat Rev Cancer, 2008, 8(12): 915-928. DOI:10.1038/nrc2536 |
| [21] |
Pollak M. The insulin and insulin-like growth factor receptor family in neoplasia: an update[J]. Nat Rev Cancer, 2012, 12(3): 159-169. DOI:10.1038/nrc3215 |
| [22] |
Grbčić P, Tomljanović Ⅰ, Klobučar M, et al. Dual sphingosine kinase inhibitor SKI-Ⅱ enhances sensitivity to 5-fluorouracil in hepatocellular carcinoma cells via suppression of osteopontin and FAK/IGF-1R signalling[J]. Biochem Biophys Res Commun, 2017, 487(4): 782-788. DOI:10.1016/j.bbrc.2017.04.100 |
| [23] |
Hosseini SA, Zand H, Cheraghpour M. The influence of curcumin on the downregulation of MYC, insulin and IGF-1 receptors: a possible mechanism underlying the anti-growth and anti-migration in chemoresistant colorectal cancer cells[J]. Medicina (Kaunas), 2019, 55(4): 90. DOI:10.3390/medicina55040090 |
| [24] |
Nuñez G, Benedict MA, Hu Y, et al. Caspases: the proteases of the apoptotic pathway[J]. Oncogene, 1998, 17(25): 3237-3245. DOI:10.1038/sj.onc.1202581 |
| [25] |
Porter AG, Jänicke RU. Emerging roles of caspase-3 in apoptosis[J]. Cell Death Differ, 1999, 6(2): 99-104. DOI:10.1038/sj.cdd.4400476 |
| [26] |
于镓锐, 杨森, 钟洪波, 等. 藤黄酸通过抑制JAKSTAT通路对食管癌细胞KYSE450增殖和凋亡的影响[J]. 实用肿瘤杂志, 2021, 36(3): 228-233. |
 2021, Vol. 36
2021, Vol. 36


