文章信息
- 张雨雁, 陈学军
- Zhang Yuyan, Chen Xuejun
- CXCL2和THBS2在结肠癌诊断、预后及免疫浸润中的生物信息学分析
- Bioinformatic analysis of role of CXCL2 and THBS2 in diagnosis, prognosis and immune infiltration of colon cancer
- 实用肿瘤杂志, 2022, 37(2): 154-162
- Journal of Practical Oncology, 2022, 37(2): 154-162
-
通信作者
- 陈学军,E-mail: xuejunchen64@126.com
-
文章历史
- 收稿日期:2021-03-30
结肠癌是消化道最常见的恶性肿瘤之一,结肠癌的发展是一个与多基因相关的多步骤的复杂过程。早期的结肠癌患者通常可以长期生存,但早期症状不典型的患者在初诊时已是晚期,往往预后不佳[1]。在过去的20年中,随着治疗措施的发展,结肠癌所有阶段的5年生存率已提高到66%。然而,进展期结肠癌的生存率仍然非常差[2]。研究表明,许多生化分子标志物参与结肠癌的发生和发展,可用于结肠癌的早期筛查[3]。鉴定新的治疗靶标和预测性生物标志物以改善结肠癌治疗反应和预后是非常必要的举措。本研究通过分析GEO数据库中结肠癌的基因芯片数据集,筛选结肠癌组织与正常组织中差异表达的核心基因,并进行核心基因的表达验证,分析预后和细胞免疫浸润水平,以期为结肠癌的治疗及预后寻找潜在的靶标。
1 资料与方法 1.1 基因芯片资料基因芯片数据的获取:根据样本来自人结肠组织标本、同时具有病例组及对照组和样本数≥20例这3个条件,2021年5月从GEO数据库(http:www.ncbi.nlm.nig.gov/geo)中获得结肠癌相关基因芯片GSE37364、GSE44076和GSE33113的RNA表达谱数据集。GSE37364包含27例结肠癌和38例正常结肠组织。GSE44076包含98例结肠癌和148例正常结肠组织(包括50例正常结肠组织和98例癌旁结肠组织);其中男性98例,女性50例;年龄25~88岁,中位年龄70岁。GSE33113包含90例结肠癌组织和6例癌旁结肠组织;其中男性42例,女性48例;年龄48~95岁,中位年龄57岁。GSE37364和GSE33113芯片为Affymetrix 5HGUl33 Plus 2.0,芯片数据生成于同一分析平台GPL570;GSE44076芯片为Affymetrix人类基因组U219阵列,来自于分析平台GPL13667。
1.2 结肠癌差异表达基因(differentially expressed genes,DEGs)筛选通过GEO自带的分析工具GEO2R对GSE37364、GSE133113和GSE44076的原始数据进行处理,将数据分为结肠癌组和正常组。筛选标准:校正后P < 0.05和∣log2差异倍数(fold change,FC)∣ > 2,数据导入Graphpad prism 8绘制DEGs分布火山图,2021年5月使用在线工具Draw Venn diagram(http://bioinformatics.psb.ugent.be/webtools/Venn/)确定3组数据的相交部分。
1.3 蛋白互作网络的构建和核心基因的筛选2021年5月通过STRING在线数据库(http://string-db.org/)对差异基因构建蛋白互作(protein-protein interaction,PPI)网络分析,互作评分 > 0.4。将上述结果导入Cytoscape(版本3.7.2)进行可视化, 计算节点的连通度,通过Cytohubba插件获取核心基因。
1.4 核心基因预后分析和差异表达水平验证2021年12月通过GEPIA(http://gepia.cancer-pku.cn/)在线分析工具对核心基因进行预后分析和表达差异验证,以P < 0.05为差异具有统计学意义。
1.5 UALCAN分析核心基因表达与临床病理变量的关系2021年12月UALCAN(http://ualcan.path.uab.edu/index.html)网站分析核心基因CXC型趋化因子配体2(CXC chemokine ligand 2,CXCL2)和血小板反应蛋白2(thrombospondin-2,THBS2)表达与临床病理变量的关系。筛选条件:(1)TCGA analysis;(2)Enter gene symbol: CXCL2、THBS2;(3)TCGA dataset colon adenocarcinoma;(4)Links for analysis: Expression。
1.6 核心基因与结肠肿瘤免疫细胞浸润的相关性2021年12月通过TIMER(https://cistrome.shinyapps.io/timer/)在线工具分析结肠癌核心基因表达与免疫细胞浸润水平的相关性,对结肠癌中核心基因表达量进行相关性分析,以P < 0.05为差异具有统计学意义,r > 0为正相关,r < 0为负相关。
1.7 LinkedOmics鉴定核心基因的相关基因及DAVID分析KEGG通路2021年5月通过LinkedOmics(http://www.linkedomics.org)数据库进入LinkFinder模块设置目标肿瘤为“COADREAD”目标基因为“CXCL2、THBS2”,选择RNAseq的数据集,选择Pearson检验,获取CXCL2和THBS2正相关的表达基因,筛选P < 0.01且Statistic > 0排名在前30位的正相关基因,并通过DAVID(http://david.ncifcrf.gov)在线工具进行KEGG通路分析,且P < 0.05为截止标准。
2 结果 2.1 DEGs筛选通过GEO2R的筛选,获得GSE37364数据集DEGs 1 073个,其中上调基因662个,下调基因411个;GSE44076数据集DEGs 823个,其中上调基因588个,下调基因235个;GSE33113数据集DEGs 878个,其中上调基因754个,下调基因124个(图 1)。

|
| 注 A:GSE33113上调和下调基因火山图;B:GSE37364上调和下调基因火山图;C:SGE44076上调和下调基因火山图;FC:差异倍数(fold change) 图 1 结肠癌差异表达基因分布图 Fig.1 Distribution of differentially expressed genes of colon cancer |
通过韦恩图取交集后获得202个DEGs(图 2)。通过STRING数据库对202个DEGs进行PPI网络分析,并将结果导入Cytoscape分析软件,获得199个节点和351对PPI关系。通过Cytohubba插件,采用MCC、Degree和Closeness 3种算法获得前25位关键基因取交集后获得核心基因16个[脂肪酸结合蛋白1(fatty acid-binding protein 1,FABP1)、肽酪氨酸酪氨酸(peptide tyrosine tyrosine,PYY)、CXCL2、CXCL1、过氧化物酶体增殖物激活受体辅激活因子1α(promoter of peroxisome proliferators-activated receptor-γ coactivator 1α,PPARGC1A)、Ⅰ型胶原α2(collagen type Ⅰ alpha 2,COL1A2)、溶质载体26A3(solute carrie 26A3,SLC26A3)、分泌性磷蛋白1(secreted phosphorprotein-1,SPP1)、核受体亚家族Ⅰ,H组,成员4(nuclear receptor subfamily Ⅰ,group H,member 4,NR1H4)、Ⅰ型胶原α1(collagen type Ⅰ alpha1,COL1A1)、基质金属蛋白酶1(matrix metallaproteinase 1,MMP1)、金属蛋白酶抑制物1(tissue inhibitor of metalloproteinase 1,TIMP1)、CXCL12、CXCL5、THBS2和生长抑素(somatostatin,SST)]。

|
| 图 2 结肠癌差异基因筛选韦恩图 Fig.2 Differential gene screening Veen map |
选取在结肠癌中研究较少的CXCL2和THBS2进一步经GEPIA在线网站分析其表达水平和预后表明,CXCL2和THBS2在结肠癌组织中的表达水平高于正常结肠组织,差异均具有统计学意义(均P < 0.05)。CXCL2高表达组患者的5年生存率高于低表达组患者(P < 0.05),THBS2高表达组患者的5年生存率低于低表达组患者(P < 0.05,图 3)。

|
| 注 A:CXCL2在结肠癌中的表达水平;B:THBS2在结肠癌中的表达水平;C:CXCL2表达对结肠癌患者生存曲线的影响;D:THBS2表达对结肠癌患者生存曲线的影响;*P<0.05 图 3 结肠癌患者CXCL2和THBS2的表达水平和预后分析图 Fig.3 Expression and prognostic analysis of CXCL2 and THBS2 in colon cancer patients |
通过UALCAN检索源于TCGA数据库中283例结肠癌患者的临床资料,分别按照年龄、性别和病理分期等因素分析CXCL2和THBS2 mRNA表达差异。CXCL2在结肠癌中的表达水平高于正常组织(P < 0.01,图 4A)。CXCL2的表达在年龄、分期、性别和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05,图 4)。THBS2在结肠癌中的表达水平高于正常组织(P < 0.01,图 5A)。其表达在年龄、分期、性别和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05,图 5)。

|
| 注 A:CXCL2在结肠癌组织和正常组织中的表达水平;B:不同性别结肠癌组织中CXCL2表达水平;C:不同临床分期结肠癌组织中CXCL2表达水平;D:不同年龄结肠癌组织中CXCL2表达水平;E:不同淋巴结转移情况结肠癌组织中CXCL2表达水平;*P<0.05;**P<0.01 图 4 结肠癌组织中CXCL2表达与临床病理特征的关系 Fig.4 Relationship between the expression of CXCL2 in colon cancer and clinicopathological characteristics |

|
| 注 A:THBS2在结肠癌组织和正常组织中表达水平;B:不同性别结肠癌组织中THBS2表达水平;C:不同临床分期结肠癌组织中THBS2表达水平;D:不同年龄结肠癌组织中THBS2表达水平;E:不同淋巴结转移情况结肠癌组织中THBS2表达水平;**P<0.01 图 5 结肠癌组织中THBS2表达与临床病理特征的关系 Fig.5 Relationship between the expression of THBS2 in colon cancer and clinicopathological characteristics |
通过TIMER在线工具分析结肠癌中CXCL2和THBS2表达水平与免疫细胞浸润水平的相关性发现,CXCL2与巨噬细胞呈负相关(r=-0.197,P < 0.01),与中性粒细胞呈正相关(r=0.265,P < 0.01),与细胞纯度、B细胞、CD8+T细胞、CD4+T细胞和树突状细胞均无相关性(均P > 0.05)。THBS2表达与细胞纯度呈负相关(r=-0.336,P < 0.01),与CD8+T细胞(r=0.201,P < 0.01)、CD4+T细胞(r=0.412,P < 0.01)、树突状细胞(r=0.508,P < 0.01)、巨噬细胞(r=0.609,P < 0.01)和中性粒细胞(r=0.473,P < 0.01)呈正相关,与B细胞无相关性(r=0.030,P=0.544;图 6)。分析CXCL2和THBS2在结肠癌中表达水平的相关性发现,CXCL2和THBS2呈负相关(r=-0.153,P < 0.01;图 7),CXCL2和THBS2可能参与结肠癌的免疫浸润。
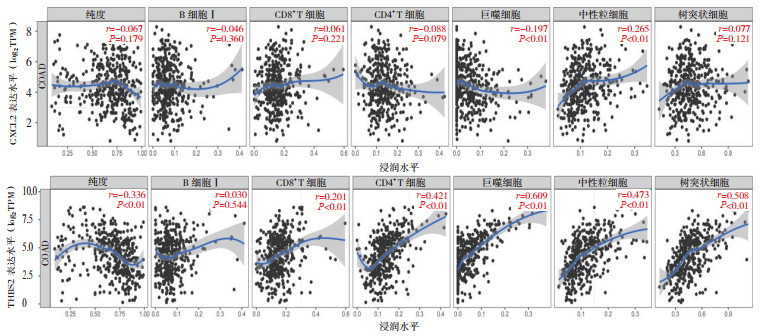
|
| 图 6 CXCL2和THBS2表达与肿瘤免疫浸润水平的相关性 Fig.6 Correlation between the expression of CXCL2 and THBS2 and tumor immune infiltration level |

|
| 图 7 CXCL2和THBS2表达水平相关性 Fig.7 The correlation between CXCL2 and THBS2 |
为进一步预测CXCL2和THBS2基因在结肠癌恶性进程中可能参与的信号通路,通过LinkedOmics数据库获得CXCL2正相关基因1 059个(图 8A),THBS2正相关基因5 832个(图 8B)。将排名前30位的正相关基因导入DAVID,得到与CXCL2和THBS2正相关基因的KEGG通路(表 1~2)。其中CXCL2基因主要与细胞因子受体的相互作用、TNF信号通路、沙门氏菌感染、趋化因子信号通路和核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)受体信号等通路有关(图 9A)。THBS2基因主要与细胞外基质ECM-受体相互作用、局灶性粘连和PI3K-Akt等信号通路有关(图 9B)。

|
| 注 A:CXCL2正相关基因热图;B:THBS2正相关基因热图 图 8 CXCL2和THBS2正相关基因热图 Fig.8 Heat map of positive genes associated with CXCL2 and THBS2 |
| 通路 | P值 | 数目 | 基因 |
| 细胞因子-细胞因子受体相互作用 | < 0.01 | 15 | CXCL6、IL22、CSF3、CSF2、IL26、CCL20、IL24、CXCL1、CXCL3、CXCL2、TNF、IL1A、IL6、IL1B和IL17A |
| 类风湿性关节炎 | < 0.01 | 9 | IL1A、CXCL6、IL6、CSF2、CCL20、IL1B、MMP3、TNF和IL17A |
| 肿瘤坏死因子信号通路 | < 0.01 | 9 | IL6、CSF2、CCL20、IL1B、MMP3、CXCL1、CXCL3、TNF和CXCL2 |
| IBD | < 0.01 | 7 | IL1A、IL6、CSF2、IL1B、CXCL1、CXCL3和CXCL2 |
| 军团菌病 | < 0.01 | 6 | IL6、IL1B、CXCL1、CXCL3、TNF和CXCL2 |
| 造血细胞系 | < 0.01 | 6 | IL1A、CSF3、IL6、CSF2、IL1B和TNF |
| NOD受体信号通路 | < 0.01 | 5 | IL6、IL1B、CXCL1、TNF和CXCL2 |
| Jak-STAT信号通路 | < 0.01 | 6 | IL22、CSF3、IL6、SOCS1、CSF2和IL24 |
| 百日咳 | < 0.01 | 5 | IL1A、CXCL6、IL6、IL1B和TNF |
| 移植物抗宿主病 | < 0.01 | 4 | IL1A、IL6、IL1B和TNF |
| 甲型流感 | < 0.01 | 4 | CSF3、IL6、IL1B和TNF |
| 趋化因子信号通路 | 0.002 | 5 | CXCL6、CCL20、CXCL1、CXCL3和CXCL2 |
| Toll受体信号通路 | 0.003 | 4 | IL6、IL1B、TNF和IKBKE |
| 阿米巴病 | 0.003 | 4 | IL6、CSF2、IL1B和TNF |
| 非洲锥虫病 | 0.004 | 3 | IL6、IL1B和TNF |
| 朊病毒病 | 0.004 | 3 | IL1A、IL6和IL1B |
| 破骨细胞分化 | 0.006 | 4 | IL1A、SOCS1、IL1B和TNF |
| Ⅰ型糖尿病 | 0.006 | 3 | IL1A、IL1B和TNF |
| 非酒精性脂肪肝 | 0.009 | 4 | IL1A、IL6、IL1B和TNF |
| 癌症中的转录失调 | 0.011 | 4 | IL6、CSF2、MMP3和NFKBIZ |
| 肺结核 | 0.014 | 4 | IL1A、IL6、IL1B和TNF |
| 胞浆DNA感应途径 | 0.015 | 3 | IL6、IL1B和IKBKE |
| 单纯疱疹感染 | 0.015 | 4 | IL6、IL1B、TNF和IKBKE |
| 利什曼病 | 0.018 | 3 | IL1A、IL1B和TNF |
| 美洲锥虫病 | 0.036 | 3 | IL6、IL1B和TNF |
| 注 IBD:炎症性肠病(inflammatory bowel disease);NOD:核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain);Jak-STAT:酪氨酸激酶/ 信号转导与转录激活子(the Janus kinase/signal transducer and activator of transcription) | |||
| 通路 | P值 | 数目 | 基因 |
| ECM-受体相互作用 | < 0.01 | 7 | COL1A1、COL3A1、COL1A2、COL11A1、ITGA11、COL5A2和THBS2 |
| 蛋白质消化吸收 | < 0.01 | 6 | COL1A1、COL3A1、COL1A2、COL11A1、COL5A2和COL10A1 |
| 黏着斑 | < 0.01 | 7 | COL1A1、COL3A1、COL1A2、COL11A1、ITGA11、COL5A2和THBS2 |
| PI3K-Akt信号通路 | < 0.01 | 7 | COL1A1、COL3A1、COL1A2、COL11A1、ITGA11、COL5A2和THBS2 |
| 阿米巴病 | < 0.01 | 5 | COL1A1、COL3A1、COL1A2、COL11A1和COL5A2 |
| 血小板激化 | < 0.01 | 5 | COL1A1、COL3A1、COL1A2、COL11A1和COL5A2 |
| 注 ECM:细胞外基质(extracellular matrix);PI3K-Akt:磷脂酰肌醇3- 激酶/ 蛋白激酶B(phosphatidyl inositide 3-kinase/ protein kinase B) | |||
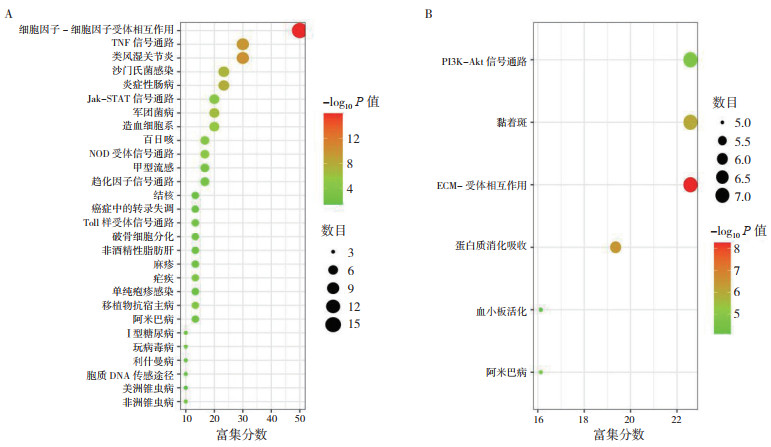
|
| 注 A:CXCL2正相关基因气泡图;B:THBS2正相关基因气泡图;TNF:肿瘤坏死因子(tumor necrosis factor);Jak-STAT:酪氨酸激酶/ 信号转导与转录激活子(the Janus kinase/signal transducer and activator of transcription);NOD:核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain);PI3K-Akt:磷脂酰肌醇3-激酶/ 蛋白激酶B(phosphatidyl inositide 3-kinase/protein kinase B);ECM:细胞外基质(extracellular matrix) 图 9 CXCL2和THBS2正相关基因KEGG通路 Fig.9 KEGG pathway of CXCL2 and THBS2 positively related gene |
结直肠癌因其高发病率和高死亡率成为全球最恶性的肿瘤之一,其中以结肠癌最为常见。结肠癌发生是多基因和多途径驱动的过程,通过全基因组数据来筛选肿瘤标志物,可以用于诊断和预后,也可用于指导探索前瞻性机制[4-5]。本研究通过分析基因芯片GSE44076、GSE37364和GSE33113数据集,共筛选出202个在3个数据集中共有的差异表达基因,将所有差异表达基因通过STRING在线工具蛋白互作分析,Cytoscape筛选核心基因,共得到16个关键基因,对其中研究较少的CXCL2和THBS2基因进行进一步分析。
CXCL2是一种小分泌蛋白,是趋化因子CXC亚家族的成员,趋化因子有5个亚家族:CXC、CC、XC、CX3C和CX是编码参与免疫调节的分泌蛋白,主要募集嗜中性粒细胞。CXC趋化因子及其受体在多种细胞中表达,在免疫细胞和骨髓造血细胞的生成、分化、发育调节和免疫反应调节等方面发挥重要作用。CXCL2可以调节肿瘤上皮-基质相互作用,以促进肿瘤的生长和浸润,并与血管生成有关[6-7]。越来越多的证据表明,趋化因子在癌症进展和致癌作用中起着关键作用[8]。CXCL2在乳腺癌和前列腺癌中高表达,介导肿瘤的生长和转移[9-10]。在膀胱癌中肿瘤细胞通过CXCL2/巨噬细胞迁移抑制因子-趋化因子受体2(macrophage migration inhibitory factor-chemokine receptor 2,MIF-CXCR2)信号诱导髓源抑制细胞(myeloid-derived suppressor cell,MDSC)在膀胱癌微环境中积累和扩增,CXCL2在膀胱癌中表达升高,与肿瘤的浸润程度呈正相关[11]。CXCL2在肿瘤中的作用也有一些争议,其在肝癌患者的血清中高表达,但在肝癌组织中低表达,对肿瘤起抑制作用[7],其作用机制还需进一步研究证实。在结直肠癌血清中CXCL2的蛋白浓度高于正常血清中的CXCL2蛋白浓度[12],与本研究结论相似。在结肠癌基因芯片的表达谱中,CXCL2亦作为中枢基因,其表达水平高于正常结肠组织,且表示水平与患者的年龄、分期、性别和淋巴结转移有关,高表达患者的生存率要高于低表达的患者。其与巨噬细胞和中性粒细胞呈正相关,可能参与结肠癌肿瘤细胞的免疫浸润。
THBS2属于由基质成纤维细胞、内皮细胞和免疫细胞分泌的基质细胞钙结合糖蛋白家族的一员。其与各种细胞表面受体、生长因子、细胞因子和蛋白酶相互作用,以参与细胞基质粘附、运动、趋化性、伤口愈合和血管抑制等作用[13]。在许多肿瘤中,血小板反应蛋白的下调伴随着癌基因的激活或肿瘤抑制基因的失活,在肿瘤组织中增加THBS2的表达水平能抑制肿瘤生长[14]。其在子宫颈癌、甲状腺癌和胰腺癌中表达下调,起到抑癌基因作用[15-17]。其在胃癌中THBS2表达量升高,可抑制胃癌细胞的增殖、迁移和侵袭。同时,通过PI3k-Akt信号通路促进细胞凋亡,ECM-受体相互作用途径在胃癌进展中也起到关键作用[18-19]。THBS1通常在肺癌中表达不足;但在非小细胞肺癌中THBS2 mRNA过表达[20]。THBS2在上尿路和膀胱尿路上皮癌中过表达,是患者独立不良预后的生物标志物[21]。THBS2在结直肠腺瘤和结直肠癌正常邻近组织中均显示甲基化不足[22]。在大肠癌血清中THBS2的表达要低于正常对照组,其浓度与病理特征无关。本研究发现,THBS2在结肠癌中高表达,且高表达与患者的预后不良相关。THBS2可能参与结肠肿瘤的免疫浸润,但在结肠癌中相互作用的生物学效应与分子机制还需进一步研究。
综上所述,CXCL2和THBS2在结肠癌中高表达,可能是结肠癌诊断及预后的生物标志物,并可能参与结肠肿瘤细胞的免疫浸润,可为结肠癌的治疗研究提供新的方向,有望成为结肠癌新型的诊断和治疗靶点。
| [1] |
Liu H, Ma L, Wang L, et al. MicroRNA-937 is overexpressed and predicts poor prognosis in patients with colon cancer[J]. Diagn Pathol, 2019, 14(1): 136. DOI:10.1186/s13000-019-0920-3 |
| [2] |
程龙, 刘晓昌, 梅俏. 关于建立结直肠癌立体防治系统的探讨[J]. 实用肿瘤杂志, 2021, 36(1): 1-5. |
| [3] |
邱洁萍, 孙梦雨, 左瑞东, 等. 基于GEO数据库的胃癌差异表达基因的生物信息学分析[J]. 中国免疫学杂志, 2020, 36(19): 2394-2399. DOI:10.3969/j.issn.1000-484X.2020.19.023 |
| [4] |
Ruan GT, Gong YZ, Liao XW, et al. Diagnostic and prognostic values of C-X-C motif chemokine ligand 3 in patients with colon cancer[J]. Oncol Rep, 2019, 42(5): 1996-2008. |
| [5] |
Xie B, Zhao R, Bai B, et al. Identification of key tumorigenesis-related genes and their microRNAs in colon cancer[J]. Oncol Rep, 2018, 40(6): 3551-3560. |
| [6] |
Shi H, Han X, Sun Y, et al. Chemokine (C-X-C motif) ligand 1 and CXCL2 produced by tumor promote the generation of monocytic myeloid-derived suppressor cells[J]. Cancer Sci, 2018, 109(12): 3826-3839. DOI:10.1111/cas.13809 |
| [7] |
Zhou X, Peng M, He Y, et al. CXC chemokines as therapeutic targets and prognostic biomarkers in skin cutaneous melanoma microenvironment[J]. Front Oncol, 2021, 11(6): 19003. |
| [8] |
Ding J, Xu K, Zhang J, et al. Overexpression of CXCL2 inhibits cell proliferation and promotes apoptosis in hepatocellular carcinoma[J]. BMB Rep, 2018, 51(12): 630-635. DOI:10.5483/BMBRep.2018.51.12.140 |
| [9] |
孙美琪, 张薇, 郝倩文, 等. 肿瘤标志物对良恶性胸腔积液鉴别的研究进展[J]. 实用肿瘤杂志, 2020, 35(3): 278-283. |
| [10] |
Hardaway AL, Herroon MK, Rajagurubandara E, et al. Marrow adipocyte-derived CXCL1 and CXCL2 contribute to osteolysis in metastatic prostate cancer[J]. Clin Exp Metastasis, 2015, 32(4): 353-368. DOI:10.1007/s10585-015-9714-5 |
| [11] |
Zhang H, Ye YL, Li MX, et al. CXCL2/MIF-CXCR2 signaling promotes the recruitment of myeloid-derived suppressor cells and is correlated with prognosis in bladder cancer[J]. Oncogene, 2017, 36(15): 2095-2104. DOI:10.1038/onc.2016.367 |
| [12] |
郑敏. miR-192靶向CXCL2基因对结直肠癌细胞侵袭迁移能力的抑制作用[D]. 华北理工大学, 2017.
|
| [13] |
Jiang YM, Yu DL, Hou GX, et al. Serum thrombospondin-2 is a candidate diagnosis biomarker for early nonsmall-cell lung cancer[J]. Biosci Rep, 2019, 39(7): BSR20190476. DOI:10.1042/BSR20190476 |
| [14] |
Fei W, Chen L, Chen J, et al. RBP4 and THBS2 are serum biomarkers for diagnosis of colorectal cancer[J]. Oncotarget, 2017, 8(54): 92254-92264. DOI:10.18632/oncotarget.21173 |
| [15] |
Jiao H, Zeng L, Zhang J, et al. THBS2, a microRNA-744-5p target, modulates MMP9 expression through CUX1 in pancreatic neuroendocrine tumors[J]. Oncol Lett, 2020, 19(3): 1683-1692. |
| [16] |
Kim MJ, Sun HJ, Song YS, et al. CXCL16 positively correlated with M2-macrophage infiltration, enhanced angiogenesis, and poor prognosis in thyroid cancer[J]. Sci Rep, 2019, 9(1): 13288. DOI:10.1038/s41598-019-49613-z |
| [17] |
Kodama J, Hashimoto I, Seki N, et al. Thrombospondin-1 and -2 messenger RNA expression in invasive cervical cancer: correlation with angiogenesis and prognosis[J]. Clin Cancer Res, 2001, 7(9): 2826-2831. |
| [18] |
Ao R, Guan L, Wang Y, et al. Silencing of COL1A2, COL6A3, and THBS2 inhibits gastric cancer cell proliferation, migration, and invasion while promoting apoptosis through the PI3k-Akt signaling pathway[J]. J Cell Biochem, 2018, 119(6): 4420-4434. DOI:10.1002/jcb.26524 |
| [19] |
Zhuo C, L iX, Zhuang H, et al. Elevated THBS2, COL1A2, and SPP1 expression levels as predictors of gastric cancer prognosis[J]. Cell Physiol Biochem, 2016, 40(6): 1316-1324. DOI:10.1159/000453184 |
| [20] |
Weng TY, Wang CY, Hung YH, et al. Differential expression pattern of THBS1 and THBS2 in lung cancer: clinical outcome and a systematic-analysis of microarray databases[J]. PLoS One, 2016, 11(8): e0161007. DOI:10.1371/journal.pone.0161007 |
| [21] |
Chang IW, LiC F, Lin VC, et al. Prognostic impact of thrombospodin-2 (THBS2) overexpression on patients with urothelial carcinomas of upper urinary tracts and bladders[J]. J Cancer, 2016, 7(11): 1541-1549. DOI:10.7150/jca.15696 |
| [22] |
Lin D, Alborn WE, Slebos RJ, et al. Comparison of protein immunoprecipitation-multiple reaction monitoring with ELISA for assay of biomarker candidates in plasma[J]. J Proteome Res, 2013, 12(12): 5996-6003. DOI:10.1021/pr400877e |
 2022, Vol. 37
2022, Vol. 37


