文章信息
- 凌明珠, 陈晔, 王维斯, 张丽婷, 江劲
- 维罗非尼治疗后获得性MET基因扩增肺腺癌一例
- 实用肿瘤杂志, 2021, 36(3): 215-217
-
通信作者
- 江劲, E-mail: jiangjinab@163.com
-
文章历史
- 收稿日期:2019-04-07
肺癌是我国最常见的恶性肿瘤之一。近几年,由于靶向治疗的研究进展,晚期非小细胞的生存期得到较大改善。常见的靶向治疗靶点有表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)和c-ros原癌基因1酪氨酸激酶(c-ros oncogene 1 receptor tyrosine kinase,ROS 1)等,并且针对这些靶点的靶向药物已在国内上市,对于这些靶点的研究较为成熟。但是对于少见靶点如鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1,BRAF),突变患者少,该靶点抑制剂针对非小细胞肺癌(non-small-cell lung cancer,NSCLC)的治疗也尚在研究阶段,因此国内相关临床报道较少,对于BRAF抑制剂耐药机制也不明确。现将本院1例维罗非尼治疗后间质上皮转化因子(mesenchymal-epithelial transition factor,MET)基因扩增的肺腺癌病例报道如下。
1 病例介绍男性患者,79岁,既往有支气管哮喘病史。2016年3月因咳嗽伴痰中带血2个月来本院就诊。胸部CT检查提示纵隔内肿大淋巴结,全身骨显像提示全身多处骨转移。经气管镜对气管旁肿物穿刺,免疫组织化学检查示,CK7+++,CK20-,TTF-1+++,Napsin A+++,p40-,TG-,Gelactin-3+++,HBME-1弱+,CD56-,Syn-。术后病理检查符合肺腺癌。诊断为肺腺癌Ⅳ期。当时建议患者行全身化疗。患者拒绝并出院休养。2016年5月因咳嗽咳痰胸闷气急症状加重,再次来本院,行支气管镜检查发现肿瘤侵犯主气道,行全麻下经支气管镜肿瘤切除术及支架置入术,并将气道内肿瘤送高通量测序,提示BRAF V600E突变,丰度42.8%,其余基因未见突变。建议患者靶向治疗,患者拒绝。2017年2月患者因咳嗽咳痰气急加重再次入院,CT检查提示纵隔淋巴结较前增大,两侧大量胸腔积液。予胸腔穿刺胸腔积液引流,胸腔积液中找到癌细胞。胸腔积液量多,反复引流。2017年8月11日患者开始每天2次口服BRAF抑制剂维罗非尼480 mg(考虑患者高龄,予减量)治疗。口服维罗非尼治疗1个月后患者胸腔积液量逐渐减少,拔除胸腔置管后复查胸腔B型超声,胸腔积液量未见明显增多。2017年9月复查胸部CT提示纵隔淋巴结较前缩小,疗效评价为部分缓解(partial response, PR;图 1)。之后患者每2~3个月复查CT,疗效评价维持PR。2018年4月复查胸部CT提示纵隔淋巴结较前明显增大,疗效评价为疾病进展(progressive disease, PD;图 1)。再次行支气管镜,通过支架网眼行经支气管镜针吸活检术(tranbronchial needle aspiration, TBNA)送检病理明确肿瘤组织,外送二代测序(next-generation sequencing,NGS),提示BRAF突变(丰度39.3%),MET扩增[拷贝数(copy number,CN)=3.18],鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)阴性,其余基因未见突变。予维罗非尼联合克唑替尼联合治疗。病情未见好转,2018年8月患者病情加重,死亡。
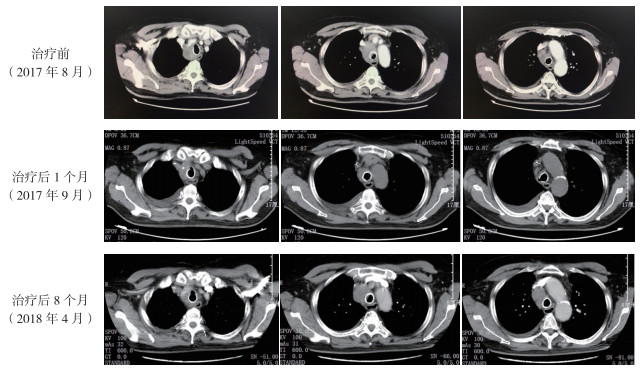
|
| 图 1 肺腺癌患者维罗非尼治疗前后胸部CT检查结果 |
维罗非尼治疗期间出现的不良反应为右上肢出现皮肤鳞状细胞癌,根据常见不良反应事件评价标准(common terminology criteria for adverse events,CTCAE)分级1级。未处理。
2 讨论肿瘤的发生、增殖和转移与信号通路密切相关。其中一条重要的信号通路是丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号通路。该通路主要由RAS、RAF、丝裂原激活蛋白激酶的激酶(mitogen-activated protein kinase kinase,MEK)和细胞外信号调节激酶(extracellular-signal-regulated kinase, ERK)等蛋白激酶构成,通过以此催化下级蛋白激酶发生磷酸化而激活整个信号通路。活化的ERK可以通过影响小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)等促使细胞生长过度,导致正常细胞向肿瘤细胞转化。BRAF是RAF家族的一员,BRAF基因突变也已被证实在黑色素瘤等多种肿瘤中起重要作用,BRAF抑制剂治疗黑色素瘤等肿瘤的临床疗效也被多个临床研究证实[1-7]。BRAF突变最常在600位密码子的缬氨酸倍谷氨酸所替换。
根据目前研究结果,约0.5%~4%的NSCLC患者BRAF突变[8],其中V600E突变的患者占56.8%[9]。达拉菲尼是一种口服BRAF抑制剂,在Ⅱ期临床研究中,达拉菲尼单药治疗BRAF V600E突变的经治NSCLC患者客观缓解率(objective response rate, ORR)为33%[10]。达拉菲尼联合曲美替尼(一种MEK抑制剂)治疗方案的ORR达63.2%[11]。从2项临床研究的数据可以看出BRAF抑制剂对BRAF V600E突变的NSCLC患者有较好的临床疗效。因此,美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)NSCLC临床实践指南2017年第8版开始也将达拉非尼联合曲美替尼、达拉菲尼单药和维罗非尼单药的治疗方案推荐作为BRAF V600E突变肺癌患者的一线治疗方案[12]。随后,2017年10月另一篇发表在柳叶刀杂志上的达拉菲尼联合曲美替尼治疗方案的临床研究数据再次证实BRAF抑制剂对于BRAF V600E突变肺癌患者的疗效[13]。1项荟萃分析中,72例BRAF突变的远处转移的肺癌患者,中位生存期达31个月,其中接受达拉菲尼和维罗非尼等BRAF抑制剂靶向治疗的患者与不接受BRAF抑制剂靶向治疗的患者,中位总生存期(median overall survival, mOS)分别为56.5个月和27.2个月。这项研究提示,BRAF抑制剂能为BRAF突变患者带来更好的生存获益。研究显示,使用BRAF抑制剂(维罗非尼、达拉非尼和索拉菲尼)治疗BRAF突变的肺癌患者,ORR为53%,疾病控制率(disease control rate, DCR)为85%,中位无进展生存期(median progression-free survival,mPFS)为5个月[14]。上述研究结果及其他一些小样本的临床研究结果均提示,维罗非尼等BRAF抑制剂在BRAF V600E突变的肺癌患者上存在一定疗效[15-16]。在1项关于达拉非尼治疗BRAF突变NSCLS的Ⅱ期临床研究中,维罗非尼单药组和达拉非尼联合曲美替尼组的ORR分别为42%和63%,DCR分别为84%和79%,PFS为7.3个月和9.3个月[17]。这项研究提示,维罗非尼对于BRAF突变的NCSLC患者疗效不劣于曲美替尼联合达拉非尼。
对于BRAF抑制剂的耐药机制尚不明确,达拉非尼治疗后有NSCLC患者会出现KRAS基因突变。有研究提示,抑制BRAF V600E可以负反馈增强RAS的活性,提示获得性KRAS基因突变可能是BRAF抑制剂的耐药机制之一[18]。本研究中,患者维罗非尼治疗后8个月出现MET基因扩增,由于Ras/Raf/MEK/ERK/MAPK信号转导通路是MET基因下游通路之一,因此,猜测MET基因扩增可能是维罗非尼的耐药机制之一。该结论有待进一步的研究证实。BRAF抑制剂的耐药机制也有待大样本临床研究揭示。
| [1] |
Oxnard GR, Binder A, Janne PA. New targetable oncogenes in non-small-cell lung cancer[J]. J Clin Oncol, 2013, 31(8): 1097-1104. DOI:10.1200/JCO.2012.42.9829 |
| [2] |
Chapman PB, Robert C, Larkin J, et al. Vemurafenib in patients with BRAFV600 mutation-positive metastatic melanoma: final overall survival results of the randomized BRIM-3 study[J]. Ann Oncol, 2017, 28(10): 2581-2587. DOI:10.1093/annonc/mdx339 |
| [3] |
Zippel D, Markel G, Shapira-Frommer R, et al. Perioperative BRAF inhibitors in locally advanced stage Ⅲ melanoma[J]. J Surg Oncol, 2017, 116(7): 856-861. DOI:10.1002/jso.24744 |
| [4] |
Schadendorf D, Long GV, Stroiakovski D, et al. Three-year pooled analysis of factors associated with clinical outcomes across dabrafenib and trametinib combination therapy phase 3 randomised trials[J]. Eur J Cancer, 2017, 82: 45-55. DOI:10.1016/j.ejca.2017.05.033 |
| [5] |
Blank CU, Larkin J, Arance AM, et al. Open-label, multicentre safety study of vemurafenib in 3219 patients with BRAFV600 mutation-positive metastatic melanoma: 2-year follow-up data and long-term responders' analysis[J]. Eur J Cancer, 2017, 79: 176-184. DOI:10.1016/j.ejca.2017.04.007 |
| [6] |
Ascierto PA, McArthur GA, Dréno B, et al. Cobimetinib combined with vemurafenib in advanced BRAF(V600)-mutant melanoma (coBRIM): updated efficacy results from a randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2016, 17(9): 1248-1260. DOI:10.1016/S1470-2045(16)30122-X |
| [7] |
郑海红, 谢伯剑, 朱优优, 等. BRAFV600E基因检测在术前辅助细针穿刺细胞学诊断甲状腺微小乳头状癌中的意义[J]. 实用肿瘤杂志, 2020, 35(3): 228-230. |
| [8] |
Li S, Li L, Zhu Y, et al. Coexistence of EGFR with KRAS, or BRAF, or PIK3CA somatic mutations in lung cancer: a comprehensive mutation profiling from 5125 Chinese cohorts[J]. Br J Cancer, 2014, 110(11): 2812-2820. DOI:10.1038/bjc.2014.210 |
| [9] |
Marchetti A, Felicioni L, Malatesta S, et al. Clinical features and outcome of patients with non-small-cell lung cancer harboring BRAF mutations[J]. J Clin Oncol, 2011, 29(26): 3574-3579. DOI:10.1200/JCO.2011.35.9638 |
| [10] |
Planchard D, Kim TM, Mazieres J, et al. Dabrafenib in patients with BRAF(V600E)-positive advanced non-small-cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2016, 17(5): 642-650. DOI:10.1016/S1470-2045(16)00077-2 |
| [11] |
Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAF(V600E)-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial[J]. Lancet Oncol, 2016, 17(7): 984-993. DOI:10.1016/S1470-2045(16)30146-2 |
| [12] |
美国国家综合癌症网络. NCCN Clinical Practice Guidelines in Oncology: non-small cell lung cancer (Version 8.2017)[EB/OL]. (2017-07-14)[2019-04-07]. https://www.nccn.org/
|
| [13] |
Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAF V600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial[J]. Lancet Oncol, 2017, 18(10): 1307-1316. DOI:10.1016/S1470-2045(17)30679-4 |
| [14] |
Gautschi O, Milia J, Cabarrou B, et al. Targeted therapy for patients with BRAF-mutant lung cancer: results from the European EURAF cohort[J]. J Thorac Oncol, 2015, 10(10): 1451-1457. DOI:10.1097/JTO.0000000000000625 |
| [15] |
Hyman DM, Puzanov I, Subbiah V, et al. Vemurafenib in multiple nonmelanoma cancers with BRAF V600 mutations[J]. N Engl J Med, 2015, 373(8): 726-736. DOI:10.1056/NEJMoa1502309 |
| [16] |
Hainsworth JD, Meric-Bernstam F, Swanton C, et al. Targeted therapy for advanced solid tumors on the basis of molecular profiles: results from MyPathway, an open-label, phase Ⅱa multiple basket study[J]. J Clin Oncol, 2018, 36(6): 536-542. DOI:10.1200/JCO.2017.75.3780 |
| [17] |
Baik CS, Myall NJ, Wakeleeb HA. Targeting BRAF-mutant non-small cell lung cancer: from molecular profiling to rationally designed therapy[J]. Oncologist, 2017, 22(7): 786-796. DOI:10.1634/theoncologist.2016-0458 |
| [18] |
Rudin CM, Hong K, Streit M. Molecular characterization of acquired resistance to the BRAF inhibitor dabrafenib in a patient with BRAF-mutant non-small cell lung cancer[J]. J Thorac Oncol, 2013, 8(5): e41-42. DOI:10.1097/JTO.0b013e31828bb1b3 |
 2021, Vol. 36
2021, Vol. 36


