文章信息
- 虞鲁诗, 龚虹云, 李倩, 宋启斌
- Yu Lushi, Gong Hongyun, Li Qian, Song Qibin
- 术后辅助放疗对卵巢癌患者生存的影响:一项基于SEER数据库的真实世界研究
- Effect of postoperative adjuvant radiotherapy on survival of patients with ovarian cancer: A real-world study based on SEER database
- 实用肿瘤杂志, 2021, 36(6): 542-550
- Journal of Practical Oncology, 2021, 36(6): 542-550
-
通信作者
- 宋启斌, E-mail: qibinsong@whu.edu.cn
-
文章历史
- 收稿日期:2021-01-31
卵巢癌是常见的妇科恶性肿瘤。在全球,卵巢癌的发病率和死亡率均在女性恶性肿瘤中居第8位,且其发病率在部分亚洲国家仍呈上升趋势[1-2]。我国每年约有2.5万例女性患者死于卵巢癌,死亡率居女性恶性肿瘤第10位,而在城市人口中,死亡率上升至第9位[3]。卵巢癌因其病理类型繁杂,故预后差异较大。早期(Ⅰ~Ⅱ期)卵巢癌患者的5年总生存(overall survival,OS)率约为60%~80%,但有60%~75%的患者确诊时已是中晚期(Ⅲ~Ⅳ期),其5年OS率仅为19%~41%[4]。
手术是卵巢癌常用的治疗方式,即使是复发性卵巢癌,二次手术也能使部分患者获益[5-6]。含铂药物的化疗以及靶向治疗作为全身治疗方式也在卵巢癌的治疗中广泛应用。在过去,全腹放疗是卵巢癌术后消除微小残留病灶和减少复发的辅助治疗方式;但临床实践发现常规的全腹放疗会导致严重的急性和迟发性毒性,因此目前仅被推荐用于姑息治疗[7]。随着放疗技术的不断改善,新型放疗方式(如调强放疗和立体定向放疗等)的逐渐展现,肿瘤放疗向着更精准、更安全和更有效的方向发展[8-9]。但近年来关于辅助放疗在卵巢癌中应用的研究仍较少,且多为小样本的分析报道。本研究通过对Surveillance,Epidemiology,and End Results(SEER)数据库中2011年至2015年期间行手术和术后辅助放疗的卵巢癌病例进行回顾性分析,研究辅助放疗对卵巢癌患者预后的影响,为放疗在卵巢癌临床治疗上的价值提供参考。
1 资料与方法 1.1 研究对象通过SEER*Stat软件(8.3.6版本)检索并收集SEER数据库(11899-Nov2018)中2011年至2015年间经病理确诊为原发卵巢癌的患者。纳入标准:(1)原发病灶为卵巢的恶性肿瘤,国际肿瘤学疾病分类第3版(International Classification of Disease for Oncology,Third Edition,ICD-O-3)编码为C56.9[10];(2)2011至2015年间确诊;(3)年龄≥18周岁;(4)具有完整的随访信息;(5)原发病灶行手术治疗。排除标准:(1)通过尸检或死亡证明诊断为卵巢癌;(2)多发肿瘤;(3)放疗数据不详或术前放疗;(4)分期数据不详;(5)肿瘤特异性生存(cancer-special survival,CSS)情况不详的。本研究已获准使用SEER数据库公开的临床资料。
1.2 一般资料根据是否行辅助放疗将纳入的患者分为无放疗组和辅助放疗组。将年龄(≤40岁、> 40~60岁和 > 60岁)、种族(白种人、黑种人和其他)、保险情况(有、无和不详)、婚姻状况(已婚、未婚和其他)、肿瘤部位(单侧和双侧)、病理类型(上皮性肿瘤和非上皮性肿瘤)、肿瘤分化程度(G1/G2、G3/G4和不详)、AJCC分期(Ⅰ~Ⅱ和Ⅲ~Ⅳ)、第7版AJCC T分期(T1、T2和T3)、AJCC N分期(N0和N1)、AJCC M分期(M0和M1)、是否化疗(是和否/不详)、糖类抗原125(carbohydrate antigen 125,CA125)水平(正常、临界值、升高和不详)和手术残留病灶情况(R0、非R0和不详)等变量进行分组分析。
1.3 统计学分析应用SPSS 22.0软件进行统计学分析。采用Mann-Whitney U检验和χ2检验比较组间各临床病理变量分布。通过单因素和多因素Cox回归分析预测辅助放疗及其他因素对卵巢癌患者OS和CSS的影响。应用Kaplan-Meier法以及Log-rank法进行组间及各亚组生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床病理特征共纳入卵巢癌患者18 529例,其中18 362例未行放疗(无放疗组),167例行术后辅助放疗(辅助放疗组)。无放疗组和辅助放疗组中位年龄分别为59岁和56岁,> 40~60岁年龄段的卵巢癌患者行辅助放疗的比例较高(表 1)。辅助放疗组中,病理类型为非上皮性肿瘤、肿瘤分化程度为G1/2、淋巴结阳性和存在远处转移的患者比例更高,且多数接受化疗(均P < 0.01,表 1)。
| 临床特征 | 总体(n=18 529) | 无放疗组(n=18 362) | 辅助放疗组(n=167) | χ2/Z值 | P值 |
| 年龄[M(Q1~Q3),岁] | 59(49~68) | 59(49~68) | 56(48~65) | -2.101 | 0.036 |
| 年龄 | 7.393 | 0.024 | |||
| ≤40岁 | 1 941(10.5) | 1 924(10.5) | 17(10.2) | ||
| > 40~60岁 | 8 346(45.0) | 8 254(45.0) | 92(55.1) | ||
| > 60岁 | 8 242(44.5) | 8 184(44.6) | 58(34.7) | ||
| 种族 | 4.371 | 0.107 | |||
| 白种人 | 5 328(28.8) | 5 288(28.8) | 40(24.0) | ||
| 黑种人 | 413(2.2) | 412(2.2) | 1(0.6) | ||
| 其他 | 12 788(69.0) | 12 662(69.0) | 126(75.4) | ||
| 保险 | 2.331 | 0.295 | |||
| 无 | 686(3.7) | 681(3.7) | 5(3.0) | ||
| 有 | 17 619(95.1) | 17 457(95.1) | 162(97.0) | ||
| 不详 | 224(1.2) | 224(1.2) | 0(0.0) | ||
| 婚姻状况 | 4.791 | 0.091 | |||
| 已婚 | 9 801(52.9) | 9 704(52.8) | 97(58.1) | ||
| 未婚 | 3 919(21.2) | 3 880(21.1) | 39(23.4) | ||
| 其他 | 4 809(26.0) | 4 778(26.0) | 31(18.6) | ||
| 病理类型 | 35.908 | < 0.01 | |||
| 上皮性 | 14 425(77.9) | 14 327(78.0) | 98(58.7) | ||
| 非上皮性 | 4 104(22.1) | 4 035(22.0) | 69(41.3) | ||
| 分化程度 | 14.198 | 0.001 | |||
| G1/2 | 3 956(21.4) | 3 936(21.4) | 20(12.0) | ||
| G3/4 | 10 632(57.4) | 10 513(57.3) | 119(71.3) | ||
| 不详 | 3 941(21.3) | 3 913(21.3) | 28(16.8) | ||
| 肿瘤部位 | 2.587 | 0.274 | |||
| 单侧 | 11 038(59.6) | 10 929(59.5) | 109(65.3) | ||
| 双侧 | 6 950(37.5) | 6 895(37.6) | 55(32.9) | ||
| 不详 | 541(2.9) | 538(2.9) | 3(1.8) | ||
| AJCC分期 | 2.470 | 0.134 | |||
| Ⅰ~Ⅱ期 | 7 764(41.9) | 7 704(42.0) | 60(35.9) | ||
| Ⅲ~Ⅳ期 | 10 765(58.1) | 10 658(58.0) | 107(64.1) | ||
| T分期 | 73.946 | < 0.01 | |||
| T1 | 6 189(33.4) | 6 160(33.5) | 29(17.4) | ||
| T2 | 2 621(14.1) | 2 560(13.9) | 61(36.5) | ||
| T3 | 9 719(52.5) | 9 642(52.5) | 77(46.1) | ||
| N分期:N1 | 4 145(22.4) | 4 088(22.3) | 57(34.1) | 13.424 | < 0.01 |
| M分期:M1 | 3 234(17.5) | 3 179(17.3) | 55(32.9) | 28.030 | < 0.01 |
| 化疗 | 13 886(74.9) | 13 735(74.8) | 151(90.4) | 21.496 | < 0.01 |
| 肿瘤大小 | 5.149 | 0.272 | |||
| ≤50 mm | 3 632(19.6) | 3 604(19.6) | 28(16.8) | ||
| > 50~100 mm | 4 548(24.5) | 4 500(24.5) | 48(28.7) | ||
| > 100~200 mm | 5 612(30.3) | 5 555(30.3) | 57(34.1) | ||
| > 200 mm | 1 216(6.6) | 1 205(6.6) | 11(6.6) | ||
| 不详 | 3 521(19.0) | 3 498(19.1) | 23(13.8) | ||
| CA125 | 2.215 | 0.483 | |||
| 正常 | 2 053(11.1) | 2 030(11.1) | 23(13.8) | ||
| 升高 | 12 509(67.5) | 12 404(67.6) | 105(62.9) | ||
| 临界值 | 28(0.2) | 28(0.2) | 0(0.0) | ||
| 不详 | 3 939(21.3) | 3 900(21.2) | 39(23.4) | ||
| 肿瘤残留情况 | 3.552 | 0.173 | |||
| R0 | 8 436(45.5) | 8 370(45.6) | 66(39.5) | ||
| 非R0 | 3 620(19.5) | 3 579(19.5) | 41(24.6) | ||
| 不详 | 6 473(34.9) | 6 413(34.9) | 60(35.9) | ||
| 注 CA125:糖类抗原125(carbohydrate antigen 125) | |||||
无放疗组中位OS(median OS,mOS)为82个月,1、3和5年OS率分别为90.8%、71.5%和58.0%,中位CSS(median CSS,mCSS)未达到(unreached,UR),1、3和5年CSS率分别为91.6%、73.1%和60.3%;辅助放疗组mOS为38个月,1、3和5年OS率分别为77.8%、52.3%和31.9%,mCSS为40个月,1、3和5年CSS率分别为77.8%、54.9%和34.1%(图 1)。未行放疗的患者具有更长的生存期,两组OS和CSS生存曲线比较,差异均具有统计学意义(χ2=52.84,P < 0.01;χ2=51.16,P < 0.01)。
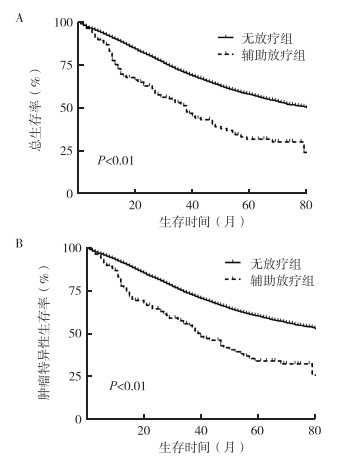
|
| 注 A:无放疗组与辅助放疗组总生存曲线;B:无放疗组与辅助放疗组肿瘤特异性生存曲线 图 1 无放疗组与辅助放疗组卵巢癌患者总生存曲线和肿瘤特异性生存曲线 Fig.1 Overall survival and cancer special survival curves of ovarian cancer patients in the non-radiotherapy and adjuvant radiotherapy groups |
分期亚组分析发现,Ⅰ~Ⅱ期无放疗组、Ⅰ~Ⅱ期辅助放疗组、Ⅲ~Ⅳ期无放疗组和Ⅲ~Ⅳ期辅助放疗组的mOS分别为UR、57个月、82个月和29个月,辅助放疗使Ⅰ~Ⅱ期(χ2=57.03,P < 0.01)和Ⅲ~Ⅳ期(χ2=71.37,P < 0.01)亚组的mOS均缩短(图 2A)。病理类型亚组分析发现,辅助放疗组较无放疗组同时缩短上皮性卵巢癌(41个月 vs 76个月,χ2=19.51,P < 0.01)与非上皮性卵巢癌患者(26个月 vs UR,χ2=36.42,P < 0.01)的mOS,特别是在非上皮性卵巢癌患者中(图 2B)。肿瘤分化程度亚组分析显示,G1/2无放疗组、G1/2辅助放疗组、G3/4无放疗组和G3/4辅助放疗组mOS分别为UR、57个月、58个月和34个月,辅助放疗缩短中高分化(G1/2)(χ2=15.74,P < 0.01)和低分化/未分化(G3/4)(χ2=34.36,P < 0.01)亚组的mOS(图 2C)。根据术后残留病灶情况进行亚组分析显示,R0切除无放疗组、R0切除辅助放疗组、非R0切除无放疗组和非R0切除辅助放疗组的mOS分别为UR、47个月、38个月和26个月。整体上,R0切除较非R0切除患者具有更长的mOS(UR vs 38个月,χ2=1514,P < 0.01),但无论是否为R0切除,辅助放疗均缩短患者mOS(R0:χ2=27.38,P < 0.01,非R0:χ2=5.378,P=0.02,图 2D)。对CSS进行亚组生存分析同样提示辅助放疗缩短各亚组卵巢癌患者的CSS(均P < 0.05,图 3)。
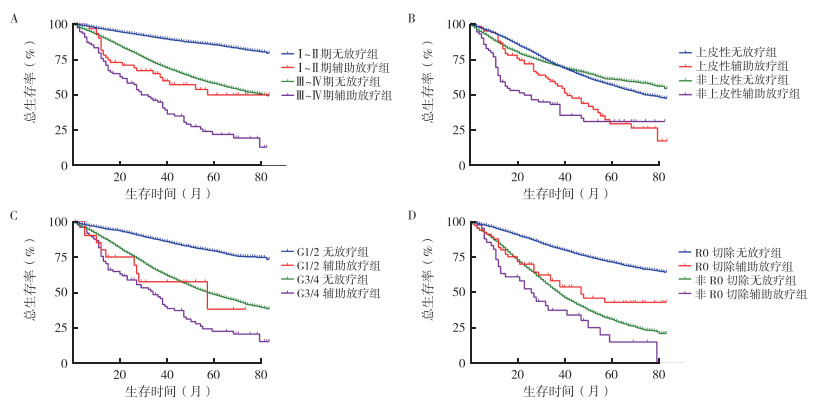
|
| 注 A:分期亚组患者生存曲线;B:病理类型亚组患者生存曲线;C:分化程度亚组患者生存曲线;D:手术残留病灶亚组患者生存曲线 图 2 亚组分析中无放疗组与辅助放疗卵巢癌患者生存曲线 Fig.2 Subgroup survival analyses on overall survival of ovarian cancer patients in the non-radiotherapy and adjuvant radiotherapy groups |
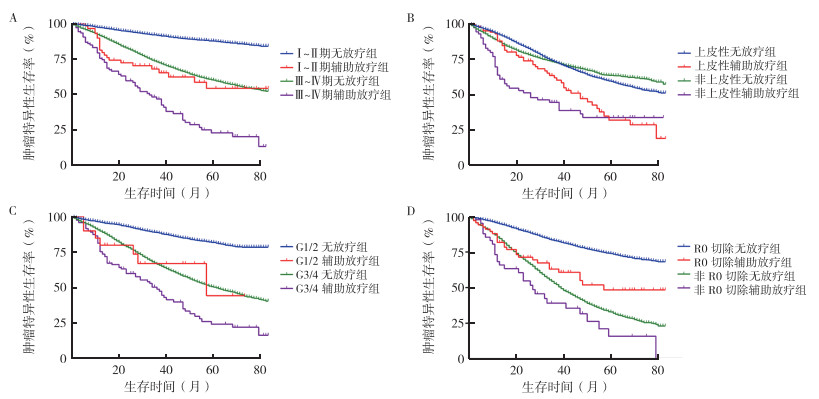
|
| 注 A:分期亚组患者肿瘤特异性生存曲线;B:病理类型亚组患者肿瘤特异性生存曲线;C:分化程度亚组患者肿瘤特异性生存曲线;D:手术残留病灶亚组患者肿瘤特异性生存曲线 图 3 亚组分析中无放疗组与辅助放疗卵巢癌患者肿瘤特异性生存曲线 Fig.3 Subgroup survival analyses of cancer special survival of ovarian cancer patients in the non-radiotherapy and adjuvant radiotherapy groups |
单因素和多因素Cox回归分析均显示年龄、种族、肿瘤分化程度、肿瘤部位、分期、辅助放疗、化疗、肿瘤大小、CA125水平以及术后残留病灶情况均是卵巢癌患者OS和CSS的影响因素(均P < 0.05,表 2~3)。在总生存的多因素分析中,年龄 > 60岁、黑种人、非上皮性卵巢癌、分化差、双侧肿瘤、Ⅲ~Ⅳ期、辅助放疗、肿瘤≤50 mm、CA125升高以及非R0切除为预后的危险因素(均P < 0.05),其中辅助放疗患者总的死亡风险是未行放疗患者的1.94倍(HR=1.94,95%CI:1.59~2.38,P < 0.01)。
| 变量 | 总生存 | 肿瘤特异性生存 | |||||
| HR(95%CI) | Wald值 | P值 | HR(95%CI) | Wald值 | P值 | ||
| 年龄 | |||||||
| > 40~60岁 | 参考 | ||||||
| ≤40岁 | 0.45(0.39~0.51) | 146.053 | < 0.01 | 0.44(0.38~0.50) | 144.059 | < 0.01 | |
| > 60岁 | 1.76(1.67~1.85) | 438.819 | < 0.01 | 1.68(1.59~1.77) | 345.006 | < 0.01 | |
| 种族 | |||||||
| 白种人 | 参考 | ||||||
| 黑种人 | 1.31(1.14~1.51) | 14.120 | < 0.01 | 1.34(1.15~1.55) | 14.981 | < 0.01 | |
| 其他 | 0.52(0.49~0.55) | 602.513 | < 0.01 | 0.55(0.52~0.58) | 463.673 | < 0.01 | |
| 保险 | |||||||
| 无 | 参考 | ||||||
| 有 | 1.09(0.95~1.25) | 1.532 | 0.216 | 1.09(0.94~1.25) | 1.300 | 0.254 | |
| 不详 | 0.95(0.71~1.27) | 0.120 | 0.729 | 0.89(0.65~1.20) | 0.587 | 0.444 | |
| 婚姻状况 | |||||||
| 已婚 | 参考 | ||||||
| 未婚 | 0.95(0.89~1.02) | 2.069 | 0.150 | 0.93(0.87~1.00) | 3.876 | 0.049 | |
| 其他 | 1.40(1.32~1.48) | 132.812 | < 0.01 | 1.35(1.27~1.43) | 96.018 | < 0.01 | |
| 病理类型 | |||||||
| 上皮性 | 参考 | ||||||
| 非上皮性 | 1.02(0.96~1.08) | 0.304 | 0.582 | 1.02(0.95~1.08) | 0.247 | 0.619 | |
| 分化程度 | |||||||
| G1/2 | 参考 | ||||||
| G3/4 | 2.95(2.71~3.20) | 645.036 | < 0.01 | 3.27(2.99~3.58) | 663.331 | < 0.01 | |
| 不详 | 2.06(1.87~2.27) | 213.426 | < 0.01 | 2.24(2.02~2.48) | 231.896 | < 0.01 | |
| 肿瘤部位 | |||||||
| 单侧 | 参考 | ||||||
| 双侧 | 1.98(1.88~2.09) | 671.623 | < 0.01 | 2.10(1.99~2.21) | 720.044 | < 0.01 | |
| 不详 | 2.52(2.22~2.86) | 207.061 | < 0.01 | 2.65(2.33~3.02) | 216.261 | < 0.01 | |
| AJCC分期 | |||||||
| Ⅰ~Ⅱ期 | 参考 | ||||||
| Ⅲ~Ⅳ期 | 5.19(4.84~5.57) | 2 094.864 | < 0.01 | 6.09(5.64~6.59) | 2081.951 | < 0.01 | |
| 辅助放疗 | |||||||
| 无 | 参考 | ||||||
| 有 | 2.01(1.64~2.45) | 45.798 | < 0.01 | 2.04(1.65~2.51) | 44.856 | < 0.01 | |
| 化疗 | |||||||
| 无/不详 | 参考 | ||||||
| 有 | 1.43(1.34~1.52) | 117.400 | < 0.01 | 1.58(1.48~1.70) | 169.392 | < 0.01 | |
| 肿瘤大小 | |||||||
| ≤50 mm | 参考 | ||||||
| > 50~100 mm | 0.94(0.87~1.01) | 2.679 | 0.102 | 0.93(0.86~1.00) | 3.457 | 0.063 | |
| > 100~200 mm | 0.74(0.69~0.80) | 62.126 | < 0.01 | 0.74(0.68~0.79) | 59.820 | < 0.01 | |
| > 200 mm | 0.71(0.62~0.80) | 29.450 | < 0.01 | 0.66(0.58~0.76) | 36.903 | < 0.01 | |
| 不详 | 1.24(1.15~1.33) | 30.281 | < 0.01 | 1.23(1.14~1.33) | 27.397 | < 0.01 | |
| CA125 | |||||||
| 正常 | 参考 | ||||||
| 升高 | 3.21(2.85~3.62) | 364.123 | < 0.01 | 3.45(3.03~3.92) | 357.563 | < 0.01 | |
| 临界值 | 1.75(0.83~3.70) | 2.124 | 0.145 | 2.00(0.94~4.24) | 3.283 | 0.070 | |
| 不详 | 2.08(1.82~2.37) | 119.837 | < 0.01 | 2.15(1.87~2.47) | 114.746 | < 0.01 | |
| 肿瘤残留情况 | |||||||
| R0 | 参考 | ||||||
| 非R0 | 3.29(3.09~3.51) | 1 361.503 | < 0.01 | 3.49(3.26~3.72) | 1 381.073 | < 0.01 | |
| 不详 | 1.77(1.67~1.89) | 326.672 | < 0.01 | 1.82(1.71~1.95) | 326.628 | < 0.01 | |
| 注 CA125:糖类抗原125(carbohydrate antigen 125) | |||||||
| 变量 | 总生存 | 肿瘤特异性生存 | |||||
| HR(95%CI) | Wald值 | P值 | HR(95%CI) | Wald值 | P值 | ||
| 年龄 | |||||||
| > 40~60岁 | 参考 | ||||||
| ≤40岁 | 0.62(0.54~0.71) | 47.465 | < 0.01 | 0.64(0.56~0.74) | 39.191 | < 0.01 | |
| > 60岁 | 1.22(1.13~1.32) | 24.340 | < 0.01 | 1.19(1.10~1.29) | 17.603 | < 0.01 | |
| 种族 | |||||||
| 白种人 | 参考 | ||||||
| 黑种人 | 1.22(1.06~1.41) | 7.758 | 0.005 | 1.25(1.08~1.45) | 8.664 | 0.003 | |
| 其他 | 0.79(0.73~0.85) | 37.350 | < 0.01 | 0.82(0.76~0.89) | 22.664 | < 0.01 | |
| 病理类型 | |||||||
| 上皮性 | 参考 | ||||||
| 非上皮性 | 1.40(1.31~1.49) | 106.716 | < 0.01 | 1.42(1.33~1.52) | 109.336 | < 0.01 | |
| 分化程度 | |||||||
| G1/2 | 参考 | ||||||
| G3/4 | 1.49(1.36~1.63) | 78.016 | < 0.01 | 1.57(1.42~1.72) | 85.758 | < 0.01 | |
| 不详 | 1.28(1.16~1.42) | 23.468 | < 0.01 | 1.35(1.21~1.50) | 29.528 | < 0.01 | |
| 肿瘤部位 | |||||||
| 单侧 | 参考 | ||||||
| 双侧 | 1.07(1.01~1.13) | 5.327 | 0.021 | 1.08(1.02~1.15) | 7.017 | 0.008 | |
| 不详 | 1.11(0.97~1.26) | 2.228 | 0.136 | 1.12(0.98~1.29) | 2.658 | 0.103 | |
| AJCC分期 | |||||||
| Ⅰ~Ⅱ期 | 参考 | ||||||
| Ⅲ~Ⅳ期 | 3.85(3.54~4.19) | 961.271 | < 0.01 | 4.40(4.01~4.82) | 987.292 | < 0.01 | |
| 辅助放疗 | |||||||
| 无 | 参考 | ||||||
| 有 | 1.94(1.59~2.38) | 41.267 | < 0.01 | 1.93(1.56~2.38) | 37.762 | < 0.01 | |
| 化疗 | |||||||
| 无/不详 | 参考 | ||||||
| 有 | 0.60(0.56~0.65) | 198.003 | < 0.01 | 0.63(0.59~0.68) | 140.333 | < 0.01 | |
| 肿瘤大小 | |||||||
| ≤50 mm | 参考 | ||||||
| 50~100 mm | 0.90(0.83~0.97) | 8.237 | 0.004 | 0.88(0.82~0.95) | 9.903 | 0.002 | |
| 100~200 mm | 0.89(0.83~0.96) | 8.567 | 0.003 | 0.89(0.83~0.97) | 7.645 | 0.006 | |
| > 200 mm | 1.13(0.99~1.28) | 3.399 | 0.065 | 1.09(0.95~1.25) | 1.537 | 0.215 | |
| 不详 | 1.08(1.00~1.17) | 3.883 | 0.049 | 1.07(0.99~1.16) | 2.647 | 0.104 | |
| CA125 | |||||||
| 正常 | 参考 | ||||||
| 升高 | 1.57(1.39~1.78) | 50.686 | < 0.01 | 1.57(1.38~1.80) | 44.582 | < 0.01 | |
| 临界值 | 1.50(0.71~3.17) | 1.113 | 0.291 | 1.72(0.81~3.64) | 1.978 | 0.160 | |
| 不详 | 1.31(1.15~1.50) | 15.974 | < 0.01 | 1.30(1.13~1.50) | 13.084 | < 0.01 | |
| 肿瘤残留情况 | |||||||
| R0 | 参考 | ||||||
| 非R0 | 1.76(1.64~1.88) | 273.555 | < 0.01 | 1.79(1.67~1.92) | 271.103 | < 0.01 | |
| 不详 | 1.45(1.36~1.54) | 132.656 | < 0.01 | 1.47(1.38~1.57) | 131.497 | < 0.01 | |
| 注 CA125:糖类抗原125(carbohydrate antigen 125) | |||||||
放疗一直是多种实体瘤的局部控制及治疗手段,其在盆腔恶性肿瘤包括直肠癌和子宫颈癌等的治疗中也都有着广泛的适应证[11-12]。早期研究认为,全腹盆腔放疗对推迟卵巢癌复发有着重要作用,但临床上长期应用后发现,全腹放疗会引起严重的骨髓抑制、急性消化道反应和肠梗阻等不良反应[13-14],因此其应用受到限制。而随着现代放疗技术的进步与发展,精准放疗和保护危及器官的水平已经较数十年前获得极大进步。因此,OVAR-IMRT-02Ⅱ期临床试验纳入2010年至2015年间20例减瘤术后行化疗到完全缓解的局部晚期卵巢癌患者行辅助调强全腹放疗,总剂量为30 Gy,分20次给予。放疗期间有1例患者(5.6%)出现Ⅲ级下肢水肿,无Ⅲ~Ⅵ级的肝肾损伤和消化道毒性。尽管在放疗期间患者体能状态有所下降(全球健康状态评分平均下降18.1分),但所有患者均在6个月内完全恢复。该研究的次要研究终点1、2和3年OS分别为89%、83%和83%。由此可见,调强全腹放疗在卵巢癌患者中是可以耐受的,不会引起严重的急性和迟发性放射毒性[15-16]。有学者认为辅助放疗可以使化疗不敏感的卵巢透明细胞癌患者获益[17],该研究中辅助放疗组5年OS率为81.8%,高于未放疗组的33.3%。但该研究纳入的是1994年至2014年的卵巢癌患者,年限跨度大,放疗技术存在差异;且研究样本量较小,辅助放疗组16例,对照组12例。在一项评估163例Ⅰ~Ⅱ期卵巢透明细胞癌患者辅助放疗生存影响的研究中(辅助放疗组44例,未放疗组119例),尽管辅助放疗组的10年无进展生存期(progression free survival,PFS)高于未放疗组(65% vs 59%),但多因素分析提示,辅助放疗并不能提高Ⅰ~Ⅱ期卵巢透明细胞癌的PFS和OS[18]。另有回顾性研究分析认为,辅助放疗能降低Ⅰ~Ⅱ期的卵巢透明细胞癌、子宫内膜样癌和黏液性癌的死亡风险,而对Ⅲ期卵巢癌及浆液性卵巢癌无生存获益[19]。总的来说,辅助放疗在卵巢癌中的作用目前在临床上尚未明确。既往的研究大多样本量较少,或并非接受同一时期的放疗技术和方案,因此对于结果的解读和应用仍需谨慎。
本研究对SEER数据库中2011年至2015年间手术切除后行辅助放疗或未行辅助放疗的卵巢癌患者进行分析。在纳入的18 529例患者中,仅0.9%(167/18 529)行辅助放疗,可见辅助放疗在卵巢癌中的应用尚未获得更多临床医师的认可。比较辅助放疗组和未放疗组发现,辅助放疗缩短卵巢癌患者的mOS(38个月 vs 82个月)和mCSS(40个月 vs UR)。这与Patel等[20]分析SEER数据库2004年至2011年间卵巢癌患者发现辅助放疗未能使总体纳入人群获益的结果是一致的。但本研究的OS与CSS低于Patel等[20]的研究,这是因为Patel等[20]的研究仅纳入Ⅰ~Ⅲ期透明细胞、黏液性细胞和子宫内膜样细胞3种病理的卵巢癌,而本研究包含Ⅳ期以及其他病理类型卵巢癌。本研究还对分期(Ⅰ~Ⅲ期和Ⅲ~Ⅳ期)、病理类型(上皮性肿瘤和非上皮性肿瘤)、分化程度(G1/2和G3/4)以及手术残留情况(R0切除和非R0切除)进行亚组分析,结果显示辅助放疗在各亚组中均缩短生存。虽然Patel等[20]的研究认为辅助放疗对Ⅲ期卵巢癌以及Ⅲ期黏液性卵巢癌患者有效,但该研究仅纳入前述3种病理类型的卵巢癌患者,且Ⅲ期黏液性卵巢癌患者仅有18例,因此该结果的意义仍需更大样本的研究验证。
由于本研究为基于SEER数据库的回顾性分析,因此存在一定的局限性:(1)作为回顾性分析,本研究排除了部分随访信息等不完全的患者,存在选择偏倚;(2)囿于样本量的限制,本研究未行更细致的亚组分析;(3)SEER数据库缺乏并发症、放疗部位/技术/剂量、化疗时间/方案、治疗相关不良反应和PFS等信息,这些都可能是影响预后的因素。此外,SEER数据库统计的是美国肿瘤患者的信息,分析所得结果是否适应于我国人群仍需进一步研究验证。
综上所述,辅助放疗不能改善卵巢癌患者的生存,是卵巢癌患者预后的危险因素。本研究作为近年来样本量最大的真实世界研究,其结论能为今后的研究及临床工作提供一定的证据支持。同样,期待大样本的前瞻性临床研究以提供高质量的证据支持。
| [1] |
Cabasag CJ, Arnold M. The influence of birth cohort and calendar period on global trends in ovarian cancer incidence[J]. Int J Cancer, 2020, 146(3): 749-758. DOI:10.1002/ijc.32322 |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. DOI:10.3760/cma.j.issn.0253-3766.2019.01.005 |
| [4] |
Torre LA, Trabert B, DeSantis CE. Ovarian cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(4): 284-296. DOI:10.3322/caac.21456 |
| [5] |
Zang RY, Harter P, Chi DS, et al. Predictors of survival in patients with recurrent ovarian cancer undergoing secondary cytoreductive surgery based on the pooled analysis of an international collaborative cohort[J]. Br J Cancer, 2011, 105(7): 890-896. DOI:10.1038/bjc.2011.328 |
| [6] |
Gockley A, Melamed A, Cronin A, et al. Outcomes of secondary cytoreductive surgery for patients with platinum-sensitive recurrent ovarian cancer[J]. Am J Obstet Gynecol, 2019, 221(6): 625.e1-625.e14. DOI:10.1016/j.ajog.2019.06.009 |
| [7] |
NCCN. NCCN guidelines: Ovarian cancer including fallopian tube cancer and primary peritoneal cancer (2021. V3)[EB/OL]. (2021-09-09)[2021-09-27]. https://www.nccn.org/professionals/physician_gls/pdf/ovarian.pdf.
|
| [8] |
Fields EC, McGuire WP, Lin L, et al. Radiation treatment in women with ovarian cancer: Past, present, and future[J]. Front Oncol, 2017, 7: 177. DOI:10.3389/fonc.2017.00177 |
| [9] |
程晓龙, 吕晓娟, 刘吉平, 等. 子宫颈癌保留双侧卵巢功能的放疗方法研究[J]. 实用肿瘤杂志, 2019, 34(6): 540-549. |
| [10] |
Fritz A, Percy C, Jack A, et al. International classification of diseases for oncology[M]. 3rd edition, Geneva: World Health Organization, 2000: 184.
|
| [11] |
Dekker E, Tanis PJ, Vleugels JLA, et al. Colorectal cancer[J]. Lancet, 2019, 394(10207): 1467-1480. DOI:10.1016/S0140-6736(19)32319-0 |
| [12] |
Small W, Bacon MA, Bajaj A, et al. Cervical cancer: A global health crisis[J]. Cancer, 2017, 123(13): 2404-2412. DOI:10.1002/cncr.30667 |
| [13] |
Engelen MJA, Snel BJ, Schaapueld M, et al. Long-term morbidity of adjuvant whole abdominal radiotherapy (wart) or chemotherapy for early stage ovarian cancer[J]. Eur J Cancer, 2009, 45(7): 1193-1200. DOI:10.1016/j.ejca.2009.01.006 |
| [14] |
Hepp R, Baeza MR, Olfos P, et al. Adjuvant whole abdominal radiotherapy in epithelial cancer of the ovary[J]. Int J Radiat Oncol Biol Phys, 2002, 53(2): 360-365. DOI:10.1016/S0360-3016(02)02728-1 |
| [15] |
Arians N, Kieser M, Benner L, et al. Adjuvant intensity modulated whole-abdominal radiation therapy for highrisk patients with ovarian cancer (International Federation of Gynecology and Obstetrics stage Ⅲ): First results of a prospective phase 2 study[J]. Int J Radiat Oncol Biol Phys, 2017, 99(4): 912-920. DOI:10.1016/j.ijrobp.2017.06.2465 |
| [16] |
Arians N, Kieser M, Benner L, et al. Adjuvant intensity modulated whole-abdominal radiation therapy for highrisk patients with ovarian cancer figo stage Ⅲ: Final results of a prospective phase 2 study[J]. Radiat Oncol, 2019, 14(1): 179. DOI:10.1186/s13014-019-1381-2 |
| [17] |
Nagai Y, Inamine M, Hirakawa M, et al. Postoperative whole abdominal radiotherapy in clear cell adenocarcinoma of the ovary[J]. Gynecol Oncol, 2007, 107(3): 469-473. DOI:10.1016/j.ygyno.2007.07.079 |
| [18] |
Hogen L, Thomas G, Bernardini M, et al. The effect of adjuvant radiation on survival in early stage clear cell ovarian carcinoma[J]. Gynecol Oncol, 2016, 143(2): 258-263. DOI:10.1016/j.ygyno.2016.09.006 |
| [19] |
Swenerton KD, Santos JL, Gilks CB, et al. Histotype predicts the curative potential of radiotherapy: The example of ovarian cancers[J]. Ann Oncol, 2011, 22(2): 341-347. DOI:10.1093/annonc/mdq383 |
| [20] |
Patel SC, Frandsen J. Impact on survival with adjuvant radiotherapy for clear cell, mucinous, and endometriod ovarian cancer: The SEER experience from 2004 to 2011[J]. J Gynecol Oncol, 2016, 27(5): e45. DOI:10.3802/jgo.2016.27.e45 |
 2021, Vol. 36
2021, Vol. 36


