文章信息
- 李珍, 董杏, 宿晓晓, 杜艳敏, 张欢欢, 曾宪旭
- Li Zhen, Dong Xing, Su Xiaoxiao, Du Yanmin, Zhang Huanhuan, Zeng Xianxu
- ING4、p53和p21在子宫内膜样癌中的表达及意义
- Expression and signifi cance of ING4, p53 and p21 in endometrioid carcinoma
- 实用肿瘤杂志, 2021, 36(3): 252-258
- Journal of Practical Oncology, 2021, 36(3): 252-258
基金项目
- 河南省医学科技攻关计划联合共建项目(LHGJ20190333,LHGJ20190332)
-
通信作者
- 曾宪旭, E-mail: xianxu77@163.com
-
文章历史
- 收稿日期:2020-07-05
子宫内膜样癌是一种原发于子宫内膜的上皮性恶性肿瘤,是女性生殖系统最常见的恶性肿瘤之一[1]。近年来子宫内膜样癌的发病率呈现年轻化趋势,加上疾病发生率及病死率逐年升高,已成为威胁女性身心健康及生活质量的主要疾病[2]。已有研究发现, 许多原癌基因和抑癌基因的表达在子宫内膜样癌的发生和发展过程中发生变化[3-4],但是目前子宫内膜样癌发生和发展的分子机制尚不清楚。因此有必要对与子宫内膜样癌发病相关的基因进行研究。
生长抑制因子蛋白家族成员4(inhibitor of growth family member 4,ING4)是一种肿瘤抑制因子,最初是由Shiseki等[5]在2003年发现并从人脑垂体中分离出来,2004年Nature杂志上正式确认[6]。ING4基因编码的蛋白主要定位于细胞核内,C端有1个植物同源结构域,能够调节细胞的生长及增殖;N端有1个核定位信号域,此结构在ING4蛋白与p53蛋白在细胞核内的复合定位中起着重要的作用[7-8]。ING4和p53蛋白结合形成转录复合物,从而抑制肿瘤血管的生成,细胞的生长和修复、对缺氧状态的适应和接触抑制的丢失等影响肿瘤的发生及发展。p21作为p53重要的下游因子,参与调解细胞周期[9-10]。ING4在人结直肠癌[11]、肺癌[12-13]、肝癌[14]、乳腺癌[15-16]和黑素色瘤[17]中的研究均显示,其具有抑制肿瘤细胞生长和促进细胞凋亡等特点。本研究通过检测ING4、p53和p21在不同子宫内膜组织中的表达情况及其与子宫内膜样癌临床病理分期等的相关性,探讨ING4-p53-p21信号通路在子宫内膜样癌发生和发展中的作用。为子宫内膜样癌的临床诊断提供新的标志物,也为指导子宫内膜癌临床诊断、疗效及预后评估等方面提供理论依据。
1 资料与方法 1.1 一般资料收集2016年12月至2019年9月郑州大学第三附属医院病理科存档的60例因子宫内膜癌行手术治疗的子宫内膜样癌标本(子宫内膜样癌组)。标本的收集得到郑州大学第三附属医院伦理委员会的批准。纳入标准: (1)经病理检查证实;(2)临床资料完整;(3)术前未接受性激素的治疗,术前肝肾功能指标均在正常范围内;(4)术前未接受放化疗。患者年龄41~68岁,平均年龄为45.5岁。所有病理切片均由2名副主任/主任医师复评确定,病理分级高分化28例,中分化17例,低分化15例;根据2009年国际妇产科联盟(Intemational Federation of Gynecology and Obstetrics,FIGO)病理分期,子宫内膜样癌Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期20例;无子宫肌层浸润7例,子宫肌层浸润深度 < 1/2的28例,子宫肌层浸润深度≥1/2或浆膜浸润的25例;有淋巴结转移8例,无淋巴结转移12例, 淋巴结转移情况不详40例。随机选择同期于本院门诊或住院部行诊刮术获得的不典型增生子宫内膜标本30例(不典型增生子宫内膜组)及正常子宫内膜标本20例(正常子宫内膜组)作为对照组。不典型增生子宫内膜组年龄39~60岁,平均年龄43.5岁。正常子宫内膜组年龄37~56岁,平均年龄41岁。制作组织芯片进行免疫组织化学分析。同时取-80℃冻存的同期20例子宫内膜样癌组织及对应癌旁正常组织进行Western blot检测,患者年龄43~68岁,平均年龄为45.5岁。
1.2 主要试剂ING4抗体购自武汉三鹰公司,p53(DO-7)抗体购自美国罗氏诊断产品(上海)有限公司,p21(EPR362)抗体购自艾博抗(上海)贸易有限公司,β-actin抗体购自美国CST公司,辣根过氧化物酶(horseradish peroxidase,HRP)羊抗兔IgG和HRP羊抗鼠IgG等二抗购自美国Thermo公司,DAB显色试剂盒购自上海生工生物工程公司,二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自美国Thermo Fisher Scientific,细胞裂解液、ECL化学发光试剂及其他试剂和耗材购自北京索莱宝科技有限公司。
1.3 试验方法 1.3.1 组织芯片的制备首先在HE切片上选定最具代表性的位点,对照石蜡标本进行标记,精确穿刺位点,用1.0 mm孔径的穿刺针将采集到的组织注入到蜡块阵列中,并对每个位点进行编号。按照6×9的序列,点间距离0.8~1.0 mm,将其整齐的排列在蜡块上。然后使用Leica2245切片机(徕卡显微系统上海有限公司)以4 μm厚度进行连续切片,以备后续实验。
1.3.2 免疫组织化学染色方法组织芯片蜡块取4 μm切片在75℃恒温烤箱中烘烤30 min后,将石蜡切片放在二甲苯中脱蜡;再进行梯度乙醇脱水,自来水冲洗;然后将切片放入乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)修复液中煮沸和修复;冷却至室温后把切片放入湿盒中用3%过氧化氢封闭;磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次后,滴加按比例稀释的一抗,包括ING4(1∶600)、p53(即用型)、p21(1∶200),37℃孵育1 h;PBS冲洗3次后,室温下加用相应二抗30 min;DAB显色和对比染色后用中性树胶封固,在光学显微镜下观察。
1.3.3 Western blot法将-80℃冻存的子宫内膜组织分类并提取总蛋白,BCA试剂盒测定蛋白浓度,计算出蛋白量,上样时加入不同体积的蛋白样品,再加入相应量的缓冲液使得各孔体积相同,以均衡电源。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(dodecyl sulfate, sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE)(选取12%的分离胶,5%浓缩胶制胶),采用湿转法将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂牛奶封闭1 h,Tris-HCl Tween(TBST)缓冲液洗膜3次,加入一抗(ING4为1∶1 000,p53为1∶1 000,p21为1∶1 000),4 ℃孵育过夜,TBST液洗膜3次,加入相应荧光二抗(1∶1 500)于37℃孵育60 min,TBST液再次洗膜3次,在凝胶成像系统检测分析蛋白条带,蛋白表达定量分析用Image J图像分析软件对条带进行分析,内参采用β-actin。
1.4 阳性结果判定评价三组中ING4、p53和p21的阳性表达情况:ING4主要表达于细胞核, 在胞质及间质中同样有少许表达,阳性表达以细胞核和(或)细胞质内出现棕黄色颗粒为准;p53和p21以细胞核内有棕黄色颗粒分布为阳性表达。计数5个高倍视野或500个细胞。按染色强度计分:0分为无色;1分为淡黄色;2分为棕黄色;3分为棕褐色。按阳性细胞所占百分比计分:0分为阴性;1分为阳性细胞数≤10%;2分为阳性细胞数11%~50%;3分为阳性细胞数51%~75%;4分为阳性胞数 > 75%。以上述二者之和的总得分判定结果:≤2分为阴性;> 2分为阳性[18]。
1.5 统计学分析采用SPSS 24.0统计学软件对数据进行分析。计数资料以频数(百分比)表示,组间比较采用χ2检验。正态分布计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验。ING4、p53和p21蛋白在子宫内膜样癌中表达的相关性采用Spearman相关分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 组织芯片质量经过常规切片和免疫组织化学染色,除了少许组织芯片在免疫组织化学染色中有部分脱落,其余芯片组织排列整齐,点结构保存完整,形态良好,免疫组织化学染色效果良好,具有代表性(图 1)。
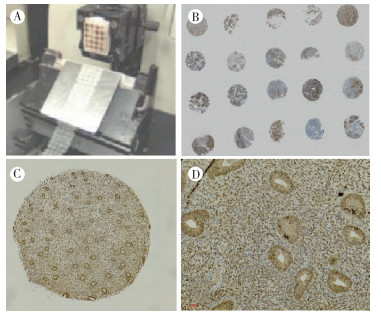
|
| 注 A: 组织芯片切片过程;B:部分组织芯片免疫组织化学染色(SP×10);C: 低倍镜下组织芯片染色效果(SP×20);D:高倍镜下组织芯片染色效果(SP×400) 图 1 组织芯片制作及不同放大倍数下免疫组织化学染色效果图 Fig.1 Tissue chip production and immunohistochemical staining effect under different magnifications |
ING4的阳性表达主要定位于腺上皮细胞核, 在细胞质及间质中同样有少许表达。ING4在正常子宫内膜组、不典型增生子宫内膜组及子宫内膜样癌组中的阳性表达率分别为95.0%(19/20)、53.3%(16/30)和23.3%(14/60),差异具有统计学意义(χ2=32.477,P < 0.05)。各组两两比较,正常子宫内膜组阳性表达率高于不典型增生子宫内膜组(χ2=9.921,P < 0.05),不典型增生子宫内膜组高于子宫内膜样癌组(χ2=8.100,P < 0.05),正常子宫内膜组高于子宫内膜样癌组(χ2=31.790,P < 0.05)。ING4的阳性表达率和子宫内膜病变的严重程度呈负相关关系(r=-0.486,P < 0.05;图 2)。
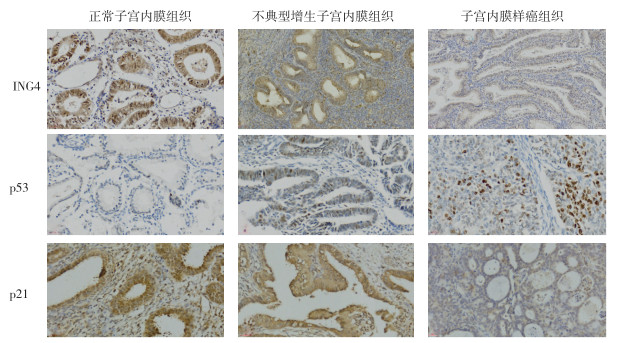
|
| 图 2 不同子宫内膜组织ING4、p53和p21的免疫组织化学检查结果(SP×400) Fig.2 Immunohistochemical results of ING4, p53 and p21 in different endometrial tissues(SP×400) |
p53的阳性表达定位于腺上皮细胞核,呈强弱不等的差异性着色。p53在正常子宫内膜组阳性表达率较低为15.0%(3/20),在不典型增生子宫内膜组及子宫内膜样癌组中的阳性表达率分别为40.0%(12/30)和63.3%(38/60),三组比较差异具有统计学意义(χ2=15.141,P < 0.05)。三组两两比较,不典型增生子宫内膜组低于子宫内膜样癌组(χ2=4.410,P < 0.05),正常子宫内膜组低于子宫内膜样癌组(χ2=14.025,P < 0.05),正常子宫内膜组阳性表达率与不典型增生子宫内膜组比较,差异无统计学意义(χ2=3.571,P > 0.05;图 2)。
p21的阳性表达定位于腺上皮细胞核。p21在正常子宫内膜组、不典型增生子宫内膜组及子宫内膜样癌组中的阳性表达率分别为90.0%(18/20)、63.3%(19/30)和28.3%(17/60),三组比较差异具有统计学意义(χ2=26.172,P < 0.05)。三组间两两比较,正常子宫内膜组阳性表达率低于不典型增生子宫内膜组(χ2=4.435,P < 0.05),不典型增生子宫内膜组低于子宫内膜样癌组(χ2=10.208,P < 0.05),正常子宫内膜组低于子宫内膜样癌组(χ2=23.179,P < 0.05)。p21的阳性表达率和子宫内膜病变的严重程度呈负相关关系(r=-0.478,P < 0.05;图 2)。
2.3 ING4、p53和p21蛋白表达情况与子宫内膜样癌临床病理特征之间的关系在60例子宫内膜样癌患者中,ING4、p53和p21在Ⅲ~Ⅳ期的阳性表达率均低于Ⅰ~Ⅱ期(均P < 0.05,表 1)。ING4、p53和p21阳性表达率在分化程度和肌层浸润方面比较,差异均具有统计学意义(均P < 0.05)。p53在无淋巴结转移组织中阳性表达率高于淋巴结转移组织,但因标本数量有限,尚未能准确评估。
| 临床病理特征 | 例数 | ING4 | p53 | p21 | ||||||||
| 阳性 | χ2值 | P值 | 阳性 | χ2值 | P值 | 阳性 | χ2值 | P值 | ||||
| 病理分期 | 5.64 | 0.01 | 4.34 | 0.03 | 4.97 | 0.03 | ||||||
| Ⅰ~Ⅱ期 | 40 | 13(32.5) | 29(72.5) | 15(37.5) | ||||||||
| Ⅲ~Ⅳ期 | 20 | 1(5.0) | 9(45.0) | 2(10.0) | ||||||||
| 分化程度 | 7.58 | 0.02 | 12.1 | 0.01 | 6.57 | 0.03 | ||||||
| G1 | 28 | 11(39.3) | 20(71.4) | 12(42.9) | ||||||||
| G2 | 17 | 2(11.8) | 14(82.4) | 4(23.5) | ||||||||
| G3 | 15 | 1(6.7) | 4(26.7) | 1(6.7) | ||||||||
| 肌层浸润 | 10.9 | < 0.01 | 7.18 | 0.02 | 16.64 | < 0.01 | ||||||
| 无 | 7 | 5(71.4) | 6(85.7) | 6(85.7) | ||||||||
| < 1/2 | 28 | 6(21.4) | 21(75.0) | 9(32.1) | ||||||||
| ≥1/2 | 25 | 3(12.0) | 11(44.0) | 2(8.0) | ||||||||
| 淋巴结转移 | 0.70 | 0.40 | 5.69 | 0.01 | 0.09 | 0.76 | ||||||
| 阴性 | 12 | 1(8.3) | 8(66.7) | 1(8.3) | ||||||||
| 阳性 | 8 | 0(0.0) | 1(12.5) | 1(12.5) | ||||||||
| 注 ING4:生长抑制因子蛋白家族成员4(inhibitor of growth family memember 4) | ||||||||||||
Western blot法检测20例子宫内膜样癌和癌旁正常子宫内膜组织标本中ING4、p53和p21蛋白表达量显示,癌旁的正常子宫内膜中ING4及p21表达量较高,子宫内膜样癌组织中的表达量较低;p53在子宫内膜样癌组织中的表达量高于癌旁的正常子宫内膜(图 3)。
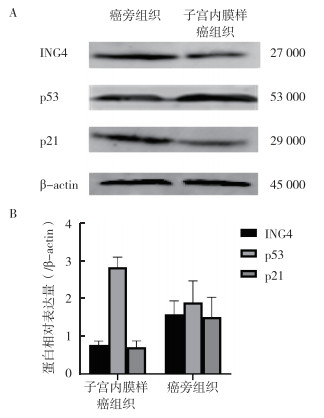
|
| 注 A:Western blot检测结果;B:蛋白相对表达量柱状图 图 3 子宫内膜样癌组织及其癌旁组织中ING4、p53和p21蛋白表达情况 Fig.3 Expressions of ING4, p53 and p21 in endometrioid carcinoma tissues and their adjacent tissues |
组织芯片体积小,信息量丰富,可根据不同的实验目的进行排列设计,为医学分子生物学研究提供一种大样本、高通量以及高效的分析工具。组织芯片用于多因子之间的比较,具有高效性、对比性强和好质控的优点[19]。本研究运用这种高通量和高效率的组织芯片,制作的3个蜡块上包含110例组织标本,将原本1个多月的工作量压缩在数天内完成,节约抗体、实验试剂及各种耗材,同时减少实验误差。ING4和p53蛋白结合形成转录复合物,从而激活p53基因,介导肿瘤血管的生成,细胞的生长和修复、对缺氧状态的适应、接触抑制的丢失以及对化学药物敏感性等影响肿瘤的发生和发展。p21作为p53重要的下游因子,参与调节细胞周期。本研究运用免疫组织化学技术结合组织芯片及Western blot法研究ING4在子宫内膜样癌中的表达情况及其与肿瘤级别的相关性,并探讨ING4、p53和p21在子宫内膜样癌发生和发展中的相关性。
ING4基因定位于染色体12p13-31区域内, 由84个基因编码,包括8个外显子和7个内含子,具有高度保守的植物同源结构域和1个核定位信号(nuclear localization signal,NLS)区[7, 9]。ING4可能通过多个通路在癌症的发生及转移中发挥抑制作用,成为抑制肿瘤的热门靶点[7-10]。本研究表明,ING4基因在子宫内膜样癌组织中的表达量较正常子宫内膜组织降低,并随着肿瘤临床分期的升高而下降,表明ING4蛋白表达水平的下降与子宫内膜样癌的发生和发展有密切关联,也提示ING4在子宫内膜样癌的发生和发展中起抑制作用。ING4作为一种新型的肿瘤抑制剂,能够增强p53乙酰化及其转录活性,从而起到激活细胞凋亡和影响细胞周期的作用, 其机制可能是ING4蛋白的NLS转录的氨基酸蛋白能参与p53活化后的四聚化、细胞内定位及调节p53蛋白转录, 同时ING4的NLS区域能与p53结合, 进而增强p53蛋白活性和提高p53的甲基化[20-21]。相关研究证明,ING4 / p53介导的p53和ING4共表达诱导协同生长抑制和凋亡,并增强乙酰化p53和p21的上调[22]。
p53基因是由11个外显子组成核酸蛋白,参与调节包括新陈代谢、自噬以及细胞迁移和侵袭等过程,是一种重要的抑癌基因,几乎在人类的所有肿瘤细胞中均可检测出[23-26]。p53基因分为p53野生型和p53突变型。野生型p53作为转录因子,能够调节细胞生长和分化,引起细胞周期阻滞,诱导凋亡,促进分化,监视细胞基因组的完整性,阻止具有癌变倾向的细胞产生。野生型p53是一种抑癌基因,一旦因为各种基因改变而导致突变,则成为突变型p53。突变型p53基因不仅失去抑癌作用,更重要的是具有参与和促进细胞恶性变的活性,导致细胞增殖过度、凋亡减少而发生癌变。突变型p53的主要组织学类型为浆液性癌,少量为高级别内膜样癌[27]。在子宫内膜样癌中野生型p53的占比较高,野生型p53在子宫内膜样癌中呈现强弱不等的阳性表达,根据免疫组织化学染色强度及p53的阳性细胞数进行统计分析发现,随着子宫内膜样癌手术分期、肌层浸润深度及分化程度的增加,p53的阳性表达率越低(均P < 0.05)。p53阳性表达率更高的子宫内膜样癌患者细胞恶性程度低。本研究中Western blot检测显示,子宫内膜样癌组织中p53的蛋白表达量高于癌旁组织,与免疫组织化学结论中子宫内膜样癌组阳性表达率高于不典型增生子宫内膜组及正常子宫内膜组的结论类似。除了个别病例中出现深肌层浸润和淋巴结转移等预后不良的指征,其余p53阳性表达的子宫内膜样癌患者预后较好。p53作为ING4的下游因子,随着ING4表达的降低,p53的转录活性降低,可能减弱对细胞周期的调节机制,促进子宫内膜样癌的发生与进展。
细胞周期调控因子p21是最早发现的一种细胞周期素依赖性激酶的抑制因子,p21蛋白是由188或189个氨基酸组成的相对分子质量为21 000的蛋白质,可以通过p53而诱导表达, 是p53重要的下游因子,同时还可以通过抑制多组cyclin/CDK复合物的活性而调节细胞周期[15]。p21蛋白可作为细胞周期抑制蛋白,使细胞周期停滞在G1期,从而抑制肿瘤的发生和发展。免疫组织化学和Western blot结果还显示,p21在Ⅰ~Ⅱ期、高中分化以及肌层浸润深度 < 1/2的组织中具有较高的阳性表达率,p21在子宫内膜样癌中的阳性表达率较非癌组降低,染色强度也较之为弱,表明癌变后的细胞中p21的表达发生下调。ING4及同一信号通路p21表达的减弱或下调可以造成细胞生长抑制作用的下降, 可能与子宫内膜样癌的发生或恶性增生有关。
在本研究中,子宫内膜样癌中ING4和p21的阳性表达率在病理分期方面比较,差异均具有统计学意义(均P < 0.05),且ING4及p21蛋白表达水平的下降与子宫内膜病变程度密切相关。随着临床分期及肌层浸润深度的增加,ING4、p53和p21的阳性表达均不同程度的降低。说明在子宫内膜恶性变的过程中ING4基因与p53的相互作用减弱,从而降低对p21的调节,使细胞周期失去调节,细胞凋亡机制丧失和异常增生导致子宫内膜组织癌变。在本研究中,因淋巴结转移标本收集不足,尚未明确上述因子与子宫内膜样癌淋巴结转移之间的关联,未对患者进行随访,无法研究其与患者生存及预后有无指导意义。所以还需要更大的样本量及随访数据来进一步研究ING4、p53和p21三者联合对子宫内膜样癌患者预后的关系,后续还可开展分子水平的研究。ING4可能成为女性子宫内膜样癌治疗的新靶点,为患者带来福音。
| [1] |
谢幸, 苟文丽. 妇产科学[M]. 8版. 北京: 人民卫生出版社, 2013: 313-317.
|
| [2] |
Rodriguez AC, Blanchard Z, Maurer KA, et al. Estrogen signaling in endometrial cancer: a key oncogenic pathway with several open questions[J]. Horm Cancer, 2019, 10(2/3): 51-63. DOI:10.1007/s12672-019-0358-9 |
| [3] |
Nguyen TT, Kurita T, Chiho K, et al. GalNAc-T6 in the relationship with invasion ability of endometrial carcinomas and prognostic significance[J]. Am J Cancer Res, 2017, 7(5): 1188-1197. |
| [4] |
高灵通, 刘玮. MTA2在子宫内膜癌中的表达及其与临床病理特征的关系[J]. 上海交通大学学报: 医学版, 2018, 38(1): 52-56. DOI:10.3969/j.issn.1674-8115.2018.01.009 |
| [5] |
Shiseki M, Nagashima M, Pedeux RM, et al. p29ING4 and p28ING5 bind to p53 and p300, and enhance p53 activity[J]. Cancer Res, 2003, 63: 2373-2378. |
| [6] |
Garkavtsev I, Kozin SV, Chernova O, et al. The candidate tumour suppressor protein, ING4 regulates brain tumour growth and angiogenesis[J]. Nature, 2004, 428(6980): 328-332. DOI:10.1038/nature02329 |
| [7] |
Li X, Cai L, Chen H, et al. Inhibitor of growth 4 induces growth suppression and apoptosis in glioma U87MG[J]. Pathobiology, 2009, 76(4): 181-192. DOI:10.1159/000218334 |
| [8] |
Archambeau J, Blondel A, Pedeux R, et al. Focus-ING on DNA integrity: implication of ING proteins in cell cycle regulation and DNA repair modulation[J]. Cancers (Basel), 2019, 76(4): 181-192. |
| [9] |
Ren X, Liu H, Zhang M J, et al. Co-expression of ING4 and P53 enhances hypopharyngeal cancer chemosensitivity to cisplatin in vivo[J]. Mol Med Rep, 2016, 14(3): 2431-2438. DOI:10.3892/mmr.2016.5552 |
| [10] |
Wu J, Zhu Y, Xu C, et al. Adenovirus-mediated p53 and ING4 gene co-transfer elicits synergistic antitumor effects through enhancement of p53 acetylation in breast cancer[J]. Oncol Rep, 2016, 35(1): 243-252. DOI:10.3892/or.2015.4385 |
| [11] |
Yin SL, Xiao F, Liu YF, et al. Long non-coding RNA FENDRR restrains the aggressiveness of CRC via regulating miR-18a-5p/ING4 axis[J]. J Cell Biochem, 2020, 121(8/9): 3973-3985. |
| [12] |
Wang QS, Li M, Zhang LY, et al. Down-regulation of ING4 is associated with initiation and progression of lung cancer[J]. Histopathology, 2010, 57(2): 271-281. DOI:10.1111/j.1365-2559.2010.03623.x |
| [13] |
Qian FL, Hu QQ, Tian YL, et al. ING4 suppresses hepatocellular carcinoma via a NF-κB/miR-155/FOXO3a signaling axis[J]. Int J Biol Sci, 2019, 15(2): 369-385. DOI:10.7150/ijbs.28422 |
| [14] |
Qian FL, Hu QQ, Tian YL, et al. ING4 suppresses hepatocellular carcinoma via a NF-κB/miR-155/FOXO3a signaling axis[J]. Int J Biol Sci, 2019, 15(2): 369-385. DOI:10.7150/ijbs.28422 |
| [15] |
Jiang LJ, Zhang XL, Xiang CL, et al. Differential cellular localization of CELSR2 and ING4 and correlations with hormone receptor status in breast cancer[J]. Histol Histopathol, 2018, 33(8): 835-842. |
| [16] |
Liu YL, Yu LQ, Wang YW, et al. Expression of tumor suppressor gene ING4 in ovarian carcinoma is correlated with microvessel density[J]. J Cancer Res Clin Oncol, 2012, 138(4): 647-655. DOI:10.1007/s00432-011-1099-5 |
| [17] |
Cai LM, Li HY, Chen C, et al. Role of inhibitor of growth 4 in the suppression of human melanoma cells through the Fas/FasL-mediated apoptosis pathway[J]. Int J Mol Med, 2018, 41(2): 1055-1061. |
| [18] |
赵倩. ING4在子宫内膜癌中的表达及其临床意义的研究[D]. 郑州: 郑州大学第一临床学院, 2015.
|
| [19] |
李婳, 曹艳莎, 赵津平, 等. 组织芯片技术检测SIRT6蛋白在结肠癌组织中的表达及其临床意义[J]. 吉林大学学报: 医学版, 2019, 45(4): 893-898. |
| [20] |
Russell M, Berardi P, Gong W, et al. Grow-ING, AgeING and Die-ING: ING proteins link cancer, senescence and apoptosis[J]. Exp Cell Res, 2006, 312(7): 951-961. |
| [21] |
Zhang X, Wang KS, Wang ZQ, et al. Nuclear localization signal of ING4 plays a key role in its binding to p53[J]. Biochem Biophys Res Commun, 2005, 331(4): 1032-1038. DOI:10.1016/j.bbrc.2005.04.023 |
| [22] |
Guo Y, Meng XK, Wang Q, et al. The ING4 binding with p53 and induced p53 acetylation were attenuated by human papillomavirus 16 E6[J]. PLoS One, 2013, 8(8): e71453. DOI:10.1371/journal.pone.0071453 |
| [23] |
余倩, 李小林, 陆远强, 等. p53 Arg72Pro基因多态性与食管癌相关性的meta分析[J]. 实用肿瘤杂志, 2020, 35(6): 534-541. |
| [24] |
Blagih J, Buck MD, Vousden KH. p53, cancer and the immune response[J]. J Cell Sci, 2020, 133(5): jcs237453. |
| [25] |
Pitolli C, Wang Y, Candi E, et al. p53-mediated tumor suppression: DNA-damage response and alternative mechanisms[J]. Cancers (Basel), 2019, 11(12): E1983. DOI:10.3390/cancers11121983 |
| [26] |
Bollu LR, Shepherd J, Zhao D, et al. Mutant p53 induces MELK expression by release of wild-type p53-dependent suppression of FOXM1[J]. NPJ Breast Cancer, 2020, 6(1): 2. |
| [27] |
杜宁宁, 刘岩, 任彩霞, 等. 癌症基因组图谱子宫内膜癌分子分型在子宫内膜样癌中的临床应用探索[J]. 中华病理学杂志, 2019, 48(8): 596-603. |
 2021, Vol. 36
2021, Vol. 36


