文章信息
- 陈虹悯, 刘佳, 邓中华, 赖佳路, 李安, 张英杰, 桑旦旺姆, 宫友陵, 周麟
- Chen Hongmin, Liu Jia, Deng Zhonghua, Lai Jialu, Li An, Zhang Yingjie, Sang Danwangmu, Gong Youling, Zhou Lin
- 局部晚期胸段食管鳞癌同步加量调强放疗联合化疗的疗效及不良反应分析
- Efficacy and toxicity of simultaneous integrated boost intensity modulated radiation therapy combined with concurrent chemotherapy in patients with locally advanced thoracic esophageal squamous cell carcinoma
- 实用肿瘤杂志, 2023, 38(1): 46-53
- Journal of Practical Oncology, 2023, 38(1): 46-53
-
通信作者
- 周麟, E-mail: drzhoulin@163.com
-
文章历史
- 收稿日期:2021-11-15
2. 成都市第一人民医院肿瘤科, 四川 成都 610041;
3. 四川大学华西医院肿瘤中心放疗科, 四川 成都 610041;
4. 西藏自治区人民医院肿瘤科, 西藏自治区 拉萨 850000
2. Department of Oncology, Chengdu First People's Hospital, Chengdu 610041, China;
3. Department of Radiotherapy, Cancer Center, West China Hospital, Sichuan University, Chengdu 610041, China;
4. Department of Oncology, People's Hospital of Tibet Autonomous Region, Lhasa 850000, China
食管鳞癌是我国临床最常见的恶性肿瘤之一,我国西部地区更是该病的高发区域,其发病率及死亡率逐年上升[1-3]。早期食管鳞癌患者可首选手术切除治疗,但因早期症状不明显,多数患者就诊时已为中晚期,无法进行根治性手术治疗[4]。目前,局部晚期食管鳞癌的标准治疗方案为同步放化疗,但有关放疗的靶区勾画方式及最佳放疗剂量还存有争议。临床中主要的靶区勾画方式有预防性淋巴结区域照射(elective nodal irradiation,ENI)、受累野照射(involved-field irradiation,IFI)及同步加量调强放疗(simultaneous integrated boost intensity modulated radiation therapy,SIB-IMRT)等方式。因食管鳞癌是放疗剂量依赖性肿瘤,理论上其疗效与放疗剂量呈正相关,但前瞻性Ⅲ期临床研究显示,同步放化疗中 > 50 Gy的放疗剂量未使患者有更多的获益。因此,NCCN指南推荐同步放化疗中的放疗剂量为50.4 Gy/28 f,1.8 Gy/f,5 f/周[5]。但为使患者获得更好的疾病局部控制效果,国内多数单位在临床中应用60~66 Gy的放疗剂量。SIB-IMRT采用瘤灶同步推量的放疗方式,在保护周围正常组织的基础上,提高肿瘤的放疗剂量,理论上可以部分克服剂量与毒性之间的矛盾。本研究回顾性分析四川大学华西医院接受SIB-IMRT(肿瘤剂量60~66 Gy)同步化疗的局部晚期胸段食管鳞癌患者的疗效及不良反应情况。
1 资料与方法 1.1 临床资料纳入标准:(1)年龄≥18岁;(2)放疗方式采用SIB-IMRT,肿瘤区域放疗剂量为60~66 Gy;(3)完成既定方案的放化疗处理,同步化疗≥2个周期;(4)病理确诊为食管鳞状细胞癌;(5)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分≤1分;(6)病历资料完整,随访时间≥3个月。
排除标准:(1)患者资料不完善,不能及时进行回访或复查者;(2)病理为非鳞状细胞癌;(3)未完成既定方案放疗或化疗;(4)难以遵循医嘱完成相关检查和治疗者。
本研究共纳入2017年2月至2018年7月于四川大学华西医院收治的符合纳入和排除标准的43例局部晚期胸段食管鳞癌患者,年龄43~68岁,中位年龄58岁。本研究已通过四川大学华西医院伦理审查。患者一般资料见表 1。
| 临床特征 | 例数(%) |
| 性别 | |
| 男性 | 32(74.4) |
| 女性 | 11(25.6) |
| 年龄 | |
| < 60岁 | 26(60.5) |
| ≥60岁 | 17(39.5) |
| 肿瘤部位 | |
| 胸上段 | 21(48.8) |
| 胸中段 | 19(44.2) |
| 胸下段 | 3(7.0) |
| 原发肿瘤长度 | |
| ≤5 cm | 22(51.2) |
| > 5 cm | 21(48.8) |
| GTV体积 | |
| ≤50 cm3 | 26(60.5) |
| > 50 cm3 | 17(39.5) |
| 巩固化疗 | |
| 是 | 25(58.1) |
| 否 | 18(41.9) |
| 化疗方案 | |
| TP方案 | 34(79.1) |
| DP方案 | 9(20.9) |
| 临床分期 | |
| Ⅱ | 12(27.9) |
| Ⅲ | 31(72.1) |
| T分期 | |
| T1+T2 | 15(34.9) |
| T3 | 18(41.9) |
| T4 | 10(23.3) |
| N分期 | |
| N0 | 7(16.3) |
| N1 | 16(37.2) |
| N2 | 20(46.5) |
| 注 GTV: 肿瘤靶区体积(gross target volume);TP方案:紫杉醇+顺铂;DP方案:多西他赛+顺铂 | |
靶区定义:肿瘤靶区体积(gross target volume,GTV)为影像学(CT和食管钡餐)及胃镜确定的食管肿瘤及阳性淋巴结,临床靶区体积(clinical target volume,CTV)为GTV外放0.5~1.0 cm,头脚方向外放3~4 cm,并包含相应的淋巴结引流区;计划靶区体积(planning target volume,PTV)为CTV外放0.5~1.0 cm;原发肿瘤计划靶区体积(primary gross target volume,PGTV)为GTV四周外放0.5 cm,头脚方向外放1~2 cm。胸上段CTV上界为环甲膜水平,下界为隆突下3 cm/肿瘤下3~4 cm,包括1、2、4、7、8U和8M淋巴引流区;胸中段CTV上界为胸1锥体的上缘,下界为肿瘤下3~4 cm,包括1、2、4、7、8U、8M和8L淋巴结引流区;胸下段CTV上界为肿瘤上3~4 cm,下界为肿瘤下3~4 cm,包括7、8M、8L、15、16、17和20淋巴结区。所有患者均采用直线加速器6 MV-X线照射,行同步调强放疗(SIB-IMRT),PTV 50.4 Gy/28 f,1.8 Gy/f,5 f/周,同步PGTV 60~66 Gy/28 f,2.14~2.35 Gy/f,5 f/周,要求处方剂量包含95%的靶区体积。正常组织限量:脊髓≤45 Gy,两肺V5≤60%、V20≤28%、V30≤18%和平均肺剂量(mean lung dose,MLD) < 18 Gy,心脏V40 < 30%及平均心脏剂量(mean heart dose,MHD) < 27 Gy。
1.3 化疗所有患者皆行同步放化疗。34例接受TP方案(紫杉醇+顺铂)化疗,9例接受DP方案(多西他赛+顺铂)化疗。其中25例行巩固化疗(巩固化疗定义为同步放化疗结束后,再行1~2个周期化疗)。TP方案:紫杉醇135~175 mg/m2,静脉滴注,d1;顺铂25 mg/m2,静脉滴注,d1~d3;21 d为1个周期,共2~4个周期。DP方案:多西他赛75 mg/m2,静脉滴注,d1;顺铂25 mg/m2,静脉滴注,d1~d3;21 d为1个周期,共2~4个周期。
1.4 疗效及毒性判定标准所有患者放疗结束后4周,行胸部及上腹部增强CT及食管钡餐复查,此后每2~3个月复查1次,食管原发灶疗效按国际抗癌联盟(International Union Against Cancer,UICC)疗效标准以食管钡餐评价[6],淋巴结转移灶疗效评价参考美国实体瘤疗效评价标准1.1(Response Evaluation Criteria in Solid Tumor 1.1, RECIST 1.1)[7],结合患者临床资料、影像学检查进行评估:完全缓解(complete remission,CR),所有靶病灶全部消失,所有病理性淋巴结短径必须缩小至 < 10 mm;部分缓解(partial remission,PR),以基线期或最小值靶病灶直径总和为参照,所有靶病灶直径总和减少≥30%;疾病进展(progressive disease,PD),以研究期间靶病灶直径之和的最小值(包括基线值,如果基线值为最小值时)为参照,靶病灶直径之和增加≥20%;疾病稳定(stable disease,SD),以研究期间靶病灶直径之和的最小值为参照,既没有减少至PR,也没有增加至PD。客观有效率(objective response rate,ORR)为CR+PR,疾病控制率(disease control rate,DCR)为CR+PR+SD。
所有患者在放化疗期间的每周、放疗后的1个月及此后的每2~3个月进行治疗毒性评价,评价标准参照美国国立癌症研究院通用不良反应分级标准(National Cancer Institute-Common Terminology Criteria Adverse Events Version 4.0,NCI-CTCAE 4.0)[8]。
局部无进展生存期(locoregional recurrence-free survival,LRFS)定义为患者从放疗开始至放射野内复发或患者死亡。无远处转移生存期(distant metastasis-free survival,DMFS)定义为患者从放疗开始至放射野外复发、远处转移或患者死亡。无进展生存期(progression-free survival,PFS)定义为患者从放疗开始至第1次发生PD或任何原因死亡。总生存期(overall survival,OS)定义为患者从放疗开始至死亡。
1.5 随访本研究采用门诊复查、电话及信件随访及等方式对患者的症状、复查时间、复查内容、复查结果和生存情况等进行随访。
1.6 统计学分析采用SPSS 26.0软件进行数据分析。计数资料采用频数(百分比)表示。Kaplan-Meier法作生存曲线。Log-rank法作生存预后单因素分析,Cox模型作生存预后多因素分析。以P < 0.05为差异具有统计学意义。
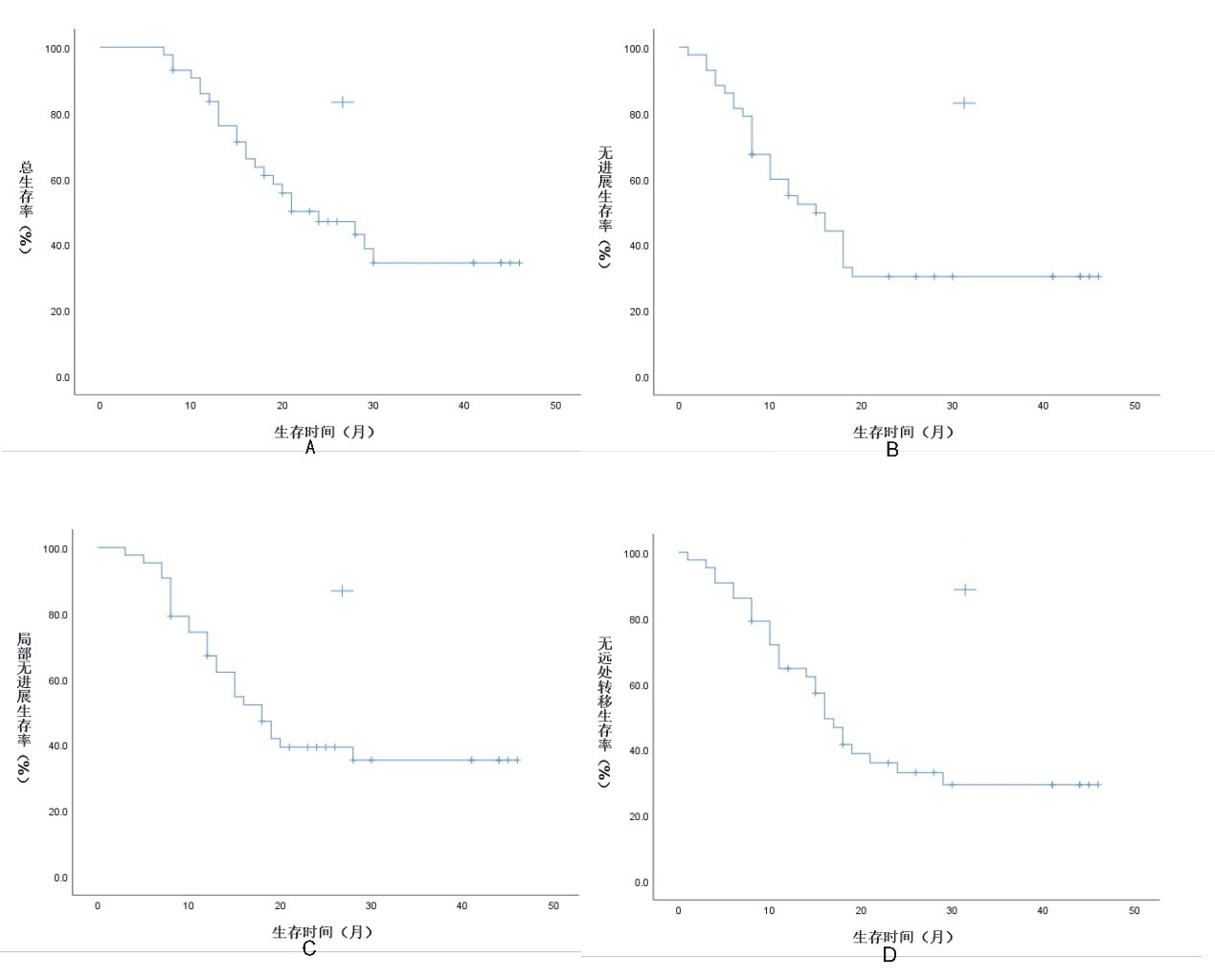
2 结果 2.1 疗效随访截至2021年6月,中位随访时间30个月。全组患者治疗后无CR发生,ORR及DCR分别为81.4%(35/43)及100%(43/43)。1年和3年OS率分别为83.5%和35.5%;1年和3年PFS率分别为59.9%和30.4%;1年和3年LRFS率分别为74.3%和35.4%;1年和3年的DMFS率分别为64.7%和29.4%(图 1)。
|
| 注 A:总生存曲线;B:无进展生存曲线;C:局部无进展生存曲线;D:无远处转移生存曲线 图 1 接受同步调强加量放疗联合化疗的局部晚期胸段食管鳞癌患者的生存曲线 Fig.1 Survival curves of patients with locally advanced thoracic esophageal squamous cell carcinoma receiving simultaneous integrated boost intensity modulated radiation therapy combined with concurrent chemotherapy |
单因素分析显示,患者GTV、肿瘤长度、T分期、N分期和临床分期是影响OS和PFS的预后因素,GTV、肿瘤长度、T分期和临床分期是影响LRFS的预后因素,而GTV、T分期、N分期和临床分期是影响DMFS的预后因素(均P < 0.05,表 2)。将单因素分析中差异具有统计学意义(P < 0.05)的因素以及临床上与生存关系密切的因素纳入Cox回归模型显示,T分期和临床分期为影响OS的独立预后因素,T分期为影响PFS的独立预后因素,GTV为影响LRFS的独立预后因素,而年龄、T分期、N分期、临床分期及肿瘤长度为影响DMFS的独立预后因素(均P < 0.05,表 3)。因胸下段患者例数过少,肿瘤部位未纳入生存分析。
| 因素 | P值 | ||||||
| 总生存 | 无进展生存 | 局部无进展生存 | 无远处转移生存 | ||||
| 年龄 | 0.839 | 0.931 | 0.905 | 0.940 | |||
| T分期 | 0.008 | 0.018 | 0.006 | 0.026 | |||
| N分期 | 0.017 | 0.003 | 0.118 | 0.002 | |||
| 临床分期 | < 0.01 | 0.003 | 0.001 | 0.006 | |||
| 肿瘤长度 | 0.025 | 0.015 | 0.042 | 0.652 | |||
| 巩固化疗 | 0.369 | 0.305 | 0.429 | 0.205 | |||
| GTV | 0.019 | 0.011 | 0.003 | 0.040 | |||
| 因素 | 总生存 | 无进展生存 | 局部无进展生存 | 无远处转移生存 | |||||||||||
| OR | P值 | 95%CI | OR | P值 | 95%CI | OR | P值 | 95%CI | OR | P值 | 95%CI | ||||
| 年龄 | 0.907 | 0.840 | 0.351~2.344 | 0.424 | 0.099 | 0.153~1.174 | 1.353 | 0.507 | 0.553~3.312 | 0.290 | 0.031 | 0.094~0.892 | |||
| T分期 | 2.653 | 0.040 | 1.358~5.181 | 2.473 | 0.023 | 1.130~5.411 | 1.828 | 0.062 | 0.970~3.445 | 4.999 | 0.001 | 1.930~12.946 | |||
| N分期 | 1.582 | 0.386 | 0.561~4.461 | 2.057 | 0.136 | 0.797~5.306 | 0.802 | 0.633 | 0.323~1.990 | 3.313 | 0.015 | 1.265~8.675 | |||
| 临床分期 | 17.526 | 0.048 | 1.032~297.611 | 3.636 | 0.184 | 0.540~24.465 | 8.930 | 0.052 | 0.979~81.452 | 16.385 | 0.033 | 1.254~214.116 | |||
| 肿瘤长度 | 0.407 | 0.206 | 0.101~1.641 | 0.367 | 0.096 | 0.113~1.195 | 0.575 | 0.365 | 0.174~1.903 | 0.116 | 0.005 | 0.026~0.517 | |||
| 巩固化疗 | 1.560 | 0.423 | 0.525~4.637 | 1.258 | 0.573 | 0.537~3.071 | 0.971 | 0.954 | 0.361~2.615 | 1.856 | 0.196 | 0.728~4.732 | |||
| GTV | 2.748 | 0.100 | 0.824~9.166 | 1.836 | 0.203 | 0.720~4.682 | 4.455 | 0.011 | 1.402~14.159 | 2.159 | 0.138 | 0.781~5.974 | |||
复发模式分析显示,随访截止时,全组患者的放射野内复发率为23.3%,其中单纯GTV靶区内复发为4.7%(2/43),单纯CTV靶区内复发为14.0%(6/43),GTV及CTV内皆有复发为2.3%(1/43);放射野外区域淋巴结复发率为2.3%(1/43);远处转移率为34.9%(15/43),其中肺转移30.2%(13/43),肝转移9.3%(4/43),骨转移2.3%(1/43)。
2.2 治疗相关不良反应全组患者治疗后的3~4级不良反应主要为白细胞减少(23.2%)及放射性食管炎(14.0%),另外血小板减少为7.0%,恶心为9.3%,呕吐为2.3%,放射性肺炎4.7%(表 4)。93%的患者经对症支持,抗感染、升白细胞和升血小板治疗后好转,可耐受。
| 不良反应 | 0级 | 1级 | 2级 | 3级 | 4级 |
| 放射性食管炎 | 11(25.6) | 17(39.5) | 9(20.9) | 3(7.0) | 3(7.0) |
| 放射性肺炎 | 36(83.7) | 4(9.3) | 1(2.3) | 2(4.7) | 0(0.0) |
| 放射性皮炎 | 21(48.8) | 22(51.2) | 0(0.0) | 0(0.0) | 0(0.0) |
| 白细胞减少 | 12(27.9) | 8(18.6) | 13(30.2) | 9(20.9) | 1(2.3) |
| 血小板减少 | 32(74.4) | 6(14.0) | 2(4.6) | 3(7.0) | 0(0.0) |
| 血红蛋白减少 | 29(67.4) | 12(27.9) | 2(4.7) | 0(0.0) | 0(0.0) |
| 恶心 | 14(32.5) | 18(41.9) | 7(16.3) | 4(9.3) | 0(0.0) |
| 呕吐 | 23(53.5) | 13(30.2) | 6(14.0) | 1(2.3) | 0(0.0) |
| 腹泻 | 40(93.0) | 3(7.0) | 0(0.0) | 0(0.0) | 0(0.0) |
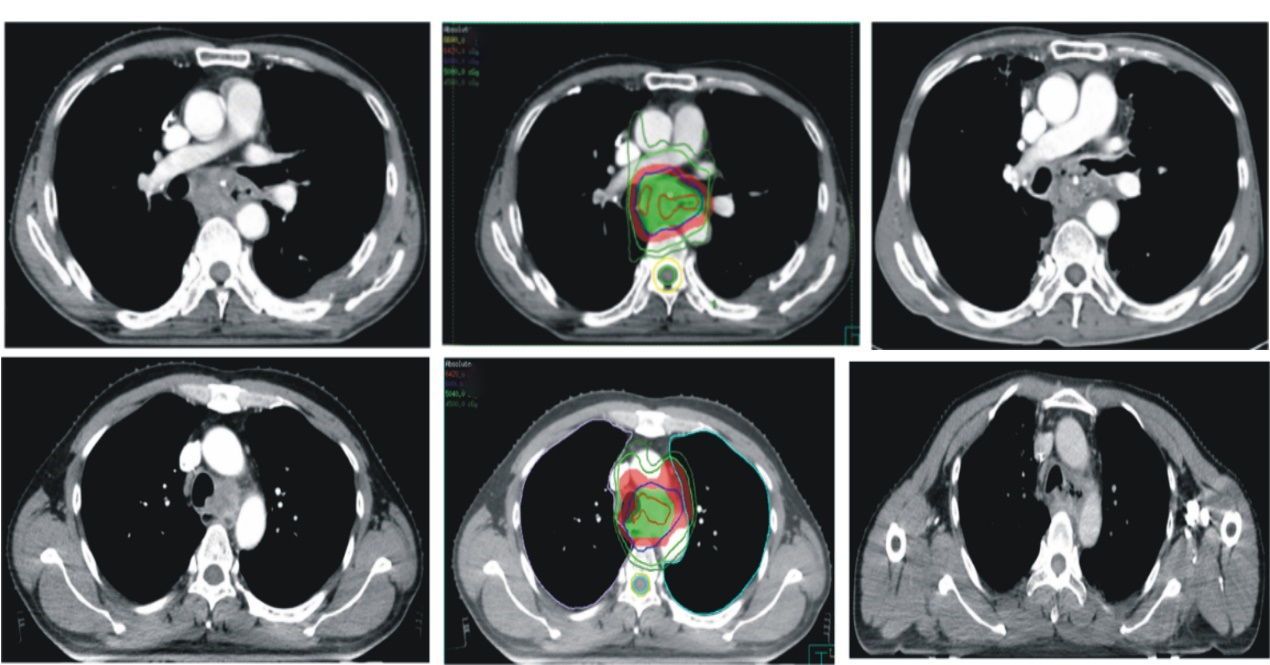
全组患者中有2例出现食管气管瘘,1例出现食管纵隔瘘(表 5)。这3例患者中,2例PGTV放疗剂量为60 Gy/28 f,1例为64.4 Gy/28 f;放疗前CT或食管钡餐皆显示有气管受侵或深溃疡的症状,典型病例影像表现见图 2。
| 编号 | 治疗前风险 | 剂量 | 分期 | 肿瘤位置 | 瘘位置 | 瘘出现时间 |
| 病例1 | 深溃疡 | PGTV 64.4 Gy/28 f | T3N2MO | 胸下段 | 纵隔 | 放疗9次时 |
| PTV 50.4 Gy/28 f | ||||||
| 病例2 | 左支气管受侵 | PGTV 60 Gy/28 f | T4N1M0 | 胸中段 | 支气管 | 放疗后4个月 |
| PTV 50.4 Gy/28 f | ||||||
| 病例3 | 淋巴结侵及气管和食管 | PGTV 60 Gy/28 f | T4N1M0 | 胸上段 | 支气管 | 放疗后2个月 |
| PTV 50.4 Gy/28 f | ||||||
| 注 PGTV:原发肿瘤计划靶区体积(primary gross target volume);PTV:计划靶区体积(planning target volume) | ||||||
|
| 注 放疗剂量分布中,绿色为PGTV,红色为PTV,PGTV剂量为60 Gy/28 f,PTV剂量为50.4 Gy/28 f 图 2 接受同步调强加量放疗联合化疗的2例局部晚期胸段食管鳞癌患者的食管瘘CT表现 Fig.2 CT findings of esophageal fistula in two patients with locally advanced thoracic esophageal squamous cell carcinoma receiving simultaneous integrated boost intensity modulated radiation therapy combined with concurrent chemotherapy |
同步放化疗是不可切除局部晚期食管癌的标准治疗手段,随着放疗技术的进步,局部晚期食管鳞癌的疗效有了较大提高。研究报道,局部晚期食管鳞癌根治性同步放化疗(常规分割方式放疗)后3年OS率为33.7%~41.7%,3年PFS率为28.0%~37.3%,3年LRFS率为55.3%[5-9]。本研究回顾性分析SIB-IMRT同步化疗对43例局部晚期胸部食管鳞癌患者的疗效及不良反应的情况。结果显示,3年OS率、PFS率和LRFS率分别为35.5%、30.4和35.4%,与既往报道相似[9-13]。
ENI是局部晚期食管鳞癌常用的放疗靶区设计方式,但其放疗范围通常较大,提高放疗剂量会同时增加放疗毒性,并对患者的免疫状态起到负性作用,这可能是在ENI模式下单纯提高剂量并未提高疗效的原因之一[14]。SIB-IMRT针对肿瘤病灶同步推量,在一定程度上解决大靶区和放疗剂量提高间的矛盾,在不延长总疗程时间的基础上,给予肿瘤病灶更高剂量的放疗,同时较少增加周围正常组织的受照剂量,有进一步提高疗效的理论基础[15-16]。回顾性临床研究显示,局部晚期食管癌SIB-IMRT后毒性可耐受,1年LRFS率为78.8%,1年和3年OS率为76.9%~78.0%和35.0%[16-17],其较常规方式放疗患者的生存获益更大(中位OS:28个月vs 24个月,P < 0.01)[18]。一项1/2期前瞻性临床研究纳入46例局部晚期食管癌(50%为鳞癌),患者接受SIB-IMRT放疗(PTV受量50.4 Gy/28 f,PGTV同步推量58.8~63 Gy/28 f)同步多西他赛联合5-氟尿嘧啶/卡培他滨化疗,结果显示,SIB-IMRT的最大耐受剂量为PGTV 63 Gy/28 f,毒性可耐受。其疗效数据与同中心97例接受常规方式放疗(PTV 50.4 Gy/28 f)的局部晚期食管癌患者的疗效数据进行比较显示,SIB-IMRT可降低淋巴结阳性和Ⅲ~Ⅳ期患者的局部复发率(13% vs 56%,P=0.04;29% vs 55%,P=0.04),局部控制率更高(HR=0.49),生存期更长(HR=0.66)[19-20]。遗憾的是,后续的随机对照临床研究未能证实SIB-IMRT的优势。随机对照临床研究ARTDECO纳入260例局部晚期食管癌(61%为鳞癌),随机分为SIB-IMRT组(PTV 50.4 Gy/28 f,原发肿瘤同步推量至61.6 Gy/28 f)及常规放疗组(PTV 50.4 Gy/28 f),两组患者皆接受紫杉醇联合卡铂同步化疗[21]。结果显示,SIB-IMRT及常规放疗组的3年LRFS率分别为59.0%和52.0%(P=0.08)。本研究的疗效数据与上述研究有可比性,同时本研究显示,放疗区域内肿瘤控制较为理想,但患者的远处转移失败率仍较高(3年的DMFS为29.4%),提示了此类患者全身治疗的重要性,其整体疗效的提高不仅需要局部放疗方式的优化,全身治疗方案的更新和优化也非常重要。
研究显示,食管癌SIB-IMRT后主要的毒性反应为白细胞减少及放射性食管炎[16-20],本研究数据与其一致。食管穿孔是食管癌放疗中或放疗后发生的严重并发症之一,对患者的生活质量及总生存影响较大。研究报道,局部晚期食管癌同步放化疗(包括SIB-IMRT)后食管瘘的发生率为6.9%~13.0%[16, 22],本研究中食管瘘发生率为7.0%,与过往报道相近。目前对于放疗中出现食管瘘的情况下能否继续放疗仍存争议。有研究显示,对于放疗效果较好的患者,在控制感染和充分营养支持下继续完成放疗有利于瘘口愈合[23]。本研究中有3例出现食管瘘,均存在发生食管瘘的高危因素,其中1例在放疗前CT及食管钡餐显示有深溃疡,在其放疗9次时就出现食管纵隔瘘,后经植入空肠营养管、抗感染及对症支持治疗后好转,后续完成原方案放疗,后患者因局部肿瘤复发导致再次食管纵隔瘘,其OS为23个月。研究显示,食管癌放疗后组织柔韧度降低和脆性增加,治疗后仍存在再次穿孔的风险[24-25],该病例的转归与上述研究一致。另有2例放疗后出现食管气管瘘,其放疗前CT检查显示,食管肿瘤及肿瘤转移淋巴结与气管的脂肪间隙消失,肿瘤有突入气管的征象,其中1例放疗结束后4个月出现食管瘘,经抗感染及营养支持治疗后好转,而另1例在放疗结束后2个月时出现食管瘘,最终死于重症感染和呼吸衰竭,这2例的OS分别为15个月及4个月。研究显示,大体肿瘤为溃疡型、淋巴结包膜外受侵和T4分期的患者在高剂量放疗时更易发生穿孔[23-27]。本研究中3例食管瘘患者中有2例为溃疡型,2例为T4分期,1例为淋巴结包膜外受侵,与这些报道一致[23-27]。穿孔原因可能为患者在接受SIB-IMRT时发生穿孔的位置(肿瘤位置)承受了总剂量为60~64.4 Gy的照射,虽然放疗后肿瘤产生退缩,但正常组织未及时得以修复,最终导致食管瘘的发生。
综上所述,同步调强加量放疗同步化疗治疗局部晚期食管鳞癌局部控制较为理想,不良反应可耐受,但需警惕治疗前有食管穿孔高危因素存在的患者,其在高剂量放疗后可能存在穿孔风险。同时患者远期疗效的提高可能需要全身治疗方案的进一步优化。此外本研究为小样本回顾性研究,病例数较少,其结果不可避免存在着一定的偏倚,结论需后续扩大样本量进一步分析,并有待前瞻性随机对照研究进一步验证。
| [1] |
Deng W, Yang JS, Ni WJ, et al. Postoperative radiotherapy in pathological T2-3N0M0 thoracic esophageal squamous cell carcinoma: interim report of a prospective, phase Ⅲ, randomized controlled study[J]. Oncologist, 2020, 25(4): e701-708. DOI:10.1634/theoncologist.2019-0276 |
| [2] |
Lu D, Liu XG, Feng SY, et al. The Current situation of esophageal cancer staging and perioperative strategies determination in central and southern China: a cross sectional survey[J]. Front Oncol, 2019, 9: 1098. DOI:10.3389/fonc.2019.01098 |
| [3] |
侯新芳, 李帅, 吴晨, 等. 信迪利单抗联合化疗一线治疗晚期食管癌完全缓解一例[J]. 实用肿瘤杂志, 2021, 36(1): 66-69. |
| [4] |
王鑫, 王澜, 陈俊强, 等. 多中心食管鳞癌根治性三维放疗的预后分析: 3JECROG R-01[J]. 中华放射肿瘤学杂志, 2018, 27(11): 959-964. DOI:10.3760/cma.j.issn.1004-4221.2018.11.002 |
| [5] |
Ajani J, D'Amico T, Bentrem D, et al. Esophageal and esophagogastric junction cancers, version 2.2019, NCCN Clinical Practice Guidelines in Oncology[J]. J Nat Compr Cancer Netw, 2019, 17(7): 855-883. DOI:10.6004/jnccn.2019.0033 |
| [6] |
任雪姣, 许立昂, 王澜, 等. 食管癌钡餐造影结合CT近期疗效评价标准的临床应用研究[J]. 中华放射肿瘤学杂志, 2018, 27(5): 6. |
| [7] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 0-247. |
| [8] |
皋文君, 刘砚燕, 袁长蓉. 国际肿瘤化疗药物不良反应评价系统——通用不良反应术语标准4.0版[J]. 肿瘤, 2012, 32(2): 3. DOI:10.3969/j.issn.1005-5304.2012.02.002 |
| [9] |
于波, 汪建林, 刘惠兰, 等. 373例食管癌患者三维技术放疗预后分析[J]. 中华放射医学与防护杂志, 2018, 38(3): 174-179. DOI:10.3760/cma.j.issn.0254-5098.2018.03.003 |
| [10] |
谭立君, 刘晓, 肖泽芬, 等. 592例食管癌3DRT的预后分析[J]. 中华放射肿瘤学杂志, 2015, 24(1): 10-15. DOI:10.3760/cma.j.issn.1004-4221.2015.01.004 |
| [11] |
任雪姣, 王澜, 韩春, 等. 食管癌同期放化疗不同放疗剂量远期疗效分析[J]. 中华放射肿瘤学杂志, 2017, 26(9): 1006-1011. DOI:10.3760/cma.j.issn.1004-4221.2017.09.006 |
| [12] |
徐勇刚, 王鑫, 李晨, 等. IMRT/3DCRT治疗Ⅱ/Ⅲ期食管鳞癌疗效和预后分析: 泛京津冀多中心回顾分析(3JECROG R-06)[J]. 中华放射肿瘤学杂志, 2019, 28(6): 405-411. DOI:10.3760/cma.j.issn.1004-4221.2019.06.002 |
| [13] |
李巧芳, 邓文钊, 赵彦, 等. 食管癌根治性调强放疗+化疗照射靶区范围对预后的影响[J]. 中华放射肿瘤学杂志, 2020, 29(7): 513-518. DOI:10.3760/cma.j.cn113030-20191009-00407 |
| [14] |
Deng W, Xu C, Liu A, et al. The relationship of lymphocyte recovery and prognosis of esophageal cancer patients with severe radiation-induced lymphopenia after chemoradiation therapy[J]. Radiother Oncol, 2019, 133: 9-15. DOI:10.1016/j.radonc.2018.12.002 |
| [15] |
张斯渊, 董信春, 韩松辰, 等. 精准医疗: 中晚期食管癌放疗技术进展浅谈[J]. 实用肿瘤杂志, 2021, 36(4): 368-374. |
| [16] |
徐敏, 王玮, 李振祥, 等. 同步增量调强放疗联合化疗治疗食管鳞癌疗效评估[J]. 中华肿瘤防治杂志, 2021, 28(10): 770-775. |
| [17] |
Li C, Ni WJ, Wang X, et al. A phase Ⅰ/Ⅱ radiation dose escalation trial using simultaneous integrated boost technique with elective nodal irradiation and concurrent chemotherapy for unresectable esophageal Cancer[J]. Radiat Oncol, 2019, 14(1): 48. DOI:10.1186/s13014-019-1249-5 |
| [18] |
Wang X, Chen JQ, Zhang WC, et al. Definitive intensity-modulated radiation therapy with a simultaneous integrated boost may lead to better outcome for non-operated localized esophageal squamous cell carcinoma-analysis from a multicenter study[J]. Int J Radiat Oncol, 2017, 99(2): E197-198. |
| [19] |
Chen DW, Menon H, Verma V, et al. Results of a phase 1/2 trial of chemoradiotherapy with simultaneous integrated boost of radiotherapy dose in unresectable locally advanced esophageal cancer[J]. JAMA Oncol, 2019, 5(11): 1597-1604. |
| [20] |
Welsh JW, Seyedin SN, Allen PK, et al. Local control and toxicity of a simultaneous integrated boost for dose escalation in locally advanced esophageal cancer: interim results from a prospective phase Ⅰ/Ⅱ trial[J]. J Thorac Oncol, 2017, 12(2): 375-382. |
| [21] |
Hulshof MCCM, Geijsen ED, Rozema T, et al. Randomized study on dose escalation in definitive chemoradiation for patients with locally advanced esophageal cancer (ARTDECO study)[J]. J Clin Oncol, 2021, 39(25): 2816-2824. |
| [22] |
Forootan M, Tabatabaeefar M, Mosaffa N, et al. Investigating esophageal stent-placement outcomes in patients with inoperable non-cervical esophageal cancer[J]. J Cancer, 2018, 9(1): 213-218. |
| [23] |
Ma L, Luo GY, Ren YF, et al. Concurrent chemoradiotherapy combined with enteral nutrition support: a radical treatment strategy for esophageal squamous cell carcinoma patients with malignant fistulae[J]. Chin J Cancer, 2017, 36(1): 8. |
| [24] |
So H, Ahn JY, Han S, et al. Efficacy and safety of fully covered self-expanding metal stents for malignant esophageal obstruction[J]. Dig Dis Sci, 2018, 63(1): 234-241. |
| [25] |
唐玲荣, 李光. 食管癌放射治疗中或放射治疗后并发食管穿孔的临床分析[J]. 中国医科大学学报, 2018, 47(5): 439-442. |
| [26] |
王大权, 庞青松, 章文成, 等. 食管癌IMRT食管瘘及出血危险因素分析[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1182-1186. |
| [27] |
杨军, 王亚军. 食管癌放疗后并发食管穿孔的临床治疗研究[J]. 中国继续医学教育, 2016, 8(29): 86-87. |
 2023, Vol. 38
2023, Vol. 38


