文章信息
- 杜静, 李文生, 白旭升, 郭波, 闵智乾, 雷鹏真
- 原发性椎管内滑膜肉瘤一例
- 实用肿瘤杂志, 2021, 36(3): 276-280
-
通信作者
- 李文生, E-mail: liwensheng@sohu.com
-
文章历史
- 收稿日期:2020-01-19
2. 唐都医院烧伤整形科, 陕西 西安 710038;
3. 陕西省人民医院放射科, 陕西 西安 710068;
4. 陕西省人民医院骨科, 陕西 西安 710068
滑膜肉瘤(synovial sarcoma,SS)是一种高度恶性并且少见的软组织肿瘤,发生在椎管内更为少见。多数SS发生在四肢大关节附近,但其组织发生与滑膜并无关系,而且也可发生在人体无滑膜的部位,如心、肺、肾、腹膜和纵隔等。本文报道1例发生在椎管内的SS,其组织学结构较为不典型,经免疫组织化学染色后仍难以作出SS的诊断,最后经荧光原位杂交试验证实存在具有滑膜肉瘤特异性的t(X;18)(pl 1.2;ql 1.2)染色体异位,即18号染色体上的SYT基因与X染色体上的SSX(SSX1、SSX2/SSX4)SYT-SSX基因融合,最终诊断为SS。
1 病例资料患者女性,13岁,于2019年8月20日主诉左下肢疼痛2年并进行性加重1个月余就诊于外院。患者2年前无明显诱因出现左下肢疼痛,未重视,未行检查及治疗。1个月前感左下肢疼痛加重,休息后不能缓解,夜间休息时疼痛明显,影响日常活动及夜休,遂于8 d前至当地县医院诊治,行数字化X线摄影(digital radiography, DR)示,腰椎脊椎侧弯畸形,腹部可见透亮钙化影建议进一步检查。腹部CT检查示,左腹中部肿块,考虑良性肿瘤,神经源性?建议至上级医院进一步明确。遂于5 d前前往西京医院行PET/CT检查示,腰1-2椎体水平脊髓局限性增粗,其内可见点片状钙化影,并沿腰2-3左侧椎间孔向左侧腹膜后生长,于胸11-腰4椎体水平椎体左侧形成巨大团块状混杂密度病变,其内多发斑片状钙化影,并累及腰1-2椎体左侧附件及相应水平腰大肌及竖棘肌,上述病变呈葡萄糖代谢异常增高,多考虑为恶性病变(恶性神经鞘瘤?),胸11-腰4椎体局限性受压、右侧弯,左肾受压、上移,左侧腹部肠管受压、移位。期间未行治疗。2019年9月7日门诊以腰椎管内及腰椎旁、腹腔巨大肿瘤收治入陕西省人民医院,无发热和咳嗽,体格检查示,腰椎向右侧呈侧凸畸形,腰背部以腰2-3棘突为中心压痛、叩击痛,伴左侧腰背部及左下肢放射性疼痛,站立时疼痛加重。胸椎活动受限,左大腿后外侧、小腿外侧、足背和足底浅感觉减退,左下肢肌肉萎缩,股四头肌肌力Ⅳ级,胫前肌力Ⅳ级,足背跖屈和背伸肌力Ⅳ级,侧伸趾伸踇肌力Ⅳ级,侧屈趾屈踇肌力Ⅳ级。双侧膝腱和跟腱反射减弱,左下肢直腿抬高实验阳性,加强实验阳性。腰椎MRI平扫示,腰1-3椎体水平椎管内、椎体旁左侧腹腔内及椎后软组织内巨大占位性病变并邻近骨质破坏(图 1)。于9月12日和9月24日分别行全麻下腰椎管内/腰椎旁/腹腔内巨大肿瘤切除+内固定术以及腰椎管内肿瘤清除术。术中见肿瘤自椎管内向外生长部分位于左侧腰部硬膜外,向腹腔凸出,向上压迫左侧膈肌及肾脏和脾脏器官,向下与腰大肌相连。肿瘤质稍硬,包膜完整,表面血运丰富,与周围组织界限清楚,切面质软。
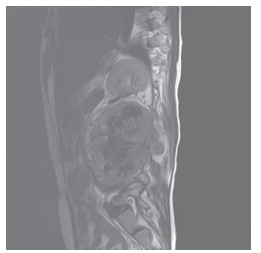
|
| 注 腰1-3椎体水平椎管内和椎体旁左侧腹腔内及椎后软组织内巨大占位性病变并邻近骨质破坏 图 1 2019年9月9日腰椎管巨大肿瘤患者腰椎MRI T1和T2平扫结果 |
病理检查巨检示:(1)(腰椎)灰红灰白不整形组织1堆,体积3 cm×2 cm×0.7 cm;(2)(椎管旁腹腔)灰红色组织1块,体积13 cm×9.5 cm×9 cm,切面灰红灰白、质细,局部钙化,包膜完整(图 2)。镜下:低倍镜下肿瘤细胞以梭形细胞为主,呈片状、束状排列,形态较一致,局部呈浸润性生长,细胞间可见上皮样裂隙结构(图 3A),部分区域呈疏密不均分布(图 3B);密集区梭形细胞丰富、疏松区细胞略少、玻变样间质丰富;局部间质纤维化、玻变,部分区域血管丰富,部分区域见灶状钙化(图 3C)。高倍镜下瘤细胞边界不清、少到中等量的嗜酸性胞质,细胞核呈卵圆形、染色较深,核浆比增高,染色质细腻,部分可见核仁,核分裂象少见(图 3D)。免疫组织化学检查示,CK+,EMA局灶+,Vim部分+,CD34血管+,NSE小灶+,p53少数细胞+,S100部分+,Ki-67指数约20%,β-catenin+;STAT6-,CD99弱+,bcl-2局灶+,SMA-,Desmin-,Caldesmon-,DOG-1-,CD117-,CD56-,HMB45-,Melan-A-,Syn-,NF-(图 4)。术中病理诊断:(腰椎、椎管旁腹腔)梭形细胞肿瘤伴灶状钙化,倾向孤立性纤维性肿瘤(低度恶性),穿通性脊膜瘤(WHO 2级)不能完全除外。
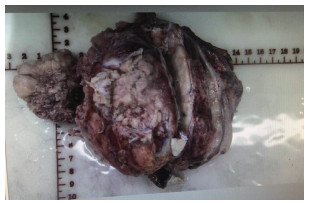
|
| 注 体积13 cm×9.5 cm×9 cm,切面灰红灰白、质细,局部钙化,包膜完整 图 2 患者巨检示椎管旁腹腔灰红色组织1块 |
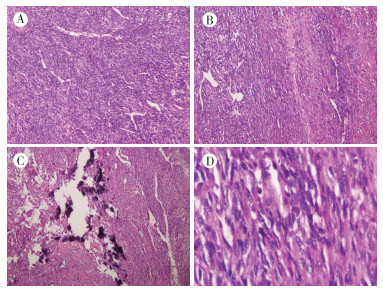
|
| 注 A:肿瘤细胞以梭形细胞为主,呈片状、束状排列,形态较一致,细胞间可见上皮样裂隙结构(HE×40);B:疏密不均区,左侧为肿瘤细胞密集区,右侧为稀疏区(HE×40);C:局部可见灶状钙化(HE×100);D:肿瘤细胞边界不清、少到中等量的嗜酸性胞质,细胞核呈卵圆形、染色较深,核浆比增高,染色质细腻,部分可见核仁、核分裂象少见(HE×200) 图 3 骨膜肉瘤患者术后病理检查结果 |
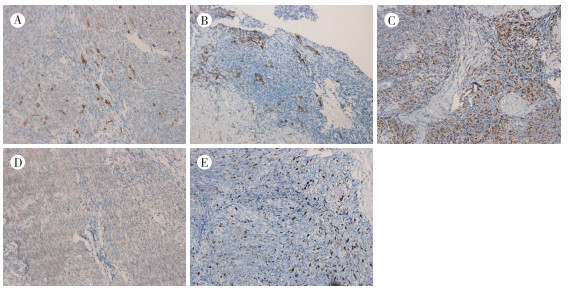
|
| 注 A:CK在部分肿瘤细胞胞质中阳性表达(SP×100);B:局灶EMA阳性表达于肿瘤细胞胞质(SP×100);C:S-100阳性表达于肿瘤细胞胞质(SP×100);D:部分区域CD99弱阳性表达(SP×100);E:Ki-67表达于肿瘤细胞胞核中热点区域约20%(SP×200) 图 4 患者免疫组织化学检查结果 |
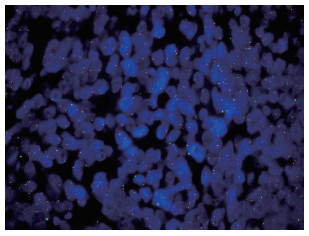
基因检测:使用FISH-SS18基因断裂检测试剂盒检测,计数200个细胞,SS18基因发生断裂细胞个数为65个,正常细胞为135个,断裂比值为32.5%,结果为阳性(图 5)。病理诊断:(椎管内)符合SS。目前针对SS的治疗以扩大手术切除为主,但此病具有易复发和转移的特点,故术后在本院使用新辅助化疗方案多以多柔比星(或表柔比星)联合异环磷酰胺(AⅠ方案)。患者在术后4个月已发生肺部转移,目前在陕西省肿瘤医院接受化疗(具体用药方案不详)。
|
| 图 5 FISH检测SS18基因发生断裂的细胞数目 > 30%(FISH×100) |
SS是一种高度恶性肿瘤,约占软组织肉瘤的7%~10%[1],较为罕见,发生在椎管内的是迄今为止本院首例。SS常见于15~40岁的青年,典型的SS发生在儿童和年轻患者的四肢关节常见膝关节和踝关节周围,少数也可发生在躯干。偶可见发生于胸膜、纵隔、肾脏和腹壁等[2]。临床上多表现为深部软组织内缓慢生长的肿块,可伴有疼痛,肿块较大时可伴局部压迫症状。起病时生长较缓慢,部分病例生长迅速并可成浸润性或破坏性生长。部分病例可伴程度不等的钙化。部分病例易误诊为良性疾病,尤其在病变较小、血肿形成及明显的囊性变时。本病预后不良的因素包括年龄 > 50岁、肿瘤直径 > 5 cm和分化较差。平均5年生存率为30%~50%[2]。
2.2 影像学特征SS的影像学特征无明显特异性。CT检查通常显示 > 5 cm的边界清晰、密度均匀或稍低的实质性团块影,部分病例可伴局灶钙化,增强扫描肿瘤轻度强化。MRI检查常显示边界清晰的肿块,内部信号可能不均[3]。有临床数据表明,在软组织SS中有 > 30%的病例在影像学的X线或CT上表现为局灶性钙化[4-6]。
2.3 病理特征 2.3.1 病理形态严格意义来讲SS并不是滑膜肿瘤,肿瘤细胞可能起源于未知的多潜能干细胞,可向上皮或间叶分化[7],根据SS的病理学形态分型包括梭形细胞性/单相纤维型、双相型和分化差型。梭形细胞性/单相纤维型主要由致密交织条束状、片状或漩涡状排列的梭形细胞组成,肿瘤细胞形态相对一致,核分裂多少不等。间质内胶原化程度不一,可伴黏液变,可伴钙化或骨化,肿瘤内血管可丰富,呈鹿角状,形成血管外皮瘤样结构[8]。双相型由比例不等的上皮样成分和梭形细胞成分混合构成,上皮样成分可呈小巢团状或明显的腺管样和梁状,部分可有乳头形成,梭形细胞成分较明显,部分与上皮样细胞可有移行[9]。分化差型可呈局灶或弥漫性出现在梭形细胞型和双相型中,肿瘤细胞核级高,核分裂像易见[8]。除部分SS可根据临床特征及镜下形态来作诊断外,多数SS的形态学特征并不典型常需免疫组织化学甚或分子病理检查来证实。
2.3.2 免疫组织化学多数SS在作出准确的病理诊断过程中单依靠镜下形态较困难,通常需要使用免疫组织化学的方法来协助诊断。尤其在鉴别诊断中常常需要依靠免疫组织化学。在SS中上皮细胞标志物EMA和CK常见阳性。间叶细胞标志物Vim可与CK和EMA同时表达。TLE1、BCL-2、CD99和calponin通常阳性。部分SS可表达S-100和calretinin。但一般不表达SMA、CD34和TTF1。
2.3.3 分子病理研究表明,> 90%的SS存在特异性的染色体易位t(X;18)(p11.2;q11.2), 导致18号染色体上的SS18(SYT)基因与X染色体上的SSX(SSX1、SSX2/SSX4)发生融合,形成融合性基因SYT-SSX[10]。这种融合基因型特异性存在于SS中,不存在于其他任何肿瘤中。故其对SS的诊断具有特异性,也是目前相关领域公认的金标准。
本例经免疫组织化学结果仍较难作出准确诊断。使用FISH-SS18基因断裂检测试剂盒,采用FISH法进行试验后,选择细胞核边界完整、无重叠和杂交信号清晰的细胞核进行判读,计数 > 200个肿瘤细胞,Ratio值≥30%时判读为阳性,提示SS18基因发生断裂;Ratio值< 10%时判读为阴性,提示SS18基因未发生断裂;Ratio值≥10%但 < 30%时,可再增加计数200个细胞,重新计算,Ratio值≥15%判为阳性,< 15%判为阴性。本例结果SS18基因发生断裂的细胞个数为65个,断裂比值32.5%,SS18基因发生断裂,提示存在SS18-SSX基因融合。通过本例也再次印证SS18融合基因的检测对于辅助SS诊断的重要意义。
2.4 鉴别诊断本例中光学显微镜下形态特点主要为:大量短到中等梭形细胞为主,细胞大小较一致,异型性不大、核分裂少见,局部呈疏密不均分布,部分区域可见血管样裂隙,间质见玻璃样变。以本例为例主要的鉴别诊断如下。
2.4.1 椎管内恶性神经鞘瘤鉴于本病发生在腰椎管内,首先需与椎管内恶性神经鞘瘤鉴别。脊椎及脊椎旁区是恶性神经鞘瘤的好发部位,常见于中老年,少数也可发生于儿童,临床症状以脊髓压迫症状为主,常伴骨质破坏,生长相对迅速,肿块边界往往不清。镜下细胞形态多样,最多见为极丰富的梭形细胞的肿瘤细胞,无明显多形性,但核分裂较常见,核深染而胞质浅染,部分可呈栅栏状或漩涡状排列,血管呈上皮细胞样的内皮细胞。免疫组织化学通常S-100、GFAP、CD57和CD34呈阳性表达。
2.4.2 神经纤维瘤神经纤维瘤是主要以神经鞘细胞和纤维母细胞组成的良性肿瘤,生长较缓慢,但任何年龄和部位均可发病,经常发生在皮肤和皮下组织以及神经走形的部位,大体上可表现为结节状或息肉状,境界较清,部分也可呈侵袭性生长。镜下多数细胞为明显的长形、带波浪状或蛇形的和两端变尖的核,间质可有黏液变性。免疫组织化学S-100、NF、SOX18、CD34和第8因子ⅩⅢ因子阳性表达。
2.4.3 孤立性纤维性肿瘤孤立性纤维性肿瘤最早发现在胸膜后证实也可发生颅内、鼻腔、口腔和眼眶等部位,是一种罕见的无痛性孤立性梭形细胞肿瘤,多表现为良性或交界性生物学行为,生长缓慢,境界清楚,肿块生长较大时可表现为局部脏器的压迫症状[10],镜下富于细胞区和细胞稀少区交替排列、致密的瘢痕样胶原沉积及血管外皮瘤样区域的存在,是其较为重要和特异之处。免疫组织化学肿瘤细胞较特异性表达Vim、CD34、BCL-2、CD99、STAT6和β-catenin[11]。
2.4.4 纤维肉瘤纤维肉瘤可发生于任何年龄,较常见于成年患者,可发生在浅表和深部结缔组织,生长可快可慢,界限较清,可伴出血坏死。分化较好的肿瘤细胞常呈纤维母细胞性,排列成束、彼此交叉呈锐角,网染可证明其含有丰富的环绕每个细胞的网织纤维,也可呈现多形性。免疫标志物Vim、CD34、EMA、S-100和actin可阳性表达。
2.4.5 平滑肌肉瘤平滑肌肉瘤好发于中老年患者,儿童少见,可发生于任何部位,多见四肢,大体上肿瘤一般边界较清,但易发生出血、坏死和囊性变,镜下主要呈束状排列,以钝角彼此交叉。免疫组织化学α-SMA、MSA、desmin和h-caldesmon常为阳性表达。
很多软组织肿瘤形态学特点极不典型,如本例依据形态学较难与孤立性纤维性肿瘤区分,结合免疫组织化学检查后可排除神经纤维瘤及恶性神经鞘瘤、纤维肉瘤及平滑肌肉瘤,但仍较难排除孤立性纤维肿瘤,最终经FISH检测SS18发生断裂,提示SYT-SSX基因融合,诊断为SS。但病理医师仍应牢记任何肿瘤,应当把握形态学是基础,免疫组织化学检查是辅助,基因检测在需要时可以是金标准。
此病例在诊断过程中形态学不典型,局部呈疏密不均的梭形细胞,并伴较丰富的血管,加上冰冻具有一定的局限性,在免疫组织化学检查后,仍不具有明显的特异性,导致误诊。显微镜下组织学形态观察到点状或点状钙化可考虑SS而不是骨肉瘤或脂肪肉瘤。
| [1] |
周小兵, 洪玉蓉, 黄品同. 滑膜肉瘤的二维及彩色多普勒超声特征[J]. 实用肿瘤杂志, 2018, 33(5): 459-462. |
| [2] |
庄荣源, 王毅超, 蒋亚平, 等. 右肘部滑膜肉瘤MDT诊治报道[J]. 实用肿瘤杂志, 2018, 33(3): 193-197. |
| [3] |
谢荣倩, 马鼎, 金开元. 软组织滑膜肉瘤的CT、MRI表现[J]. 中国中西医结合影像学杂志, 2019, 17(3): 303-305. DOI:10.3969/j.issn.1672-0512.2019.03.027 |
| [4] |
谈东风. 滑膜肉瘤[J]. 中国组织化学与细胞化学杂志, 2016, 25(2): 174-178. |
| [5] |
Murphey MD, Gibson MS, Jennings BT, et al. From the archives of the AFIP: Imaging of synovial sarcoma with radiologic-pathologic correlation[J]. Radiographics, 2006, 26(5): 1543-1565. DOI:10.1148/rg.265065084 |
| [6] |
Hisaoka M, Matsuyama A, Shimajiri S, et al. Ossifying synovial sarcoma[J]. Pathol Res Pract, 2009, 205(3): 195-198. |
| [7] |
王坚, 朱雄增. 软组织肿瘤病理学[M]. 1版. 北京: 人民卫生出版社, 2008: 515.
|
| [8] |
刘慧, 唐小万, 陈莉莉. 肺原发性单相纤维型滑膜肉瘤1例及文献复习[J]. 温州医科大学学报, 2017, 47(12): 921-923. DOI:10.3969/j.issn.2095-9400.2017.12.016 |
| [9] |
蒲杨梅, 印隆林, 苟文枭, 等. 滑膜肉瘤MRI征象与病理对照分析[J]. 实用医院临床杂志, 2018, 15(6): 217-221. DOI:10.3969/j.issn.1672-6170.2018.06.068 |
| [10] |
焦彦超, 丁鑫, 杨海斌, 等. 头颈部孤立性纤维性肿瘤的临床病理及治疗(附5例报道)[J]. 实用肿瘤杂志, 2014, 29(4): 345-348. |
| [11] |
Ishii M, Suehara Y, Sano K, et al. Proteomic signatures corresponding to the SS18/SSX fusion gene in synovial sarcoma[J]. Oncotarget, 2018, 9(101): 37509-37519. DOI:10.18632/oncotarget.26493 |
 2021, Vol. 36
2021, Vol. 36


