文章信息
- 赵艳秋
- 从贝伐珠单抗生物类似药IBI305的Ⅲ期临床研究结论看其临床优势
- 实用肿瘤杂志, 2020, 35(4): 313-316
-
作者简介
- 赵艳秋(1965-), 女, 河南郑州人, 主任医师, 硕士, 从事肺癌临床研究.
-
文章历史
- 收稿日期:2020-06-25
贝伐珠单抗是一种抗血管内皮生长因子(vascular endothelial growth factor, VEGF)的单克隆抗体(monoclonal antibody, mAb),可与A型VEGF结合,阻止VEGF与其位于内皮细胞表面的受体(vascular endothelial growth factor receptor, VEGFR)相互作用,通过中和VEGF,从而抑制肿瘤新生血管的形成,进而抑制肿瘤的生长、维持及转移[1],于2004年获得FDA批准用于治疗结直肠癌,之后又被批准用于治疗晚期、转移性或复发性肺癌和乳腺癌等[2],目前已经在120多个国家或地区获得批准用于肿瘤的治疗,2010年在我国获得批准[3],适应证为转移性结直肠癌,2015年又被批准用于晚期非小细胞肺癌(non-small-cell lung cancer, NSCLC)。虽然疗效确切,但其高昂的价格限制了国内患者的可及性。生物类似药的出现则为癌症患者提供了一种可负担的替代治疗方案。IBI305即为贝伐珠单抗生物类似药候选药物, 是信达生物制药公司研制的针对VEGF的重组人源化单克隆抗体,与原研贝伐珠单抗序列一致[4]。
1 IBI305临床前研究IBI305与贝伐珠单抗有相同序列,相同二硫键连接方式,有类似的翻译后修饰。同时,IBI305与贝伐珠单抗有相似高级结构、电荷异质性、纯度和产品相关杂质、蛋白含量和工艺相关杂质[1]。在寡糖分析方面,研究显示,寡糖五糖(oligomannose 5, Man-5)水平通过影响与mAb上Fc区相关的结合活性,进而有可能影响药代动力学[5-6]。虽然IBI305的Man-5含量略高于贝伐珠单抗,但Man-5在IBI305和贝伐珠单抗中含量都 < 1.5%,对半衰期的影响理论上很小,这一点也得到了非临床和临床药代动力学数据的支持[7]。
IBI305与其原研药贝伐珠单抗的相似性评估中,根据各质量属性对临床有效性和安全性的潜在影响,采用风险排序分级(Tier)法进行排序。在这项研究中,Tier 1属性影响临床结果的潜在风险高,当2种产品的均值差异的90% CI在等效性可接受标准内(原研药数据集的±1.5 SD)时,认为相似。Tier 2属性影响临床效果的风险为中等水平,当90%的IBI305数据落在原研药数据集的预定义质量范围内时(±3 SD),认为相似。抗原结合片段(fragment of antigen binding, Fab)介导的生物学特性,经过荧光素酶报告基因细胞测定法以及与VEGF 165结合的酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA),IBI305通过了等级为Tier 1和Tier 2的等效性评估。Fc受体(Fc receptors,FcR)和补体组分1q亚组分(component 1q subcomponent, C1q)结合的分析结果显示,IBI305和贝伐珠单抗在Fc介导的生物学活性方面也相似。此外,稳定性数据支持IBI305与贝伐珠单抗降解趋势相似[1]。
2 IBI305疗效和安全性研究IBI305理化结构和生物功能与贝伐珠单抗体现出高度相似。Ⅰ期临床研究表明,IBI305的药代动力学特征、免疫原性及安全性特征与贝伐珠单抗相似[7]。为证实IBI305作为一线治疗用于晚期或转移性非鳞状NSCLC患者的安全性和有效性,研究者开展了一项以贝伐珠单抗为对照药的随机、双盲、多中心Ⅲ期临床试验[8]。
研究在2016年11月28日至2018年5月23日期间进行,共纳入来自中国42个研究中心的450例组织学和(或)细胞学确诊的无法切除的局部晚期(ⅢB期)、转移性(Ⅳ期)或复发性非鳞状NSCLC患者,并按照1:1的比例随机分配至IBI305组(n=224)和贝伐珠单抗组(n=226),根据年龄(< 60岁或≥60岁)和表皮生长因子受体(epidermal growth factor receptor, EGFR)基因型(野生型或未知型)分层。对于EGFR基因型的纳入标准,多项大型III期研究证实突变型患者获益于以EGFR为靶点的EGFR酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors, EGFR-TKIs)治疗[9-12]。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)[13]、欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)[14]和中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)指南[15]也推荐EGFR-TKIs作为这类患者的一线治疗。这意味着EGFR突变型患者对以EGFR为靶点的治疗模式敏感度更高。本研究若纳入EGFR突变的受试者可能会导致贝伐珠单抗的疗效被高估。因此,研究排除该类患者以提高研究设计的科学性和严谨性。治疗包括联合治疗和单药维持治疗2个阶段。在联合治疗阶段,研究设计为患者接受6个周期联合治疗,用药方案包括:IBI305(15 mg/kg)或贝伐珠单抗(15 mg/kg)静脉给药,与卡铂(血药浓度-时间曲线下面积=6)和紫杉醇(175 mg/m2)静脉给药联用,每3周给药1次。随后在单药维持治疗阶段,患者接受IBI305(7.5 mg/kg)或贝伐珠单抗(7.5 mg/kg)静脉给药治疗,每隔3周给药1次,直至出现以下1种或多种情况:不可耐受的毒性、退出研究、疾病进展、失访或死亡。
主要疗效终点为客观缓解率(objective response rate, ORR),90% CI为0.75~1.33则认为两组临床等效。次要疗效终点为缓解持续时间(duration of response, DOR)、疾病控制率(disease control rate, DCR)、无进展生存期(progression-free survival, PFS)和总生存期(overall survival, OS)。安全性特征通过不良事件(adverse events, AEs)和免疫原性进行比较。药动学和药效学终点为多次给药后的药物稳态浓度和VEGF浓度。
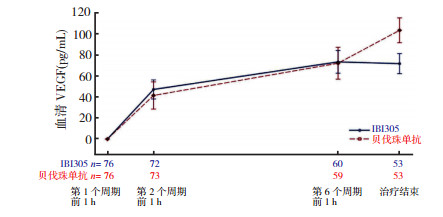
主要疗效终点分析显示,IBI305组和贝伐珠单抗组的ORR分别为44.3%和46.4%,ORR比值为0.95(90% CI:0.803~1.135),在预先设定的等效性界值0.75~1.33范围内。生存获益方面,两组的中位PFS分别为7.6个月和7.8个月,差异无统计学意义(P=0.998 7)。在药代动力学和药效学分析中,IBI305组和贝伐珠单抗组分别有76和75例受试者分析药代动力学数据。在第5周期,两组的最低浓度均值分别为102.21 mg/L和115.75 mg/L。多次给药后,两组的浓度变化趋势一致。两组各有76例受试者分析药效学数据。两组自基线的血浆VEGF浓度变化值相似,表明两组由药物引起的血浆VEGF浓度变化导致的药效学趋势一致(图 1)[8]。安全性分析显示,两组≥3级AEs、严重不良事件(severe adverse events, SAEs)、致死性SAEs及特别关注不良事件(adverse events of special interest, AESIs)发生率相似(P > 0.05)。两组各有2例患者抗药抗体呈阳性(阳性率均为0.2%),且两组患者均未检测到中和抗体。值得注意的是,与以往研究不同,该研究排除了EGFR突变患者,98%的患者EGFR为野生型[8]。因此,该研究结果可能更准确地反映IBI305的实际临床疗效。
根据国家药品监督管理局(national medical products administration, NMPA)药品评审中心《生物类似药研发与评价技术指导原则(试行)》[16]对贝伐珠单抗临床的设计要点,IBI305通过开展药代动力学比对研究和临床安全有效性比对研究,充分证实IBI305与贝伐珠单抗在药代动力学、有效性、安全性和免疫原性上的相似性。基于该临床数据,NMPA已于2019年1月受理IBI305的新药上市申请(New Drug Application, NDA),并将其纳入优先审评[14]。
3 IBI305在肺癌领域的治疗前景肺癌是发病率第1位的肿瘤。NSCLC的治疗方法近年来发生了巨大的变化。除了传统的手术、放疗和化疗外,靶向治疗已经成为NSCLC的重要治疗手段[17]。对于肺癌治疗,贝伐珠单抗作为一种良好的抗血管生成药物,在改善微环境、提升免疫功能方面得到越来越多的研究证实。随着原研药物专利陆续到期,生物类似药的发展有助于减少医药产业总体支出。生物类似药研发及审评标准的侧重点不同于小分子化学仿制药,对生产制备工艺要求较高,需要研发企业具备强大的仪器设备和软件技术支持。生物类似药的出现与发展,不仅顺应医疗保健事业发展,也减轻患者治疗经济负担,提高实现药物足量使用的可能性,有利于保障药物使用规范性和临床疗效稳定性。
另一方面,基于近十余年来对癌症驱动分子及肿瘤免疫环境的研究与新认知,靶向治疗联合免疫治疗、化疗的新型治疗模式也得到广泛应用[18]。长期的临床研究证实,贝伐珠单抗与化疗、靶向治疗、免疫治疗等多元化治疗手段相辅相成,表现出良好的治疗前景,这也间接体现出贝伐珠单抗类似物在临床应用上存在较大的治疗需求,因此IBI305的成功上市势必蕴藏着巨大的治疗潜力。生物类似药的全球发展呈大势所趋,基于Ⅲ期研究所证实的与原研贝伐珠单抗相类似的结果,无疑为IBI305的临床应用提供高质量的循证医学证据,近期IBI305已在我国成功获批上市[19],使其联合化疗更有望作为肺癌患者的标准治疗选择,提高患者生存获益。
总的来说,生物类似药在全球范围内处于一个上升发展阶段,对药品价格控制和患者用药可及性都会得到较大程度改善。今后,随着国内贝伐珠单抗生物类似药IBI305的成功上市,能帮助更多患者用到优质好药,有望降低医疗保健系统的支出,而这也符合临床工作者的治疗初衷。相信在肺癌之外,更多其他疾病领域生物类似药也能有蓬勃发展,为患者带来更多的治疗选择,优化肿瘤治疗的临床决策。
| [1] |
Yu C, Zhang F, Xu G, et al. Analytical similarity of a proposed biosimilar BVZ-BC to bevacizumab[J]. Anal Chem, 2020, 92(4): 3161-3170. |
| [2] |
U.S. Food & Drug Administration. Avastin (bevacizumab) prescribing information[EB/OL].(2016-12)[2020-07-02].https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/125085s317lbl.pdf
|
| [3] |
国家食品药品监督管理局.总局关于公布2015年度药品上市批准情况的公告(2016年第39号)[EB/OL].(2016-02)[2020-07-02]. http://www.nmpa.gov.cn/WS04/CL2138/299814.html.
|
| [4] |
李伟, 李佳, 孙立, 等. IBI305和安维汀临床前安全性相似性评价[J]. 中国新药杂志, 2015, 24(20): 2330-2335. |
| [5] |
Liu L. Antibody glycosylation and its impact on the pharmacokinetics and pharmacodynamics of monoclonal antibodies and Fc-fusion proteins[J]. J Pharm Sci, 2015, 104(6): 1866-1884. DOI:10.1002/jps.24444 |
| [6] |
Wang Y, Fei D, Vanderlaan M, et al. Biological activity of bevacizumab, a humanized anti-VEGF antibody in vitro[J]. Angiogenesis, 2004, 7(4): 335-345. DOI:10.1007/s10456-004-8272-2 |
| [7] |
Zhang H, Zhu X, Wei H, et al. A phase Ⅰ, randomized, double-blinded, single-dose study evaluating the pharmacokinetic equivalence of the biosimilar IBI305 and bevacizumab in healthy male subjectss[J]. Int J Clin Pharmacol Ther, 2019, 57(3): 167-174. DOI:10.5414/CP203349 |
| [8] |
Yang Y, Wu B, Huang L, et al. Biosimilar candidate IBI305 plus paclitaxel/carboplatin for the treatment of non-squamous non-small cell lung cancer[J]. Transl Lung Cancer Res, 2019, 8(6): 989-999. DOI:10.21037/tlcr.2019.12.23 |
| [9] |
Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735-742. DOI:10.1016/S1470-2045(11)70184-X |
| [10] |
Sequist LV, Yang JC, Yamamoto N, et al. Phase Ⅲ study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations[J]. J Clin Oncol, 2013, 31(27): 3327-3334. DOI:10.1200/JCO.2012.44.2806 |
| [11] |
Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6):an open-label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(2): 213-222. DOI:10.1016/S1470-2045(13)70604-1 |
| [12] |
Yang JC, Wu YL, Schuler M, et al. Afatinib versus cisplatin-based chemotherapy for EGFR mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6):analysis of overall survival data from two randomised, phase 3 trials[J]. Lancet Oncol, 2015, 16(2): 141-151. DOI:10.1016/S1470-2045(14)71173-8 |
| [13] |
National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Non-Small Cell Lung Cancer.Version 2.2020[EB/OL]. (2019-12-23)[2020-07-02]. https://www.nccn.org/professionals/physician_gls/default.aspx
|
| [14] |
Planchard D, Popat S, Kerr K, et al. Metastatic non-small cell lung cancer:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(Suppl 4): iv192-237. |
| [15] |
中国临床肿瘤学会.非小细胞肺癌诊疗指南[EB/OL]. (2020-05-23)[2020-07-02]. http://www.csco.org.cn/
|
| [16] |
国家食品药品监督管理总局.生物类似药研发与评价技术指导原则(试行)[EB/OL].(2015-02-28)[2020-07-02]. http://www.nmpa.gov.cn/WS04/CL2138/300003.html
|
| [17] |
王慧, 陆舜. VEGFR抑制剂在晚期NSCLC靶向治疗中的研究进展[J]. 实用肿瘤杂志, 2018, 33(4): 289-296. |
| [18] |
章程燕, 王苹莉. 联合免疫治疗在晚期NSCLC中的疗效现状与前景[J]. 实用肿瘤杂志, 2019, 34(3): 191-197. |
| [19] |
国家食品药品监督管理局.2020年06月19日药品批准证明文件待领取信息发布[EB/OL]. (2020-06-19)[2020-07-02]. http://www.nmpa.gov.cn/WS04/CL2455/378255.html
|
 2020, Vol. 35
2020, Vol. 35