文章信息
- 方美新, 沈笛颖, 宋华, 李思思, 汤永民
- 儿童伯基特淋巴瘤继发性中枢神经系统侵犯一例
- 实用肿瘤杂志, 2022, 37(5): 475-477
基金项目
- 浙江省科技厅项目(2019c03032)
-
通信作者
- 汤永民, E-mail: y_m_tang@zju.edu.cn
-
文章历史
- 收稿日期:2021-07-29
中枢神经系统淋巴瘤(central nervous system lymphoma,CNSL)非常罕见但却致命,在非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)中,病理类型不同,CNSL发病率也不同,其中伯基特淋巴瘤和B淋巴母细胞淋巴瘤发生率最高,均为30%[1]。近几年,CNSL的治疗有显著进展,提高了这种罕见的侵袭性淋巴瘤的生存率,然而,复发是常见的,长期生存率仍然很低。
继发性CNSL(secondary CNSL,SCNSL)的治疗主要是从原发性CNSL(primary CNSL,PCNSL)中获取经验。研究表明,以大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)为基础的全身高强度化疗(high-dose chemotherapy,HDC)作为诱导治疗对于PCNSL是有效的,而且相关的急性和慢性不良反应也是可控的[2]。自体造血干细胞移植(autologous hematopoietic stem cell transplantation,AHSCT)作为巩固治疗在PCNSL中取得了令人鼓舞的结果[3]。虽然HD-MTX为基础的化疗在PCNSL中取得显著疗效,但关于这个方案在儿童SCNSL中的治疗效果的研究几乎没有。
脑脊液微小残留病(minimal residual disease,MRD)的检测对于SCNSL的早期诊断非常重要。目前主要采用流式细胞术(flow cytometry,FCM)对脑脊液MRD进行检测,但受到“免疫漂移”以及技术人员主观因素的影响可能会出现假阴性[4]。近几年,二代基因测序(next generation sequencing,NGS)在精准医疗方面运用越来越广泛[5]。一项回顾性研究分析儿童B细胞急性淋巴细胞白血病(B cell acute lymphoblastic leukemia,B-ALL)诱导前后的骨髓MRD结果发现,NGS的MRD阳性检出率比FCM高[6]。早期诊断和早期治疗对于提高SCNSL患者生存率至关重要。然而,目前关于儿童SCNSL的最佳治疗方案以及检测方法仍不确定。本文通过对1例伯基特淋巴瘤继发性中枢神经系统侵犯的临床分析,探讨SCNSL的最佳治疗方案以及最佳检测方法。
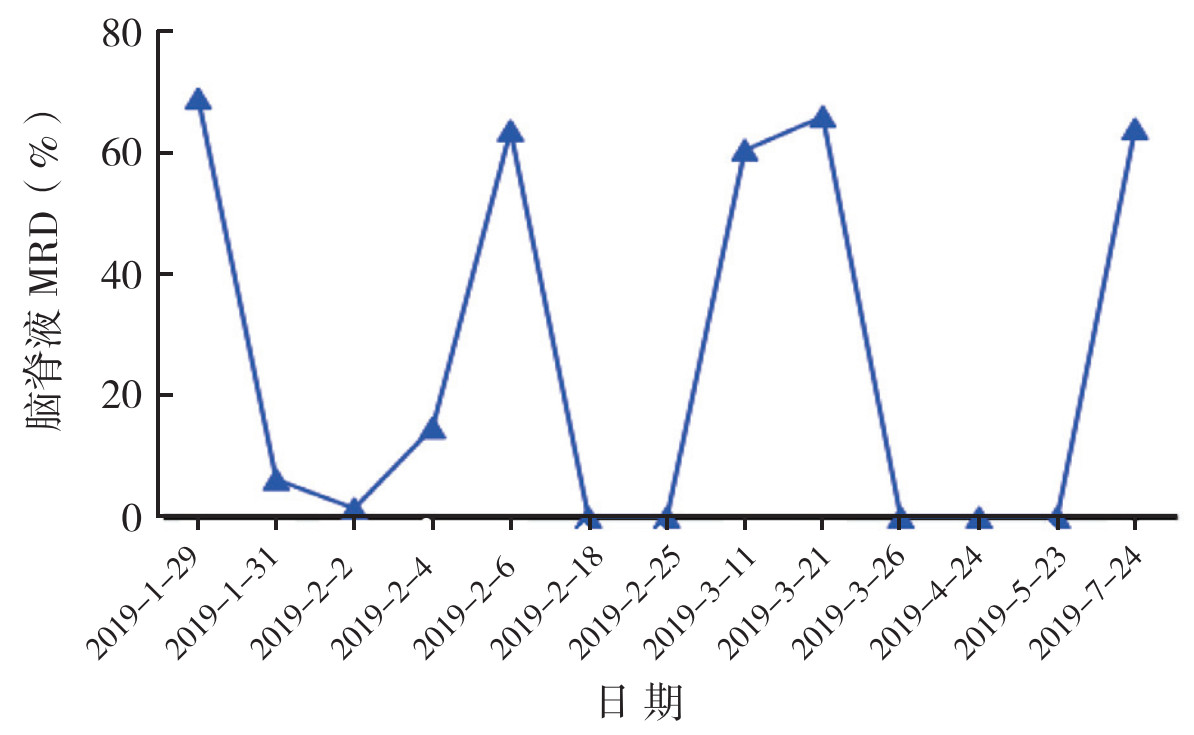
1 病例资料患儿,男性,年龄6岁8个月,于2019年1月初因右颈部包块进行性增大1个月余和下肢疼痛10 d收治本院,经骨髓常规、免疫组织化学、基因测序、染色体以及PET-CT检查确诊为伯基特淋巴瘤(Ⅳ期)。患儿头颅MRI和PET-CT检查均未显示颅内脑实质侵犯。既往无免疫缺陷病毒感染,无器官移植及自身免疫疾病史。首次腰椎穿刺行脑积液常规检测显示脑积液MRD:69%,提示患儿病变累及中枢神经系统,由此确诊SCNSL。已获得患者监护人关于患者治疗的知情同意。
患者从1月29日开始给予甲氨蝶呤(12.5 mg)、阿糖胞苷(30 mg)和地塞米松(5 mg)三联鞘注,隔天1次至2月6日,运用FCM检测脑脊液MRD。经过2次鞘注后,脑脊液MRD从69%(1月29日)下降到1.5%(2月2日),后续2次鞘注后脑脊液MRD(2月4日)开始上升,2月6日脑脊液MRD上升到65%(图 1)。2月7日给予伊达比星静脉滴注,患儿随后2次(2月18日和2月25日)脑脊液MRD得到有效控制。2月25日、3月11日和3月21日予以利妥昔单抗(15 mg)和地塞米松(5 mg) 二联鞘注给药,联合全身静脉滴注利妥昔单抗(375 mg/m2)。3月11日患儿脑脊液MRD再次呈阳性,3月21日比例达到66%(图 1)。3月23日、4月24日和5月23日予以HD-MTX,利妥昔单抗静脉滴注,甲氨蝶呤、阿糖胞苷和地塞米松三联鞘注及联合其他高强度化疗药物, 具体方法:d0,利妥昔单抗静脉滴注;d1:HD-MTX(4 g/m2,4 h内静脉滴注),甲氨蝶呤静脉滴注2 h后给予甲氨蝶呤、阿糖胞苷和地塞米松三联鞘注;d2:静脉输注其他高强度化疗药物(伊达比星10 mg/m2、依托泊苷60 mg/m2、环磷酰胺600 mg/m2、异环磷酰胺1 200 mg/m2和阿糖胞苷1 500 mg/m2);在第1次以HD-MTX为基础的联合其他高强度化疗药物结束后患儿脑脊液MRD(3月26日)转阴性(图 1),后续2次同样的化疗结束后患者脑脊液MRD(4月24日和5月23日)也维持阴性。但由于化疗强度大,骨髓抑制时间过长,患者未能及时进行进一步化疗以及自体造血干细胞移植,4个月后患儿脑脊液MRD再次转阳,5个月后患儿死于脓毒性休克。
|
| 注 1月29日~2月6日隔天1次甲氨蝶呤+阿糖胞苷+地塞米松三联鞘注;2月7日予伊达比星治疗;2月25日、3月11日和3月21日予以利妥昔单抗和地塞米松二联鞘注联合全身利妥昔单抗静脉滴注;3月23日、4月24日和5月23日予以HD-MTX、利妥昔单抗静脉滴注、三联鞘注及联合其他高强度化疗药物;MRD:微小残留病(minimal residual disease) 图 1 流式细胞术检测伯基特淋巴瘤继发性中枢神经系统淋巴瘤患儿各个治疗阶段的脑脊液MRD |
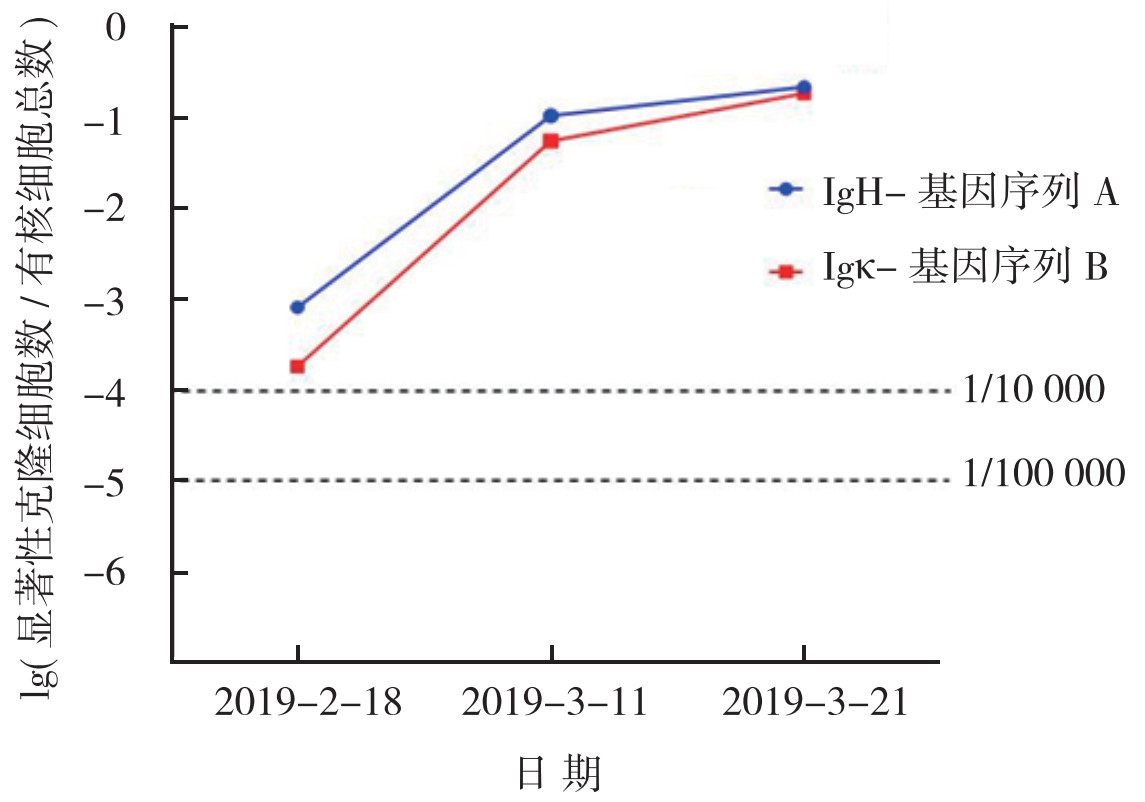
本例患者采用NGS检测脑脊液MRD(图 2)。2月18日,FCM尚无法检测到肿瘤细胞(图 1),而NGS检测到了肿瘤细胞,提示NGS检测方法更敏感。
|
| 注 2月7日予伊达比星治疗;2月25日、3月11日和3月21日予以利妥昔单抗和地塞米松二联鞘注联合全身利妥昔单抗静脉滴注;IgH:免疫球蛋白重链(immunoglobulin heavy chain);Igκ:免疫球蛋白kappa轻链(immunoglobulin kappa light-chain) 图 2 二代基因测序法检测伯基特淋巴瘤继发性中枢神经系统淋巴瘤患儿脑脊液MRD |
脑和软脑膜侵犯是复发性侵袭性NHL最严重的并发症之一。最近的一项回顾性研究显示,在SCNSL的自然史中,中枢神经系统复发往往先于全身复发。诊断为SCNSL的中位生存时间仅为2.2个月,而诊断为非中枢神经系统复发的中位生存时间为9个月[7]。为此,早期诊断和早期治疗对于改善SCNSL预后非常重要。
利妥昔单抗不能通过血-脑脊液屏障,其在预防或减少CNSL进展中的作用还是有争议的。本例报道中利妥昔单抗对于SCNSL并无明显作用。有研究显示,利妥昔单抗不能改善CNSL的预后[8]。而也有学者认为利妥昔单抗可改善CNSL患者的预后[9-10]。利妥昔单抗在CNSL中的作用需要进一步的大规模临床研究去验证。包括利妥昔单抗的剂量、添加时间以及合适的患者群体都需要进一步的研究去阐明。
近几年,以HD-MTX为基础的高强度化疗的诱导治疗已经作为CNSL的一线治疗方案。标准剂量的甲氨蝶呤不能透过血-脑脊液屏障,剂量≥1 g/m2会导致脑部肿瘤的死亡,剂量≥3.5 g/m2在脑脊液中产生杀死肿瘤的水平[11]。本例中,以HD-MTX(4 g/m2)为基础的联合化疗(伊达比星、依托泊苷、环磷酰胺、异环磷酰胺和阿糖胞苷)的诱导治疗对于儿童SCNSL是有效的。Holdhoff等[12]也表明,HD-MTX为基础的联合化疗在CNSL中是最合理的选择。研究表明,10%~15%的CNSL患者对初级诱导化疗有耐药性,即使治疗有效,仍有50%的患者复发[13]。因此,如果CNSL患者对HD-MTX有反应,则应尽快进行AHSCT。HD-MTX为基础的化疗联合AHSCT能够改善CNSL患者的生存率[4]。然而,以HD-MTX为基础的高强度化疗容易导致各种不良反应,特别是神经并发症和血液毒性[14]。本例患者在接受以HD-MTX为基础的诱导化疗3个周期后,脑脊液MRD虽然得到控制,但由于长期处于骨髓抑制状态,无法接受进一步治疗或AHSCT,4个月后患儿中枢神经系统再次复发,5个月后患儿死于脓毒性休克。
本例患儿在脑脊液MRD监测过程中,和FCM比较,NGS具有更高的敏感度。Abbosh等[15]也认为和FCM比较,NGS能够检测出更低水平的MRD。脑脊液MRD的检测在CNSL的整个治疗过程中,至关重要。对于脑脊液MRD未达到预期的患者,需要改变治疗方案,才能进一步改善患儿预后。
总而言之,本例报道提示,以HD-MTX为基础的高强度化疗对于儿童SCNSL是有效的,但是其最佳治疗方案仍未确定。目前仍存在一些问题:包括甲氨蝶呤的最佳剂量、疗程以及自体造血干细胞移植的时机仍需进一步的研究,是今后研究的重点和难点。在脑脊液MRD检测方面,NGS具有更高的敏感度。然而,由于NGS检测费用昂贵,对技术人员要求高,很难广泛运用于临床,只能作为传统方法的补充。今后,随着科研进一步的发展,NGS也将更广泛地运用于临床。
| [1] |
Siegel RL, Miller KD, Goding Sauer A, et al. Colorectal cancer statistics[J]. CA A Cancer J Clin, 2020, 70(3): 145-164. DOI:10.3322/caac.21601 |
| [2] |
Burton EC, Ugiliweneza B, Kolikonda MK, et al. A regional multicenter retrospective analysis of patients with primary central nervous system lymphoma diagnosed from 2000-2012:treatment patterns and clinical outcomes[J]. Cureus, 2017, 9(7): e1512. |
| [3] |
Young PA, Gaut D, Kimaiyo DK, et al. Durable survival outcomes in primary and secondary central nervous system lymphoma after high-dose chemotherapy and autologous stem cell transplantation using a thiotepa, busulfan, and cyclophosphamide conditioning regimen[J]. Clin Lymphoma Myeloma Leuk, 2020, 20(7): 468-479. DOI:10.1016/j.clml.2020.02.009 |
| [4] |
Zeijlemaker W, Gratama JW, Schuurhuis GJ. Tumor heterogeneity makes AML a "moving target" for detection of residual disease[J]. Cytometry B Clin Cytom, 2014, 86(1): 3-14. DOI:10.1002/cytob.21134 |
| [5] |
张林艳, 苏丽萍. 弥漫大B细胞淋巴瘤预后影响因素的研究进展[J]. 实用肿瘤杂志, 2019, 34(5): 473-477. DOI:10.13267/j.cnki.syzlzz.2019.05.018 |
| [6] |
Wood B, Wu D, Crossley B, et al. Measurable residual disease detection by high-throughput sequencing improves risk stratification for pediatric B-ALL[J]. Blood, 2018, 131(12): 1350-1359. DOI:10.1182/blood-2017-09-806521 |
| [7] |
Bernstein SH, Unger JM, Leblanc M, et al. Natural history of CNS relapse in patients with aggressive non-Hodgkin's lymphoma: a 20-year follow-up analysis of SWOG 8516:the Southwest Oncology Group[J]. J Clin Oncol, 2009, 27(1): 114-119. DOI:10.1200/JCO.2008.16.8021 |
| [8] |
Mocikova H, Pytlik R, Sykorova A, et al. Role of rituximab in treatment of patients with primary central nervous system lymphoma: a retrospective analysis of the Czech lymphoma study group registry[J]. Leuk Lymphoma, 2016, 57(12): 2777-2783. DOI:10.3109/10428194.2016.1167203 |
| [9] |
Biccler JL, Savage KJ, Brown PDN, et al. Risk of death, relapse or progression, and loss of life expectancy at different progression-free survival milestones in primary central nervous system lymphoma[J]. Leuk Lymphoma, 2019, 60(10): 2516-2523. DOI:10.1080/10428194.2019.1594219 |
| [10] |
Chen C, Sun P, Cui J, et al. High-dose Methotrexate plus temozolomide with or without rituximab in patients with untreated primary central nervous system lymphoma: a retrospective study from China[J]. Cancer Med, 2019, 8(4): 1359-1367. DOI:10.1002/cam4.1906 |
| [11] |
Lister A, Abrey LE, Sandlund JT. Central nervous system lymphoma[J]. Hematology Am Soc Hematol Educ Program, 2002, 283-296. |
| [12] |
Holdhoff M, Mrugala MM, Grommes C, et al. Challenges in the treatment of newly diagnosed and recurrent primary central nervous system lymphoma[J]. J Natl Compr Canc Netw, 2020, 18(11): 1571-1578. DOI:10.6004/jnccn.2020.7667 |
| [13] |
Grommes C, DeAngelis LM. Primary CNS lymphoma[J]. J Clin Oncol, 2017, 35(21): 2410-2418. DOI:10.1200/JCO.2017.72.7602 |
| [14] |
Hattori K, Sakata-Yanagimoto M, Okoshi Y, et al. A single institutional retrospective evaluation for younger patients with primary central nervous lymphomas on a modified R-MPV regimen followed by radiotherapy and high dose cytarabine[J]. J Clin Exp Hematop, 2017, 57(2): 41-46. DOI:10.3960/jslrt.17012 |
| [15] |
Abbosh C, Birkbak NJ, Swanton C. Early stage NSCLC-challenges to implementing ctDNA-based screening and MRD detection[J]. Nat Rev Clin Oncol, 2018, 15(9): 577-586. DOI:10.1038/s41571-018-0058-3 |
 2022, Vol. 37
2022, Vol. 37


