文章信息
- 黄旻然, 金娇悦, 吴映雪, 徐晨阳, 王金超, 应莉莎, 苏丹
- Huang Minran, Jin Jiaoyue, Wu Yingxue, Xu Chenyang, Wang Jinchao, Ying Lisha, Su Dan
- 吉非替尼耐药的低分化肺癌细胞系的建立及其生物学特征分析
- Establishment and biological characteristics of a gefi tinib-resistant poorly differentiated lung carcinoma cell line
- 实用肿瘤杂志, 2020, 35(2): 127-133
- Journal of Practical Oncology, 2020, 35(2): 127-133
基金项目
- 国家自然科学基金(81972917);浙江省部共建重大项目(WKJ-ZJ-1902-01)
-
作者简介
- 黄旻然(1991-), 男, 浙江杭州人, 硕士生, 从事肿瘤分子分型及靶向治疗相关研究.
-
通信作者
- 苏丹, E-mail:sudan@zjcc.org.cn
-
文章历史
- 收稿日期:2019-12-28
2. 中国科学院肿瘤与基础医学研究所, 中国科学院大学附属肿瘤医院, 浙江省肿瘤医院病理科, 浙江 杭州 310022;
3. 中国科学院肿瘤与基础医学研究所, 浙江 杭州 310022
2. Institute of Cancer and Basic Medicine(ICBM), Chinese Academy of Sciences, Department of Pathology, Cancer Hospital of the University of Chinese Academy of Sciences, Zhejiang Cancer Hospital, Hangzhou 310022, China;
3. Institute of Cancer and Basic Medicine(ICBM), Chinese Academy of Sciences, Hangzhou 310022, China
肺癌是最常见的癌症之一,也是癌症造成死亡的主要原因之一[1],其中非小细胞肺癌(nonsmall-cell lung cancer, NSCLC)约占所有肺癌的85% [2]。根据我国的癌症数据显示,肺癌的发病例数以及病死例数仍在上升[3]。早期肺癌的5年生存率可达到55 %,而晚期肺癌的5年生存率仅为4%左右[4]。NSCLC在其早期阶段(Ⅰ和Ⅱ期)主要通过手术治疗,只有约25%的患者通过化疗和(或)放疗。而多数晚期NSCLC(Ⅲ和Ⅳ期)患者基本行化疗和放疗[5]。随着肺癌分子生物学研究的发展,靶向治疗以及免疫治疗成为NSCLC治疗的重要组成部分,如表皮生长因子受体(epidermal growth factor receptor, EGFR)抑制剂[6]、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene, KRAS)抑制剂和间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)抑制剂等[7]。此外,程序性细胞死亡受体(programmed cell death protein 1, PD-1)及其相关配体(programmed cell death-ligand 1, PD-L1)抑制剂也已经被批准用于治疗某些类型的NSCLC[8-9]。
在肺癌发病机制的研究以及靶向和化学等抗癌药物的研发方面,良好的研究模型具有非常重要的作用。然而目前已建立的肺癌细胞系主要来自西方国家,相关研究和临床结果表明,亚洲人和西方人之间相同肿瘤也存在相当大的差异[10-11],同时,多数细胞系经过数十年的培养通常在遗传学和表型上有所改变。对于发病机制以及药物研发来说具有一定的局限性。而原代细胞可以很好地规避这些问题,原代细胞是直接从组织中分离所得的细胞,就细胞的性状和生物学特性上来看更接近于生理状态,是一种理想的实验模型[12]。因此想要研究亚洲人群的肿瘤发病机制,研发适合我国患者的靶向治疗药物,建立我国患者来源的细胞模型(patient-derived cell, PDC)至关重要。
本研究从1例44岁的中国女性患者中建立低分化NSCLC细胞系ZLC-001,并进行生物学特征分析,这为了解肺癌的发病机制,同时为靶向治疗和化学疗法的抗癌药物研发提供可用的研究模型[13]。
1 材料与方法 1.1 患者信息及临床标本的收集收集1例于2014年8月25日就诊于中国科学院大学附属肿瘤医院的44岁女性肺癌患者,无吸烟史,生存期7个月余(pStage Ⅳ)。肿瘤位于右肺的中下叶,胸腔镜检查胸壁活检显示为低分化肺癌。此外,使用PCR法进行石蜡组织突变检测显示,该突变为EGFR Exon21 T2576G。该患者接受吉西他滨和顺铂的全身化学疗法以及博来霉素的腹膜内化学疗法,但疗效不佳。
患者签署知情同意后,在B型超声引导下行胸腔穿刺引流,收集胸腔积液50 mL。将胸腔积液送到中国科学院大学附属肿瘤医院肿瘤研究所实验室,在室温下30 min内进行原代细胞培养。该项目已获得医院伦理委员会(中国科学院大学附属肿瘤医院)的批准。
1.2 原代细胞培养将胸腔积液以1 000 r/min的速度离心5 min。在超净工作台中,弃去上清液,加入磷酸盐缓冲液(phosphate buffer saline, PBS),再次离心,弃上清液,将沉淀物重悬于含有10%胎牛血清(Gibco公司,美国)、1% MEM非必需氨基酸溶液(Gibco公司,美国)、1%青霉素的10 mL原代细胞培养液中、链霉素(Gibco公司,美国)和78% Dulbecco改良的培养液(DMEM / F12;上海Gibco公司)。然后将悬浮液移入10 cm培养皿中,置于37℃ 5% CO2的培养箱中培养。每周更换2次培养液。当细胞长满后,使用0.25%胰蛋白酶-EDTA溶液(无酚红;北京Solarbio公司)消化以进行传代纯化,使肿瘤细胞纯度>95%。并且将建立的细胞系在培养液中进行连续传代。
1.3 核型分析将原代细胞接种在6孔板中,培养48 h,然后用0.01 mg/mL秋水仙碱(Sigma公司,美国)处理16 h。当M相细胞的比例>50%时,收集细胞。将细胞收集在氯化钾低渗溶液中(杭州化学试剂有限公司)约15 ~ 20 min。在室温下用甲醇/冰醋酸(体积比3:1)固定细胞7 ~ 10 min后,将细胞悬浮液滴到预冷的载玻片上,然后用0.25%胰蛋白酶-EDTA溶液消化30 ~ 60 s,并使用Giemsa染液(Sigma公司,美国)染色8 min。最后,在显微镜下随机选择20个细胞计算每个细胞的染色体数。
1.4 短串联重复序列(short tandem repeats, STR)分析使用QIAamp DNA Mini Kit(Qiagen公司,德国)提取ZLC-001的基因组DNA。使用5'荧光标记STR引物进行PCR扩增基因组DNA,然后对产物进行测序。测序后,将获得的序列与美国模式菌种收集中心(American Type Culture Collection, ATCC)、德国国家菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, DSMZ)和其他细胞库的数据进行比较,以确定其唯一性。
1.5 细胞增殖分析使用CCK-8试剂盒(Dojindo公司,日本)测定细胞活力。将3 000个/孔ZLC-001细胞接种于96孔板中。孵育指定时间(6 h、24 h、48 h、72 h、96 h和120 h)后,将20 μL CCK-8试剂添加到每个孔中,并将板在37℃孵育2.5 h。用酶标仪在450 nm的波长下测量。每个实验重复进行3次。
1.6 菌落形成测定将细胞(每板500、1 500和4 500个细胞)接种到6孔板上,孵育2周后,用PBS洗涤2次,甲醇固定10 min,并用0.1%结晶紫染色15 min,使用PBS洗涤>3次。拍照并计数> 50个细胞的细胞克隆数。
1.7 免疫组织化学免疫组织化学染色采用UltraSensitiveTM SP(小鼠/兔)IHC试剂盒(福建Maxim公司),通过链霉亲和素过氧化物酶(streptavidin-perosidase, S-P)方法进行。其中细胞角蛋白(cytokeratin,CK)、波形蛋白(Vimentin)、Napsin A、钙结合蛋白(calretinin, CR)和D2-40来自于德国DAKO公司,MOC-31和乳腺癌相关蛋白1(breast cancer associated protein 1, BRAP1)来自英国Abcam公司,甲状腺转录因子1(thyroid transcription factor 1, TTF1)来自福建Maxim公司。
细胞爬片制备:将原代细胞接种在无菌玻片上,细胞贴壁24 h后,用PBS缓冲液轻轻冲洗,然后用预冷的丙酮固定约15 min。加入0.5% Triton X-100孵育20 min,50 μL过氧化物酶封闭溶液(试剂A)在室温孵育10 min。
1.8 肿瘤原代细胞三维立体培养法药敏检测技术(collagen gel droplet-embedded culture drug sensitivity test, CD-DST)将细胞悬浮液添加至I型胶原蛋白(Cellmatrix Type CD;Kurabo Industries Ltd., 日本)包被的细胞培养瓶中,培养24 h。用胶原酶消化活细胞,并以1×105细胞/mL的最终密度将其悬浮在重建的I型胶原溶液中。将3滴细胞混合物(30 μL/滴)滴在6孔板中37℃培养约1 h,然后加入培养液培养过夜。将抗癌药加入孔中,培养72 h。然后去除抗癌药,并将细胞转移至无血清培养液(DMEM / F12;上海Gibco公司)中,继续孵育7 d。最后,向每个孔中加入中性红染色液(50 µg/mL),并染色3 h。用4%甲醛缓冲液固定,用PBS洗涤2次并进行图像分析。具体步骤参考文献[14-15]。T / C比(%)用于评估药物敏感性,其中T和C分别是治疗组和对照组的总细胞数。T / C比(%)≤ 50%为高度敏感,>50% ~ 60%为中度敏感,> 60%为耐药。
在CD-DST中测试的抗癌药物为吉非替尼、舒尼替尼、索拉非尼、拉帕替尼和伊马替尼,浓度均为1 µmol/L。
1.9 裸鼠的皮下成瘤和体内转移实验从上海松驰实验动物有限公司购买SPF级BALB/c雄性裸鼠(4周龄,体质量17 ~ 20 g)20只。动物实验得到浙江中医药大学(杭州)机构动物管理和使用委员会的许可。将20只裸鼠分成4组,每组包含5只裸鼠,选择1组皮下接种1×107个细胞,另外3组分别将1×106个细胞注入左心室、颈内动脉和尾静脉。连续观察裸鼠的全身状况、进食和活动以及皮下肿瘤的生长。接种2周后,每3天测量1次肿瘤的体积。记录并根据肿瘤算法计算肿瘤体积:体积=(长度×宽度2)/2[16]。将肿瘤样本石蜡包埋,并通过切片机(Leica Microsystems,Wetzlar,德国)连续切片(4 μm)。用苏木精和酚红(HE)染色后使用iViewer软件(北京联合科技有限公司)观察分析图像。
2 结果 2.1 ZLC-001细胞系的建立成功从该例中国女性患者的胸腔积液中分离建立低分化肺癌细胞系ZLC-001,该细胞系可以在细胞培养液中稳定传代>30代。
2.2 ZLC-001细胞系的形态和核型该细胞系增殖能力强且肿瘤纯度高达>95%。细胞贴壁单层生长,椭圆形或不规则多边形,细胞核大,细胞质丰富(图 1A~1B)。计数20个细胞的细胞系核型分析结果显示,染色体数分布在60 ~ 69,与恶性肿瘤特征相符(图 1C~1D)。
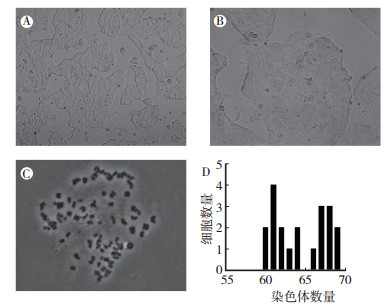
|
| 注 A:光学显微镜下细胞图像(×100);B:光学显微镜下细胞图像(×200);C:细胞染色体核型图(×100);D:细胞染色体计数情况 图 1 ZLC001的细胞形态及核型图 Fig.1 Cell morphology and karyotype of ZLC001 |
对ZLC-001进行20个STR基因座分型分析(表 1)。通过与ATCC、DSMZ和其他细胞保存库的数据进行比较,未发现相同的STR测试结果,提示此细胞系为新的细胞系。
| 标记物 | 等位基因1 | 等位基因2 |
| TH01 | 9 | 9 |
| D12S391 | 17 | 18 |
| D7S820 | 8 | 11 |
| CSF1PO | 10 | 11 |
| FGA | 19 | 25 |
| AMEL | X | X |
| D5S818 | 9 | 12 |
| D2S1338 | 25 | 25 |
| D21S11 | 28.2 | 30 |
| D18S51 | 13 | 13 |
| TPOX | 8 | 8 |
| VWA | 16 | 17 |
| D8S1179 | 14 | 15 |
| D3S1358 | 15 | 17 |
| D13S317 | 8 | 11 |
| D6S1043 | 15 | 15 |
| D16S539 | 12 | 13 |
| PENTAE | 14 | 15 |
| D19S433 | 14 | 15 |
| PENTAD | 9 | 13 |
通过CCK8和细胞克隆评估ZLC-001细胞系的体外增殖情况。ZLC-001的倍增时间约为72 h(图 2A)。克隆形成的结果表明,该细胞系具有形成克隆的能力,并且与接种细胞的密度成正比。细胞密度越高,克隆形成能力越强(图 2B)。
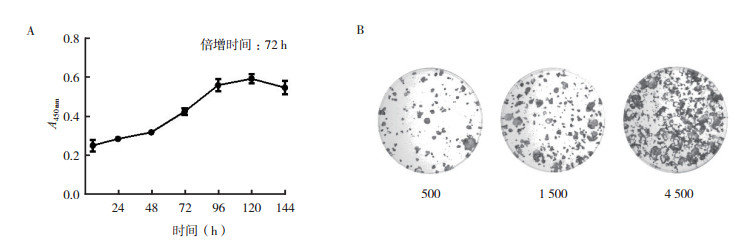
|
| 注 A:通过CCK8试剂盒测量的细胞生长;B:克隆形成,初始细胞数分别为500、1 500和4 500(×10) 图 2 ZLC001的增殖情况 Fig.2 Proliferation of ZLC001 |
通过免疫组织化学方法检测原代细胞系中相关肿瘤标志物的表达。免疫组织化学结果显示,CK及BRAP1为阳性,波形蛋白、Wnt-1和CR个别阳性,Napsin A、MOC-31、TTF1和D2-40均为阴性(图 3)。
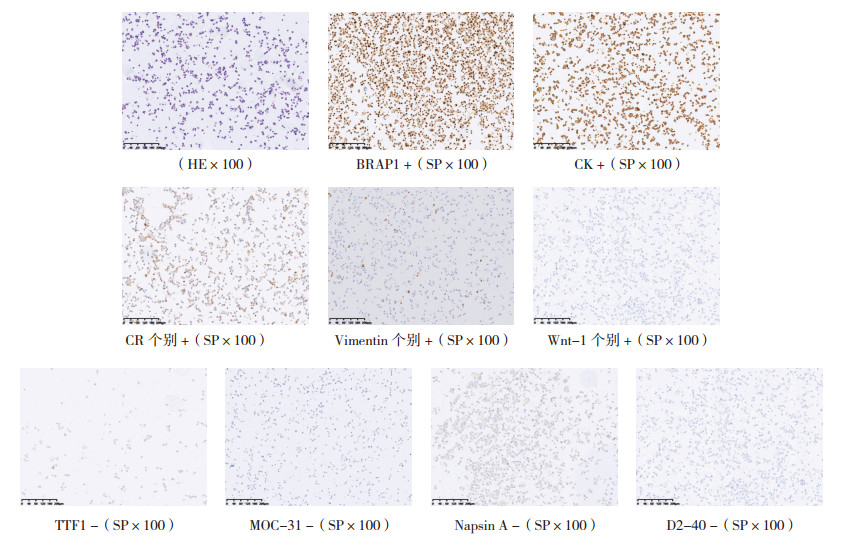
|
| 图 3 ZLC001的HE及免疫组织化学结果 Fig.3 HE and immunohistochemical results of ZLC001 |
同时患者肿瘤组织也进行相关肿瘤标志物的表达检测。免疫组织化学结果显示,CK和波形蛋白表达阳性,Wnt-1部分阳性,Napsin A、CR、TTF1和D2-40均为阴性(图 4)。
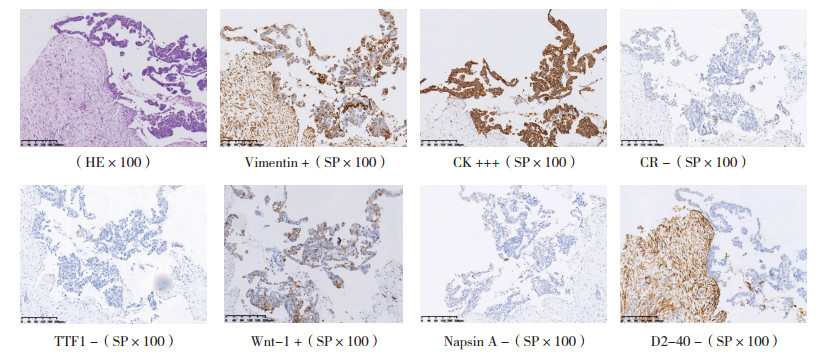
|
| 图 4 患者来源组织的HE及免疫组织化学结果 Fig.4 HE and immunohistochemical results of tissue from patient |
ZLC-001对吉非替尼[T/C=(61.35±4.64)%]、舒尼替尼[T/C=(90.54±4.47)%]、索拉菲尼[T/C= (167.14±15.18)%]和伊马替尼[T/C=(58.66±9.64)%]耐药,但是对拉帕替尼具有中度敏感性[T/C= (115.07±28.83)%]。
2.7 体内致瘤性将原代细胞系接种到裸鼠中后,ZLC-001可以在皮下成瘤(图 5)。接种2周后,裸鼠可触及肿瘤,且肿瘤随着时间增加而增大(图 5B)。但通过注射左心室、颈内动脉和尾静脉未能成功形成肿瘤。
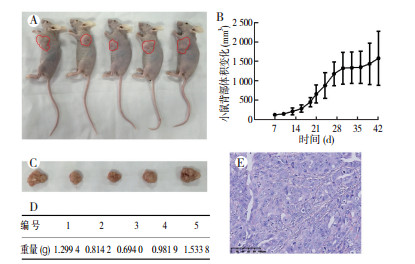
|
| 注 A:原代细胞系建立的动物模型(红圈示小鼠体内肿瘤范围);B:裸鼠肿瘤的体积增长图;C:裸鼠肿瘤;D:肿瘤重量;E:肿瘤组织(HE×400);A与C中从左到右依次编号为1~5 图 5 ZLC-001在裸鼠中的成瘤能力 Fig.5 The tumorigenicity of ZLC-001 in nude mice |
过去10年中,靶向治疗已经取得巨大发展,在肿瘤治疗尤其是晚期NSCLC治疗中发挥越来越重要的作用[17]。如果EGFR出现致敏突变,建议口服表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor, EGFR-TKI)作为一线治疗方案,与铂类化疗比较,治疗效果更好,患者无进展生存时间更长[18-19]。在精确治疗以及开发靶向药物的过程中,合适的细胞模型显得尤为重要[20-21]。根据种族和地区之间的差异,本研究成功从1例中国女性患者的胸腔积液中建立了肺癌细胞系,为研究针对中国患者的药物和肿瘤特征提供可靠的新模型。
使用PCR对该患者病理石蜡块进行测序后发现,该突变为EGFR Exon21 T2576G。然而到目前为止,在DSMZ、ATCG和其他数据库中均未找到此突变。Exon21 T2576G的突变主要引起的氨基酸序列改变为EGFR L859R。该突变是否是引起EGFR-TKI耐药的主要原因以及相关的机制还有待研究。
ZLC-001以及患者的免疫组织化学结果基本相同,这说明本实验建立的ZLC-001与患者的肿瘤组织具有良好的均一性。同时也通过免疫组织化学对肿瘤组织的来源进行鉴别。CK阳性而MOC- 31阴性提示此细胞株肺鳞癌可能性低,TTF-1和Napsin A阴性提示此细胞株肺腺癌可能性低,同时组织Wnt-1部分阳性,细胞株Wnt-1弱阳性,合并BRAP1和D2-40皆阴性说明肿瘤排除间皮瘤倾向于肉瘤。此外,研究表明,TTF1在肺腺癌中的表达与分化程度和组织学类型有关,TTF1缺失的肿瘤分化较差[22]。ZLC-001以及患者肿瘤组织的免疫组织化学结果均提示TTF1为阴性,说明ZLC-001细胞分化程度低,恶性程度高,符合低分化NSCLC的诊断,同时这一结果和患者本身病情进展快只有7个月余的生存期相吻合。
目前,靶向治疗已成为癌症最流行的治疗方法之一。吉非替尼作为EGFR酪氨酸激酶抑制剂广泛用于肺癌治疗。EGFR T790M的突变与吉非替尼耐药有关[23]。但有部分吉非替尼耐药的患者并无此突变。因此,对于吉非替尼耐药的机制仍需进行下一步的研究。本实验所建立的ZLC-001细胞系对吉非替尼、舒尼替尼、索拉非尼和伊马替尼耐药,对拉帕替尼敏感,是进行此类耐药机制研究的体外实验良好工具。
综上所述,本研究建立的ZLC-001人源肺癌细胞系是可用于中国晚期肺癌相关发病机制研究、肺癌检测试剂盒开发和药物开发的理想细胞系模型。同时由于该细胞在体外稳定的增殖能力以及体内的强致瘤性,使其成为具有动物体内实验模型构建基础的良好选择。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
Kimberly D, Chun CL, Angela B, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4): 271-289. DOI:10.3322/caac.21349 |
| [3] |
Wanqing C, Rongshou Z, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
Surveillance Research Program. SEER Stat Fact Sheets: lung and bronchus cancer[EB/OL].(2017-09-01)[2017-09-01]. http://seer.cancer.gov/statfacts/html/lungb.html
|
| [5] |
Hoffman PC, Mauer AM, Vokes EE. Lung cancer[J]. Lancet, 2000, 355(9202): 479-485. DOI:10.1016/S0140-6736(00)82038-3 |
| [6] |
张欣伟, 王勇, 罗辉, 等. 自噬相关蛋白在EGFR-TKI耐药NSCLC患者中的表达及其相关性[J]. 实用肿瘤杂志, 2019, 34(6): 508-512. |
| [7] |
Pirker R. Milestones in the systemic treatment of lung cancer[J]. Memo, 2017, 10(1): 22-26. |
| [8] |
章程燕, 王苹莉. 联合免疫治疗在晚期NSCLC中的疗效现状与前景[J]. 实用肿瘤杂志, 2019, 34(3): 191-197. |
| [9] |
Diggs LP, Hsueh EC. Utility of PD-L1 immunohistochemistry assays for predicting PD-1/PD-L1 inhibitor response[J]. Biomark Res, 2017, 15(5): 12. |
| [10] |
Choi SJ, Lee H, Choe C, et al. Establishment and characterization of a lung cancer cell line, SMC-L001, from a lung adenocarcinoma[J]. In Vitro Cell Dev Biol Anim, 2014, 50(6): 519-526. DOI:10.1007/s11626-014-9736-3 |
| [11] |
Yang J, Li LJ, Wang K, et al. Race differences:modeling the pharmacodynamics of rosuvastatin in Western and Asian hypercholesterolemia patients[J]. Acta Pharmacol Sin, 2011, 32(1): 116-125. DOI:10.1038/aps.2010.169 |
| [12] |
ATCC. Human primary cells[EB/OL]. (2017-09-01)[2017-09-01]. https://www.atcc.org/en/Products/Cells_and_Microorganisms/Human_Primay_Cells.aspx
|
| [13] |
Gazdar AF, Girard L, Lockwood WW, et al. Lung cancer cell lines as tools for biomedical discovery and research[J]. J Natl Cancer Inst, 2010, 102(17): 1310-1321. DOI:10.1093/jnci/djq279 |
| [14] |
Akazawa Y, Higashiyama M, Nishino K, et al. Impact of in vitro chemosensitivity test-guided platinum-based adjuvant chemotherapy on the surgical outcomes of patients with p-stageⅢA non-small cell lung cancer that underwent complete resection[J]. Mol Clin Oncol, 2017, 7(3): 327-335. DOI:10.3892/mco.2017.1340 |
| [15] |
Hou J, Hong Z, Feng F, et al. A novel chemotherapeutic sensitivity-testing system based on collagen gel droplet embedded 3D-culture methods for hepatocellular carcinoma[J]. BMC Cancer, 2017, 17(1): 729. DOI:10.1186/s12885-017-3706-6 |
| [16] |
Gu L, Feng J, Zheng Z, et al. Polyphyllin I inhibits the growth of ovarian cancer cells in nude mice[J]. Oncol Lett, 2016, 12(6): 4969-4974. DOI:10.3892/ol.2016.5348 |
| [17] |
Moreira AL, Eng J. Personalized therapy for lung cancer[J]. Chest, 2014, 146(6): 1649-1657. DOI:10.1378/chest.14-0713 |
| [18] |
Forde PM, Ettinger DS. Targeted therapy for non-smallcell lung cancer:past, present and future[J]. Expert Rev Anticancer Ther, 2013, 13(6): 745-758. DOI:10.1586/era.13.47 |
| [19] |
Cobo M, Gutierrez V, Villatoro R, et al. Spotlight on ramucirumab in the treatment of nonsmall cell lung cancer:design, development, and clinical activity[J]. Lung Cancer (Auckl), 2017, 12(8): 57-66. |
| [20] |
Ku JL, Kim KH, Choi JS, et al. Establishment and characterization of six human lung cancer cell lines:EGFR, p53 gene mutations and expressions of drug sensitivity genes[J]. Cell Oncol (Dordr), 2011, 34(1): 45-54. DOI:10.1007/s13402-010-0004-6 |
| [21] |
Suzawa K, Yamamoto H, Murakami T, et al. Establishment and molecular characterization of cell lines from Japanese patients with malignant pleural mesothelioma[J]. Oncol Lett, 2016, 11(1): 705-712. DOI:10.3892/ol.2015.3955 |
| [22] |
Jerome M, Groussard O, Garcia O, et al. Expression of TTF-1 and cytokeratins in primary and secondary epithelial lung tumours:correlation with histological type and grade[J]. Histopathology, 2004, 45(2): 125-134. DOI:10.1111/j.1365-2559.2004.01893.x |
| [23] |
Kobayashi S, Boggon TJ, DayaramT, et al. EGFR mutatin and resistance of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2005, 352(8): 786-792. DOI:10.1056/NEJMoa044238 |
 2020, Vol. 35
2020, Vol. 35

