文章信息
- 林雪芳, 周建维
- Lin Xuefang, Zhou Jianwei
- miR-513a-5p通过靶向调控PAK1抑制子宫颈癌细胞增殖和侵袭
- Inhibition of proliferation and invasion of cervical cancer cells by miR-513a-5p targeting PAK1
- 实用肿瘤杂志, 2023, 38(1): 17-25
- Journal of Practical Oncology, 2023, 38(1): 17-25
-
通信作者
- 周建维, E-mail: 2195045@zju.edu.cn
-
文章历史
- 收稿日期:2021-09-10
2. 丽水市人民医院妇科, 浙江 丽水 323000
2. Department of Gynecology, Lishui People's Hospital, Lishui 323000, China
子宫颈癌是最常见的妇科恶性肿瘤。近几年来,其发病率呈现年轻化的趋势[1]。该病在发展中国家的发病率较高,并且主要的致病原因包括性活动的早期开始、不经常使用避孕套以及高危型人乳头瘤病毒(human papilloma virus,HPV)感染等[2]。随着子宫颈细胞学筛查的普遍应用,子宫颈癌和癌前病变得以早期发现和治疗,子宫颈癌的发病率和死亡率已有明显下降[3]。目前主要的治疗方法是以手术和放疗为主、化疗为辅的综合治疗方案[3]。多数患者的预后良好,5年生存率较高。然而,部分发生淋巴结转移的患者则预后相对较差[4]。因此,深入探索子宫颈癌的发病机制,发掘新的治疗策略迫在眉睫。
microRNA(miRNA)是一类由内源基因编码的长度约22个核苷酸的非编码单链RNA分子,具有通过抑制mRNA翻译或促进mRNA降解在转录后水平调节基因表达的能力[5]。越来越多的证据表明,miRNA通过与靶基因mRNA的3’-UTR互补序列结合,在调节基因表达水平方面起着重要的中介作用[6]。重要的是,miRNA通过影响细胞增殖、分化、转移和凋亡等广泛的生物活性参与多种恶性肿瘤的发生和进化[7]。例如,miR-590-3p可以通过靶向高迁移率族蛋白2(high mobility group AT-hook 2,HMGA2)在甲状腺乳头状癌细胞的增殖、转移和侵袭中发挥抑癌基因的作用[8]。miR-3934-5p可以靶向抑制β-内酰胺酶(lactamase beta,LACTB)表达促进肝癌细胞增殖[9]。miR-22通过靶向异黏蛋白(metadherin,MTDH)抑制胶质瘤细胞的生长[10]。并且,已经有大量的miRNA在子宫颈癌细胞中被鉴定发挥抑癌或致癌作用。例如,miR-181a通过靶向蛋白激酶C-δ(protein kinase C delta,PRKCD)调节子宫颈癌放疗敏感性[11]。miR-410通过靶向Snail1抑制子宫颈癌细胞的迁移和侵袭[12]。本研究旨在研究特定miRNA在子宫颈癌发生和发展中的作用机制。通过分析高通量基因表达(Gene Expression Omnibus,GEO)数据库数据发现miR-513a-5p在子宫颈癌患者组织中低于其在正常人子宫颈上皮组织中的表达。此外,以往研究表明,miR-513a-5p可以参与多种恶性肿瘤的发生和发展,包括神经胶质瘤[13]、膀胱癌[14]和胃癌[15]等。然而其在子宫颈癌中的调控作用尚未阐明。有研究显示,miR-513a-5p在子宫颈癌细胞中低表达[16]。
miRNA被广泛报道能够通过靶向mRNA发挥作用[17-20]。因此,本研究组想进一步探索miR-513a-5p下游的靶基因。p21活化激酶1(p21-activated kinase 1,PAK1)能够参与调节肿瘤细胞的生物学活动,在癌症中发挥致癌因子的作用。PAK1被证实是一种乳腺癌癌基因,可协调调节多种信号通路,其协同导致恶性转化[21]。PAK1可促进口腔癌细胞的侵袭、迁移和细胞骨架重塑[22]。PAK1对非小细胞肺癌具有促进细胞增殖和侵袭的作用[23]。PAK1在子宫颈癌中也发挥促癌作用[24]。本研究旨在研究miR-513a-5p与PAK1在子宫颈癌细胞增殖和侵袭过程中的作用机制。
1 材料与方法 1.1 细胞培养子宫颈癌细胞株(HT3、C-33A和HeLa)和人子宫颈内膜上皮细胞株(End1/E6E7)购自美国典型培养物保藏中心。将细胞培养于含10%胎牛血清和1%青霉素-链霉素的RPMI-1640培养液中,于37℃含5%CO2的环境下保存细胞。
1.2 细胞转染HT3和C-33A细胞分别转染由上海吉玛制药技术有限公司合成的miR-513a-5p mimics(miR-513a-5p mimics组)以及阴性对照NC mimics(NC mimics组)。转染前1 d胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90%。细胞铺板在0.5 mL含血清的24孔板中,培养于不含抗生素的培养液中。每孔细胞使用50 μL无血清培养液稀释1.25 μL miR-513a-5p mimics(或同等剂量的NC mimics)存储液。每孔细胞使用50 μL无血清培养液稀释1 μL Lipofectamine 3000(Invitrogen,美国)。Lipofectamine 3000稀释后室温5 min内同稀释的RNA混合,室温保温20 min。直接将复合物加入到每孔中,轻轻摇动混匀,加入500 μL培养液,混匀,在37℃含5%CO2的环境中保温48 h。
为了过表达PAK1,将PAK1全长克隆进pcDNA3.1载体中,构建PAK1过表达载体pcDNA3.1-PAK1,pcDNA3.1空载作为阴性对照。在HT3和C-33A细胞中分别转染pcDNA3.1-PAK1和空载pcDNA3.1-NC。
每孔细胞使用50 μL无血清培养液稀释1 μg DNA。每孔细胞使用50 μL DMEM培养液稀释1 μL Lipofectamine 3000试剂。将稀释的Lipofectamine 3000与DNA于5 min内混合,室温保温20 min。将复合物加入每孔中,轻轻摇匀培养板。在37℃含5%CO2的环境中保温48 h。
1.3 实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测基因表达使用TRIzol法提取细胞中总RNA。使用反转录试剂盒(Invitrogen,美国)将其反转录成cDNA。根据操作说明,使用RT-qPCR SYBR Premix Ex TaqTM(TaKaRa,日本)进行操作。最后采用2-ΔΔCt方法分析基因的相对表达。GAPDH或U6作为内参。miR-513a-5p上游引物为5’-CCGAGGGGAGGTGTCAT-3’,下游引物为5’-CTCAACTGGTGTCGTGGA-3’;SS18上游引物为5’-CTCGGGACTTGCCGATAGTG-3’,下游引物为5’-TGTGGGTGGTGCTGGTAAAA-3’;IGF2BP3上游引物为5’-ATCGGAAACCTCAGCGAGAA-3’,下游引物为5’-TATCCAGCACCTCCCACTGT-3’;MTCL1上游引物为5’-GCCCGGATCCTCAACAAGAA-3’,下游引物为5’-GGGCTCTAGGGATGGAGCTA-3’;STRBP上游引物为5’-TGACTGCGTCAGTTAGCGTT-3’,下游引物为5’-CCTTGCACAAGAGATGGGGT-3’;PLK2上游引物为5’-TCACCACCATTCGCACTCG-3’,下游引物为5’-TCACCACCATTCGCACTCG-3’;PRLR上游引物为5’-TCGCGAAACAGCTTTCCACA-3’,下游引物为5’-CATCCTCAGTGTTCGCCTCC-3’;PAK1上游引物为5’-CCTTCCCCCTTGGACTCTCA-3’,下游引物为5’-CCTTCCCCCTTGGACTCTCA-3;TXN2上游引物为5’-CATTGCAGGGAGATGGCTCA-3’,下游引物为5’-ATATTGTCCGGGCTGGGTTG-3’;SOX11上游引物为5’-CGGTCAAGTGCGTGTTTCTG-3’,下游引物为5’-CACTTTGGCGACGTTGTAGC-3’;FAM168B上游引物为5’-GCCTCTTATCGTAGCAGGTC-3’,下游引物为5’-GCCTCTTATCGTAGCAGGTC-3’;KIAA0232上游引物为5’-GTGGACTCTGCCCCTGTAAC-3’,下游引物为5’-GTGGACTCTGCCCCTGTAAC-3’;TMX4上游引物为5’-GCCCTCCTGTGGTTGAATGA-3’,下游引物为5’-GCCCTCCTGTGGTTGAATGA-3’;ILF3上游引物为5’-GAACGTAAAACAGCAGGGGC-3’,下游引物为5’-TTTTGTTGGCATCAAGGGCG-3’;JRKL上游引物为5’-GCAAGAGAGTCTATTTGCCAGC-3’,下游引物为5’-CCGTTTCCCTGACATAGCGA-3’;RAB40C上游引物为5’-TCTACCTCCTGTCCTCAGGC-3’,下游引物为5’-CTGGTAGTTCATGCAGGCCA-3’;SNX27上游引物为5’-CATCCTGGAGGTGAACCACG-3’,下游引物为5’-CATCCTGGAGGTGAACCACG-3’;GAPDH上游引物为5’-TTCTTTTGCGTCGCCAGCC-3’,下游引物为5’-TCCCGTTCTCAGCCTTGACG-3’;U6上游引物为5’-TCCCTTCGGGGACATCCG-3’,下游引物为5’-AATTTTGGACCATTTCTCGATTTGT-3’。
1.4 EdU实验使用EdU标记/检测试剂盒(广州Ribobio)进行EdU实验。细胞接种到96孔板后,将其与EdU标记培养液一同孵育2 h。使用4%多聚甲醛固定细胞,并用0.5% Triton X-100进行处理。DAPI对比染色细胞核。最后使用荧光显微镜对EdU阳性细胞进行观察。
1.5 Transwell实验在transwell小室上室铺设基质胶为细胞侵袭实验做准备。将细胞重悬在无血清培养液中,向transwell上室加入细胞悬液,在下室加入完全培养液。培养24 h后,使用4%多聚甲醛和结晶紫固定并染色细胞。最后使用显微镜观察侵袭的细胞数量。
1.6 荧光素酶实验构建PAK1的野生型和突变型的pmirGLO荧光素酶表达载体,将PAK1-WT和PAK1-Mut与NC mimics和miR-513a-5p mimics共转染到细胞里。采用Lipofectamine 3000试剂转染48 h后,用荧光素酶报告基因检测系统(Promega,美国)检测荧光素酶活性。
1.7 生物信息学预测2020年10月13日采用GEO在线数据库(https://www.ncbi.nlm.nih.gov/gds/)检索4个子宫颈癌患者癌组织样本和4个正常子宫颈组织中表达异常的miRNA。患者年龄范围为46~49岁,平均年龄为46.3岁。采用R语言(The R Programming Language)分析miR-513a-5p在数据集GSE145372中的4个子宫颈癌组织样本和4个正常子宫颈组织样本中的表达差异以及PAK1在数据集GSE63514中的28个子宫颈癌组织样本和24个正常子宫颈组织中的表达差异。采用在线生物信息学分析工具starBase(http://starbase.sysu.edu.cn/index.php)预测可以和miR-513a-5p结合的靶基因。筛选条件如下:CLIP Data为strict stringency(≥5);Three predicted programs为miRmap、PITA和RNA22。筛选出16个可能与miR-513a-3p结合的mRNA。
1.8 统计学分析采用SPSS 20.0软件进行数据分析。所有实验重复≥3次。计量资料采用均数±标准差(x±s)表示,通过GraphPad Prism 7.0进行数据展示。采用t检验比较两组数据,采用方差分析比较多组数据。以P < 0.05为差异具有统计学意义。
2 结果 2.1 miR-513a-5p在子宫颈癌组织和细胞中低表达通过R语言分析GEO数据库GSE145372数据集发现,miR-513a-5p在4个子宫颈癌组织中较4个正常子宫颈组织中低表达(P=0.042,图 1A)。RT-qPCR检测发现,miR-513a-5p在子宫颈癌细胞株HT3、C-33A和HeLa中的表达均低于人子宫颈内膜上皮细胞株End1/E6E7(均P < 0.01,图 1B)。
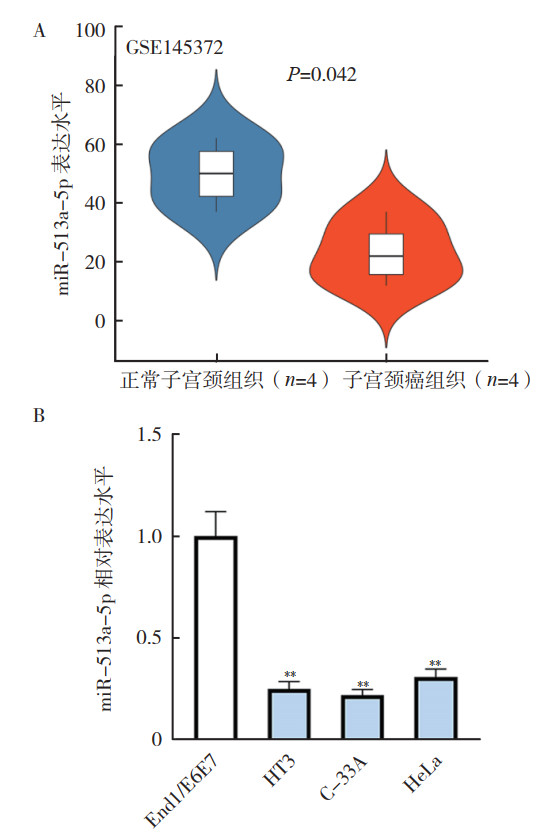
|
| 注 A:GEO数据库GSE145372数据集中miR-513a-5p在子宫颈癌组织和正常子宫颈组织中的表达水平;B:RT-qPCR检测miR-513a-5p在子宫颈癌细胞株和人子宫颈内膜上皮细胞株中的表达水平;**与End1/E6E7比较,P < 0.01 图 1 miR-513a-5p在子宫颈癌组织和细胞中低表达 Fig.1 Low expression of miR-513a-5p in cervical cancer tissues and cells |
在表达最低的2种细胞株HT3和C-33A中分别稳定转染miR-513a-5p mimics来上调miR-513a-5p的表达(miR-513a-5p mimics组),并转染NC mimics作为对照组(NC mimics组)。RT-qPCR结果显示,转染后48 h,2种细胞株中miR-513a-5p mimics组的miR-513a-5p表达水平均较NC mimics组升高(均P < 0.01,图 2)。EdU实验结果显示,转染后48 h,和NC mimics组比较,2种细胞株miR-513a-5p mimics组EdU阳性细胞数量均减少,表明细胞增殖能力均被抑制(均P < 0.01,图 3)。Transwell实验结果显示,转染后48 h,2种细胞株miR-513a-5p mimics组侵袭细胞数量均低于NC mimics组,表明细胞侵袭能力均被抑制(均P < 0.01,图 4)。
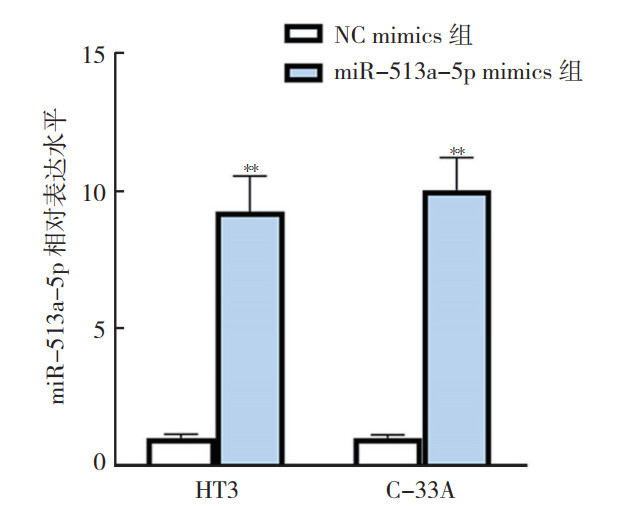
|
| 注 **与同细胞株NC mimics组比较,P < 0.01 图 2 RT-qPCR检测miR-513a-5p mimics在子宫颈癌HT3和C-33A细胞中的转染效率 Fig.2 Transfection efficiency of miR-513a-5p mimics in cervical cancer HT3 and C-33A cells detected by RT-qPCR |
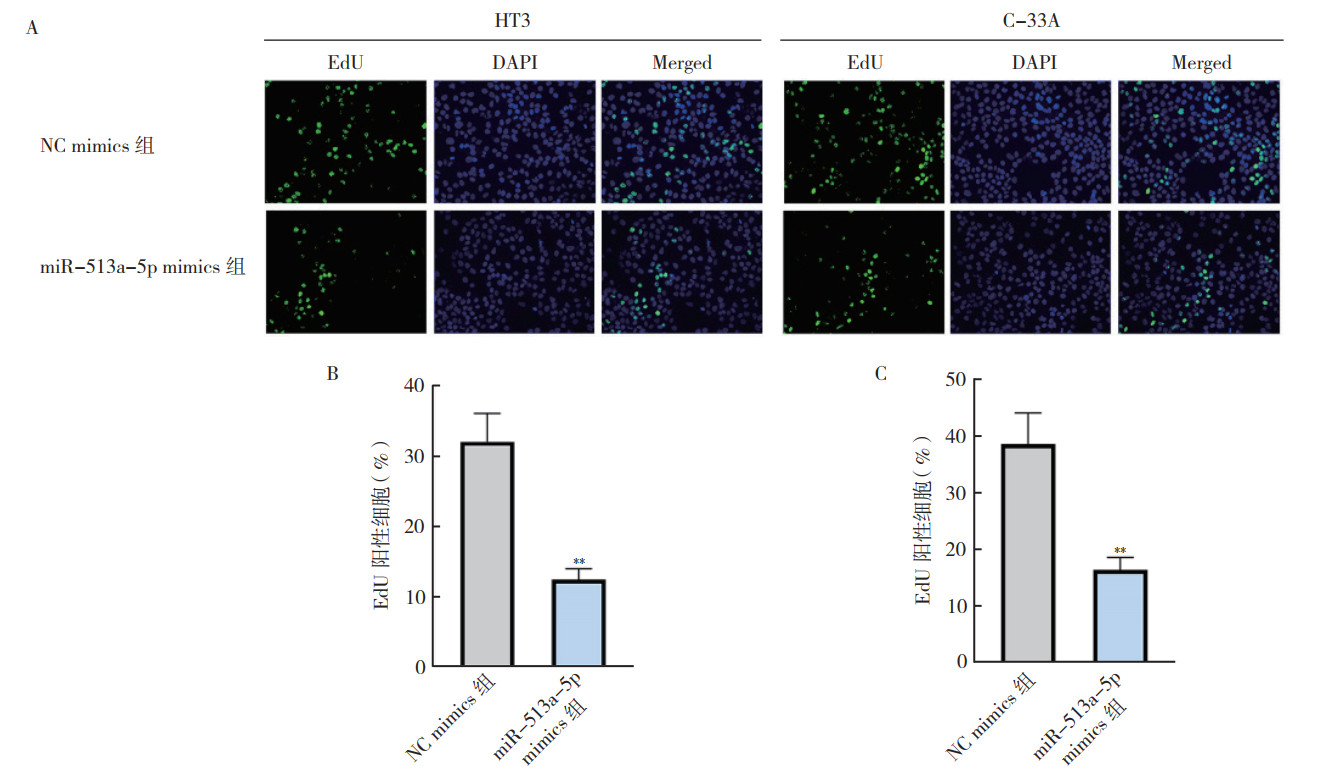
|
| 注 A:EdU实验结果图;B:HT3细胞的EdU实验定量结果;C:C-33A细胞的EdU实验定量结果;**与NC mimics组比较,P < 0.01 图 3 EdU实验检测子宫颈癌HT3和C-33A细胞miR-513a-5p mimics组和NC mimics组细胞增殖能力 Fig.3 Proliferation of cervical cancer HT3 and C-33A cells in the miR-513a-5p mimics group and NC mimic group assessed by EdU assay |
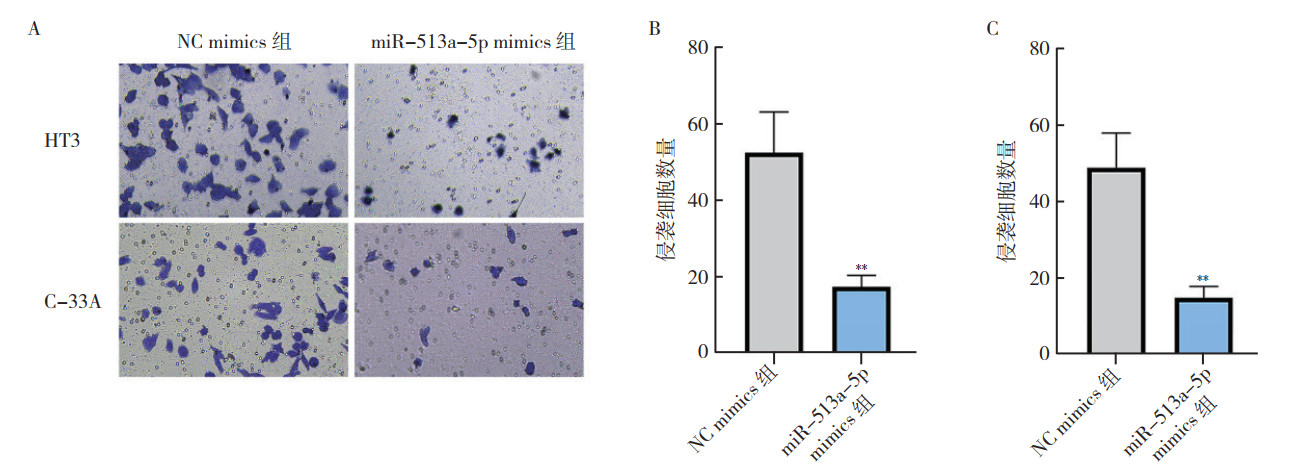
|
| 注 A:Transwell实验结果图;B:HT3细胞的transwell实验定量结果;C:C-33A细胞的transwell实验定量结果;**与NC mimics组比较,P < 0.01 图 4 Transwell实验检测子宫颈癌HT3和C-33A细胞miR-513a-5p mimics组和NC mimics组细胞侵袭能力 Fig.4 Invasion ability of cervical cancer HT3 and C-33A cells in the miR-513a-5p mimics group and NC mimic group detected by transwell assay |
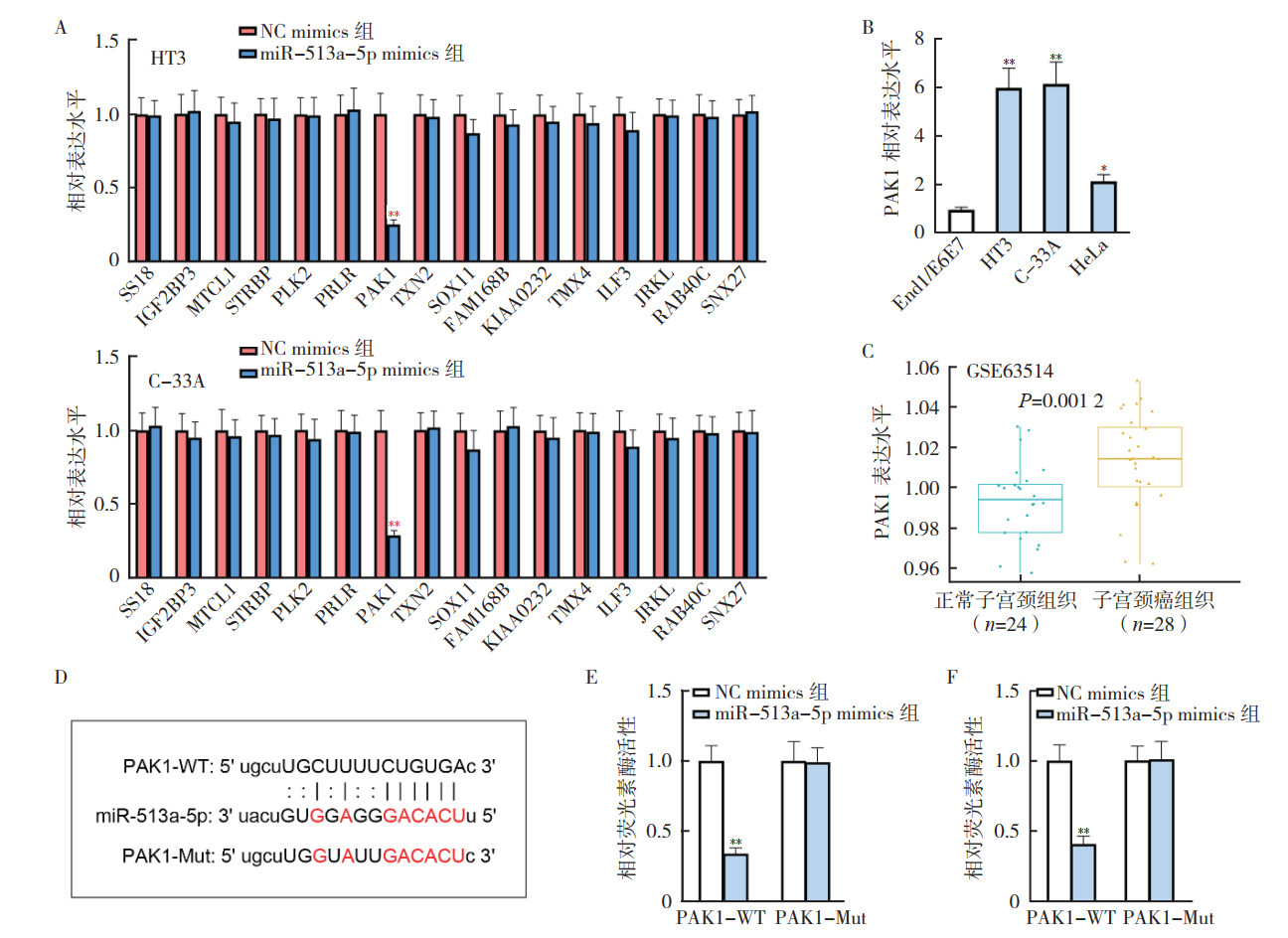
使用在线生物信息学分析工具starBase(http://starbase.sysu.edu.cn/index.php)预测可以和miR-513a-5p结合的靶基因显示(图 5),共有16个靶基因和miR-513a-5p存在结合的可能。过表达miR-513a-5p的HT3和C-33A细胞中分别检测这些潜在靶基因的表达水平显示,和NC mimics组比较,2种细胞的miR-513a-5p mimics组中均只有PAK1靶基因的表达水平被抑制(均P < 0.01,图 6A)。RT-qPCR检测进一步显示,PAK1在子宫颈癌细胞株HT3、C-33A和HeLa中均较人子宫颈内膜上皮细胞株End1/E6E7高表达(均P < 0.05,图 6B)。根据GEO数据集GSE63514数据分析显示,PAK1在子宫颈癌组织中表达高于正常组织(P=0.001 2,图 6C)。因此,本研究选择PAK1进行后续研究。通过starBase数据库获得PAK1 3’UTR的序列中含有与miR-513a-5p互补的核苷酸序列(图 6D)。荧光素酶报告基因检测显示,在HT3和C-33A中过表达miR-513a-5p均使PAK1-WT的荧光素酶活性大幅度下降(均P < 0.01,图 6E~6F),但是突变型的荧光素酶活性几乎没有变化。这些结果证实miR-513a-5p在子宫颈癌细胞中靶向并负调控PAK1。

|
| 图 5 StarBase数据库预测可以和miR-513a-5p结合的靶基因 Fig.5 Starbase database was applied to predict target mRNAs that could bind with miR-513a-5p |
|
| 注 A:RT-qPCR检测16个靶基因在子宫颈癌HT3和C-33A细胞miR-513a-5p mimics组和NC mimics组中的表达情况;B:RT-qPCR检测PAK1在子宫颈癌细胞株和人子宫颈内膜上皮细胞株中的表达水平;C:GEO数据库GSE63514数据集分析PAK1在子宫颈癌组织和正常子宫颈组织中的表达情况;D:StarBase数据库预测PAK1和miR-513a-5p的结合位点;E:荧光素酶实验验证HT3细胞中PAK1和miR-513a-5p的结合情况;F:荧光素酶实验验证C-33A细胞中PAK1和miR-513a-5p的结合情况;A、E和F:**与NC mimics组比较,P < 0.01;B:*与End1/E6E7比较,P < 0.05;B:**与End1/E6E7比较,P < 0.01 图 6 miR-513a-5p在子宫颈癌细胞中靶向调控PAK1 Fig.6 miR-513a-5p targeted and regulated PAK1 in cervical cancer cells |
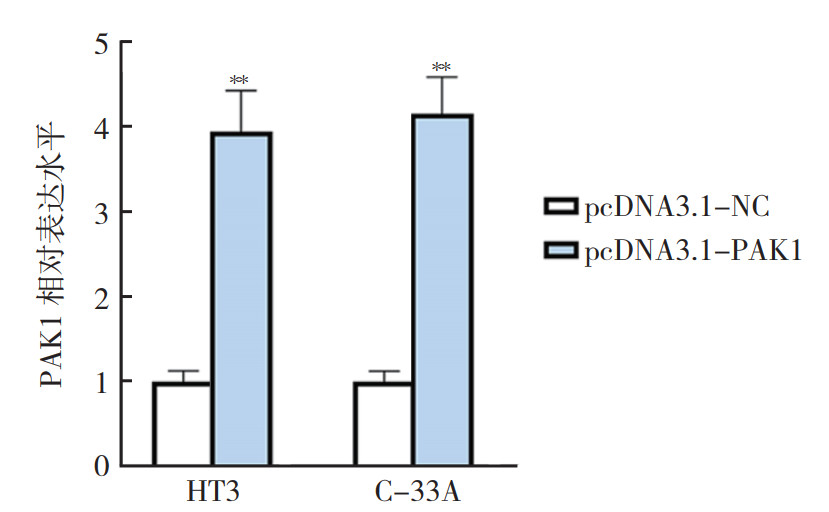
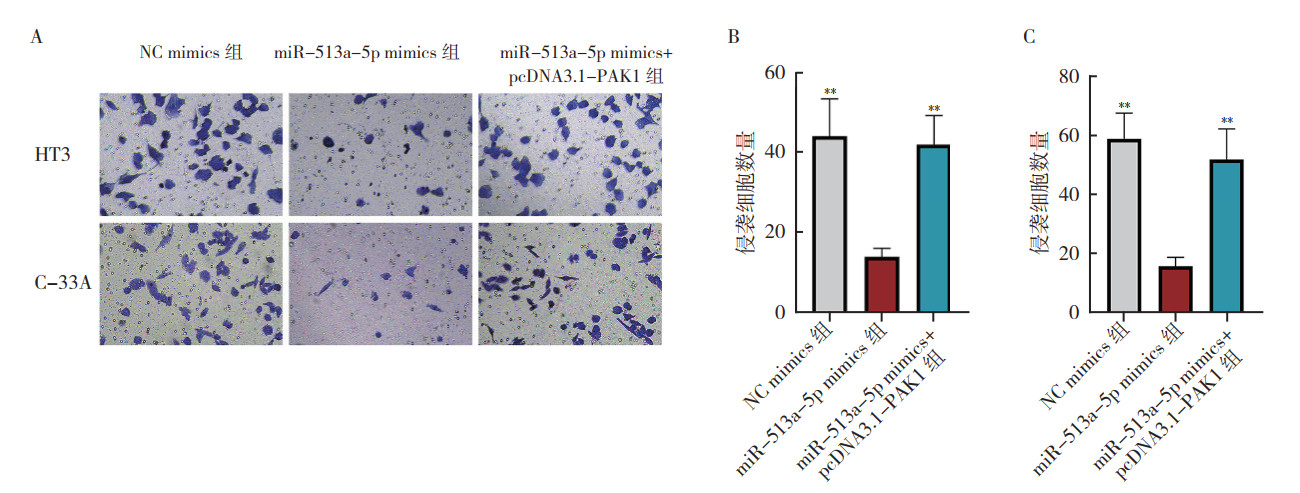
通过向HT3和C-33A细胞转染pcDNA3.1-PAK1可上调PAK1在HT3和C-33A细胞中的表达(均P < 0.01,图 7)。转染后48 h作EdU实验检测发现,与单独转染miR-513a-5p mimics比较,miR-513a-5p mimics和pcDNA3.1-PAK1共转染恢复子宫颈癌HT3和C-33A细胞的增殖能力(均P < 0.01,图 8)。转染后48 h作transwell实验检测发现,与单独转染miR-513a-5p mimics比较,miR-513a-5p mimics和pcDNA3.1-PAK1共转染恢复子宫颈癌HT3和C-33A细胞的侵袭能力(均P < 0.01,图 9)。
|
| 注 **与同细胞株pcDNA3.1-NC比较,P < 0.01 图 7 RT-qPCR检测pcDNA3.1-PAK1在子宫颈癌HT3和C-33A细胞中的转染效率 Fig.7 Transfection efficiency of pcDNA3.1-PAK1 in cervical cancer HT3 and C-33A cells detected by RT-qPCR |

|
| 注 A:EdU实验结果图;B:HT3细胞的EdU实验定量结果;C:C-33A细胞的EdU实验定量结果;**与miR-513a-5p mimics组比较,P < 0.01 图 8 EdU实验检测子宫颈癌HT3和C-33A细胞miR-513a-5p mimics+pcDNA3.1-PAK1组、miR-513a-5p mimics组和NC mimics组的细胞增殖能力 Fig.8 Proliferation of cervical cancer HT3 and C-33A cells in the miR-513a-5p mimics group+pcDNA3.1-PAK1 group, miR-513a-5p mimics group and NC mimics group detected by EdU assay |
|
| 注 A:Transwell实验结果图;B:HT3细胞的transwell实验定量结果;C:C-33A细胞的transwell实验定量结果;**与miR-513a-5p mimics组比较,P < 0.01 图 9 Transwell实验检测子宫颈癌HT3和C-33A细胞miR-513a-5p mimics+pcDNA3.1-PAK1组、miR-513a-5p mimics组和NC mimics组细胞侵袭能力 Fig.9 Invasion of cervical cancer HT3 and C-33A cells in the miR-513a-5p mimics group+pcDNA3.1-PAK1 group, miR-513a-5p mimics group and NC mimics group detected by transwell assay |
由于子宫颈细胞学筛查在世界范围内广泛实施,子宫颈癌的发病率和死亡率正在下降[25]。然而,对于晚期患者来说,目前用于治疗子宫颈癌患者的策略并没有很显著的效果。因此,研究子宫颈癌发生和发展的分子机制具有重要意义。近年来,miRNAs在癌症的靶向治疗中有很大前景[26],因此本研究组着重研究了子宫颈癌中异常表达的miRNAs。miR-513a-5p是一种内源性单链非编码小RNA分子,已被发现能够调节神经胶质瘤[13]、膀胱癌[14]和胃癌[15]等恶性肿瘤的发生和发展。先前的一项研究发现,与邻近正常组织比较,子宫颈癌组织中miR-513a-5p的表达降低[16]。通过GEO数据库数据分析发现,miR-513a-5p在子宫颈癌组织中表达低于其在正常子宫颈上皮组织中的表达。此外,与人子宫颈内膜上皮细胞株比较,子宫颈癌细胞株中的miR-513a-5p表达水平降低。本研究在子宫颈癌细胞株中上调miR-513a-5p的表达并进行功能试验。通过EdU增殖实验和transwell侵袭实验发现,上调miR-513a-5p可以有效抑制子宫颈癌细胞的增殖和侵袭能力。这提示miR-513a-5p在子宫颈癌细胞中充当抑癌因子的角色。
miRNAs被广泛报道能够通过靶向mRNAs发挥作用[17-18]。本研究进一步通过starBase数据库预测PAK1是miR-513a-5p的潜在靶基因。通过GEO数据库分析明确了PAK1在子宫颈癌组织中上调。通过荧光素酶报告实验进一步验证了miR-513a-5p与PAK1结合。之前有大量研究表明,PAK1参与调节肿瘤细胞的生物学活动,在癌症中发挥致癌因子的作用[21-24]。PAK1被证实是一种乳腺癌癌基因,可调节多种信号通路,导致恶性转化[21]。PAK1可以促进口腔癌细胞的侵袭、迁移和细胞骨架重塑[22]。PAK1对非小细胞肺癌具有促进细胞增殖和侵袭的作用[23]。PAK1在子宫颈癌中也发挥着促癌的作用[24],这些研究都支持本研究的结果。本研究证实,PAK1在子宫颈癌细胞中高表达,过表达PAK1可逆转miR-513a-5p对子宫颈癌细胞增殖和侵袭的抑制作用。
总之,本研究证实,miR-513a-5p在子宫颈癌中低表达,并且miR-513a-5p靶向PAK1抑制细胞增殖和侵袭。这些发现可以为子宫颈癌治疗策略的研究提供新的方向。本研究组将在今后的研究中进一步收集子宫颈癌患者血清和组织临床样本,分析miR-513a-5p/PAK1与子宫颈癌的临床相关性。
| [1] |
乔友林, 赵宇倩. 宫颈癌的流行病学现状和预防[J]. 中华妇幼临床医学杂志: 电子版, 2015, 11(2): 1-6. DOI:10.3877/cma.j.issn.1673-5250.2015.02.001 |
| [2] |
Olusola P, Banerjee HN, Philley JV, et al. Human papilloma virus-associated cervical cancer and health disparities[J]. Cells, 2019, 8(6): 622. DOI:10.3390/cells8060622 |
| [3] |
Wuerthner BA, Avila-Wallace M. Cervical cancer: screening, management, and prevention[J]. Nurse Pract, 2016, 41(9): 18-23. DOI:10.1097/01.NPR.0000490390.43604.5f |
| [4] |
Wardak S. Human papillomavirus (HPV) and cervical cancer[J]. Med Dosw Mikrobiol, 2016, 68(1): 73-84. |
| [5] |
Lu TX, Rothenberg ME. microRNA[J]. J Allergy Clin Immunol, 2018, 141(4): 1202-1207. DOI:10.1016/j.jaci.2017.08.034 |
| [6] |
Saliminejad K, Khorram Khorshid HR, Soleymani Fard S, et al. An overview of microRNAs: biology, functions, therapeutics, and analysis methods[J]. J Cell Physiol, 2019, 234(5): 5451-5465. DOI:10.1002/jcp.27486 |
| [7] |
Mishra S, Yadav T, Rani V. Exploring miRNA based approaches in cancer diagnostics and therapeutics[J]. Crit Rev Oncol Hematol, 2016, 98: 12-23. DOI:10.1016/j.critrevonc.2015.10.003 |
| [8] |
童厚超. MiR-590-3p对甲状腺乳头状癌作用机制的初步探究[D]. 南京: 南京医科大学, 2019.
|
| [9] |
鲜瑶, 刘润坤, 莫缓椰, 等. miR-3934-5p靶向抑制β内酰胺酶表达促进肝癌细胞增殖[J]. 第三军医大学学报, 2021, 43(13): 1219-1226. DOI:10.16016/j.1000-5404.202012245 |
| [10] |
李荣国, 王剑, 杨少陵. miR-22通过靶向MTDH抑制胶质瘤细胞的生长[J]. 中国癌症杂志, 2014, 24(6): 401-405. DOI:10.3969/j.issn.1007-3969.2014.06.001 |
| [11] |
柯桂好. MiR-181a通过靶向PRKCD调节宫颈癌放疗敏感性[D]. 上海: 复旦大学, 2011.
|
| [12] |
褚冬梅, 赵振钏, 刘荣霞, 等. miR-410通过靶向Snail1抑制宫颈癌细胞的迁移和侵袭[J]. 免疫学杂志, 2020, 36(6): 510-515. |
| [13] |
Chen KC, Chen PH, Ho KH, et al. IGF-1-enhanced miR-513a-5p signaling desensitizes glioma cells to temozolomide by targeting the NEDD4L-inhibited Wnt/β-catenin pathway[J]. PLoS One, 2019, 14(12): e0225913. DOI:10.1371/journal.pone.0225913 |
| [14] |
Xia W, Chen C, Zhang MR, et al. LncRNA PCAT6 aggravates the progression of bladder cancer cells by targeting miR-513a-5p[J]. Eur Rev Med Pharmacol Sci, 2020, 24(19): 9908-9914. |
| [15] |
Lu MD, Liu D, Li YX. LINC01436 promotes the progression of gastric cancer via regulating miR-513a-5p/APE1 axis[J]. Onco Targets Ther, 2020, 13: 10607-10619. DOI:10.2147/OTT.S257747 |
| [16] |
Shishodia G, Verma G, Das BC, et al. miRNA as viral transcription tuners in HPV-mediated cervical carcinogenesis[J]. Front Biosci (Schol Ed), 2018, 10(1): 21-47. DOI:10.2741/s499 |
| [17] |
文彩艳, 李晓霞. miR-34a通过靶向ATG7调节结直肠癌细胞自噬与增殖[J]. 实用肿瘤杂志, 2022, 37(4): 299-306. |
| [18] |
杨清, 杨海松, 张世泳, 等. miRNA-27a在人乳腺癌MCF-7/ADR细胞株中的表达及其对细胞耐药的影响[J]. 实用肿瘤杂志, 2021, 36(1): 28-32. |
| [19] |
Wang Y, Li CF, Sun LB, et al. microRNA-4270-5p inhibits cancer cell proliferation and metastasis in hepatocellular carcinoma by targeting SATB2[J]. Hum Cell, 2020, 33(4): 1155-1164. |
| [20] |
Sur S, Steele R, Shi XY, et al. miRNA-29b inhibits prostate tumor growth and induces apoptosis by increasing BIM expression[J]. Cells, 2019, 8(11): E1455. |
| [21] |
Shrestha Y, Schafer EJ, Boehm JS, et al. PAK1 is a breast cancer oncogene that coordinately activates MAPK and MET signaling[J]. Oncogene, 2012, 31(29): 3397-3408. |
| [22] |
Parvathy M, Sreeja S, Kumar R, et al. Potential role of p21 Activated Kinase 1(PAK1) in the invasion and motility of oral cancer cells[J]. BMC Cancer, 2016, 16(1_suppl): 293. |
| [23] |
Yang GX, Zhang XM, Shi JK. miR-98 inhibits cell proliferation and invasion of non-small cell carcinoma lung cancer by targeting PAK1[J]. Int J Clin Exp Med, 2015, 8(11): 20135-20145. |
| [24] |
Chen R, Zhang L. miR-29a inhibits cell proliferation and migration by targeting the CDC42/PAK1 signaling pathway in cervical cancer[J]. Anticancer Drugs, 2019, 30(6): 579-587. |
| [25] |
Tsikouras P, Zervoudis S, Manav B, et al. Cervical cancer: screening, diagnosis and staging[J]. J BUON, 2016, 21(2): 320-325. |
| [26] |
Laengsri V, Kerdpin U, Plabplueng C, et al. Cervical cancer markers: epigenetics and microRNAs[J]. Lab Med, 2018, 49(2): 97-111. |
 2023, Vol. 38
2023, Vol. 38


