文章信息
- 唐晓爽, 尹华春, 李松, 杨辉
- Tang Xiaoshuang, Yin Huachun, Li Song, Yang Hui
- Pannexin-1在垂体腺瘤中的表达及意义
- Expression and roles of Pannexin-1 in pituitary adenoma
- 实用肿瘤杂志, 2021, 36(4): 330-335
- Journal of Practical Oncology, 2021, 36(4): 330-335
基金项目
- 重庆市自然科学基金(cstc2019jcyj-msxmX0475)
-
通信作者
- 李松, E-mail: tangapply0225@163.com
-
文章历史
- 收稿日期:2020-12-07
Pannexin-1是一种存在于细胞膜上的大孔膜通道[1],具有独特的传导特性,从非选择性离子渗透性到信号分子的胞外释放都有所作用,可以影响胶质瘤细胞、黑色素瘤细胞、乳腺癌细胞和神经干细胞等细胞的侵袭和迁移能力[2-5]。垂体瘤的侵袭性是否与Pannexin-1相关以及其在垂体瘤中的表达如何尚不明确。本研究运用生物信息学分析、免疫组织化学和反转录-定量PCR(reverse transcription-quantitative PCR, RT-qPCR)技术,检测不同亚型垂体腺瘤中Pannexin-1基因的表达,分析其表达与患者血清激素水平和Ki-67指数的关系,进而探讨Pannexin-1在垂体腺瘤发病机制中的作用。
1 资料与方法 1.1 标本取材4例正常垂体(normal pituitary,NP)组织RNA购买自日本Takara公司,男性2例,女性2例;年龄36~54岁,平均年龄44岁。56例垂体腺瘤标本均取自陆军军医大学第二附属医院神经外科2017年9月至2020年12月手术切除的垂体瘤组织。年龄22~76岁,平均年龄45.1岁;男性32例,女性24例。肿瘤体积最小为0.4 cm×0.2 cm×0.3 cm,最大为5.9 cm×6.3cm×5.5 cm,平均37.9 cm3。手术均采用经鼻蝶鞍区肿瘤切除术,术后常规送检鞍底硬膜。手术时取所需的肿瘤组织,一部分组织置入多聚甲醛液内固定,另一部分肿瘤组织用生理盐水洗净后,迅速置于液氮中速冻,随后放置于-80℃冻存备用。
1.2 分组56例垂体腺瘤均经病理证实,按术后病理检查结果、术前激素水平及临床表现将标本分为3组:无功能垂体腺瘤(nonfunctional pituitary adenoma, NFPA)组28例、生长激素腺瘤(growth hormone pituitary adenoma,GH-PA)组16例和催乳素腺瘤(prolactin pituitary adenoma,PRL-PA)组12例。
根据Ki-67指数,将所有标本分为高增殖指数组(Ki-67≥3%)30例和低增殖指数组(Ki-67 < 3%)26例。
依据鞍底硬膜病检结果和影像学资料,按照Knosp分级将56例垂体腺瘤的侵袭程度分为4级:KnospⅠ级,肿瘤超过C2-C4血管管径的内切连线,但没有超过C2-C4血管管径的中心连线,海绵窦内侧部静脉丛消失;KnospⅡ级,肿瘤超过C2-C4血管管径的中心连线,但没有超过C2-C4血管管径的外切连线,可致海绵窦上部或下部静脉丛消失;Knosp Ⅲ级,海绵窦段颈内动脉被完全包裹,导致内径狭窄,各部静脉丛消失,海绵窦的上壁和外壁呈球形向外扩展突出;Knosp Ⅳ级,海绵窦段颈内动脉被完全包裹,导致内径狭窄,各部静脉丛消失,海绵窦的上壁和外壁呈球形向外扩展突出。KnospⅠ级和KnospⅡ级为非侵袭性垂体腺瘤。KnospⅢ级和KnospⅣ级为侵袭性垂体腺瘤。56例垂体腺瘤中,KnospⅠ级15例,KnospⅡ级13例,KnospⅢ级13例,KnospⅣ级15例。NFPA组中侵袭性和非侵袭性各14例。GH-PA组中侵袭性和非侵袭性各8例。PRL-PA组中侵袭性和非侵袭性各6例。
1.3 生物信息学分析本文使用的芯片数据均来自Gene Expression Omnibus(GEO)数据库,详细信息见表 1。对于原始的芯片数据集,Affymetrix平台的数据集采用robust multiarray average法进行归一化处理[6],而Agilent和Illumina平台的数据集则采用量化归一化处理后进行log2转换[7-8],值得注意的是,在log2转换前,将负值替换为基因表达矩阵中最小的正值。通过使用GEO的阵列探针-基因注释文件,将微阵列特异性探针标识符解析为基因Entrez ID,然后根据Entrez ID计算出重复基因中的平均表达值。为了结合这些来自不同来源的数据集,笔者提取本研究中使用的所有微阵列平台的共同基因。基于共同基因,将多个归一化数据集按基因Entrez ID合并成1个大数据集。然后,使用svm R包中的combat算法来消除批次效应[9],统计出Pannexin-1在垂体腺瘤各亚型的表达情况。
| 组别 | 垂体瘤亚型 | 样本量(例) | 平台 |
| GSE72490 | ACTH-PA | 12 | GPL5175 Affymetrix |
| GSE46311 | GH-PA | 16 | GPL6244 Affymetrix |
| GSE51618 | NFPA | 10 | GPL6480 Agilent |
| GSE36314 | PRL-PA vs NP | 4 vs 3 | GPL8300 Affymetrix |
| GSE26966 | NFPA vs NP | 14 vs 9 | GPL570 Affymetrix |
| GSE119063 | PRL-PA vs NP | 5 vs 4 | GPL13607 Agilent |
| GSE62866 | GH-PA vs NFPA | 9 vs 9 | GPL6480 Agilent |
| GSE63357 | GH-PA vs NFPA vs NP | 13 vs 7 vs 5 | GPL570 Affymetrix |
| 注 ACTH-PA:促肾上腺皮质激素腺瘤(adrenocorticotropic hormone pituitary adenoma);GH-PA:生长激素腺瘤(growth hormone pituitary adenoma);NFPA:无功能垂体腺瘤(nonfunctional pituitary adenoma);NP:正常垂体(normal pituitary);PRL-PA:催乳素腺瘤(prolactin pituitary adenoma) | |||
单克隆一抗包括兔抗人Pannexin-1 IgG(英国Abcam公司)和生物素标记山羊抗兔IgG(北京中杉金桥生物技术有限公司)。将肿瘤组织用多聚甲醛固定,石蜡包埋,随后切片,厚度6 mm,采用免疫组织化学链酶亲和素-生物素复合物(strept-avidin-biotin complex, SABC)法,进行实验操作。依试剂盒中提供的对照分为4个等级(+++、++、+和-)。每张切片在高倍镜下随机选取5个不重复视野,应用Image Pro Plus 6.0进行免疫染色强度分析。挑选出免疫组织化学结果图片中的黄褐色区域,将此区域定义为area of interest(AOI),以待测图片中“黄褐色”(不分颜色强度)来反映相应蛋白表达的量,由软件计算出累计吸光度(absorbance,A)值用以代表蛋白表达。
1.5 RT-qPCR总RNA的提取:切取适当大小的垂体腺瘤标本放入研磨管中,加入1 mL Trizol试剂和2颗研磨珠,用高速匀浆机充分研磨,室温静置5 min,速度15 000 rpm,4℃离心5 min,转移上清液至新1.5 mL无酶离心管中,加入200 μL氯仿,振荡混匀后静置5 min,速度8 000 rpm,4℃离心15 min,再次转移上清液至新离心管中,加入与上清液等体积的异丙醇,室温静置10 min,8 000 rpm,4℃离心10 min,倒弃上清,向沉淀中加入1 mL预冷的75%乙醇,8 000 rpm,4℃离心5 min,弃上清保留沉淀,室温干燥后加入50 μL无酶水。
模板cDNA的合成:使用武汉AG公司的PrimeScript RT Reagent kit反转录试剂盒,总RNA 1 μg加入寡聚dT 1 μL,无酶水18 μL,在65℃条件下预变性5 min,然后在冰浴中加入5×缓冲液4 μL,10×三磷酸脱氧核苷2 μL,RNasin 20 U、反转录酶10 U(湖南艾科瑞生物工程有限公司),反应体系为20 μL,42℃1 h,98℃5 min,4℃5 min,反转录产物置于4℃保存。
目的基因的扩增:以管家基因——磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,用RT-qPCR法扩增目的基因。GAPDH上游引物:5'-TGCCACTCAGAAGAAGACTGTGG-3',下游引物:5'-TTCAGCTCTGGGATGACCTT-3';人Pannexin-1基因上游引物:5'-CTTCGCTCAGGAGATCTCCA-3',下游引物:5'-GGTTTCCAGACTCACTCTGC-3'。PCR反应条件:95℃预变性2 min,95℃变性2 min,55℃退火1 min,72℃延伸1min,共进行39个循环,最后72℃终末延伸10 min。
1.6 统计学分析RT-qPCR结果分析应用美国Bio-Rad公司的CFX manager软件获取结果,应用2-△△Ct法计算Pannexin-1 mRNA的相对表达量。应用SPSS13.0软件包进行数据分析。数据采用均数±标准差(x±s)表示,两组间比较采用t检验,多组间差异用方差分析,采用回归分析方法作相关性分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 GEO数据库分析Pannexin-1在垂体腺瘤各亚型中的表达为了探究Pannexin-1基因在不同垂体瘤中的表达情况,对GEO数据库中芯片数据进行原始数据的下载和整合。利用svm包对8组芯片数据进行标准化,之后为了使表达水平的基准一致,对整合数据进行批次效应移除,对比批次效应移除前后的箱式图,发现数据标准化和批次效应的移除有效减少各组芯片数据的批次误差(图 1A)。整合数据发现,Pannexin-1在促肾上腺皮质激素腺瘤(adrenocorticotropic hormone pituitary adenoma,ACTH-PA)、GH-PA、PRL-PA、NFPA以及NP中均表达,且相较于NP组,其在各亚型垂体腺瘤中的表达均相对较高(均P < 0.05,图 1B)。
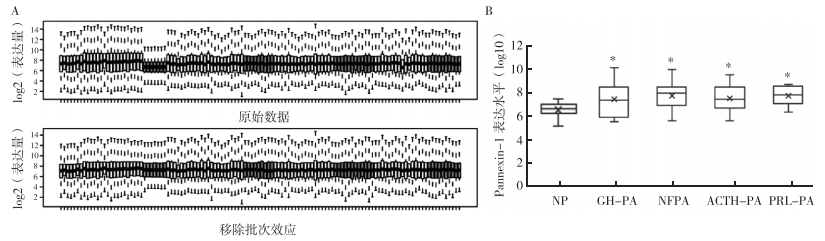
|
| 注 A:芯片数据移除批次效应;B:Pannexin-1在各亚型垂体腺瘤和NP中的表达水平;NP:正常垂体(normal pituitary);GH-PA:生长激素腺瘤(growth hormone pituitary adenoma);NFPA:无功能垂体腺瘤(nonfunctional pituitary adenoma);ACTH-PA:促肾上腺皮质激素(adrenocorticotropic hormone pituitary adenoma);PRL-PA:催乳素腺瘤(prolactin pituitary adenoma);*与NP比较,P < 0.05 图 1 GEO数据库中Pannexin-1在垂体腺瘤各亚型中的表达情况 Fig.1 Pannexin-1 expression in subtypes of pituitary adenoma in GEO database |
在56例垂体腺瘤中,NFPA、GH-PA和PRL-PA 3类腺瘤均有Pannexin-1蛋白的表达,其中强阳性表达15例(26.8%),中等强度表达22例(39.3%),其余19例为弱阳性或阴性表达。28例NFPA中有7例强阳性表达(7/28),均为侵袭性NFPA;21例弱阳性表达(21/28);16例GH-PA中有6例强阳性表达(6/16),其中4例为侵袭性GH-PA,其余10例中等强度表达(10/16);12例PRL-PA中有2例强阳性表达(2/12),均为侵袭性PRL-PA,其余10例中等强度表达(10/12,图 2)。NFPA、GH-PA和PRL-PA组Pannexin-1表达组间两两比较,差异均无统计学意义[(0.65±0.11)、(1.45±0.45)和(1.22±0.21),均P > 0.05];侵袭性垂体腺瘤和非侵袭性垂体腺瘤组间比较,差异具有统计学意义[(2.53±0.51) vs (0.42±0.25),P < 0.05]。
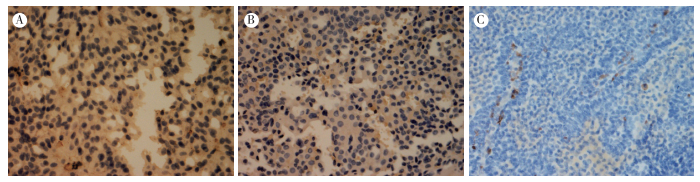
|
| 注 A:Pannexin-1蛋白在侵袭性GH-PA中强阳性表达;B:Pannexin-1蛋白在侵袭性PRL-PA中中等强度表达;C:Pannexin-1蛋白在NFPA中弱阳性表达 图 2 垂体腺瘤中Pannexin-1蛋白的免疫组织化学检查结果(SABC×400) Fig.2 Immunohistochemical results of Pannexin-1 expression in pituitary adenoma(SABC×400) |
NFPA、GH-PA、PRL-PA以及NP中均有Pannexin-1 mRNA表达。侵袭性NFPA、非侵袭性NFPA、侵袭性GH-PA、非侵袭性GH-PA、侵袭性PRL-PA和非侵袭性PRL-PA中,Pannexin-1 mRNA相对表达量分别为(3.22±3.08)、(0.57±0.46)、(1.73±0.45)、(1.21±0.69)、(1.78±0.42)和(1.15±0.36)。侵袭性NFPA较NP和非侵袭性NFPA Pannexin-1表达均上调(均P < 0.01,图 3A)。侵袭性GH-PA较NP和非侵袭性GH-PA的Pannexin-1表达均上调(均P < 0.01,图 3B)。侵袭性PRL-PA中Pannexin-1表达高于NP和非侵袭性PRL-PA(均P < 0.05,图 3C)。NFPA、GH-PA和PRL-PA组的Pannexin-1 mRNA相对表达量分别为(1.98±0.90)、(1.47±0.68)和(1.46±0.53),差异无统计学意义(P > 0.05,图 3D)。
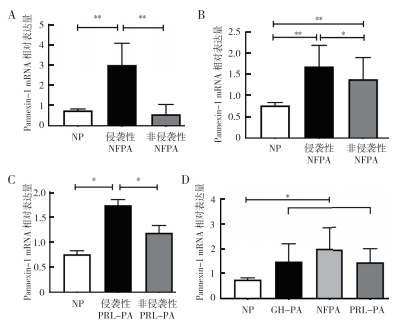
|
| 注 A:Pannexin-1 mRNA在侵袭性NFPA中较非侵袭性NFPA和NP上调表达;B:Pannexin-1 mRNA在侵袭性GH-PA中较非侵袭性NFPA和NP上调表达;C:Pannexin-1 mRNA在侵袭性PRL-PA中较非侵袭性PRL-PA和NP上调表达;D:Pannexin-1 mRNA在各亚型垂体腺瘤中较NP上调表达;*P < 0.05;**P < 0.01 图 3 垂体腺瘤各亚型中Pannexin-1 mRNA表达情况 Fig.3 Expression of Pannexin-1 mRNA in subtypes of pituitary adenoma |
8例侵袭性GH-PA患者生长激素水平为(40.7±6.88)ng/L,8例非侵袭性GH-PA患者生长激素水平为(32.3±4.05)ng/L;其次,6例侵袭性PRL-PA患者催乳素水平为(44.1±5.2)ng/mL,6例非侵袭性PRL-PA患者催乳素水平为(31.3±2.5)ng/mL。GH-PA组Pannexin-1 mRNA的表达量与其术前的生长激素水平无相关性(r=0.24,P=0.16,图 4A)。PRL-PA组Pannexin-1 mRNA的表达量与其术前的催乳素水平无相关性(r=0.37,P=0.21,图 4B)。其次,Ki-67指数 < 3%组和Ki-67指数≥3%组Pannexin-1 mRNA表达比较,差异无统计学意义[(1.65±0.22) vs (1.13±0.27),P=0.11]。
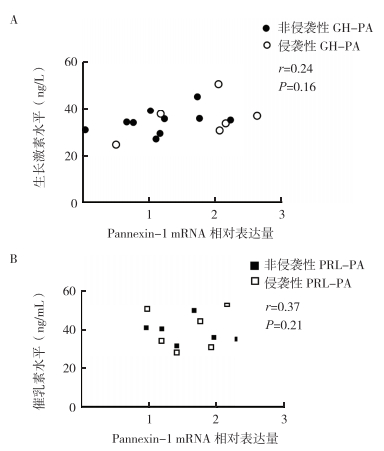
|
| 注 A:GH-PA患者Pannexin-1表达量与血清生长激素水平的相关性分析;B:PRL-PA患者Pannexin-1表达量与血清催乳素水平的相关性分析 图 4 垂体腺瘤患者Pannexin-1表达量与血清激素水平相关性分析 Fig.4 Correlation between Pannexin-1 expression and serum hormone levels of pituitary adenoma patients |
垂体腺瘤是颅内最常见的肿瘤之一。近年来发病率有逐年上升的趋势,其发生率仅次于胶质瘤,手术切除是其主要治疗方式。尽管垂体腺瘤的组织学特征为良性,但临床实践中发现约有25%~55%的肿瘤向周围结构(如硬膜、斜坡骨质和海绵窦等)呈侵犯性生长,类似于恶性肿瘤表现,手术难以完全切除;术后病理检查也证实这部分肿瘤通常合并高增殖指数及p53基因突变;并且对进一步的放疗和药物治疗均不敏感,复发率高,被定义为侵袭性垂体腺瘤(aggressive PA)[10]。
Pannexin-1作为胞膜上大分子孔道,在肿瘤发生、癫痫和缺血缺氧损伤等疾病病理生理过程中均发挥重要作用[11]。而Pannexin-1在垂体中表达分布首次于2011年被报道,并且主要表达于腺垂体细胞[12]。本研究通过生物信息学分析发现,Pannexin-1蛋白在不同亚型垂体腺瘤中均有表达,且有差异;采用临床标本检测发现,Pannexin-1蛋白在所有的GH-PA、PRL-PA和NFPA标本中均有表达,表明Pannexin-1的过表达与此3类肿瘤的发生有密切关系;此外,侵袭性垂体腺瘤组中Pannexin-1表达量较非侵袭性垂体腺瘤组增高,提示Pannexin-1对垂体腺瘤的侵袭性可能有促进作用。
本研究还发现,Pannexin-1的表达量与GH和PRL激素的水平以及Ki-67指数无关,提示Pannexin-1对垂体细胞GH和PRL的激素分泌功能可能没有刺激作用。虽然Pannexin-1 mRNA水平与腺瘤的侵袭性相关,但与腺瘤的大小无明显相关性,提示垂体腺瘤的发生和发展是包括Pannexin-1在内的多种因素共同作用的结果。
总之,本研究证明,Pannexin-1在GH、PRL和NFPA中过表达,且与腺瘤的侵袭性密切有关。因此,可以认为,Pannexin-1的表达在影响垂体瘤的表型和生物学行为方面发挥重要作用。Pannexin-1影响垂体腺瘤侵袭性的发生机制尚未完全阐明,推测其可能通过Pannexin-1/Arp3/actin途径影响细胞骨架蛋白聚合进而促进垂体腺瘤细胞侵袭[13],也可能通过Pannexin-1/ATP/Ca2+/actin途径促进垂体腺瘤细胞侵袭[14]。为了研究其机制,下一步,本研究组将着手于其机制研究,或许Pannexin-1可以成为治疗侵袭性垂体腺瘤的新靶标。
| [1] |
刘小曼, 臧福才, 郎明非, 等. Pannexin-1在急性缺血性脑卒中中的研究进展[J]. 卒中与神经疾病, 2020, 27(4): 542-545. DOI:10.3969/j.issn.1007-0478.2020.04.032 |
| [2] |
Wicki S, Swayne L. Panx1 regulates neural stem and progenitor cell behaviours associated with cytoskeletal Dynamics and interacts with multiple cytoskeletal elements[J]. Cell Commun Signal, 2013, 11(62): 62-69. |
| [3] |
Bao B, Lai C, Naus C, et al. Pannexin 1 drives multicellular aggregate compaction via a signaling cascade that remodels the actin cytoskeleton[J]. J Biol Chem, 2012, 287(11): 8407-8416. DOI:10.1074/jbc.M111.306522 |
| [4] |
Freeman TJ, Sayedyahossein S, Johnston D, et al. Inhibition of pannexin 1 reduces the tumorigenic properties of human melanoma cells[J]. Cancers, 2019, 11(1): 1-24. |
| [5] |
Dalghi MG, Ferreira-Gomes M, Rossi JP. Regulation of the plasma membrane calcium ATPases by the actin cytoskeleton[J]. Biochem Biophys Res Commun, 2018, 506(2): 347-354. DOI:10.1016/j.bbrc.2017.11.151 |
| [6] |
Gautier L, Cope L, Bolstad BM, et al. Affy-analysis of Affymetrix GeneChip data at the probe level[J]. Bioinformatics, 2004, 20(3): 307-315. DOI:10.1093/bioinformatics/btg405 |
| [7] |
Smyth GK. Limma: linear models for microarray data user's guide[M]. 1st edition. Melbourne: The Walter and Eliza Hall Institute of Medical Research, 2011: 397-420.
|
| [8] |
Dunning MJ, Smith ML, Ritchie ME, et al. Beadarray: R classes and methods for Illumina bead-based data[J]. Bioinformatics, 2007, 23(16): 2183-2184. DOI:10.1093/bioinformatics/btm311 |
| [9] |
Leek JT, Johnson WE, Parker HS, et al. The sva package for removing batch effects and other unwanted variation in high-throughput experiments[J]. Bioinformatics, 2012, 28(6): 882-883. DOI:10.1093/bioinformatics/bts034 |
| [10] |
Di Ieva A, Rotondo F, Syro LV, et al. Aggressive pituitary adenomas——diagnosis and emerging treatments[J]. Nat Rev Endocrinol, 2014, 10(7): 423-435. DOI:10.1038/nrendo.2014.64 |
| [11] |
Penuela S, Gehi R, Laird DW, et al. The biochemistry and function of pannexin channels[J]. Biochim Biophys Acta, 2013, 1828(1): 15-22. |
| [12] |
Li S, Bjelobaba I, Yan ZH, et al. Expression and roles of pannexins in ATP release in the pituitary gland[J]. Endocrinology, 2011, 152(6): 2342-2352. DOI:10.1210/en.2010-1216 |
| [13] |
Bao BA, Lai CP, Naus CC, et al. Pannexin 1 drives multicellular aggregate compaction via a signaling cascade that remodels the actin cytoskeleton[J]. J Biol Chem, 2012, 287(11): 8407-8416. DOI:10.1074/jbc.M111.306522 |
| [14] |
Wicki-Stordeur LE, Swayne LA. The emerging Pannexin 1 signalome: a new nexus revealed?[J]. Front Cell Neurosci, 2014, 7(1): 287. |
 2021, Vol. 36
2021, Vol. 36


