文章信息
- 周子超, 徐晓玲, 江海涛, 朱慧能, 陈奇勋, 杜向慧, 裘国勤, 孙才兴, 范云
- Zhou Zichao, Xu Xiaoling, Jiang Haitao, Zhu Huineng, Chen Qixun, Du Xianghui, Qiu Guoqin, Sun Caixing, Fan Yun
- 一例初诊原发性肺淋巴上皮瘤样癌患者的MDT诊治报道
- MDT diagnosis and treatment of a primary pulmonary lymphoepithelioma-like carcinoma patient
- 实用肿瘤杂志, 2021, 36(4): 293-299
- Journal of Practical Oncology, 2021, 36(4): 293-299
-
通信作者
- 范云,E-mail:fanyun@zjcc.org.cn
-
文章历史
- 收稿日期:2021-06-23
2. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)胸部肿瘤内科,浙江 杭州 310022;
3. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)放射科,浙江 杭州 310022;
4. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)病理科,浙江 杭州 310022;
5. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)胸部肿瘤外科,浙江 杭州 310022;
6. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)胸部放疗科,浙江 杭州 310022;
7. 中国科学院大学附属肿瘤医院(浙江省肿瘤医院)神经外科,浙江 杭州 310022
2. Thoracic Oncology Department, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou 310022, China;
3. Medical Imaging Department, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou 310022, China;
4. Pathology Department, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou 310022, China;
5. Thoracic Oncology Surgery Department, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou 310022, China;
6. Thoracic Radiotherapy Department, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou 310022, China;
7. Neurosurgery Department, Cancer Hospital of the University of Chinese Academy of Sciences (Zhejiang Cancer Hospital), Hangzhou 310022, China
患者男性,47岁,身高184 cm,体质量81 kg,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状况评分(performance score,PS)1分。因咳嗽伴痰中带血1周于2016年12月28日收治中国科学院大学附属肿瘤医院(浙江省肿瘤医院)胸部肿瘤内科。2016年12月患者无明显诱因下出现咳嗽,痰中带少量鲜红血丝,无其他不适。吸烟史5包年,既往体健,否认家族肿瘤病史。2016年12月28日胸部+上腹部增强CT检查示:右下肺门类结节影(长径2.5 cm),恶性肿瘤可能。肝超声造影示:左肝结节,转移性考虑(长径1.6 cm);肝脏多发粟粒影,肝硬化结节可能。颅脑增强MRI检查示:未见异常。PET-CT检查示:右肺下叶近肺门结节见氟脱氧葡萄糖(fluorodeoxyglucose,FDG)代谢增高,肺恶性肿瘤考虑;肝顶部结节FDG代谢增高,考虑转移;左侧第7后肋点状骨质密度异常,FDG代谢略增高,转移不除外。经支气管镜检查示:(右肺下叶)基底段-亚段开口黏膜增厚、粗糙,咬检。支气管病理检查示:第1次报告示,(右肺下叶)低分化(鳞)癌;第2次报告示,(右肺下叶)低分化癌,免疫组织化学检查结果符合肺淋巴上皮瘤样癌(lymphoepithelioma-like carcinoma,LELC)。免疫组织化学检查示:间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK;兔单克隆抗体试剂)-,细胞角蛋白5/6(cytokeratin,CK5/6)-,p40 -,甲状腺转录因子-1(thyroid specific transcription factor,TTF1)-,p63 +,细胞角蛋白7(cytokeratin,CK7)-,Napsin A -,嗜铬粒蛋白A(chromogranin A, CGA)-,突触素(synaptophysin,Syn)-,CD56 -,Epstein-Barr病毒编码RNA(Epstein-Barr virus encoded RNA,EBER)+。送检组织基因检测(二代测序法)示:表皮生长因子受体基因(epithelial growth factor receptor,EGFR)、ALK、ROS原癌基因1(ROS proto-oncogene 1,ROS1)和Kirsten大鼠肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)等基因均未见异常。因患者病理类型特殊,于2017年1月4日行鼻咽镜检查,未见异常。血Epstein-Barr病毒(Epstein-Barr virus,EBV)DNA测定:102.13拷贝/mL;EBV衣壳抗原抗体-IgA为阳性。建议患者行肝部病灶粗针穿刺活检,患者及家属拒绝。目前初步诊断:右肺LELC,cT1cN0M1b(肝转移可能大),ⅣA期[1],驱动基因阴性,ECOG评分1分。
2 诊疗经过 2.1 第1次多学科团队(multidisciplinary team,MDT)讨论及诊治情况 2.1.1 第1次MDT讨论(2017年1月5日)放射科江海涛医师:根据患者胸部增强CT结合全身PET-CT检查提示,右肺下叶类结节影,肿块长径2.5 cm,边缘见毛刺,呈浅分叶状,右肺下叶钱基底段支气管受压变窄甚至闭塞,增强后不均匀强化,符合原发肺癌表现。值得关注的是此例患者纵隔未见淋巴结转移征象,但右肝近膈顶部可见一类圆形混杂密度影(直径1.6 cm);PET-CT检查结果显示该结节FDG代谢增高,标准摄取值(standard uptake value,SUV)最大值为9.6;肝脏MRI增强检查提示该结节为长T1长T2信号结节,增强后持续强化。综合各项检查结果肝单发结节考虑转移可能性大。颅脑增强MRI检查未见颅脑转移征象。
病理科朱慧能医师:患者右下肺病灶经支气管镜活检见低分化非小细胞肺癌(non-small-cell lung cancer,NSCLC),免疫组织化学检查结果具有鳞癌特征:CK5/6+和p40+,但镜下观察未见典型鳞状细胞分化,本科讨论后加行EBER分子检测(原位杂交法),结果呈阳性,符合肺LELC。肺LELC类似于未分化鼻咽癌,形态学与其不易区分,由未分化癌细胞、丰富的淋巴间质和具有鳞癌细胞超微结构特征的细胞组成,并伴大量淋巴细胞浸润。在分子检测方面,此类患者驱动基因变异罕见,仅2%的患者具有EGFR突变,但PD-L1表达较高[2]。目前该患者已行鼻咽镜检查排除鼻咽癌可能,符合肺原发LELC的病理诊断(图 1)。
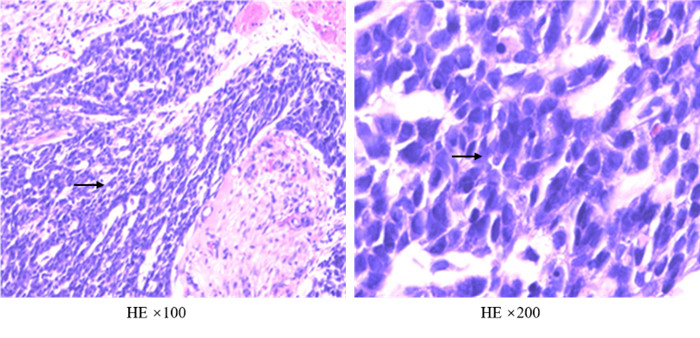
|
| 注 低分化非小细胞肺癌组织(箭头示),分化差,未见腺癌形态,未见典型角化珠和细胞剑桥等鳞癌形态,结合免疫组织化学检查结果符合淋巴上皮瘤样癌 图 1 初诊时经支气管镜肺活检病理检查结果 Fig.1 Pathological results of the primary lesion at the first visit by transbronchial lung biopsy |
胸部肿瘤外科陈奇勋医师:肺LELC是一种少见的病理亚型。研究报道,Ⅰ期及Ⅱ期的比例>50%,多数患者有手术治疗的机会[3];EBV-DNA拷贝数变化可能是复发的预测因子。该患者虽原发肿块偏小,且未见纵隔淋巴结转移,但肝顶部结节灶转移首先考虑,目前暂无根治性手术指征,建议内科治疗。
胸部肿瘤内科范云医师:LELC发生于鼻咽以外前肠起源的器官如肺和乳腺等[4]。肺原发LELC十分罕见,发生率仅占NSCLC的0.9%,多见亚裔不吸烟的患者[5]。在病理分类上属于NSCLC。组织学上与鼻咽未分化癌相似。肺LELC发病机制尚不清楚,>90%的肺LELC与EBV感染相关,该患者血EBV-DNA拷贝数阳性;EBV衣壳抗原抗体-IgA阳性,EBER原位杂交结果阳性。该患者虽为晚期,但其预后仍可能优于其他类型NSCLC[6]。在治疗方面,根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南(Version 4. 2016)晚期未分型NSCLC一线治疗推荐含铂双药化疗。基于JMDB研究,针对未分类的NSCLC,培美曲塞联合铂类方案优于吉西他滨联合铂类方案[7]。结合此患者为LELC,在多种特性上与鼻咽癌相似,故建议选择GP方案(吉西他滨+顺铂)作为一线治疗方案。
胸部放疗科杜向慧医师:患者肝部为单发病灶,长径1.6 cm,转移首先考虑,必要时推荐行穿刺确诊。目前患者肝功能无明显异常,可先行内科治疗后观察肝部病灶的反应情况,必要时可以考虑局部姑息性放疗。已有研究显示姑息性放疗可延长原发肺LELC的总生存期(overall survival,OS)[8]。
MDT讨论总结:综合MDT各专家成员意见,该患者为可疑肝转移的ⅣA期原发性肺LELC(T1cN0M1b)。建议先行GP方案化疗,预防并处理化疗相关不良反应。注意肝脏病灶的变化,必要时再次动员患者行肝脏病灶的穿刺活检。
2.1.2 治疗情况2017年1月6日起行2个周期GP方案化疗(吉西他滨1.6 mg/m2 d1、8;顺铂40 mg/m2d1~3;每3周重复)。化疗过程中未出现骨髓抑制,消化道反应1级。
2.2 第2次MDT讨论及诊治情况患者经过2个周期的GP方案化疗,复查胸腹部增强CT,按实体瘤的疗效评价标准1.1版(Response Evaluation Criteria in Solid Tumors Version 1.1,RECIST 1.1)[9]评价肺部病灶疗效达部分缓解(partial response,PR),肝脏病灶为疾病稳定(stable disease,SD)。为进一步治疗,准备第2次MDT团队讨论。期间进行第3个周期GP方案化疗。
2.2.1 第2次MDT讨论(2017年3月3日)放射科江海涛医师:患者2017年2月21日胸部+上腹部增强CT检查与基线2016年12月28日CT检查比较,右下肺病灶明显缩小,肝部病灶较前无明显变化(图 2)。基线CT及PET-CT检查均提示肝部病灶转移考虑,影像学表现较明确。根据RECIST 1.1标准[9],肺部靶病灶较基线缩小32%,疗效评估PR;肝病灶疗效评估SD。
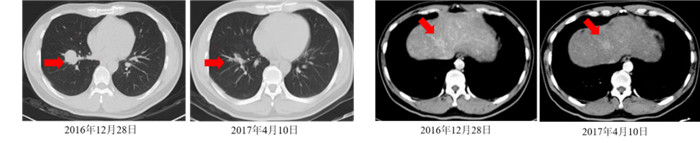
|
| 注 A:CT检查示右下肺门病灶较前明显缩小(箭头示);B:CT检查示肝顶部病灶稳定(箭头示) 图 2 GP方案化疗2个周期后复查胸腹部CT检查结果 Fig.2 CT results after 2 cycles of GP chemotherapy |
胸部肿瘤外科陈奇勋医师:患者年纪较轻,手术意愿强烈。目前ECOG评分0分,且肺部病灶局限,可考虑穿刺活检以明确肝部结节性质,以评估是否有肺部手术指征。
胸部肿瘤内科范云医师:患者2个周期GP方案化疗后,肺部病灶缩小,但肝部病灶退缩不明显,2处病灶存在明显的异质性。基线时根据影像学诊断肝转移,缺乏病理学支持,建议行肝脏病灶穿刺活检以明确性质。
胸部放疗科杜向慧医师:患者初诊为右肺LELC伴肝转移,一线2个周期GP方案化疗后肝部病灶退缩不明显,考虑肿瘤异质性。肝部单发病灶,长径1.6cm。已有回顾性研究证实,晚期NSCLC寡转移患者在有效全身治疗前提下联合积极的局部治疗可使该类生存获益[10-11]。因此本例患者可在明确肝转移后加行局部放疗。
MDT讨论总结:患者经过2个周期的GP方案化疗后,肺部病灶明显缩小,肝部病灶变化不明显,团队专家达成较一致意见,建议病理评估肝部病灶性质,重新明确分期,如果肝部病灶穿刺阴性,建议肺部手术治疗。
2.2.2 治疗情况2017年3月6日行左肝近膈顶结节穿刺,病理检查示,条状肝组织伴部分肝细胞脂肪变,局部间质内纤维组织增生,淋巴细胞浸润,间质内胆管增生,局部伴有轻度异型。免疫组织化学检测:Napsin A -,TTF1 -,CK19 +,CK7 +,簇分化抗原10(cluster of differentiation 10,CD10)+,肝实质细胞(hepatocyte,Hepa-1)-,CK5/6 -,p63个别+ 和p40 -。分子检测结果:EBER +。病理诊断暂不支持肝转移。遂至胸部肿瘤外科行手术治疗,2017年4月13日行“腔镜下右下肺切除术+淋巴清扫术”。术后病理检查示:右下肺癌化疗后,(右下)肺段支气管管壁浸润型(2.0 cm× 1.8 cm×1.3 cm)低分化鳞状细胞癌伴EBV感染,癌周纤维组织增生,大量淋巴细胞浸润,累犯肺组织,转移至右下肺支气管根部及右下肺内支气管旁淋巴结(图 3)。结合免疫组织化学检查及分子检测结果:EBER+。术后诊断右肺LELC,分期:pT1bN1M0,ⅡB期。术后继续行GP方案辅助化疗2个周期。
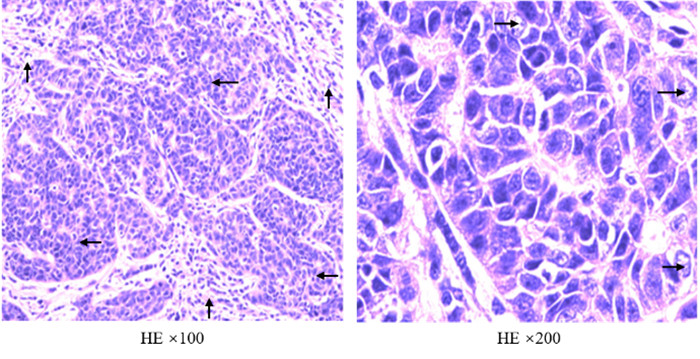
|
| 注 (右下肺叶手术切除标本)低分化鳞状癌(←),可见单个分离肿瘤细胞呈空泡泡状(→),癌周纤维组织增生,大量淋巴细胞浸润(↑),累犯肺组织。结合免疫组织化学及分子检测结果示EBER+,病理诊断为淋巴上皮瘤样癌 图 3 诱导化疗后手术切除病理检查结果 Fig.3 The pathological results of surgical resection after induction |
2017年10月初(辅助化疗后4个月),患者出现头痛流涎,行走时左下肢无力。复查头颅增强MRI,右侧额叶新发转移性肿瘤。为进一步治疗,进行第3次MDT讨论。
2.3.1 第3次MDT讨论(2017年10月23日)放射科江海涛医师:2017年10月17日颅脑增强MRI检查示,右侧额叶见一长T1长T2结节灶,大小约3.8 cm×2.8 cm,增强后病灶环形强化,周围见明显水肿;右侧侧脑室前角受压变形明显,与2016年12月28日基线颅脑增强MRI检查比较,右侧额叶新发转移瘤(图 4)。胸腹部增强CT检查示肝脏病灶较前相仿。
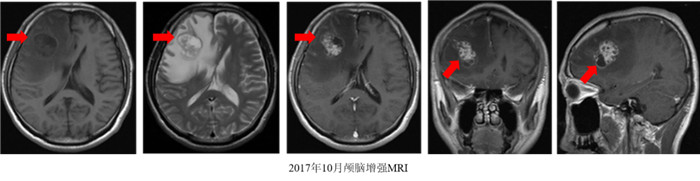
|
| 注 右侧额叶见一长T1长T2结节灶(箭头示),大小约3.8 cm×2.8 cm,增强后病灶环形强化,周围见明显水肿,右侧侧脑室前角受压变形明显;中线结构左移位 图 4 2017年10月颅脑增强MRI检查发现脑部新发转移瘤 Fig.4 Enhanced MRI revealed a new metastatic tumor in the brain in October 2017 |
胸部肿瘤内科范云医师:患者右肺癌根治术后辅助化疗后4个月,新发脑部寡转移灶,局部肿块较大。现患者出现头痛和行走不稳,结合临床及影像学考虑脑部病灶压迫功能区,宜先行脑部手术治疗以缓解症状。
胸部放疗科裘国勤医师:患者目前肺癌脑部单发转移,根据NCCN指南(Version 8. 2017),存在脑部放疗或手术治疗指征[12-13]。但该患者脑部病灶>3 cm,且水肿范围大,压迫症状明显,不宜行立体定向放疗。建议先行神经外科手术治疗,术后再评估脑部放疗的必要性。
神经外科孙才兴医师:患者脑转移临床症状明显,颅脑增强MRI检查提示单发脑转移灶,脑部水肿明显,需快速减压缓解症状,建议完善相关检查排除手术禁忌后可行脑转移灶切除术。
MDT讨论总结:患者肺LELC肺部手术治疗后6个月出现脑转移伴颅脑压迫症状,根据NSCLC及中枢神经系统NCCN指南(Version 1. 2017)推荐,有症状脑转移应积极行局部治疗,脑转移瘤病灶≤3个则可行手术/立体定向体部放疗(stereotactic body radiation,SBRT)/SBRT联合全脑放疗,术后辅助放疗可延长患者局部控制时间[12-13]。本例患者脑内转移灶单发,体积较大(长径>3 cm)且脑水肿明显,宜行手术切除以迅速降低颅内压,减轻脑部刺激症状,术后可联合脑放疗清除残留病灶。
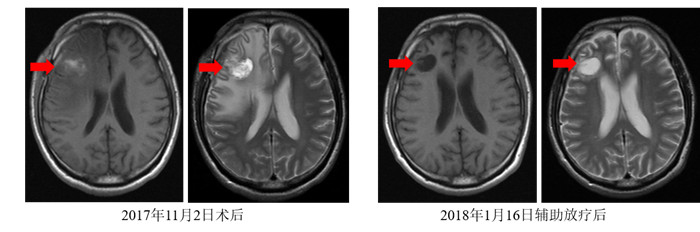
2.3.2 治疗情况2017年10月26日在全麻下行右侧额叶肿瘤切除术,术后病理检查示:(右侧额叶)脑组织内转移性低分化癌。免疫组织化学检查示:CK5/6+、CK7-、Napsin A-、p40+、p63+、TTF1-和Ki-67+,60%。分子检测结果:EBER+。2017年12月7日至2017年12年26日行术后脑部瘤床放疗:右侧额叶局部手术瘤床为临床靶区(clinical target volume,CTV),外扩1 cm作为计划靶区(planning target volume,PTV),肿瘤吸收剂量45 Gy/15 F/3周。2018年1月16日复查颅脑增强MRI:脑转移瘤术后,术区血肿已不明显,局部术后改变,术区未见明显强化(图 5)。
|
| 注 A:2017年11月2日脑转移瘤术后MRI检查示,右侧额骨呈术后改变,术区增强后未见明显异常强化影(箭头示);B:2018年1月16日脑转移瘤术后全脑放疗后MRI检查示,术区血肿已不明显,周缘轻度水肿(箭头示) 图 5 脑转移瘤术后及放疗后颅脑MRI表现 Fig.5 Brain MRI results after surgery and radiotherapy for brain metastase |
2018年10月12日在常规的上腹部MRI(增强)检查中发现,肝脏S4段转移瘤,大小2.4 cm× 2.4 cm,较前(1.6 cm)增大。肝B型超声造影检查亦显示:S4段肝结节,转移瘤可能大。行肝病灶再次穿刺,未找到癌细胞。结合患者的病史及影像检查,患者诊断仍考虑为肺LELC肝和脑转移综合治疗后未控。根据NCCN指南(Version 5.2018)推荐,晚期无驱动基因突变NSCLC的二线治疗可选择免疫检查点抑制剂或其他系统治疗[14]。2018年10月30日起行纳武利尤单抗240 mg(每2周)治疗;免疫治疗1个周期后行肝转移病灶的射频治疗。免疫治疗期间患者病情稳定,ECOG评分0~1。纳武利尤单抗治疗满2年(共56个周期)后停药。患者2021年2月23日复查胸部增强CT:右心缘旁转移性结节。经行胸部姑息性放疗寡转移病灶,控制良好。
3 讨论肺LELC是一种罕见的EBV相关的恶性肿瘤,仅占NSCLC的0.7%,好发于年轻和无吸烟史的亚裔人群[15]。肺LELC的镜下细胞形态无特异性,免疫组织化学呈CK5/6、上皮膜抗原(epithelial membrane antigen,EMA)、p63和p40阳性,提示为鳞状细胞;在亚裔患者该肿瘤细胞核中常可检测到EBV+[16]。在血清学检查中,循环EBV DNA浓度常作为辅助诊断标准。一项大样本多中心前瞻性研究发现其与预后存在相关性,基线高EBV DNA浓度(≥4 000拷贝数/mL)可能与疾病复发及较差的生存率相关[17]。在驱动基因方面,一项基于多中心中国肺LELC患者的不同阶段基因谱分析研究发现,与肺腺癌不同,肺LELC很少有EGFR、ALK和ROS1等驱动基因突变,而51.9%(14/27)的患者检测到拷贝数变异[18]。此外,该研究还发现77.8%(21/27)的患者有表观遗传调节因子的突变,提示表观遗传调控可能参与肺LELC的发生过程。与此同时,在肺LELC中还存在多种体细胞突变参与肿瘤的发生与进展,包括病毒感染相关的载脂蛋白B-mRNA编辑酶催化多肽家族基因过表达、Ⅰ型干扰素(interferon,IFN)基因缺失,IFN诱导的JAK/STAT通路抑制和核因子κB通路异常激活等[19]。
由于肺LELC发病率低,缺乏大样本的临床研究数据,除早期患者明确首选手术治疗外,局部晚期/转移性肺LELC患者目前尚无针对性治疗策略。现有研究提示,肺LELC对放化疗敏感[20];根据其免疫微环境状态,有望从免疫检查点抑制剂的治疗中获益。基于目前的研究数据,肺LELC往往具有程序性死亡受体配体-1(programmed cell death-ligand 1,PD-L1)高表达,阳性表达率约63.3%~75.8%[21]。其次,肺LELC的病灶常可观察到高密度的淋巴细胞浸润,包括CD8+和T细胞浆内抗原+细胞毒性T细胞,呈现“炎性肿瘤微环境”状态[22]。目前认为其高淋巴细胞浸润可能与EBV的持续感染相关。
一项晚期肺LELC患者(n=27)接受免疫或化学治疗的回顾性研究显示,免疫治疗组(n=10)和化疗组(n=17)的客观缓解率分别为80.0%和70.5%(P=0.678),疾病控制率分别为100%和88.2%(P=0.516);与化疗组比较,免疫治疗组有更长的中位PFS(7.9个月vs 15.0个月,P=0.005)和更高的1年PFS率(5.9% vs 40.0%,P=0.047),提示肺LELC可能在免疫治疗中获益[23]。另一项基于128例肺LELC患者的回顾性研究也得出相似结论,该研究入组5例在多线治疗后接受免疫治疗的晚期肺LELC患者,疾病控制率达60.0%(3/5),中位PFS优于前期化疗阶段的PFS(7.8个月vs 4.2个月)[24]。另有多个病例个案报道支持上述结论[25-26]。
多项回顾性研究显示,局晚期/转移性LELC患者可通过接受多模式治疗获得满意的生存期[6, 27-28]。因此由有经验的放射科、病理科、胸部肿瘤内科、胸部肿瘤外科和放疗科医师组成的MDT团队对肺LELC病例进行全程管理尤为重要。由于肺LELC病理类型罕见,在病理诊断时病理科医师应与临床医师沟通后加行相关免疫组织化学检查及EBER分子检测,可有效避免误诊和漏诊。本例肺LELC患者的MDT诊疗在基于循证医学证据的模式下进行,为患者提供了包含肺部手术、脑部手术、免疫治疗、化疗和放疗的多学科的个性化综合诊疗方案。该ⅣA期患者的总生存期已>4年,MDT诊疗模式在该患者取得长期生存的过程中起到关键作用。
| [1] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for revision of the TNM Stage Groupings in the forthcoming (eighth) edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [2] |
Fang W, Hong S, Chen N, et al. PD-L1 is remarkably over-expressed in EBV-associated pulmonary lymphoepithelioma-like carcinoma and related to poor disease-free survival[J]. Oncotarget, 2015, 6(32): 33019-33032. DOI:10.18632/oncotarget.5028 |
| [3] |
Sathirareuangchai S, Hirata K. Pulmonary lymphoepithelioma-like carcinoma[J]. Arch Pathol Lab Med, 2019, 143(8): 1027-1030. DOI:10.5858/arpa.2018-0149-RS |
| [4] |
He J, Shen J, Pan H, et al. Pulmonary lymphoepithelioma-like carcinoma: a Surveillance, Epidemiology, and End Results database analysis[J]. J Thorac Dis, 2015, 7(12): 2330-2338. |
| [5] |
Castro CY, Ostrowski ML, Barrios R, et al. Relationship between Epstein-Barr virus and lymphoepithelioma-like carcinoma of the lung: a clinicopathologic study of 6 cases and review of the literature[J]. Hum Pathol, 2001, 32(8): 863-872. DOI:10.1053/hupa.2001.26457 |
| [6] |
Huang CJ, Feng AC, Fang YF, et al. Multimodality treatment and long-term follow-up of the primary pulmonary lymphoepithelioma-like carcinoma[J]. Clin Lung Cancer, 2012, 13(5): 359-362. DOI:10.1016/j.cllc.2012.01.002 |
| [7] |
Scagliotti GV, Parikh P, von Pawel J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-3551. DOI:10.1200/JCO.2007.15.0375 |
| [8] |
Lin Z, Fu S, Zhou Y, et al. First-line platinum-based chemotherapy and survival outcomes in locally advanced or metastatic pulmonary lymphoepithelioma-like carcinoma[J]. Lung Cancer, 2019, 137(9): 100-107. |
| [9] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [10] |
Ricco A, Davis J, Rate W, et al. Lung metastases treated with stereotactic body radiotherapy: the RSSearch(R) patient Registry's experience[J]. Radiat Oncol, 2017, 12(1): 35. DOI:10.1186/s13014-017-0773-4 |
| [11] |
Salah S, Tanvetyanon T, Abbasi S. Metastatectomy for extra-cranial extra-adrenal non-small cell lung cancer solitary metastases: systematic review and analysis of reported cases[J]. Lung Cancer, 2012, 75(1): 9-14. DOI:10.1016/j.lungcan.2011.07.014 |
| [12] |
Ewend MG, Morris DE, Carey LA, et al. Guidelines for the initial management of metastatic brain tumors: role of surgery, radiosurgery, and radiation therapy[J]. J Natl Compr Canc Netw, 2008, 6(5): 505-513; quiz 14. DOI:10.6004/jnccn.2008.0038 |
| [13] |
Patchell RA, Tibbs PA, Walsh JW, et al. A randomized trial of surgery in the treatment of single metastases to the brain[J]. N Engl J Med, 1990, 322(8): 494-500. DOI:10.1056/NEJM199002223220802 |
| [14] |
Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627-1639. DOI:10.1056/NEJMoa1507643 |
| [15] |
Kim C, Rajan A, DeBrito PA, et al. Metastatic lymphoepithelioma-like carcinoma of the lung treated with nivolumab: a case report and focused review of literature[J]. Transl Lung Cancer Res, 2016, 5(6): 720-726. DOI:10.21037/tlcr.2016.11.06 |
| [16] |
Anand A, Zayac A, Curtiss C, et al. Pulmonary lymphoepithelioma-like carcinoma disguised as squamous cell carcinoma[J]. J Thorac Oncol, 2018, 13(5): e75-76. DOI:10.1016/j.jtho.2017.11.133 |
| [17] |
Xie M, Wu X, Wang F, et al. Clinical significance of plasma Epstein-Barr virus DNA in pulmonary lymphoepithelioma-like carcinoma (LELC) patients[J]. J Thorac Oncol, 2018, 13(2): 218-227. DOI:10.1016/j.jtho.2017.10.031 |
| [18] |
Xie Z, Liu L, Lin X, et al. A multicenter analysis of genomic profiles and PD-L1 expression of primary lymphoepithelioma-like carcinoma of the lung[J]. Mod Pathol, 2020, 33(4): 626-638. DOI:10.1038/s41379-019-0391-9 |
| [19] |
Hong S, Liu D, Luo S, et al. The genomic landscape of Epstein-Barr virus-associated pulmonary lymphoepithelioma-like carcinoma[J]. Nat Commun, 2019, 10(1): 3108. DOI:10.1038/s41467-019-10902-w |
| [20] |
Liang Y, Wang L, Zhu Y, et al. Primary pulmonary lymphoepithelioma-like carcinoma: fifty-two patients with long-term follow-up[J]. Cancer, 2012, 118(19): 4748-4758. DOI:10.1002/cncr.27452 |
| [21] |
Hu Y, Ren S, Liu Y, et al. Pulmonary Lymphoepithelioma-like carcinoma: a mini-review[J]. Onco Targets Ther, 2020, 13: 3921-3929. DOI:10.2147/OTT.S241337 |
| [22] |
Bremnes RM, Busund LT, Kilvaer TL, et al. The role of tumor-infiltrating lymphocytes in development, progression, and prognosis of non-small cell lung cancer[J]. J Thorac Oncol, 2016, 11(6): 789-800. DOI:10.1016/j.jtho.2016.01.015 |
| [23] |
Fu Y, Zheng Y, Wang PP, et al. Pulmonary lymphoepithelioma-like carcinoma treated with immunotherapy or chemotherapy: a single institute experience[J]. Onco Targets Ther, 2021, 14: 1073-1081. DOI:10.2147/OTT.S290113 |
| [24] |
Wu Z, Xian X, Wang K, et al. Immune checkpoint blockade therapy may be a feasible option for primary pulmonary lymphoepithelioma-like carcinoma[J]. Front Oncol, 2021, 11: 626566. DOI:10.3389/fonc.2021.626566 |
| [25] |
Sasaki A, Kato T, Ujiie H, et al. Primary pulmonary lymphoepithelioma-like carcinoma with positive expression of Epstein-Barr virus and PD-L1: A case report[J]. Int J Surg Case Rep, 2021, 79(1): 431-435. |
| [26] |
Qiu ZX, Zhou P, Wang K. Primary pulmonary lymphoepithelioma-like carcinoma response favorably to nivolumab: a case report[J]. Onco Targets Ther, 2019, 12: 8595-8600. DOI:10.2147/OTT.S219512 |
| [27] |
Zhou N, Lin Y, Peng X, et al. Thorough survey and analysis of pulmonary lymphoepithelioma-like carcinoma in Macau and multimodality treatment for advanced disease[J]. Lung Cancer, 2019, 138(10): 116-123. |
| [28] |
Qin Y, Gao G, Xie X, et al. Clinical features and prognosis of pulmonary lymphoepithelioma-like carcinoma: summary of eighty-five cases[J]. Clin Lung Cancer, 2019, 20(3): e329-337. DOI:10.1016/j.cllc.2018.12.014 |
 2021, Vol. 36
2021, Vol. 36


