文章信息
- 张洁, 张艺洪, 张华, 罗惠丹, 牟永告, 何杏勤, 何振强
- Zhang Jie, Zhang Yihong, Zhang Hua, Luo Huidan, Mou Yonggao, He Xingqin, He Zhenqiang
- 新诊断高级别胶质瘤合并代谢综合征患者的临床特征及预后
- Clinical characteristics and prognosis of newly diagnosed high-grade glioma patients with metabolic syndrome
- 实用肿瘤杂志, 2021, 36(3): 234-240
- Journal of Practical Oncology, 2021, 36(3): 234-240
基金项目
- 国家自然科学基金(81872324);广东省医学科学技术研究基金(A2020149);中央高校基本科研业务费/中山大学青年教师培育项目(20ykpy163)
-
通信作者
-
何杏勤, E-mail: hexq@sysucc.org.cn
何振强, E-mail: hezhenq@sysucc.org.cn
-
文章历史
- 收稿日期:2020-09-04
代谢综合征(metabolic syndrome, MetS)是指包括高血糖、高血压、腹型肥胖/腹围增加和血脂代谢紊乱等风险因素的一组综合征[1]。由于肥胖的患病率逐渐上升,MetS及其相关疾病正逐渐变成世界范围内的健康问题,因而对MetS的管理及研究正逐渐得到医护人员的重视。许多研究发现,MetS及其风险因素与乳腺癌、胃癌、结直肠癌和肝癌等多种癌症的发病风险、肿瘤进展及预后相关[2-5]。既往研究发现,高血糖和高血压等MetS风险因素与胶质瘤的发病率相关[6-8],且青少年及儿童脑瘤患者治疗后更易出现MetS表现[9],为进一步探索MetS对高级别胶质瘤(high-grade gliomas, HGG)患者的影响,本文对单中心治疗的新诊断HGG患者及其合并MetS情况的临床资料进行分析,总结这部分患者的临床预后特点。
1 资料和方法 1.1 纳入及排除标准回顾性收集2001年1月1日至2014年7月31日收治于中山大学肿瘤防治中心神经外科的新诊断HGG患者331例。其中男性200例,女性131例,年龄5~78岁,中位年龄44岁。本研究纳入标准:(1)根据世界卫生组织(World Health Organization, WHO)对神经系统肿瘤的分类,经病理学诊断为WHO Ⅲ级以及WHO Ⅳ级的新诊断HGG患者[10];(2)既往无恶性肿瘤病史;(3)术前未接受抗肿瘤治疗;(4)临床资料及随访信息完整。排除标准:(1)患者缺乏MetS诊断相关检查指标;(2)患者出现围手术期死亡。根据以上纳入及排除标准,4例患者被排除,327例入组本研究。
1.2 临床资料及随访资料收集入组患者的一般资料包括性别、年龄、卡氏评分(Karnofsky performance status, KPS)、病理诊断、肿瘤级别、肿瘤大小、肿瘤部位、切除程度、围手术期护理记录和术后辅助治疗等通过中山大学肿瘤防治中心的电子病历系统查找并收集。胶质瘤患者的病理诊断分类依据2007年修订的WHO对神经系统肿瘤分类[10]。HGG包括WHO Ⅲ级以及WHO Ⅳ级胶质瘤。肿瘤大小被定义为患者术前MRI T1增强序列图像上病灶的最大直径。肿瘤部位分为端脑部位与非端脑部位,端脑部位包括大脑额叶、顶叶、枕叶、颞叶和岛叶区域,非端脑部位即除大脑额叶、顶叶、枕叶、颞叶和岛叶区域以外的部位,包括中线区域及幕下区域。肿瘤切除程度分为全切除、次全切除、部分切除以及活检。肿瘤切除程度的判断根据患者术前和术后的MRI和CT检查对比以及术者的手术记录得出。HGG患者术后辅助治疗包括同步放化疗后行一线化疗药物辅助化疗,或者接受单纯放疗后行一线化疗药物的辅助化疗。患者的随访通过对患者进行电话随访及患者门诊就诊随访。患者最终随访日期为2019年12月31日,中位随访时间为20.0个月,随访时间四分位间距为13.2~36.2个月。随访内容包括生存状态、主要症状和近期复查结果等。患者的无进展生存期(progression free survival, PFS)定义为从患者接受手术的日期开始,到观察到疾病进展或因任何原因的死亡之间的时间;患者的总生存期(overall survival,OS)定义为从患者接受手术的日期开始,至因任何原因引起死亡的时间。
1.3 MetS的诊断标准考虑到多个MetS的诊断标准以及本研究临床数据的实际获取情况,本研究采用美国胆固醇教育计划中对MetS的定义[11],符合以下5项标准中≥3项的可诊断存在MetS:(1)高血糖,空腹血糖≥6.1 mmol/L(110 mg/dL)或已确诊为糖尿病者;(2)超重或肥胖,体质量指数(body mass index, BMI)≥25.0 kg/m2;(3)空腹三酰甘油(triglyceride, TG)≥1.7 mmol/L(150 mg/dL);(4)男性空腹高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)≤1.04 mmol/L(40 mg/dL),女性空腹HDL-C≤1.3 mmol/L(50 mg/dL);(5)高血压:收缩压≥130 mmHg(1 mmHg=0.133 kPa)/舒张压≥80 mmHg。通过电子病历系统,收集患者治疗前血压、身高、体质量、血常规、血生化和凝血功能检测结果,判断患者合并MetS的情况。
1.4 检测方法血常规检查使用Sysmex NX-2000血液分析仪(Sysmex Corporation, 日本),其中血中性粒细胞、淋巴细胞、红细胞和血小板计数检测通过电阻抗法获得,血红蛋白浓度通过比色法获得。凝血功能检测应用Sysmex CS-5100全自动血细胞凝集仪(Sysmex Corporation, 日本),其中凝血酶原时间、凝血酶时间、部分凝血活酶时间和纤维蛋白原浓度通过凝固法获得。血生化检测应用ROCHE COBAS702全自动生化分析仪(F. Hoffmann-La Roche Ltd,瑞士),其中三酰甘油浓度通过酶比色法获得,HDL-C浓度通过均相测定法获得,血糖浓度通过己糖激酶法获得。
1.5 统计学分析采用SPSS 22.0软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验。计数资料采用频数(百分比)表示,组间比较采用χ2检验。生存分析通过Kaplan-Meier法进行。以P < 0.05为差异具有统计学意义。
2 结果 2.1 HGG患者的临床特征及合并MetS的情况本研究纳入的HGG患者的临床特征及血液检测结果的汇总可见表 1~2。本组患者包括男性198例,女性129例,年龄范围5~78岁,(43.90±15.96)岁,中位年龄44岁。WHO Ⅲ级胶质瘤患者157例,包括间变星形胶质细胞瘤115例,间变少突胶质细胞瘤32例,间变少突星形胶质细胞瘤9例,大脑胶质瘤病1例;WHO Ⅳ级胶质瘤患者共170例,包括胶质母细胞瘤169例,胶质肉瘤1例。所有患者均接受手术治疗,其中209例(63.9%)实现肿瘤全切除,87例(26.6%)患者肿瘤为次全切除,29例(8.9%)接受肿瘤部分切除,仅2例接受肿瘤活检。本组患者接受手术及放化疗情况汇总见表 3,术后接受标准辅助治疗患者共178例(54.4%)。
| 临床特征 | 所有患者 | 合并MetS | 未合并MetS | χ2值 | P值 |
| 年龄 | 4.637 | 0.031 | |||
| < 60岁 | 269 (82.3) | 35 (13.0) | 234 (87.0) | ||
| ≥60岁 | 58 (17.7) | 14 (24.1) | 44 (75.9) | ||
| 性别 | 0.546 | 0.460 | |||
| 男性 | 198 (60.6) | 32 (16.2) | 166 (83.8) | ||
| 女性 | 129 (39.4) | 17 (13.2) | 112 (86.8) | ||
| KPS评分 | 0.009 | 0.926 | |||
| ≥70 | 306 (93.6) | 46 (15.0) | 260 (85.0) | ||
| < 70 | 21 (6.4) | 3 (14.3) | 18 (85.7) | ||
| 肿瘤级别 | 0.224 | 0.636 | |||
| WHO Ⅲ级 | 157 (48.0) | 22 (14.0) | 135 (86.0) | ||
| WHO Ⅳ级 | 170 (52.0) | 27 (15.9) | 143 (84.1) | ||
| 肿瘤大小 | 0.044 | 0.834 | |||
| ≤5 cm | 158 (48.3) | 23 (14.6) | 135 (85.4) | ||
| > 5 cm | 169 (51.7) | 26 (15.4) | 143 (84.6) | ||
| 肿瘤位置 | 0.389 | 0.533 | |||
| 端脑 | 292 (89.3) | 45 (15.4) | 247 (84.6) | ||
| 非端脑 | 35 (10.7) | 4 (11.4) | 31 (88.6) | ||
| 切除范围 | 0.792 | 0.673 | |||
| GTR | 209 (63.9) | 33 (15.8) | 176 (84.2) | ||
| STR | 87 (26.6) | 13 (14.9) | 74 (85.1) | ||
| PR+活检 | 31 (9.5) | 3 (9.7) | 28 (91.3) | ||
| 标准辅助治疗 | 0.524 | 0.469 | |||
| 有 | 178 (54.4) | 29 (16.3) | 149 (83.7) | ||
| 无 | 149 (45.6) | 20 (13.4) | 129 (86.6) | ||
| 高血压 | 79.99 | < 0.01 | |||
| 有 | 116 (35.5) | 45 (38.8) | 71 (61.2) | ||
| 无 | 211 (64.5) | 4 (1.9) | 207 (98.1) | ||
| 注 MetS:代谢综合征(metabolic syndrome);KPS:卡氏功能评分(Karnofsky performance status);WHO:世界卫生组织(World Health Organization);GTR:全切除(gross total resection);STR:次全切除(subtotal resection);PR:部分切除(partial resection) | |||||
| 检验指标 | 所有患者 | 合并MetS | 未合并MetS | t值 | P值 |
| NE (109/L) | 6.61±3.33 | 6.84±3.01 | 6.57±3.39 | 0.510 | 0.610 |
| LY (109/L) | 1.90±0.85 | 2.10±0.97 | 1.86±0.83 | -1.772 | 0.077 |
| RBC (1012/L) | 4.78±0.57 | 4.95±0.53 | 4.75±0.57 | 2.261 | 0.024 |
| PLT (109/L) | 238.3±65.4 | 251.5±67.4 | 236.0±64.9 | 1.534 | 0.126 |
| HGB (g/L) | 140.3±16.0 | 146.2±12.6 | 139.3±16.4 | 2.782 | 0.006 |
| BMI (kg/m2) | 22.03±3.45 | 24.98±3.06 | 21.51±3.26 | 6.922 | < 0.01 |
| FBG (mmol/L) | 5.60±1.51 | 6.72±2.46 | 5.40±1.17 | 3.708 | 0.010 |
| TG (mmol/L) | 1.26±0.77 | 1.98±1.04 | 1.13±0.63 | 5.529 | < 0.01 |
| HDL-C (mmol/L) | 1.34±0.36 | 1.11±0.25 | 1.38±0.36 | -6.328 | < 0.01 |
| AST (U/L) | 21.90±17.34 | 21.80±12.20 | 21.91±18.12 | -0.041 | 0.967 |
| ALT (U/L) | 28.86±26.4 | 34.05±22.71 | 27.94±26.94 | 1.495 | 0.136 |
| ALP (U/L) | 72.20±37.03 | 76.78±22.49 | 71.39±39.03 | 0.939 | 0.349 |
| GGT (U/L) | 38.14±48.91 | 48.75±45.57 | 36.25±49.32 | 1.654 | 0.099 |
| LDH (U/L) | 161.8±48.6 | 168.1±40.9 | 160.6±49.9 | 0.987 | 0.324 |
| ALB (g/L) | 43.23±4.48 | 42.93±3.00 | 43.28±4.70 | -0.503 | 0.616 |
| PT (s) | 11.55±1.18 | 11.25±1.10 | 11.60±1.19 | -2.079 | 0.041 |
| APTT (s) | 28.23±8.67 | 25.65±5.45 | 28.69±9.05 | -2.276 | 0.024 |
| TT (s) | 17.62±1.55 | 17.59±1.36 | 17.62±1.58 | -0.124 | 0.901 |
| Fib (g/L) | 2.97±1.06 | 3.27±0.80 | 2.92±1.09 | 2.155 | 0.032 |
| 注 MetS:代谢综合征(metabolic syndrome);NE:中性粒细胞(neutrophil);LY:淋巴细胞(lymphocyte);RBC:红细胞(red blood cell);PLT:血小板(platelet);HGB:血红蛋白(hemoglobin);BMI:体质量指数(body mass index);FBG:空腹血糖(fasting blood-glucose);TG:三酰甘油(triglyceride);HDL-C:高密度脂蛋白胆固醇(high density lipoprotein cholesterol);AST:谷草转氨酶(glutamic oxalacetic transaminase);ALT:谷丙转氨酶(glutamic-pyruvic transaminase);ALP:碱性磷酸酶(alkaline phosphatase);GGT:谷氨酰转肽酶(glutamyltranspeptidase);LDH:乳酸脱氢酶(lactic dehydrogenase);ALB:血白蛋白(albumin);PT:凝血酶原时间(prothrombin time);APTT:部分凝血活酶时间(activated partial thromboplastin time);TT:凝血酶时间(thrombin time);Fib:纤维蛋白原(fibrinogen) | |||||
| 治疗方案 | 所有患者 | 合并MetS | 未合并MetS |
| 仅手术 | 107 (32.7) | 15 (30.6) | 92 (33.1) |
| 手术→放疗 | 31 (9.5) | 5 (10.2) | 26 (9.4) |
| 手术→放疗→化疗(A) | 129 (39.4) | 26 (53.1) | 103 (37.1) |
| 手术→放疗→化疗(B) | 49 (15.0) | 3 (6.1) | 46 (16.5) |
| 手术→化疗(A) | 6 (1.8) | 0 (0.0) | 6 (2.2) |
| 手术→化疗(B) | 5 (1.5) | 0 (0.0) | 5 (1.8) |
| 注 A:以替莫唑胺为主的化疗方案;B:以铂类及亚硝脲类药物为主的化疗方案;MetS:代谢综合征(metabolic syndrome) | |||
327例入组的HGG患者中,合并MetS患者共49例,发生率为15.0%;高血糖、高血压、高TG、低HDL及超重的发生率分别为25.4%、35.5%、16.5%、34.3%和20.5%。其中WHO Ⅲ级胶质瘤患者中,22例合并MetS,发生率为14.0%;在WHO Ⅳ级胶质瘤患者中,27例合并MetS,发生率为15.9%。
2.2 MetS与HGG临床特征的相关性本研究HGG患者的临床特征与MetS之间的相关性分析结果见表 1。合并MetS的HGG患者的年龄较未合并MetS的患者大(P=0.031),且合并高血压的比例更高(P < 0.01),而在其他临床特征包括性别、KPS、肿瘤级别、肿瘤大小、肿瘤位置、切除范围和辅助治疗方面比较,差异均无统计学意义(均P > 0.05)。
2.3 MetS与HGG检验指标的相关性HGG患者的血检验指标与MetS之间的相关性分析结果见表 2。通过对各个检验指标的比较发现,合并MetS的患者与未合并MetS的患者比较,外周血红细胞数量、血红蛋白浓度及血纤维蛋白原浓度均较高,而凝血酶原时间与部分凝血活酶时间均缩短(均P < 0.05),提示合并MetS的HGG患者术前存在高凝状态;其他血液检查指标包括血中性粒细胞、淋巴细胞、血小板、白蛋白和肝功能等指标比较,差异均无统计学意义(均P > 0.05)。
2.4 MetS对HGG患者生存期的影响截至最后随访日期,本研究中252例(77.1%)患者死亡,所有入组患者的中位PFS为10.6个月(95%CI:9.03~12.2个月),中位OS为17.0个月(95%CI:14.8~19.2个月)。生存分析显示,在OS不同的HGG患者中,MetS的影响并不相同。以2年OS作为分组标准,在OS较短(OS≤2年)的220例患者中,MetS的出现并未影响患者的PFS(P=0.907)及OS(P=0.957)。然而OS > 2年的长期生存HGG患者共107例,其中WHO Ⅲ级胶质瘤患者68例,WHO Ⅳ级胶质瘤患者39例,Kaplan-Meier法作生存分析显示,长期生存且合并MetS的患者18例(16.8%),其中位PFS(21.9个月 vs 42.5个月,P=0.01)及中位OS(37.8个月 vs 57.9个月,P=0.001)均较短(图 1),提示MetS影响HGG患者的长期治疗效果。
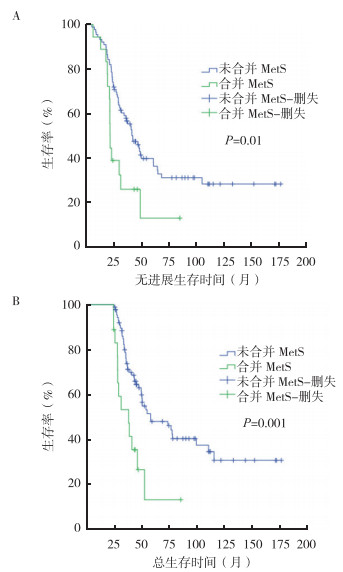
|
| 注 A:无进展生存曲线;B:总生存曲线;MetS:代谢综合征(metabolic syndrome) 图 1 合并和未合并MetS的长期生存(总生存期 > 2年)高级别胶质瘤患者的生存曲线 Fig.1 Survival curves of high-grade glioma patients with long-term survival (overall survival > 2 years) with and without MetS |
HGG包括WHO Ⅲ级胶质瘤及WHO Ⅳ级胶质瘤,是中枢神经系统内最常见的原发恶性肿瘤[12],具有浸润性生长和边界不清的特性[13],而且由于血-脑脊液屏障的存在[14],就算接受手术、放疗和化疗等综合治疗手段,多数HGG患者生存期仍较差[15],进一步探索这类患者的临床特征有助于更好地辅助HGG患者的个体化临床管理工作。
本文探索总结在本中心就诊手术的327例新诊断HGG患者中MetS的临床预后特征。结果提示,新诊断HGG患者合并MetS的比例约为15%,MetS的各种风险因素中,高血压的发病率最高,达到35.5%。临床特征数据的对比分析发现,合并MetS的胶质瘤患者年龄较大,而且较未合并MetS的患者有更高的红细胞数量和血纤维蛋白原浓度以及更短的凝血酶原时间和部分凝血活酶时间,提示这部分患者存在相对高凝状态。对患者的预后分析提示,合并MetS是影响HGG患者长期生存的负面因素,在OS > 2年的HGG患者中,合并MetS的患者的中位PFS及OS更短。
本研究发现的HGG患者合并MetS比例约为15%,与既往报道的其他肿瘤患者合并MetS的比例类似[2-5, 16]。多项研究报道,乳腺癌、胃癌、结直肠癌、肝癌和子宫内膜癌等患者合并MetS比例为15%~20%,另外,对MetS患者的肿瘤发生风险的研究提示,MetS可以增加乳腺癌、子宫内膜癌和结肠癌的发病率风险[2-5, 16]。这些结果表明,恶性肿瘤患者合并MetS的情况比较常见,在恶性肿瘤的治疗及护理中,如果遇到合并MetS的情况,应当引起主管医师及护士的重视。
笔者发现,合并MetS的HGG患者更容易合并高凝状态,这与既往研究相符[17-19]。MetS患者常见的高凝状态是MetS患者出现心血管疾病及血栓性疾病的风险因素之一[17-19]。MetS患者由于存在过多的内脏脂肪细胞,在慢性炎性反应状态下,激活的脂肪细胞可以分泌组织因子(tissue facotr, TF)和凝血因子Ⅶ,激活机体的凝血级联反应[20-21]。同时由于MetS患者存在肥胖和胰岛素抵抗等情况,体内游离脂肪酸和胰岛素水平升高,刺激机体分泌纤溶酶原激活物抑制物1(plasminogen activator inhibitor-1, PAI-1),PAI-1通过抑制组织型纤溶酶原激活物(tissue plasminogen-activator, t-PA),抑制纤溶,因而导致高凝状态[22]。高凝状态可以导致术后深静脉血栓及肺栓塞等严重并发症。有研究提出HGG本身就可以导致患者的高凝状态[23],合并MetS引起的高凝状态增加患者术后并发血栓性疾病的风险。这部分患者的护理工作中,必须高度注意其他可能增加血栓发生的风险因素,如肢体瘫痪和长期卧床等。
本研究还发现,对于生存期较长(OS > 2年)的HGG患者,合并MetS与患者的PFS及OS缩短有关,说明MetS的存在影响HGG患者的长期预后。多项关于MetS对恶性肿瘤患者预后影响的研究同样发现,合并MetS是胃癌、结直肠癌和乳腺癌等患者复发及死亡的风险因素[2-4]。但是本研究还发现,MetS的发生与年龄相关,而年龄本身就是胶质瘤预后的重要因素,因而MetS可能通过年龄影响胶质瘤患者的生存期,同时仍可能通过多种机制影响肿瘤患者的预后。由于肥胖、高血糖及胰岛素抵抗等因素,MetS患者体内普遍存在高胰岛素血症,胰岛素可通过提高生长激素受体的表达,促进肝细胞分泌胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1),IGF-1作用在肿瘤细胞的IGF受体,可通过p21/丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)通路以及磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3 kinase,PI-3K)/蛋白激酶B(protein kinase B,PKB,也称为AKT)通路促进肿瘤细胞的增殖[24];同时胰岛素可通过降低胰岛素样生长因子结合蛋白-1(insulin-like growth factor binding protein-1,IGFBP-1)的分泌,提高IGF-1的活性[25],而且IGF-1可通过刺激血管内皮生长因子(vascular endothelial growth factor,VEGF)的分泌促进肿瘤的血管生成[26]。研究也发现,MetS患者体内的炎性因子如白介素1β(interleukin-1β,IL-1β)、IL-6和IL-10的水平与胰岛素抵抗相关,炎性环境可以促进多种肿瘤的生长[27],IL-6也被发现可以促进胶质瘤微环境内巨噬细胞的M2极化,促进胶质瘤免疫抑制微环境,促进肿瘤生长[28]。这些研究结果提示,控制MetS不仅能降低胶质瘤患者围手术期相关并发症的发生率,还能减少促进肿瘤生长的因素,有助于提高患者的长期疗效。
综上所述,本研究回顾性结果提示,合并MetS的HGG患者更易合并高凝状态,且在长期生存的HGG患者中,合并MetS患者的PFS及OS更短。对MetS的各种风险因素进行干预,帮助HGG患者控制MetS,将有望使患者更好地从抗肿瘤治疗中获益,延长部分长期生存患者的OS及PFS。但是本研究是单中心的回顾性研究,可能会存在选择偏移,而且纳入研究的HGG患者的临床数据中,缺乏O6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA methyltransferase, MGMT)启动子甲基化和1p/19q缺失状态等分子特征相关数据,因此本研究结果具有一定的局限性。今后需要进行前瞻性的研究进一步了解MetS对HGG患者的影响。
| [1] |
Hirode G, Wong RJ. Trends in the prevalence of metabolic syndrome in the United States, 2011-2016[J]. JAMA, 2020, 323(24): 2526-2528. DOI:10.1001/jama.2020.4501 |
| [2] |
Li P, Wang T, Zeng C, et al. Association between metabolic syndrome and prognosis of breast cancer: a meta-analysis of follow-up studies[J]. Diabetol Metab Syndr, 2020, 12(1): 10. DOI:10.1186/s13098-019-0514-y |
| [3] |
Li F, Du H, Li S, et al. The association between metabolic syndrome and gastric cancer in Chinese[J]. Front Oncol, 2018, 8(1): 326. |
| [4] |
Lee J, Lee KS, Kim H, et al. The relationship between metabolic syndrome and the incidence of colorectal cancer[J]. Environ Health Prev Med, 2020, 25(1): 6. DOI:10.1186/s12199-020-00845-w |
| [5] |
Tsoulfas G. Hepatocellular carcinoma and metabolic syndrome: The times are changing and so should we[J]. World J Gastroenterol, 2019, 25(29): 3842-3848. DOI:10.3748/wjg.v25.i29.3842 |
| [6] |
Schwartzbaum J, Edlinger M, Zigmont V, et al. Associations between prediagnostic blood glucose levels, diabetes, and glioma[J]. Sci Rep, 2017, 7(1): 1436. DOI:10.1038/s41598-017-01553-2 |
| [7] |
Aldea M, Tomuleasa C, Petrushev B, et al. Antidiabetic pharmacology: a link between metabolic syndrome and neuro-oncology?[J]. J BUON, 2011, 16(3): 409-413. |
| [8] |
Edlinger M, Strohmaier S, Jonsson H, et al. Blood pressure and other metabolic syndrome factors and risk of brain tumour in the large population-based Me-Can cohort study[J]. J Hypertens, 2012, 30(2): 290-296. DOI:10.1097/HJH.0b013e32834e9176 |
| [9] |
Siviero-Miachon AA, Monteiro CM, Pires LV, et al. Early traits of metabolic syndrome in pediatric post-cancer survivors: outcomes in adolescents and young adults treated for childhood medulloblastoma[J]. Arq Bras Endocrinol Metabol, 2011, 55(8): 653-660. DOI:10.1590/S0004-27302011000800022 |
| [10] |
Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109. DOI:10.1007/s00401-007-0243-4 |
| [11] |
Expert Panel on Detection E, Treatment of High Blood Cholesterol in A. Executive summary of the third report of The National Cholesterol Education Program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (Adult Treatment Panel Ⅲ)[J]. JAMA, 2001, 285(19): 2486-2497. DOI:10.1001/jama.285.19.2486 |
| [12] |
Molinaro AM, Taylor JW, Wiencke JK, et al. Genetic and molecular epidemiology of adult diffuse glioma[J]. Nat Rev Neurol, 2019, 15(7): 405-417. DOI:10.1038/s41582-019-0220-2 |
| [13] |
折刚刚, 郝文炯. 磁共振波谱在脑胶质瘤边界确定中的研究进展[J]. 实用肿瘤杂志, 2019, 34(1): 7-10. |
| [14] |
朱明微, 刘鹏飞, 陈耀东, 等. 通过开放血脑肿瘤屏障治疗胶质母细胞瘤[J]. 实用肿瘤杂志, 2020, 35(4): 371-377. |
| [15] |
Ostrom QT, Cote DJ, Ascha M, et al. Adult glioma incidence and survival by race or ethnicity in the United States from 2000 to 2014[J]. JAMA Oncol, 2018, 4(9): 1254-1262. DOI:10.1001/jamaoncol.2018.1789 |
| [16] |
Esposito K, Chiodini P, Capuano A, et al. Metabolic syndrome and endometrial cancer: a meta-analysis[J]. Endocrine, 2014, 45(1): 28-36. DOI:10.1007/s12020-013-9973-3 |
| [17] |
Khunger JM, Kumar N, Punia VPS, et al. Study of prothrombotic changes in metabolic syndrome[J]. Indian J Hematol Blood Transfus, 2020, 36(4): 695-699. DOI:10.1007/s12288-020-01291-y |
| [18] |
Nieuwdorp M, Stroes ES, Meijers JC, et al. Hypercoagulability in the metabolic syndrome[J]. Curr Opin Pharmacol, 2005, 5(2): 155-159. DOI:10.1016/j.coph.2004.10.003 |
| [19] |
Franchini M, Targher G, Montagnana M, et al. The metabolic syndrome and the risk of arterial and venous thrombosis[J]. Thromb Res, 2008, 122(6): 727-735. DOI:10.1016/j.thromres.2007.09.010 |
| [20] |
Samad F, Pandey M, Loskutoff DJ. Regulation of tissue factor gene expression in obesity[J]. Blood, 2001, 98(12): 3353-3358. DOI:10.1182/blood.V98.12.3353 |
| [21] |
Anand SS, Yi Q, Gerstein H, et al. Relationship of metabolic syndrome and fibrinolytic dysfunction to cardiovascular disease[J]. Circulation, 2003, 108(4): 420-425. DOI:10.1161/01.CIR.0000080884.27358.49 |
| [22] |
Alessi MC, Bastelica D, Mavri A, et al. Plasma PAI-1 levels are more strongly related to liver steatosis than to adipose tissue accumulation[J]. Arterioscler Thromb Vasc Biol, 2003, 23(7): 1262-1268. DOI:10.1161/01.ATV.0000077401.36885.BB |
| [23] |
Chaichana KL, Pendleton C, Jackson C, et al. Deep venous thrombosis and pulmonary embolisms in adult patients undergoing craniotomy for brain tumors[J]. Neurol Res, 2013, 35(2): 206-211. DOI:10.1179/1743132812Y.0000000126 |
| [24] |
Ibrahim YH, Yee D. Insulin-like growth factor-I and cancer risk[J]. Growth Horm IGF Res, 2004, 14(4): 261-269. DOI:10.1016/j.ghir.2004.01.005 |
| [25] |
Giovannucci E. Insulin, insulin-like growth factors and colon cancer: a review of the evidence[J]. J Nutr, 2001, 131(Suppl 11): 3109-3120. |
| [26] |
Hoeben A, Landuyt B, Highley MS, et al. Vascular endothelial growth factor and angiogenesis[J]. Pharmacol Rev, 2004, 56(4): 549-580. DOI:10.1124/pr.56.4.3 |
| [27] |
Uzunlulu M, Telci Caklili O, Oguz A. Association between metabolic syndrome and cancer[J]. Ann Nutr Metab, 2016, 68(3): 173-179. DOI:10.1159/000443743 |
| [28] |
Wang Q, He Z, Huang M, et al. Vascular niche IL-6 induces alternative macrophage activation in glioblastoma through HIF-2 alpha[J]. Nat Commun, 2018, 9(1): 559. DOI:10.1038/s41467-018-03050-0 |
 2021, Vol. 36
2021, Vol. 36


