文章信息
- 寇建锋, 刘永, 马鹏飞
- Kou Jianfeng, Liu Yong, Ma Pengfei
- PRICKLE1与ECT2在三阴性乳腺癌患者中表达的临床意义
- Clinical significance of PRICKLE1 and ECT2 expressions in patients with triple negative breast cancer
- 实用肿瘤杂志, 2020, 35(6): 555-558
- Journal of Practical Oncology, 2020, 35(6): 555-558
-
作者简介
- 寇建锋(1980-),男,陕西延安人,主治医师,硕士,从事乳腺肿瘤和胸部肿瘤临床研究.
-
通信作者
- 马鹏飞, E-mail: mapengff00@163.com
-
文章历史
- 收稿日期:2019-05-23
2. 延安市同济医院妇产科,陕西 延安 716000
2. Department of Obstetrics and Gynecology, Tongji Hospital, Yan'an 716000, China
三阴性乳腺癌具有恶性程度高、预后差和易早期发生远处转移等特点,有效改善预后已经成为临床治疗关注的热点[1]。上皮细胞转化序列2(epithelial cell transforming sequence 2,ECT2)为Rho家族中三磷酸鸟苷(guanosine triphosphate,GTP)酶的鸟嘌呤核苷酸交换因子,与多种肿瘤的发生相关。刺痛感蛋白1(prickle like protein 1,PRICKLE1)为一种核受体,参与Wnt信号通路的调控,进而影响肿瘤细胞的增殖和转移,相关研究证实其是乳腺癌预后不良的标志物[2]。为了探讨PRICKLE1与ECT2在三阴性乳腺癌患者中表达情况及对预后的影响,本院对88例三阴性乳腺癌进行研究,现报道如下。
1 资料和方法 1.1 一般资料收集2013年1月至2014年1月延安市人民医院收治的资料完整的病理确诊为三阴性乳腺癌的88例女性患者的临床和病理资料。年龄20~65岁,平均年龄42.5岁。88例患者乳腺癌根治标本中的癌组织标本为研究对象,远离癌组织的正常乳腺标本作为对照。所有患者术前均未行放疗和化疗。本研究经医院伦理委员会通过,所有患者及其家属均签署知情同意书。
1.2 研究方法PRICKLE1与ECT2抗体均购自美国Sigma公司,免疫组织化学试剂盒和DAB显色试剂盒购自上海国源生物技术有限公司。免疫组织化学以EnVision二步法,PRICKLE1与ECT2抗体浓度比为1∶100。严格参照按试剂说明书进行实验步骤,主要包括切片常规脱蜡至水,3%H2O2液处理标本,高压抗原修复冲洗,加一抗二抗,显色,苏木精复染,脱水、透明和封片等。已知阳性切片作阳性对照,PBS液代替一抗作阴性对照。
ECT2蛋白主要在肿瘤细胞细胞核中表达,PRICKLE1主要表达于细胞膜。根据染色强度和阳性细胞百分率判断来确定PRICKLE1与ECT2的阳性表达。400倍镜下随机选取10个视野,每个视野计数100个细胞。根据阳性细胞百分比确定评分:不表达为0分,阳性细胞占≤10%为1分,11%~50%为2分,51%~80%为3分,81%~100%为4分。根据染色强度确定评分:不显色为0分,浅棕色为1分,棕色为2分,深棕色为3分。两者积分相乘,若总分≤4分为阴性表达,>4分为阳性表达。
所有患者术后每6个月门诊或电话随访1次,直至患者死亡,随访截止日为2018年12月31日。随访内容包括生存情况、是否复发和转移等。
1.3 统计学分析采用SPSS 21.0软件进行统计学分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验。计量资料符合正态分布,采用均数±标准差(x±s)表示,组间比较采用t检验。相关性分析采用Spearman法。采用Kaplan-Meier法和Log-rank检验进行生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 PRICKLE1与ECT2蛋白表达三阴性乳腺癌组织中PRICKLE1与ECT2蛋白表达阳性率为68.2%和70.5%,高于正常乳腺组织的13.6%和10.2%(χ2=54.154, P < 0.01;χ2=66.136, P < 0.01)。
2.2 PRICKLE1与ECT2蛋白表达与临床病理特征的关系三阴性乳腺癌患者PRICKLE1和ECT2蛋白表达阳性率在临床分期和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05,表 1)。
| 临床病理特征 | 例数 | PRICKLE1 | ECT2 | |||||||
| 阳性 | 阴性 | χ2值 | P值 | 阳性 | 阴性 | χ2值 | P值 | |||
| 年龄 | 0.112 | 0.738 | 0.147 | 0.701 | ||||||
| ≤48岁 | 40 | 28(70.0) | 12(30.0) | 29(72.5) | 11(27.5) | |||||
| >48岁 | 48 | 32(66.7) | 16(33.3) | 33(68.8) | 15(31.2) | |||||
| 肿瘤直径 | 0.010 | 0.922 | 0.133 | 0.715 | ||||||
| ≤2 cm | 38 | 28(73.7) | 10(26.3) | 26(68.4) | 12(31.6) | |||||
| >2 cm | 50 | 32(64.0) | 18(36.0) | 36(72.0) | 14(28.0) | |||||
| 临床分期 | 3.959 | 0.047 | 9.828 | 0.002 | ||||||
| Ⅰ~Ⅱ期 | 56 | 34(60.7) | 22(39.3) | 33(58.9) | 23(41.1) | |||||
| Ⅲ期 | 32 | 26(81.3) | 6(18.7) | 29(90.6) | 3(9.4) | |||||
| 淋巴结转移 | 12.729 | < 0.01 | 17.040 | < 0.01 | ||||||
| 是 | 35 | 28(80.0) | 7(20.0) | 30(85.7) | 5(14.3) | |||||
| 否 | 53 | 22(41.5) | 31(58.5) | 22(41.5) | 31(58.5) | |||||
| 组织学分级 | 0.045 | 0.832 | 0.001 | 0.975 | ||||||
| 1~2 | 12 | 8(66.7) | 4(33.3) | 8(66.7) | 4(33.3) | |||||
| 3 | 76 | 52(68.4) | 24(31.6) | 54(71.1) | 22(28.9) | |||||
| 注 PRICKLE1:刺痛感蛋白1(prickle like protein 1);ECT2:上皮细胞转化序列2(epithelial cell transforming sequence 2) | ||||||||||
Spearman相关性分析结果显示,三阴性乳腺癌中PRICKLE1与ECT2蛋白的表达呈正相关(r=0.375,P=0.002;表 2)。
| PRICKLE1 | ECT2 | r值 | P值 | |
| 阳性 | 阴性 | |||
| 阳性 | 44 | 16 | 0.375 | 0.002 |
| 阴性 | 18 | 10 | ||
| 注 PRICKLE1:刺痛感蛋白1(prickle like protein 1);ECT2:上皮细胞转化序列2(epithelial cell transforming sequence 2) | ||||
Kaplan-Meier法显示,PRICKLE1(+)ECT2(+)的三阴性乳腺癌患者5年生存率低于PRICKLE1(+)ECT2(-)、PRICKLE1(-)ECT2(+)以及PRICKLE1(-)ECT2(-)的三阴性乳腺癌患者(P < 0.05,图 1)。
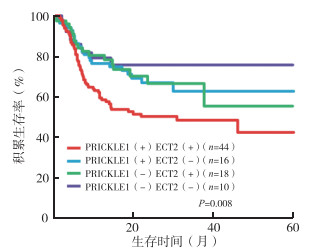
|
| 图 1 不同PRICKLE1与ECT2蛋白表达水平的三阴性乳腺癌患者生存曲线比较 Fig.1 Survival comparison of triple negative breast cancer patients with different PRICKLE1 and ECT2 protein levels |
在乳腺癌中,三阴性乳腺癌是最具侵袭性的一种类型。由于缺乏特定的靶点,目前尚无靶向治疗[3]。在三阴性乳腺癌中PRICKLE1过表达提示预后不良[4]。PRICKLE1蛋白非常依赖受翻译后修饰调控,主要通过泛素化/去泛素化和丝氨酸/苏氨酸激酶磷酸化来调控,进而促进PRICKLE1的功能、膜定位以及与信号分子的联系。ECT2作为一种原癌基因,在多种癌症中频繁表达上调,且影响患者预后[5]。
本研究对88例三阴性乳腺癌患者的PRICKLE1和ECT2蛋白表达水平进行研究。结果显示,三阴性乳腺癌组织PRICKLE1和ECT2蛋白表达水平高于正常组织,且不同临床分期和淋巴结转移患者的PRICKLE1和ECT2蛋白表达阳性率比较,差异均具有统计学意义(均P>0.05)。这表明PRICKLE1和ECT2均参与三阴性乳腺癌的发生和发展过程。相关研究已经证实,ECT2与胃癌、肝癌和食管癌的发生和发展密切相关[6-7]。ECT2与细胞周期调控及细胞分裂密切相关,过表达ECT2的肿瘤细胞增殖和侵袭迁移能力提高。在人乳腺癌MDA-MB-231细胞中,无论是PRICKLE1的缺失会通过促进肌动蛋白束的形成和细胞的扩散而降低细胞的活力,RICKLE1可能通过雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)-蛋白激酶B(protein kinase B,AKT)通路参与调控肿瘤细胞迁移,在肿瘤进展和转移中起着关键作用[8]。
进一步相关性研究发现,三阴性乳腺癌患者的PRICKLE1和ECT2蛋白表达呈正相关(r=0.375,P=0.002),而PRICKLE1(+)ECT2(+)的三阴性乳腺癌患者5年生存率低于PRICKLE1(+)ECT2(-)、PRICKLE1(-)ECT2(+)以及PRICKLE1(-)ECT2(-)的三阴性乳腺癌患者,提示在三阴性乳腺癌的发生和发展过程中,二者可能存在相互协同作用。ECT2是迄今为止唯一确定与该领域有关的蛋白。研究表明,在分子水平上,PRICKLE1以开放和封闭的构象存在[9]。在闭构象中,PRICKLE1的调控关键结构域被屏蔽,在开放构象中,调控关键结构域被打开,从而激活PRICKLE1。通过在这2种构象之间的切换,可以调节PRICKLE1和ECT2之间的相互作用。研究表明,ECT2参与Rac1活性的调控[10]。而PRICKLE1可能参与ECT2的空间定位,从而参与调节Rac活性[11]。研究显示,在三阴性乳腺癌细胞中,ECT2的过表达增加Rac活性,而PRICKLE1可以通过影响ECT2的表达影响Rac活性,提示PRICKLE1可能是迁移癌细胞中局部表达和信号事件调控的主调控因子[12-13]。
作为一项回顾性分析,本研究尚存在一些不足之处:(1)本研究纳入研究的样本量仅为150例,尚显不足,还需进一步扩大样本量;(2)本研究并未涉及PRICKLE1和ECT2蛋白相互作用的分子水平机制,后续还需进一步深入探讨。
综上所述,三阴性乳腺癌组织中PRICKLE1与ECT2蛋白均呈高表达。PRICKLE1与ECT2蛋白在三阴性乳腺癌发生和发展过程中相互之间存在一定的作用,共同考察二者的表达有利于评估患者预后。
| [1] |
陈钦, 张苏展, 胡凯敏, 等. 铂类药物在三阴性乳腺癌新辅助化疗中的应用及前景展望[J]. 实用肿瘤杂志, 2019, 34(1): 86-89. |
| [2] |
王宏坤, 郑绘霞, 梁建芳, 等. ECT2和P21蛋白在乳腺癌中的表达及意义[J]. 山西医科大学学报, 2017, 48(10): 1057-1060. |
| [3] |
陈俊青, 陈占红, 王晓稼. 2018年美国ASCO会议三阴性乳腺癌研究进展[J]. 实用肿瘤杂志, 2018, 33(6): 510-514. |
| [4] |
Takeuchi M, Nakabayashi J, Sakaguchi T, et al. The prickle-related gene in vertebrates is essential for gastrulation cell movements[J]. Curr Biol, 2003, 13(8): 674-679. DOI:10.1016/S0960-9822(03)00245-8 |
| [5] |
Katoh M, Katoh M. Identification and characterization of human PRICKLE1 and PRICKLE2 genes as well as mouse Prickle1 and Prickle2 genes homologous to Drosophila tissue polarity gene prickle[J]. Int J Mol Med, 2003, 11(2): 249. |
| [6] |
Huff LP, Decristo MJ, Trembath D, et al. The role of Ect2 nuclear RhoGEF activity in ovarian cancer cell transformation[J]. Genes Cancer, 2013, 4(11/12): 460-475. |
| [7] |
Justilien V, Ali SA, Jamieson L, et al. Ect2-dependent rRNA synthesis is required for KRAS-TRP53-driven lung adenocarcinoma[J]. Cancer Cell, 2017, 31(2): 256-269. DOI:10.1016/j.ccell.2016.12.010 |
| [8] |
Chiapparo G, Lin X, Lescroart F, et al. Mesp1 controls the speed, polarity, and directionality of cardiovascular progenitor migration[J]. J Cell Biol, 2016, 213(4): 463-477. DOI:10.1083/jcb.201505082 |
| [9] |
Paemka L, Mahajan VB, Ehaideb SN, et al. Seizures are regulated by ubiquitin-specific peptidase 9 X-linked (USP9X), a de-ubiquitinase[J]. PLoS Genet, 2015, 11(3): e1005022. DOI:10.1371/journal.pgen.1005022 |
| [10] |
Daulat A, Bertucci F, Audebert, Stéphane, et al. PRICKLE1 contributes to cancer cell dissemination through its interaction with mTORC2[J]. Dev Cell, 2016, 37(4): 311-325. DOI:10.1016/j.devcel.2016.04.011 |
| [11] |
Chan DW, Chan CY, Yam J, et al. Prickle-1 negatively regulates Wnt/beta-catenin pathway by promoting Dishevelled ubiquitination/degradation in liver cance[J]. Gastroenterology, 2006, 131(4): 1218-1227. DOI:10.1053/j.gastro.2006.07.020 |
| [12] |
Lim BC, Matsumoto S, Yamamoto H, et al. Prickle1 promotes focal adhesion disassembly in cooperation with the CLASPLL5beta complex in migrating cells[J]. J Cell Sci, 2016, 129(16): 3115-3129. DOI:10.1242/jcs.185439 |
| [13] |
Lim BC, Matsumoto S, Yamamoto H, et al. Prickle1 promotes focal adhesion disassembly in cooperation with CLASP-LL5β complex in migrating cells[J]. J Cell Sci, 2016, 129(16): 3115-3129. DOI:10.1242/jcs.185439 |
 2020, Vol. 35
2020, Vol. 35


