文章信息
- 周思成, 姜玉娟, 张景, 毕建军, 陈海鹏, 裴炜, 梁建伟
- Zhou Sicheng, Jiang Yujuan, Zhang Jing, Bi Jianjun, Chen Haipeng, Pei Wei, Liang Jianwei
- 肿瘤细胞减灭术联合腹腔热灌注化疗治疗结直肠癌异时性腹膜转移的临床疗效及预后分析
- Clinical efficacy and prognosis of cytoreductive surgery combined with hyperthermic intraperitoneal chemotherapy in treatment of metachronous peritoneal metastasis of colorectal cancer
- 实用肿瘤杂志, 2022, 37(4): 320-326
- Journal of Practical Oncology, 2022, 37(4): 320-326
基金项目
- 首都卫生发展科研专项项目(首发2016-2-4022)
-
通信作者
- 梁建伟,E-mail:liangjw1976@163.com
-
文章历史
- 收稿日期:2021-08-17
2. 北京市朝阳区桓兴肿瘤医院腹部外科,北京 100122
2. Department of Abdominal Surgery, Cancer Hospital of Huanxing ChaoYang District Beijing, Beijing 100122, China
结直肠癌是全世界常见的恶性肿瘤之一。全球肿瘤流行病统计数据显示,2020年全球结直肠癌新发病例及死亡病例分别占所有恶性肿瘤的第3位和第2位[1-2]。腹膜是结直肠癌根治术后较为少见的复发部位,仅占复发患者的2%~5%[3-4]。此外,腹膜转移(peritoneal metastasis,PM)的患者治疗效果差,预后不理想,以往多采取较为保守的姑息治疗[5]。目前,指南中对于结直肠癌PM仍未形成一致的标准化治疗方案。近些年,细胞减灭术(cytoreductive surgery,CRS)联合腹腔热灌注化疗术(hyperthermic intraperitoneal chemotherapy,HIPEC)逐渐成为PM患者可能的治疗模式,然而其远期疗效仍存在争议。相关文献报道对于特定结直肠癌PM患者,CRS+HIPEC可改善总生存(overall survival,OS)[6-9]。然而,2021年发表的一项来自法国17个癌症中心的Ⅲ期PRODIGE 7随机对照研究显示,CRS+HIPEC并不会为结直肠癌PM患者带来OS获益,相反还会增加术后并发症发生率[10]。因此,目前CRS+HIPEC治疗结直肠癌PM的疗效与安全性仍存在争议。此外,目前多数针对CRS+HIPEC治疗结直肠癌PM的远期疗效的研究并未区分同时性和异时性结直肠癌PM,对于结直肠癌根治术后出现PM的患者行CRS+HIPEC的安全性与有效性仍缺少循证医学证据。本文对本中心34例结直肠癌根治术后出现PM患者行CRS+HIPEC疗效进行分析,旨在探讨CRS+HIPEC治疗结直肠癌根治术后PM的安全性与远期预后因素分析。
1 资料与方法 1.1 病例资料回顾性分析2017年6月至2019年6月在中国医学科学院北京协和医学院肿瘤医院(28例)与北京市朝阳区桓兴肿瘤医院(6例)行CRS+HIPEC治疗的34例结直肠癌异时性PM患者的临床资料。其中男性16例,女性18例;年龄30~75岁,(54.6±10.9)岁。纳入标准:(1)年龄18~75岁;(2)病理证实为结直肠来源的PM;(3)异时性PM,即于首次结直肠癌根治术后≥6个月出现PM或同时性PM手术切除后再次出现腹膜复发。排除标准:(1)既往合并其他恶性肿瘤病史;(2)阑尾来源的恶性肿瘤;(3)急诊手术者。所有患者均签署手术知情同意,本研究的设计与开展经过中国医学科学院北京协和医学院肿瘤医院和北京市朝阳区桓兴肿瘤医院伦理委员会审批通过。
1.2 观察指标收集患者的一般资料、临床特征、围手术期资料以及长期生存预后情况,包括年龄、性别、术前化疗、癌胚抗原(carcinoembryonic antigen,CEA)水平、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平、肿瘤位置、复发时间、合并转移、腹膜癌指数(peritoneal carcinomatosis index,PCI)、病理类型、T分期、N分期、HIPEC化疗方案、手术时间、合并腹腔积液、细胞减灭完整程度(completeness of cytoreduction,CC)评分、术后3~4级并发症和术后出院时间。根据Sugarbaker/Jacquet分类,分别采用PCI和CC评分评估PM灶肿瘤负荷程度和细胞减少完整性[11]。所有术后并发症均采用Clavien-Dindo外科手术并发症分级法进行分级,本研究仅统计3~4级并发症[12]。
1.3 手术方法腹腔镜或开腹探查后,首先采用PCI评估PM肿瘤负荷程度。然后,根据探查情况,按照Sugarbaker腹膜切除程序,切除受累腹膜与脏器,尽可能清除所有肿瘤组织。CRS可能切除的部分包括壁层或脏层腹膜、大网膜、脾脏、胆囊、肝脏、小肠、子宫、卵巢切除术和膀胱等。重建消化道或肠造瘘后,根据减瘤情况进行CC评分。评分标准:CC 0为无肉眼可见残余肿瘤;CC 1为残留肿瘤直径 < 2.5 mm;CC 2为2.5 mm≤残余肿瘤直径≤2.5 cm;CC 3为残余肿瘤直径 > 2.5 cm;其中CC 0~1被定义为完全性CRS。关腹前,分别于肝顶、脾窝和左右盆腔处放置4根腹腔热灌注管。于术后第1、3和5天分别进行1次HIPEC。本研究共采用2种HIPEC化疗方案:奥沙利铂(200 mg/m2)+雷替曲塞(4 mg/m2)或奥沙利铂(200 mg/m2)+雷替曲塞(4 mg/m2)+洛铂(50 mg/m2)。化疗药物溶解于3 L生理盐水中,维持循环水温为42~43℃,循环灌注时间为60 min。
1.4 随访患者术后均根据肿瘤内科医师与自身意愿选择性进行辅助化疗,辅助化疗方案均由2名在胃肠道领域具有专业知识的肿瘤内科医师共同制定。所有患者术后均通过门诊或电话的形式进行随访,术后前2年每3个月进行1次,之后的3年每6个月进行1次随访,直至因肿瘤复发和转移死亡或2020年7月31日。常规复查项目包括:体格检查、胸腹盆CT、盆腔MRI和肿瘤标志物等。本研究的长期终点是2年肿瘤特异性生存(cancer-specific survival,CSS)率。
1.5 统计学分析采用SPSS 24.0统计学软件进行数据分析。计数资料采用频数(百分比)表示。计量资料采用均数±标准差(x±s)表示。采用Kaplan-Meier法绘制患者生存曲线,并用log-rank法比较两组患者的CSS。将Cox单因素分析差异具有统计学意义(P < 0.05)的相关因素纳入多因素Cox比例风险模型。以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床病理资料34例患者中,多数患者原发肿瘤位于左半结肠(41.2%)与直肠(38.2%);6例(17.6%)同时合并肝转移或肺转移;17例(50.0%)PCI≥12分;94.1%的患者原发肿瘤T分期为T3~T4,85.3%的患者原发肿瘤N分期为N1~N2(表 1)。
| 临床病理特征 | 例数(%) |
| 年龄(岁,x±s) | 54.6±10.9 |
| 性别 | |
| 男性 | 16(47.1) |
| 女性 | 18(52.9) |
| 术前化疗 | |
| 有 | 14(41.2) |
| 无 | 20(58.8) |
| 术前CEA水平(ng/ml,x±s) | 17.7±21.8 |
| 术前CA19-9水平(U/L,x±s) | 80.5±102.8 |
| 肿瘤位置 | |
| 右半结肠 | 7(20.6) |
| 左半结肠 | 14(41.2) |
| 直肠 | 13(38.2) |
| 复发时间(月,x±s) | 16.0±11.4 |
| 合并转移 | 6(17.6) |
| 肝 | 6(17.6) |
| 肺 | 1(2.9) |
| PCI | |
| < 12分 | 17(50.0) |
| ≥12分 | 17(50.0) |
| 首次手术病理类型 | |
| 腺癌 | 8(23.5) |
| 黏液腺癌/印戒细胞癌 | 26(76.5) |
| 首次手术原发肿瘤T分期 | |
| T1~T2 | 2(5.9) |
| T3~T4 | 32(94.1) |
| 首次手术原发肿瘤N分期 | |
| N0 | 5(14.7) |
| N1~N2 | 29(85.3) |
| HIPEC化疗方案 | |
| 奥沙利铂+雷替曲塞+洛铂 | 17(50.0) |
| 奥沙利铂+雷替曲塞 | 17(50.0) |
| 手术时间(min,x±s) | 213.4±79.3 |
| 合并腹腔积液 | |
| 有 | 15(44.1) |
| 无 | 19(55.9) |
| CC评分 | |
| CC 0~1 | 25(73.5) |
| CC 2~3 | 9(26.5) |
| 术后3~4级并发症 | 8(23.5) |
| 腹腔出血 | 3(8.8) |
| 腹腔感染 | 2(5.9) |
| 心率失常 | 1(2.9) |
| 肠梗阻 | 3(8.8) |
| 直肠阴道瘘 | 1(2.9) |
| 切口感染 | 2(5.9) |
| 肾功能不全 | 1(2.9) |
| 术后住院时间(d,x±s) | 15.9±7.2 |
| 注 CEA:癌胚抗原(carcinoembryonic antigen,CEA);CA19-9:糖类抗原19-9(carbohydrate antigen 19-9);PCI:腹膜癌指数(peritoneal carcinomatosis index);HIPEC:腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy);CC:细胞减灭完整程度(completeness of cytoreduction) | |
所有患者CRS时间为(213.4±79.3)min,术中探查发现15例(44.1%)患者合并腹腔积液;25例(73.5%)达到完全性CRS(表 1)。术后8例(23.5%)出现3~4级并发症,最常见的并发症依次为腹腔出血(8.8%)、肠梗阻(8.8%)、腹腔感染(5.9%)、切口感染(5.9%)、心率失常(2.9%)、直肠阴道瘘(2.9%)和肾功能不全(2.9%)。全组患者住院时间为(15.9±7.2)d。
2.3 生存分析全组患者中位随访时间为21(4~36)个月,中位OS为26个月。全组患者1、2和3年OS率分别为70.6%、53.6%和42.2%。对各项临床病理特征进行单因素分析显示,肿瘤位置(P=0.022)、PCI(P=0.013)和CC评分(P=0.032)均为影响CSS的因素(表 2)。肿瘤位置位于右半结肠、左半结肠和直肠的患者2年CSS率分别为100.0%、52.5%和28.8%(图 1)。PCI < 12分和≥12分的患者2年CSS率分别为75.9%和26.4%(图 2)。达到完全性CRS与不完全性CRS的患者2年CSS率分别为73.8%和27.2%(图 3)。多因素分析显示,原发肿瘤位于直肠(HR=10.85,95%CI:1.21~97.11,P=0.033)和PCI≥12分(HR=5.22,95%CI:1.13~42.16,P=0.042)为影响CSS的独立危险因素(表 2)。
| 预后因素 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 性别:男性/女性 | 0.91(0.35~2.36) | 0.843 | |||
| 年龄 | 1.01(0.96~1.05) | 0.915 | |||
| 术前化疗:有/无 | 1.48(0.55~4.02) | 0.441 | |||
| 术前CEA水平 | 1.01(0.99~1.03) | 0.186 | |||
| 术前CA19-9水平 | 1.00(0.99~1.01) | 0.483 | |||
| 肿瘤位置 | |||||
| 右半结肠 | - | - | |||
| 左半结肠 | 5.41(0.65~44.89) | 0.118 | 4.40(0.52~37.39) | 0.175 | |
| 直肠 | 12.49(1.43~109.04) | 0.022 | 10.85(1.21~97.11) | 0.033 | |
| 合并转移:有/无 | 2.03(0.66~6.28) | 0.217 | |||
| 首次手术病理类型:腺癌/黏液腺癌或印戒细胞癌 | 0.92(0.30~2.84) | 0.885 | |||
| PCI:≥12分/ < 12分 | 3.86(1.34~11.14) | 0.013 | 5.22(1.13~42.16) | 0.042 | |
| 首次手术原发肿瘤T分期:T3~T4/T1~T2 | 9.00(0.82~99.26) | 0.073 | |||
| 首次手术原发肿瘤N分期:N1~N2/N0 | 1.34(0.27~6.53) | 0.719 | |||
| HIPEC化疗方案:奥沙利铂+雷替曲塞+洛铂/奥沙利铂+雷替曲塞 | 0.75(0.29~1.99) | 0.569 | |||
| 合并腹腔积液:有/无 | 1.39(0.54~3.61) | 0.499 | |||
| CC评分:CC 2~3/CC 0~1 | 2.89(1.09~7.61) | 0.032 | 1.15(0.25~5.25) | 0.856 | |
| 术后3~4级并发症:有/无 | 2.06(0.75~5.61) | 0.159 | |||
| 注 CEA:癌胚抗原(carcinoembryonic antigen,CEA);CA19-9:糖类抗原19-9(carbohydrate antigen 19-9);PCI:腹膜癌指数(peritoneal carcinomatosis index);HIPEC:腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy);CC:细胞减灭完整程度(completeness of cytoreduction) | |||||
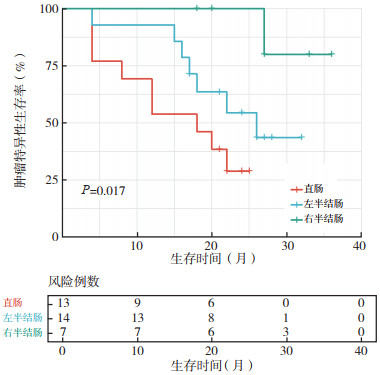
|
| 图 1 不同肿瘤位置对结直肠癌腹膜转移患者CRS+HIPEC治疗后肿瘤特异性生存的影响 Fig.1 Effects of different tumor locations on the cancer-specific survival of colorectal cancer patients with peritoneal metastases after CRS+HIPEC |
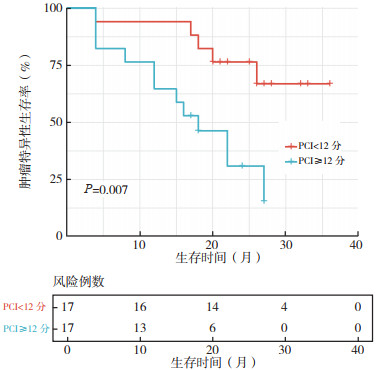
|
| 注 PCI:腹膜癌指数(peritoneal carcinomatosis index) 图 2 不同PCI对结直肠癌腹膜转移患者CRS+HIPEC治疗后肿瘤特异性生存的影响 Fig.2 Effects of different PCI on the cancer-specific survival of colorectal cancer patients with peritoneal metastases after CRS+HIPEC |

|
| 注 CC:细胞减灭完整程度(completeness of cytoreduction) 图 3 细胞歼灭程度对结直肠癌腹膜转移患者CRS+HIPEC治疗后肿瘤特异性生存的影响 Fig.3 Influence of cell annihilation degree on the cancer-specific survival of colorectal cancer patients with peritoneal metastases after CRS+HIPEC |
局部中晚期结直肠癌根治术后常出现复发,治疗方案较为棘手,预后较差。腹膜作为结直肠癌第二常见转移部位,预后往往要差于肝转移或肺转移[13]。通常认为出现异时性转移的患者预后往往优于同时性转移的患者[14]。然而,结直肠癌异时性PM的发生率低,仅为2%~5%,针对结直肠癌异时性PM的治疗及预后,相关报道较少。因此,本文主要探讨CRS+HIPEC治疗结直肠癌异时性PM的有效性以及探讨结直肠癌异时性PM患者CRS+HIPEC后远期预后的独立危险因素。
CRS+HIPEC治疗结直肠癌PM的疗效性目前仍存在较大争议。一项纳入10个国际大样本研究的meta分析显示,CRS+HIPEC术后并发症发生率为12%~52%,死亡率为0.9%~5.8%[15]。因此,明确CRS+HIPEC治疗结直肠癌PM的适应证从而选择特定的患者进行治疗是非常必要的。先前研究已证实,不同发病位置的结直肠癌患者有不同的生物学行为和预后[16-19]。本研究表明,直肠起源是异时性结直肠癌PM患者CRS+HIPEC治疗后的独立不良预后因素(HR-=10.85,95%CI:1.21~97.11,P=0.033)。一项分析CRS+HIPEC治疗结直肠PM患者的疗效情况的研究表明,与结肠来源的PM患者比较,直肠来源的PM患者中位OS缩短(47.8个月vs 22.0个月)[17]。da Silva等[16]也发现结肠起源的PM患者的预后优于直肠起源的PM患者(中位OS:35.0个月vs 17.0个月),与本研究结论基本一致。目前已有相关理论给出直肠起源的PM患者在CRS+HIPEC治疗后预后差的原因:(1)解剖学层面上,直肠肿瘤位于狭窄的盆腔内,解剖位置的特殊性与操作空间术野的限制,使原发肿瘤与盆腔PM灶的切除更加困难,使得实现完全性的CRS成为一项挑战,术后肿盆壁肿瘤细胞残存的可能性增加[11];(2)中低位直肠癌(腹膜返折以下)周围直肠壁及系膜较结肠厚,一旦肿瘤穿透直肠壁造成腹膜播散往往预示该人群的肿瘤生物学行为更具有侵袭性[16];(3)直肠癌PM患者在CRS+HIPEC治疗后更容易出现吻合口瘘、盆腔感染和泌尿系统功能障碍等并发症,并发症的发生对患者的全身情况以及后续辅助放化疗都有不利的影响,从而影响患者预后。然而,上述机制仅限于理论层面,未来仍需进一步研究,从基因水平进一步解释不同部位PM患者预后的差异。
此外,本研究发现,PCI≥12分(HR=5.22,95%CI:1.13~42.16,P=0.042)也是异时性结直肠癌PM患者CRS+HIPEC治疗后的独立不良预后因素。PCI是目前国内外常用的衡量PM程度的方法,对腹膜表面肿瘤负荷进行量化,PCI可作为预测完全性CRS的可能性,对患者远期预后也有一定评估作用[20-21]。一项纳入298例结直肠癌患者的回顾性研究显示,PCI是影响OS率(HR=1.05,95%CI:1.03~1.08,P < 0.01)与无疾病进展生存率(HR=1.05,95%CI:1.02~1.07,P < 0.01)的独立危险因素[22]。法国一项Ⅲ期临床试验表明,只有PCI为11~15分的亚组结直肠PM患者可通过CRS+HIPEC延长中位OS与无复发生存期[10]。中国医师协会结直肠肿瘤专委会腹膜肿瘤专业委员会也将PCI < 20分列为结直肠癌PM患者CRS+HIPEC的适应证之一[23]。
综上所述,CRS+HIPEC的开展应对患者进行详细的术前评估且严格遵循手术适应证,对于直肠起源和PCI≥12分的结直肠癌PM患者,可能通过CRS+HIPEC治疗中的生存获益较少,应谨慎选择。目前关于结直肠癌异时性PM患者行CRS+HIPEC的研究多属回顾性,仍需多中心大样本前瞻性随机临床试验进一步证实其安全性与疗效。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA, 2021, 71(3): 209-249. |
| [2] |
程龙, 刘晓昌, 梅俏. 关于建立结直肠癌立体防治系统的探讨[J]. 实用肿瘤杂志, 2021, 36(1): 1-5. |
| [3] |
Nagata H, Ishihara S, Hata K, et al. Survival and prognostic factors for metachronous peritoneal metastasis in patients with colon cancer[J]. Ann Surg Oncol, 2017, 24(5): 1269-1280. DOI:10.1245/s10434-016-5732-z |
| [4] |
Mayanagi S, Kashiwabara K, Honda M, et al. Risk factors for peritoneal recurrence in stage Ⅱ to Ⅲ colon cancer[J]. Dis Colon Rectum, 2018, 61(7): 803-808. DOI:10.1097/DCR.0000000000001002 |
| [5] |
Mo SB, Cai GX. Multidisciplinary treatment for colorectal peritoneal metastases: review of the literature[J]. Gastroenterol Res Pract, 2016, 2016: 1516259. |
| [6] |
Bushati M, Rovers KP, Sommariva A, et al. The Current practice of cytoreductive surgery and HIPEC for colorectal peritoneal metastases: results of a worldwide web-based survey of the Peritoneal Surface Oncology Group International (PSOGI)[J]. Eur J Surg Oncol, 2018, 44(12): 1942-1948. DOI:10.1016/j.ejso.2018.07.003 |
| [7] |
Cashin PH, Mahteme H, Spång N, et al. Cytoreductive surgery and intraperitoneal chemotherapy versus systemic chemotherapy for colorectal peritoneal metastases: a randomised trial[J]. Eur J Cancer, 2016, 53: 155-162. DOI:10.1016/j.ejca.2015.09.017 |
| [8] |
van Driel WJ, Koole SN, Sikorska K, et al. Hyperthermic intraperitoneal chemotherapy in ovarian cancer[J]. N Engl J Med, 2018, 378(3): 230-240. DOI:10.1056/NEJMoa1708618 |
| [9] |
Klaver CEL, Wisselink DD, Punt CJA, et al. Adjuvant hyperthermic intraperitoneal chemotherapy in patients with locally advanced colon cancer (COLOPEC): a multicentre, open-label, randomised trial[J]. Lancet Gastroenterol Hepatol, 2019, 4(10): 761-770. DOI:10.1016/S2468-1253(19)30239-0 |
| [10] |
Quénet F, Elias D, Roca L, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy versus cytoreductive surgery alone for colorectal peritoneal metastases (PRODIGE 7): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2021, 22(2): 256-266. DOI:10.1016/S1470-2045(20)30599-4 |
| [11] |
Sugarbaker PH. Update on the prevention of local recurrence and peritoneal metastases in patients with colorectal cancer[J]. World J Gastroenterol, 2014, 20(28): 9286-9291. |
| [12] |
Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg, 2004, 240(2): 205-213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [13] |
Franko J, Shi Q, Meyers JP, et al. Prognosis of patients with peritoneal metastatic colorectal cancer given systemic therapy: an analysis of individual patient data from prospective randomised trials from the Analysis and Research in Cancers of the Digestive System (ARCAD) database[J]. Lancet Oncol, 2016, 17(12): 1709-1719. DOI:10.1016/S1470-2045(16)30500-9 |
| [14] |
Kumar R, Price TJ, Beeke C, et al. Colorectal cancer survival: an analysis of patients with metastatic disease synchronous and metachronous with the primary tumor[J]. Clin Colorectal Cancer, 2014, 13(2): 87-93. DOI:10.1016/j.clcc.2013.11.008 |
| [15] |
Chua TC, Yan TD, Saxena A, et al. Should the treatment of peritoneal carcinomatosis by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy still be regarded as a highly morbid procedure? : a systematic review of morbidity and mortality[J]. Ann Surg, 2009, 249(6): 900-907. DOI:10.1097/SLA.0b013e3181a45d86 |
| [16] |
da Silva RG, Sugarbaker PH. Analysis of prognostic factors in seventy patients having a complete cytoreduction plus perioperative intraperitoneal chemotherapy for carcinomatosis from colorectal cancer[J]. J Am Coll Surg, 2006, 203(6): 878-886. DOI:10.1016/j.jamcollsurg.2006.08.024 |
| [17] |
Tonello M, Ortega-Perez G, Alonso-Casado O, et al. Peritoneal carcinomatosis arising from rectal or colonic adenocarcinoma treated with cytoreductive surgery (CRS) hyperthermic intraperitoneal chemotherapy (HIPEC): two different diseases[J]. Clin Transl Oncol, 2018, 20(10): 1268-1273. DOI:10.1007/s12094-018-1857-9 |
| [18] |
Zhang RX, Ma WJ, Gu YT, et al. Primary tumor location as a predictor of the benefit of palliative resection for colorectal cancer with unresectable metastasis[J]. World J Surg Oncol, 2017, 15(1): 138. DOI:10.1186/s12957-017-1198-0 |
| [19] |
Kelly KJ, Alsayadnasser M, Vaida F, et al. Does primary tumor side matter in patients with metastatic colon cancer treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy?[J]. Ann Surg Oncol, 2019, 26(5): 1421-1427. DOI:10.1245/s10434-019-07255-5 |
| [20] |
米迷, 翁姗姗, 陆德珉, 等. 2021年晚期结直肠癌治疗研究进展[J]. 实用肿瘤杂志, 2022, 37(1): 23-28. |
| [21] |
Zhou SC, Feng Q, Zhang J, et al. High-grade postoperative complications affect survival outcomes of patients with colorectal cancer peritoneal metastases treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. BMC Cancer, 2021, 21(1): 41. DOI:10.1186/s12885-020-07756-7 |
| [22] |
Beal EW, Suarez-Kelly LP, Kimbrough CW, et al. Impact of neoadjuvant chemotherapy on the outcomes of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for colorectal peritoneal metastases: a multi-institutional retrospective review[J]. J Clin Med, 2020, 9(3): E748. DOI:10.3390/jcm9030748 |
| [23] |
中国医师协会结直肠肿瘤专委会腹膜肿瘤专业委员会. 结直肠癌腹膜转移诊治中国专家意见(2017)[J]. 中华结直肠疾病电子杂志, 2017, 6(5): 360-366. DOI:10.3877/cma.j.issn.2095-3224.2017.05.002 |
 2022, Vol. 37
2022, Vol. 37


