文章信息
- 孟庆娜, 郎嘉恒, 王林波
- Meng Qingna, Lang Jiaheng, Wang Linbo
- KLF4/xCT轴通过促进铁死亡调控乳腺癌他莫昔芬耐药
- KLF4/xCT axis regulates tamoxifen resistance in breast cancer by promoting ferroptosis
- 实用肿瘤杂志, 2025, 40(3): 227-237
- Journal of Practical Oncology, 2025, 40(3): 227-237
-
通信作者
- 王林波, Email: linbowang@zju.edu.cn
-
文章历史
- 收稿日期:2024-10-28
2. 浙江大学医学院,浙江 杭州 310000
2. School of Medicine, Zhejiang University, Hangzhou 310000, China
据国家癌症中心发布的2024年全国癌症报告显示,乳腺癌是影响女性健康最常见的肿瘤之一,高居中国女性恶性肿瘤发病率的第2位,死亡率的第5位[1]。最常见的乳腺癌为Luminal型[雌激素受体(estrogen receptor, ER)阳性(ER+)乳腺癌],约占全部乳腺癌的70%,内分泌治疗在其综合治疗中具有重要作用[2]。他莫昔芬作为内分泌治疗的重要药物,有效改善此类患者的预后,但原发性和继发性耐药的发生严重影响他莫昔芬的治疗效果[3]。
铁死亡是一种新型的铁依赖性脂质过氧化损伤所导致的细胞死亡形式[4]。在乳腺癌研究领域,铁死亡的重要性也逐渐被发现,并被证实可能参与乳腺癌耐药。研究表明,他莫昔芬耐药的乳腺癌细胞受转录因子调控导致脂质活性氧(reactive oxygen species, ROS)水平升高,降低铁死亡相关蛋白谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)水平可使他莫昔芬耐药株对他莫昔芬重新敏感[5]。
RSL3是一种GPX4抑制剂,直接作用于GPX4抑制其活性,进一步诱导铁死亡发生[6]。溶质载体家族7成员11(solute carrier family 7 member 11, SLC7A11;又名xCT)作为System Xc-的重要功能亚单位,位于细胞膜上,介导胱氨酸的摄取和谷氨酸的外运,胱氨酸进入细胞后被还原成半胱氨酸,作为谷胱甘肽(glutathione, GSH)合成的底物,维持细胞氧化还原平衡[7]。Erastin是一类经典的铁死亡诱导剂。其机制是通过抑制System Xc-的功能,阻止胞外的胱氨酸摄入内部,进而阻断细胞内GSH的合成,削弱细胞的抗氧化防御系统,最终导致细胞发生铁死亡[6]。
Krüppel样因子(Krüppel-like factor, KLF)家族是一类具有锌指结构的转录因子,参与调控细胞增殖、凋亡与分化和胚胎发育等重要生命过程[8]。作为KLF家族中重要的一员,KLF4参与细胞增殖与分化、自我更新和个体发育等多种生理过程,并与代谢性疾病、心血管疾病和癌症等疾病的发生有关[9-10]。KLF4通过KLF4/胎盘特异蛋白8(placenta special gene 8, PLAC8)信号通路抑制肺癌细胞的增殖[11]。研究表明,乳腺癌中KLF4的表达水平与内分泌治疗敏感性相关,KLF4协调ER信号传导可以促进内分泌耐药[12]。目前尚未见到KLF4靶向铁死亡相关蛋白影响ER+乳腺癌他莫昔芬耐药的相关报道。
本研究首次发现抑制KLF4可以降低铁死亡相关蛋白表达水平,逆转乳腺癌他莫昔芬耐药,为乳腺癌他莫昔芬耐药的预测和治疗靶点的开发提供理论依据。
1 材料与方法 1.1 细胞和主要试剂人ER+乳腺癌细胞系MCF-7购自上海中国科学院。采用本课题组2019年建立的ER+乳腺癌细胞系MCF-7及其他莫昔芬耐药细胞株(MCF-7/TAMR,以下简称为TAMR)为实验模型,采用他莫昔芬浓度梯度递增法(依次为0、2、4、6、8、10、12和15 μmol/L)持续诱导培养6个月,成功构建稳定的他莫昔芬耐药性细胞模型。采用含1 μmol/L的他莫昔芬和10%胎牛血清的RPMI 1640培养液于37℃、5%CO2培养箱中培养TAMR细胞。
蛋白质印迹法(Western blotting)采用的抗体包括GPX4(ab125066;Abcam,英国)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH;sc-47724;Santa Cruz,美国)、xCT(12691T;Cell Signaling Technology,美国)和KLF4(11880-1-AP;Proteintech,美国)抗体,以及羊抗小鼠和羊抗兔二抗(上海碧云天生物技术有限公司)。采用的化学试剂包括铁死亡诱导剂Erastin(S7242;Selleck,美国)、GPX4抑制剂RSL3(HY-100218A;MedChemExpress,美国)和他莫昔芬(T9262-1G;Sigma-Aldrich,德国)。二价铁离子检测探针采用FerroOrange(F374;同仁化学研究所,日本)。
1.2 细胞活力测定采用购自北京博奥森的细胞计数试剂盒(Cell Counting Kit-8,CCK-8;K1018)评估细胞活力。将MCF-7和TAMR细胞接种在含10%胎牛血清的RPMI 1640培养液的96孔板中,不同浓度的他莫昔芬、Erastin和RSL3处理48 h后,培养液替换为含有10 μL CCK-8试剂的100 μL新鲜RPMI 1640培养液,在37℃、5%CO2培养箱中培养2 h。采用分光光度计在450 nm处测量吸光度值。
1.3 克隆形成实验取处于对数生长期的细胞,用胰蛋白酶消化后吹打成单细胞悬液,计数并按需求稀释,以每孔2 000个细胞的数量铺至6孔板中。将6孔板置于37℃、5%CO2及饱和湿度的细胞培养箱中培养。待细胞贴壁后,根据细胞药物敏感性的差异,加入相应浓度的药物,继续培养2~3周,定期更换新鲜培养液。当6孔板中出现肉眼可见的单细胞克隆时,弃去培养液并用PBS小心清洗3次,加入预冷的组织固定液固定15 min。倒掉固定液,加入适量0.1%结晶紫染液染色,室温下静置15 min。弃去结晶紫染液后,用流水小心洗去残留的染液,室温晾干。拍照并计数克隆的数目。
1.4 流式细胞术使用C11-BODIPY染料(D3861;Invitrogen,美国)评估细胞中的相对脂质ROS水平。将MCF-7和TAMR细胞接种于24孔板中,培养24 h后,分别用100 nmol/L和1 000 nmol/L RSL3处理2 h后,再用2 μmol/L C11-BODIPY染料处理20 min。收集细胞,用PBS洗涤2次,并在500 μL PBS中重悬。然后使用BD FACSCalibur流式细胞仪(BD Biosciences,美国)进行分析,采用FL1检测通道,激发波长为488 nm。分析所得数据显示细胞中相对脂质ROS水平归一化到对照样本。
使用Phen GreenTM SK diacetate(PGSK)染料(GC40243;Invitrogen,美国)评估细胞中的Fe2+水平。按照PGSK说明书处理细胞,并加入10 μmol/L PGSK染料孵育10 min后,用PBS洗涤细胞2次,加入0.25%的胰蛋白酶100 μL消化1 min重悬于PBS中。采用流式细胞仪检测Fe2+水平,荧光强度越高,Fe2+水平越低。
1.5 探针FerroOrange检测游离Fe2+接种转染后的细胞于培养皿中,在37℃、5%CO2培养箱中过夜培养。更换含有药物的培养液,在37℃、5%CO2培养箱中培养12 h。请根据药物特性优化培养时间。去除培养液,用无血清培养液清洗3次。加入浓度为1 μmol/L的FerroOrange工作液,在37℃、5%CO2培养箱中培养9 min。培养后在荧光显微镜下观察细胞。
1.6 RNA的提取和实时荧光定量PCR用RNAfast200试剂盒(上海飞捷生物技术有限公司)提取总RNA。在处理好的样本管中,加入RA2液500 μL,充分颠倒混匀5~10次(至裂解物澄清),静置1 min。将样本裂解物全部吸入或倒入内套管(已插在外套管中),离心1 min。取出内套管,吸弃外套管中液体后放回内套管,加入500 μL洗液,8 000 r/min离心1 min,洗2次。取出内套管,吸弃外套管中液体后放回内套管,不加洗液,离心1 min。将内套管移入新的1.5 mL EP管中,在膜中央加入洗脱液25 μL。室温静置1 min后,离心1 min,获得总RNA。将总RNA置于恒温水浴箱(DK-8D型,上海精宏实验设备有限公司)中执行程序:37℃持续20 min完成逆转录反应,85℃高温灭活5 s。产物用无核酸酶水进行5倍稀释后可直接用于下游PCR扩增,或分装储存于-80℃长期保存。
使用以下引物序列通过PCR扩增目标基因:xCT正向引物为5’-TCATTGGAGCAGGAATCTTCA-3’,反向引物为5’-TTCAGCATAAGACAAAGCTCCA-3’;GAPDH正向引物为5’-TGTGGGCATCAATGGATTTGG-3’,反向引物为5’-ACACCATGTATTCCGGGTCAAT-3’;KLF4正向引物为5’-CGGACCACCTCGCCTTACA-3’,反向引物为5’-CTGGGCTCCTTCCCTCATCG-3’。PCR反应条件:94℃预变性5 min;95℃ 10 s,60℃ 30 s,72℃ 15 s,42个循环;72℃延伸10 min。
1.7 蛋白质印迹法使用胰蛋白酶-EDTA消化液消化并离心收集24孔板中细胞,加入80 μL RIPA强裂解液(上海碧云天生物技术有限公司),裂解液中包含0.8 μL蛋白酶抑制剂(上海罗氏制药有限公司),冰上裂解细胞20 min,4℃ 12 000 r/min离心15 min,吸取上清转移至新的1.5 mL离心管中用二喹啉甲酸(bicinchoninic acid, BCA)试剂盒(上海碧云天生物技术有限公司)测定蛋白浓度,根据所测蛋白浓度,取对应体积蛋白样品转移至新的1.5 mL离心管中,加入5×蛋白上样缓冲液,100℃金属浴10 min,再4℃ 12 000 r/min离心10 s,蛋白样品制备完成。SDS-PAGE电泳:80 V跑浓缩胶,待蛋白样品跑完浓缩胶进入分离胶时,将电压调至120 V,根据所需蛋白条带终止电泳。转膜330 mV 90 min,5%脱脂牛奶封闭1 h,敷一抗KLF4(1∶1 000)、GAPDH(1∶2 000)、GPX4(1∶1 000)和xCT(1∶1 000)4℃过夜,1×TBST溶液洗涤3次,辣根过氧化物酶标记的二抗(羊抗小鼠或羊抗兔,1∶5 000)室温孵育1 h,ECL试剂发光显影并拍照,WB成像系统(上海嘉鹏科技有限公司)扫膜,ECL试剂发光显影并拍照,Image J软件进行分析。
1.8 质粒构建和细胞转染采用细胞转染腺病毒KLF4(Ad-KLF4)的质粒以实现KLF4的过表达(OE-KLF4);以质粒载体Ad-LacZ作为非特异性阴性对照(OE-NC)。质粒Ad-KLF4和Ad-LacZ来自胡文贤博士(浙江大学邵逸夫医院)[13],后续课题组进行留种扩增。采用携带小干扰RNA(small interference RNA, siRNA)的逆转录病毒来敲降KLF4、xCT和GPX4的表达。KLF4 siRNA(si-KLF4正义链:5’-GCAGCUUCACCUAUCCGAU-3’,反义链:5’-AUCGGAUAGGUGAAGCUGC-3’)、GPX4 siRNA(si-GPX4正义链:5’-GGAGUAACGAAGAGAUCAA-3’,反义链:5’-UUGAUCUCUUCGUUACUCC-3’)和敲降对照siRNA(si-NC正义链:5’-UUCUCCGAACGUGUCACGU-3’,反义链:5’-ACGUGACACGUUCGGAGAA-3’)均购自北京擎科生物科技有限公司,si-NC可通用。xCT siRNA(si-xCT正义链:5’-CCAGAUAUGCAUCGUCCUUTT-3’,反义链:5’-AAGGACGAUGCAUAUCUGGTT-3’)及其敲降对照siRNA(si-NC*正义链:5’-UUCUCCGAACGUGUCACGUTT-3’,反义链:5’-ACGUGACACGUUCGGAGAATT-3’)购自苏州吉玛基因股份有限公司。使用LipofectamineTM 3000转染试剂(Invitrogen,美国)按照说明书将质粒和siRNA转染到细胞中。细胞在转染质粒或siRNA 8 h后更换培养液,37℃、5%CO2培养箱培养48 h后收集并进行分析。
1.9 染色质免疫沉淀(chromatin immuno-precipitation, ChIP)采用SimpleChIP® Plus Enzymatic Chromatin IP Kit(Magnetic Beads)#9005(Cell Signaling Technology,美国)进行ChIP实验。染色质用抗KLF4、抗H3(阳性对照)和正常的兔IgG抗体(阴性对照)进行免疫共沉淀。ChIP实验抗体(Cell Signaling Technology,美国)稀释比例为1 μg抗体∶100 μL裂解液。采用定量PCR检测DNA,在JASPAR数据库进行转录因子KLF4与xCT结合位点的预测。预测xCT启动子的序列如下:xCT primer1:5’-ACCCACCC-3’;xCT primer2:5’-TTACCCACCCAA-3’。
1.10 Percent Input法Percent Input法是ChIP测序(ChIP-seq)中一种常用的信号标准化方法,用于将实验组(免疫沉淀后的DNA)信号与对照组(Input DNA,即未免疫沉淀的总DNA)进行比较。用定量PCR仪自带的程序定量结果,并利用公式,Percent Input=(Input信号/ChIP信号)×100%.
1.11 统计学分析采用GraphPad Prism 9.5软件和Excel软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,组间比较采用two-way ANOVA检验和t检验。采用Kaplan-Meier法绘制生存曲线。以P < 0.05为差异具有统计学意义。
2 结果 2.1 他莫昔芬耐药细胞株铁死亡敏感性更高他莫昔芬药物浓度梯度(0、5、10、15、20、25、30、35、40和50 μmol/L)处理MCF-7和TAMR细胞48 h后,采用CCK-8实验检测细胞活力;不同浓度他莫昔芬(0、10和20 μmol/L)处理MCF-7和TAMR细胞2周后,采用平板克隆形成实验检测细胞耐药性。CCK-8实验和平板克隆形成实验验证TAMR细胞株作为乳腺癌他莫昔芬耐药模型的有效性(均P < 0.05,图 1A~1B)。在MCF-7和TAMR细胞中加入(0、5、10、15、20、25、35和45 μmol/L)浓度的铁死亡诱导剂Erastin培养48 h后实验显示,在20、25、35和45 μmol/L浓度下,TAMR细胞活力较MCF-7细胞下降(均P < 0.01,图 2A)。不同浓度RSL3(0、25、50、100、200、300、400、500、1 000和2 000 nmol/L)处理MCF-7和TAMR细胞48 h后检测显示,200、300、400、500、1 000和2 000 nmol/L浓度下,TAMR细胞的细胞活力较MCF-7细胞下降(均P < 0.01,图 2B)。流式细胞术实验发现,RSL3在100 nmol/L和1 000 nmol/L浓度下处理2 h后,TAMR和MCF-7细胞脂质ROS水平均升高,且TAMR的脂质ROS水平的升高幅度大于MCF-7细胞(图 2C)。以上结果提示TAMR细胞铁死亡敏感性更高。
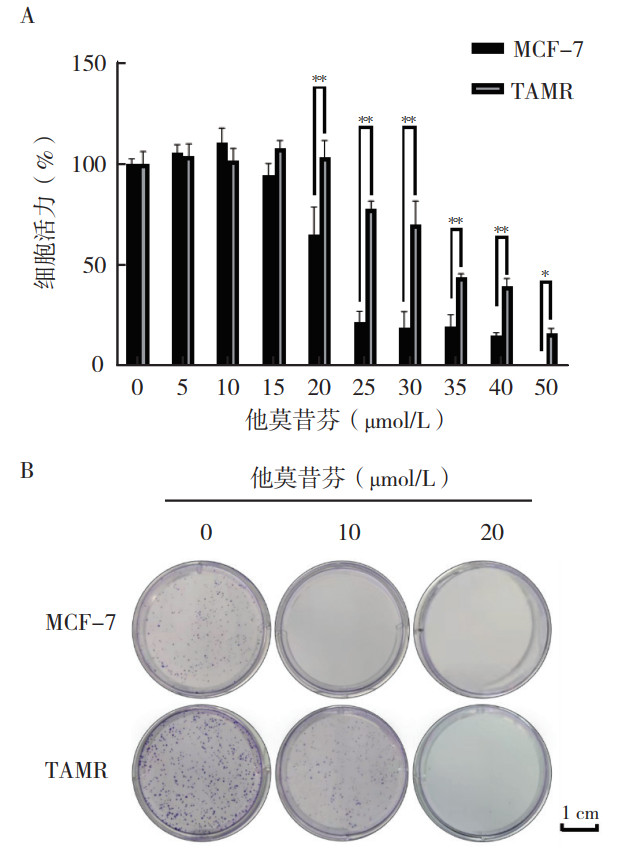
|
| 注 A:CCK-8实验检测MCF-7和TAMR细胞在他莫昔芬处理48 h后的细胞活力;B:平板克隆形成实验验证TAMR细胞的耐药性;*P < 0.05;**P < 0.01 图 1 细胞活力测定和平板克隆形成实验验证乳腺癌莫昔芬耐药细胞株TAMR的耐药性 Fig.1 Tamoxifen resistance in tamoxifen-resistant breast cancer TAMR cells validated by cell viability assay and colony formation assay |
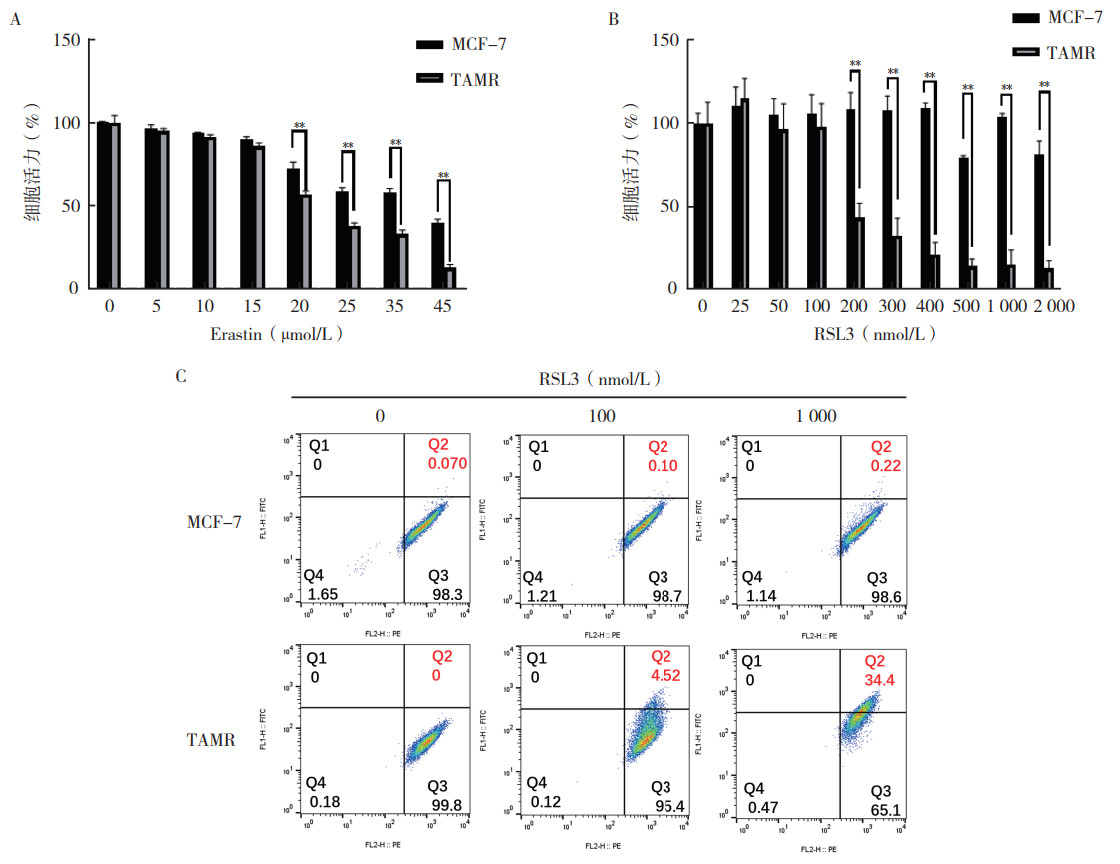
|
| 注 A:CCK-8实验检测MCF-7和TAMR细胞在Erastin处理48 h后的细胞活力;B:CCK-8实验检测MCF-7和TAMR细胞在RSL3处理48 h后的细胞活力;C:流式细胞术检测RSL3作用MCF-7和TAMR细胞2 h后脂质ROS水平的变化;**P < 0.01 图 2 MCF-7和TAMR细胞经过铁死亡诱导剂处理后的细胞活力和脂质ROS水平变化 Fig.2 Alterations in the cell viability and lipid ROS levels of MCF-7 and TAMR cells following treatment with ferroptosis inducers |
蛋白质印迹法显示,TAMR细胞中铁死亡相关蛋白xCT和GPX4表达水平均高于MCF-7细胞(图 3A)。20、30和40 μmol/L他莫昔芬作用48 h后,敲降xCT的TAMR细胞活力变差(均P < 0.01);5、10、15和20 μmol/L他莫昔芬作用48 h后,敲降GPX4的TAMR细胞活力变差(均P < 0.01),对他莫昔芬敏感性变高(图 3B~3E)。以上结果提示在TAMR细胞中敲降xCT和GPX4可使细胞对他莫昔芬重新敏感。
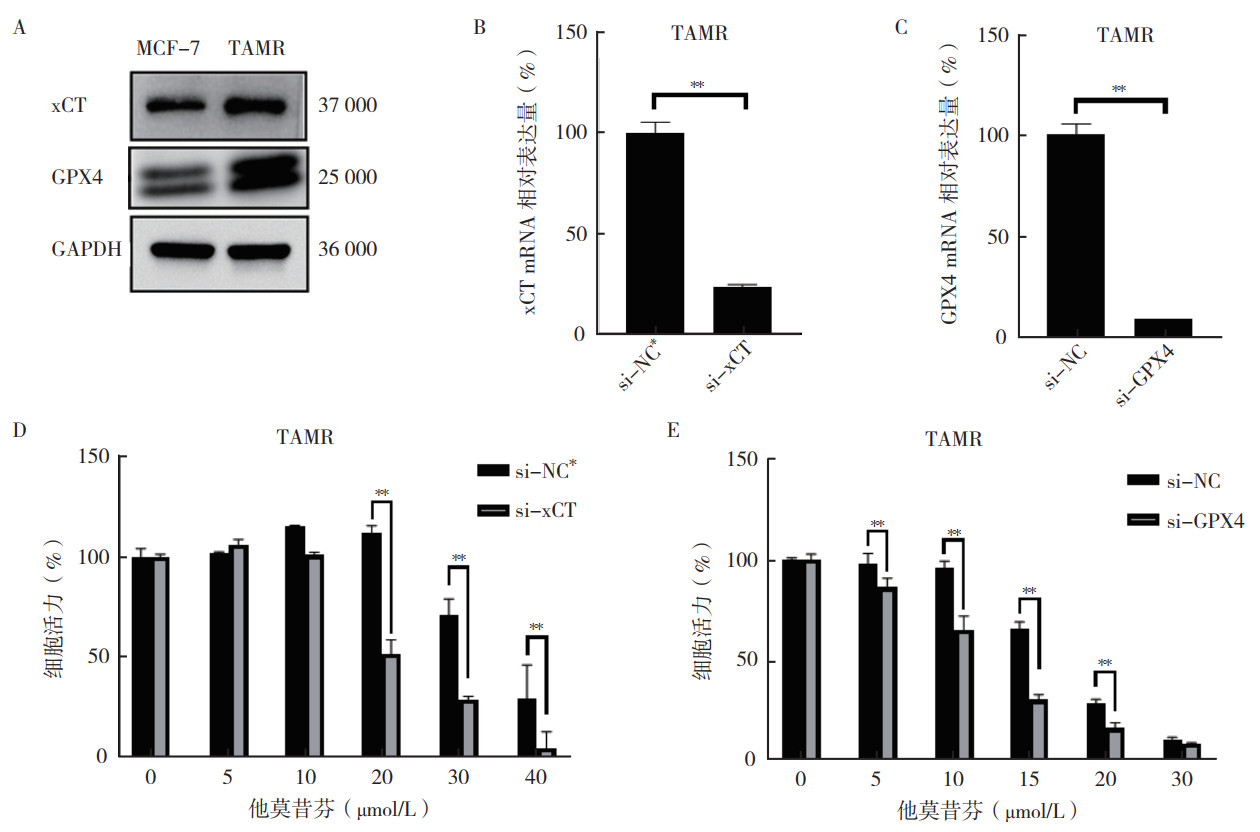
|
| 注 A:蛋白质印迹法检测MCF-7和TAMR细胞铁死亡相关蛋白xCT和GPX4的表达水平;B:PCR检测TAMR细胞敲降xCT后xCT mRNA水平的变化;C:PCR检测TAMR细胞敲降GPX4后GPX4 mRNA水平的变化;D:CCK-8检测TAMR细胞中敲降xCT后他莫昔芬处理48 h后的细胞活力;E:CCK-8检测TAMR细胞中敲降GPX4后他莫昔芬处理48 h后的细胞活力;GPX4:谷胱甘肽过氧化物酶4(glutathione peroxidase 4);GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase);**P < 0.01 图 3 靶向铁死亡相关蛋白影响TAMR细胞他莫昔芬敏感性 Fig.3 Targeting ferroptosis-related proteins affected the tamoxifen sensitivity of TAMR cells |
与MCF-7细胞比较,TAMR细胞中KLF4蛋白表达水平上调(P < 0.05,图 4A)。进一步功能研究表明,KLF4表达水平的调控与耐药表型有关。通过RNA干扰技术敲降KLF4可以使TAMR细胞对他莫昔芬(5、10、20和30 μmol/L)浓度重新敏感,而KLF4过表达则增强其的耐药特性(均P < 0.05,图 4B~4C)。在TAMR细胞中敲降KLF4,处理48 h后加入30 μmol/L他莫昔芬,12 h后加入二价铁离子检测探针FerroOrange。结果显示,和敲降对照组(si-NC)比较,敲降KLF4的细胞内游离Fe2+增加(图 4E)。TAMR细胞敲降KLF4后加入1 μmol/L铁死亡抑制剂铁他汀-1(Fer-1)处理48 h后发现,Fer-1可以阻断敲降KLF4所诱导的细胞毒性(图 4D),表明KLF4参与铁死亡。在TAMR细胞中过表达KLF4后加入铁死亡诱导剂Erastin和RSL3处理48 h,TAMR细胞活力增加,过表达KLF4可以阻断Erastin(80 μmol/L)和RSL3(25 nmol/L)所诱导的细胞毒性(均P < 0.01,图 4F~4G)。TAMR细胞中过表达KLF4后加入100 nmol/L RSL3处理2 h,检测脂质ROS和Fe2+的水平。结果显示,过表达KLF4可以挽救RSL3所导致的脂质ROS和Fe2+水平的升高(图 5A~5B)。以上结果表明,KLF4可以影响TAMR细胞的他莫昔芬和铁死亡敏感性。
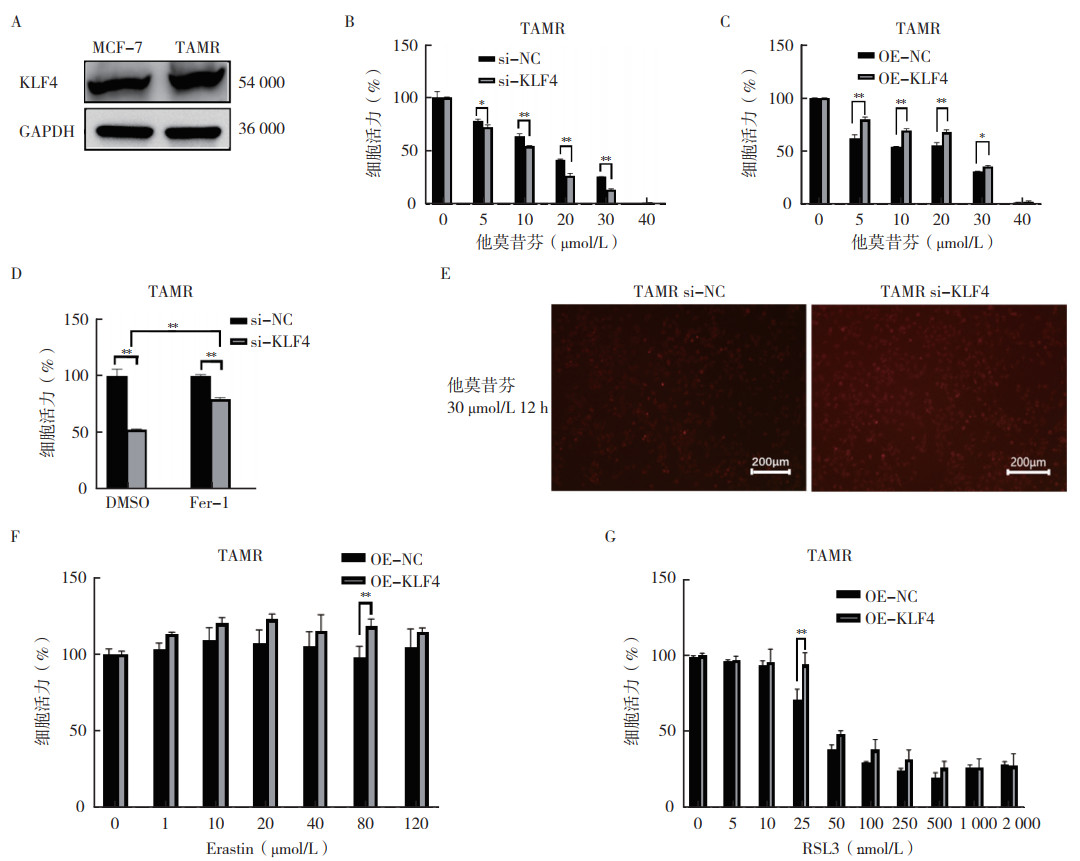
|
| 注 A:蛋白质印迹法检测MCF-7与TAMR细胞中KLF4蛋白水平;B:CCK-8检测TAMR细胞中敲降KLF4后他莫昔芬处理48 h后的细胞活力;C:CCK-8检测过表达KLF4后他莫昔芬处理48 h后的细胞活力;D:CCK-8检测TAMR细胞中敲降KLF4后加入铁死亡抑制剂Fer-1(1 μmol/L)处理48 h后的细胞活力;E:二价铁离子探针FerroOrange检测TAMR细胞中敲降KLF4后经他莫昔芬处理后的Fe2+水平;F:CCK-8检测TAMR细胞中过表达KLF4后加入铁死亡诱导剂Erastin处理48 h后的细胞活力;G:CCK-8检测TAMR细胞中过表达KLF4后加入GPX4抑制剂RSL3处理48 h后的细胞活力;*P < 0.05;**P < 0.01 图 4 KLF4影响TAMR细胞的他莫昔芬和铁死亡敏感性 Fig.4 KLF4 regulated the responsiveness of TAMR cells to tamoxifen and the susceptibility to ferroptosis |
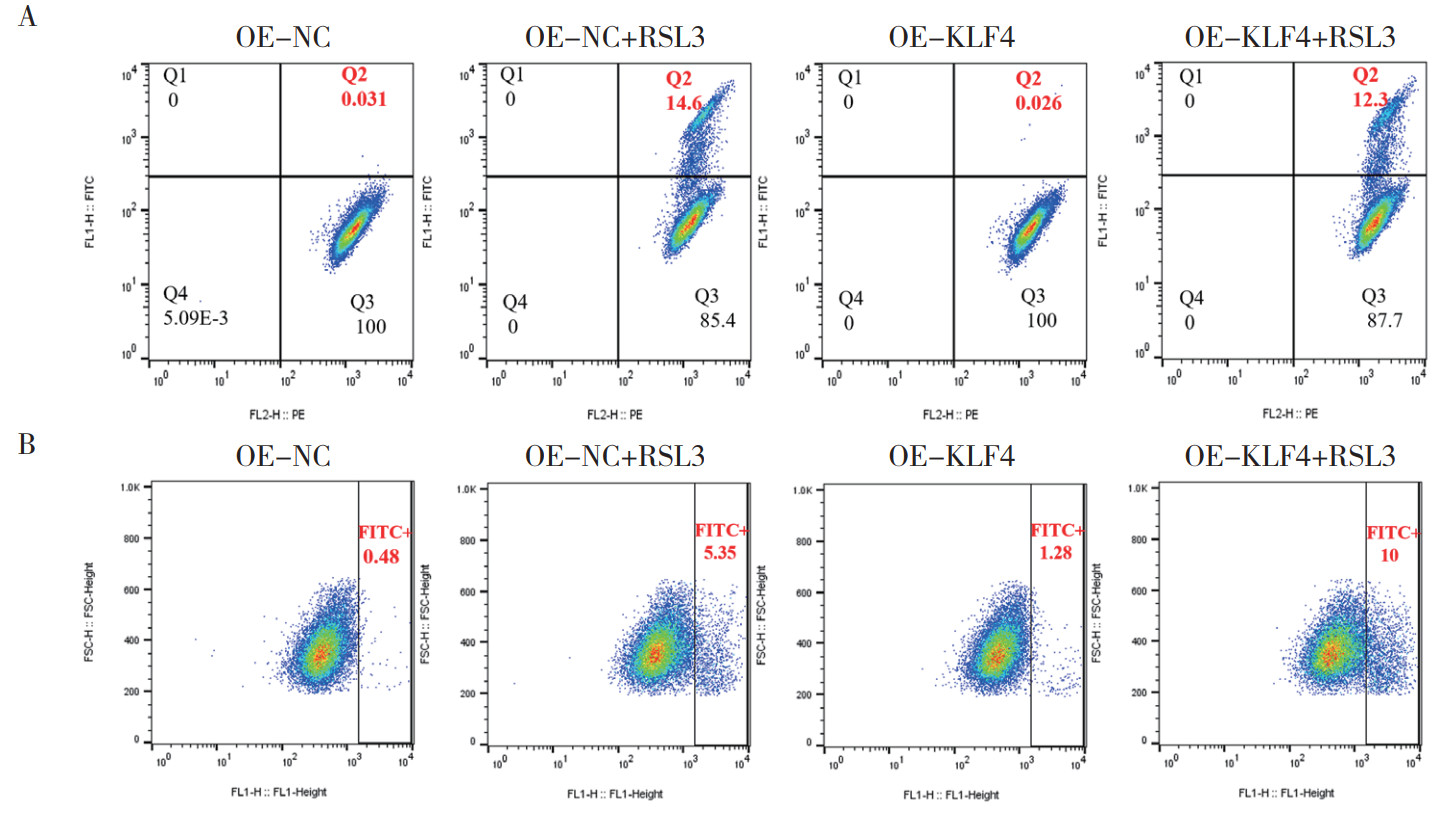
|
| 注 A:流式细胞术检测TAMR细胞中过表达KLF4后经RSL3处理后脂质ROS水平的变化;B:流式细胞术检测在TAMR细胞中过表达KLF4后加入RSL3后Fe2+水平变化 图 5 TAMR细胞中过表达KLF4和100 nmol/L RSL3处理2 h后脂质ROS和Fe2+水平的变化 Fig.5 Levels of lipid ROS and Fe2+ in TAMR cells with KLF4 overexpression and 100 nmol/L RSL3 treatment for 2 h |
在MCF-7和TAMR细胞中敲降KLF4 48 h后,xCT表达水平下降;过表达KLF4 48 h后,xCT表达水平上升(均P < 0.05,图 6A~6B),提示KLF4影响ER+乳腺癌细胞xCT转录水平的表达。
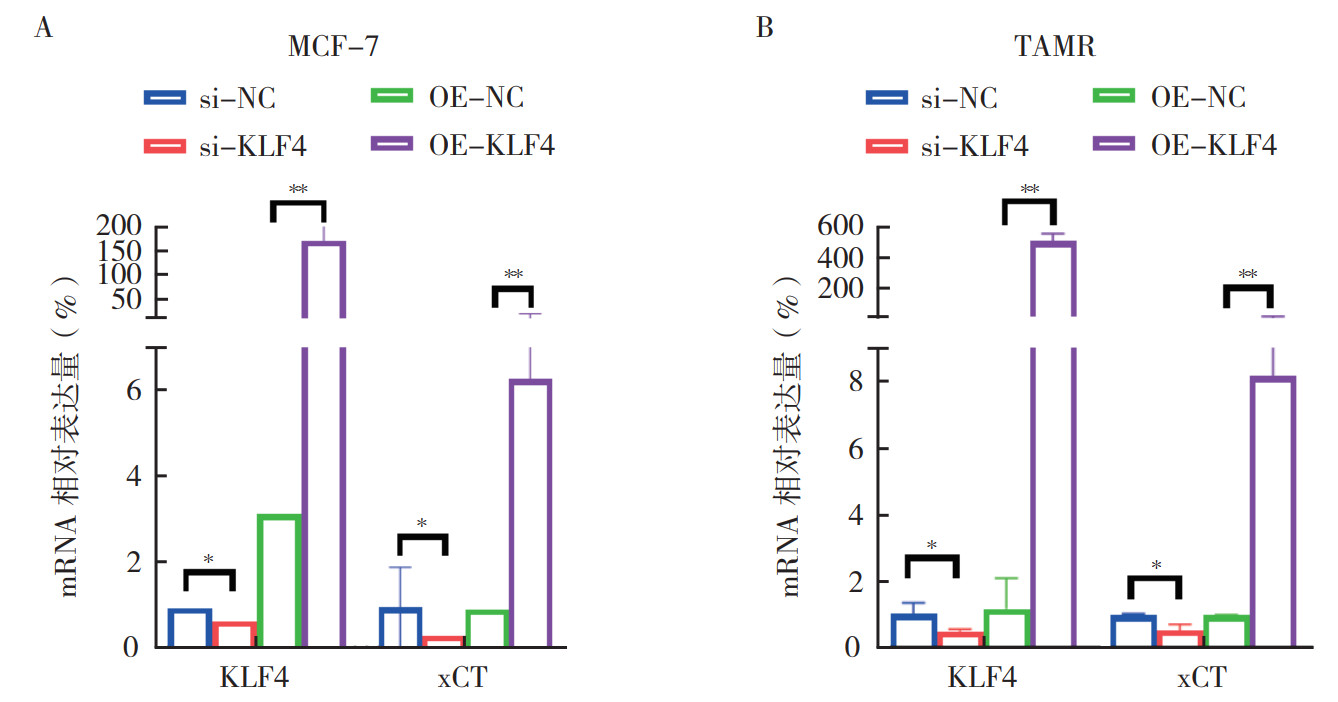
|
| 注 A:PCR检测MCF-7细胞中敲降和过表达KLF4 48 h后xCT在转录水平的变化;B:PCR检测TAMR细胞中敲降和过表达KLF4 48 h后xCT在转录水平的变化;*P < 0.05;**P < 0.01 图 6 KLF4影响ER+乳腺癌细胞铁死亡相关蛋白的mRNA表达 Fig.6 KLF4 modulated the mRNA expression of ferroptosis-associated proteins in ER+ breast cancer cells |
KLF4可发挥转录因子作用,通过直接结合组织金属蛋白酶抑制剂3(tissue inhibitor of metalloproteinase-3, TIMP-3)启动子促进肿瘤抑制基因TIMP-3的转录[14]。因此,采用ChIP实验分析KLF4调控xCT转录水平的具体机制。2024年9月10日使用JASPAR数据库[15]预测xCT的潜在KLF4结合位点xCT primer1和xCT primer2。ChIP结果显示,在MCF-7细胞中,KLF4在xCT基因启动子的xCT primer1和xCT primer2区域有较高的富集,结合效率较IgG组增强(均P < 0.05,图 7A);在TAMR细胞中,KLF4在xCT基因启动子的xCT primer2区域有较高的富集,结合效率较IgG组增强(P < 0.05,图 7B)。在MCF-7细胞中敲降KLF4和xCT后,20 μmol/L他莫昔芬处理12 h后发现,与敲降对照组比较,敲降KLF4、敲降xCT和联合敲低KLF4与xCT的细胞游离Fe2+水平均增加,铁死亡水平均升高(均P < 0.05);联合敲低KLF4和xCT后游离Fe2+的水平与单独敲低KLF4或xCT比较,差异均无统计学意义(均P > 0.05),说明KLF4和xCT是在同一通路上调控铁死亡的(图 7C)。以上结果提示,KLF4可能通过和xCT的启动子区域相结合,进一步发挥转录因子作用调控铁死亡。
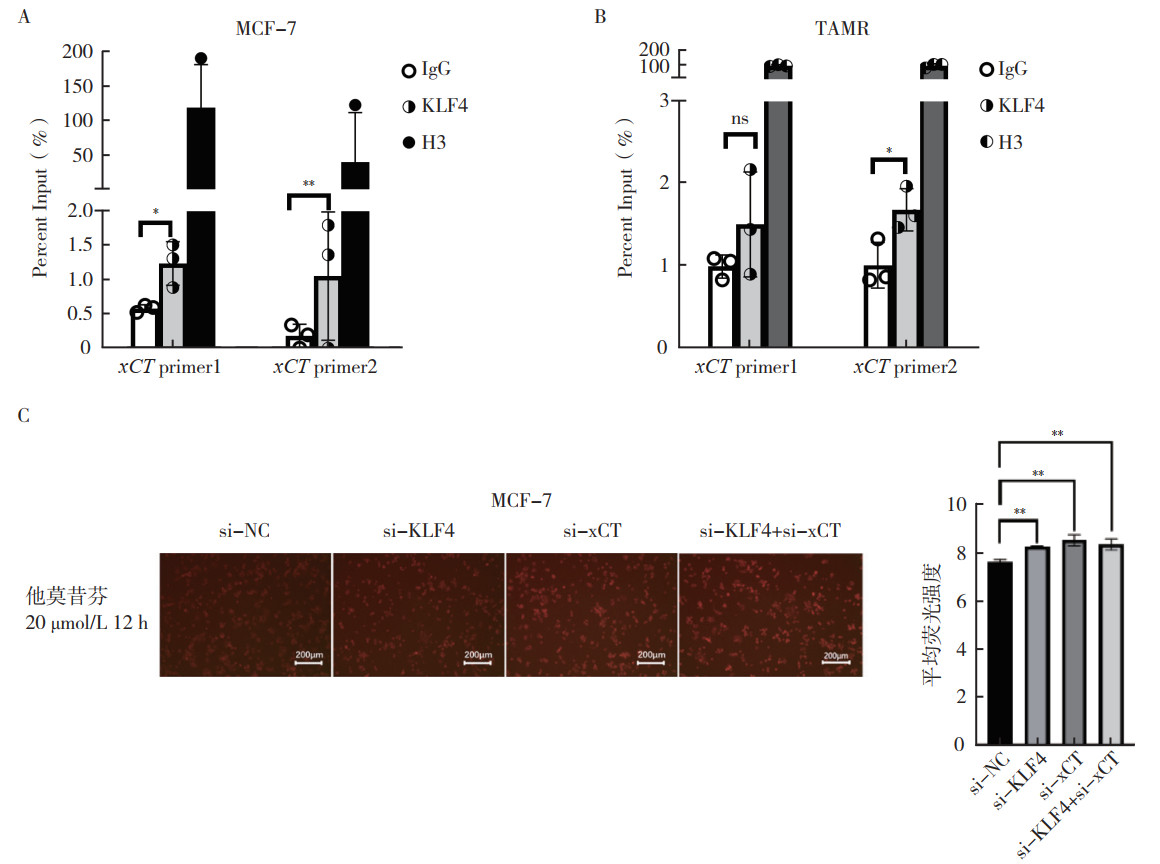
|
| 注 A:ChIP实验检测MCF-7细胞中KLF4与xCT预测位点结合情况;B:ChIP实验检测TAMR细胞中KLF4与xCT预测位点结合情况;C:二价铁离子探针FerroOrange检测MCF-7细胞中敲降KLF4和xCT后经他莫昔芬处理后的Fe2+水平;KLF4:Krüppel样因子4(Krüppel-like factor 4);ns:差异无统计学意义(not significant),P > 0.05;*P < 0.05;**P < 0.01 图 7 KLF4发挥转录因子作用调节ER+乳腺癌细胞铁死亡 Fig.7 KLF4 exerted a transcription factor role to regulate the ferroptosis of ER+ breast cancer cells |
他莫昔芬耐药性是导致ER+乳腺癌复发和死亡的关键因素之一[16]。尽管已有广泛研究揭示多种他莫昔芬耐药的分子机制,涵盖ER信号通路的改变、ER与生长因子受体(growth factor receptor, GFR)网络间的相互干扰、ER的下调、特定生长因子受体[如人表皮生长因子受体-2(human epidermal growth factor receptor 2, HER2)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)和胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF1R)]的上调和磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase, PI3K)/AKT/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路的激活等[17-18],但他莫昔芬耐药的确切机制尚未完全明确。针对他莫昔芬耐药乳腺癌的治疗效果依然有限,因此,持续探索他莫昔芬耐药的新机制显得尤为必要[16]。本研究利用本研究组2019年建立的TAMR细胞株证明他莫昔芬耐药株铁死亡敏感性更高。研究显示,MCF-7和TAMR细胞经过他莫昔芬处理后,均可以被铁死亡抑制剂包括去铁胺(deferoxamine, DFO)、Fer-1和n-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)所挽救,阻断他莫昔芬诱导的细胞毒性;与MCF-7细胞比较,TAMR细胞的挽救效果更显著[5]。因此,笔者推测铁死亡是一种能够逆转乳腺癌他莫昔芬耐药的重要机制。
研究发现,在肿瘤细胞中xCT高表达[5, 19]。在乳腺癌细胞中,同样存在xCT高表达[20],并且xCT的表达与乳腺癌患者的生存率呈负相关[21]。诸多研究提示,xCT作为铁死亡的关键蛋白,可能通过调控乳腺癌细胞氧化应激水平,提高乳腺癌细胞抗氧化能力,从而促进肿瘤增殖[19]、化疗耐药[22]和侵袭转移[23]。本研究显示,敲降xCT和GPX4可以使TAMR细胞对他莫昔芬重新敏感,证明xCT和GPX4作为铁死亡相关蛋白可调节ER+乳腺癌细胞系他莫昔芬的耐药性,以及靶向铁死亡相关蛋白可以逆转他莫昔芬耐药。
KLF4是KLF家族成员之一,在转移肿瘤细胞中表达,通过逆转上皮-间充质转化(epithelial-mesenchymal transition, EMT),促进肿瘤细胞由间充质向上皮转化,从而促进肿瘤细胞增殖[24]。研究表明,KLF4作为信号传导及转录激活蛋白5A(signal transducer and activator of transcription 5A, STAT5A)的下游靶标,在胃癌中可以被甲基转移酶样蛋白3(methyltransferase-like 3, METTL3)介导STAT5A的m6A修饰调节,进一步促进胃癌进展[25]。同时在肝细胞癌中,KLF4可以被瑞戈非尼通过抑制P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase, P38 MAPK)-环腺苷酸反应元件结合蛋白1(cyclic AMP-responsive element-binding protein 1, CREB1)-KLF4通路来调节巨噬细胞极化,增强肝细胞癌的抗肿瘤免疫力[26]。KLF4在乳腺癌和皮肤鳞状细胞癌中促进癌症进展[27-28]。此外,KLF4表达升高会促进乳腺肿瘤发生过程中的细胞迁移和侵袭[29]。
研究表明,KLF4与乳腺癌他莫昔芬耐药密切相关;TAMR细胞的KLF4表达水平比MCF-7细胞高且KLF4的上调可以使他莫昔芬耐药性增加[12]。本研究结果显示,KLF4在TAMR细胞中高表达,且敲降KLF4可以使TAMR细胞对他莫昔芬重新敏感。值得注意的是,本课题组2019年重新构建了TAMR细胞模型,其生物学特性与2017年研究所采用的耐药株存在差异[30]。KLF4在2次独立构建的TAMR细胞模型(2017年与2019年)中表现出的表达异质性,进一步暗示该转录因子在ER+乳腺癌耐药机制中的关键调控作用。这种表型差异提示KLF4可能参与更为复杂的调控网络,包括但不限于表观遗传修饰、信号通路交互作用或微环境适应性改变等潜在机制,值得通过多组学整合分析和功能验证实验等进一步探究。本研究还发现,TAMR细胞敲降KLF4后,细胞内游离Fe2+水平增加,进一步促进铁死亡发生;过表达KLF4则可以阻断RSL3所诱导的脂质ROS和游离Fe2+水平的增加,进一步证明KLF4可以影响铁死亡的敏感性。在ER+乳腺癌细胞系中敲降KLF4和过表达KLF4,KLF4与xCT表达水平同升同降,具有一致性,因此推测KLF4与xCT可能处在同一信号通路,KLF4可能通过转录激活或表观遗传调控机制直接作用于xCT基因,二者共同构成ER+乳腺癌中调控氧化应激耐受和药物代谢的关键分子机制网络。基于xCT在铁死亡中的关键作用,进一步探索KLF4是否作为转录因子发挥作用调控xCT影响乳腺癌他莫昔芬耐药细胞的铁死亡。结果显示,KLF4在xCT启动子区域有较高的富集,并且在MCF-7细胞中,联合敲低KLF4和xCT后游离Fe2+的水平与单独敲低KLF4或xCT比较,差异均无统计学意义(均P > 0.05),说明KLF4和xCT是在同一通路上调控铁死亡的。以上结果进一步说明,KLF4可能发挥转录因子作用,通过调节xCT表达水平进一步调控铁死亡。这些研究结果提示,KLF4可能是乳腺癌潜在的抗肿瘤、逆转耐药和抑制复发转移的新靶点。
综上所述,铁死亡在乳腺癌他莫昔芬耐药中具有重要作用,但具体机制有待阐明。基于铁死亡有望成为恶性肿瘤治疗的潜在靶标。探索铁死亡在乳腺癌他莫昔芬耐药中的作用有助于这一临床难题的解决。本研究结果提示,靶向铁死亡能有效逆转他莫昔芬耐药;KLF4可通过调控铁死亡关键蛋白xCT促进乳腺癌他莫昔芬耐药细胞株发生铁死亡。因此进一步研究KLF4介导的铁死亡有助于发现他莫昔芬耐药的新机制,为乳腺癌他莫昔芬耐药的预测治疗靶点的开发应用提供理论依据。本研究为ER+乳腺癌他莫昔芬耐药机制的阐明提供了基础数据,为ER+乳腺癌的治疗提供了新思路。后续可通过动物实验进一步验证,并深入探讨KLF4-xCT通路影响ER+乳腺癌他莫昔芬耐药性的具体机制。
| [1] |
Han BF, Zheng RS, Zeng HM, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53. DOI:10.1016/j.jncc.2024.01.006 |
| [2] |
Harvey JM, Clark GM, Osborne CK, et al. Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer[J]. J Clin Oncol, 2023, 41(7): 1331-1338. DOI:10.1200/JCO.22.02500 |
| [3] |
Pan HC, Gray R, Braybrooke J, et al. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years[J]. N Engl J Med, 2017, 377(19): 1836-1846. DOI:10.1056/NEJMoa1701830 |
| [4] |
Jiang XJ, Stockwell BR, Conrad M. Ferroptosis: mechanisms, biology and role in disease[J]. Nat Rev Mol Cell Biol, 2021, 22(4): 266-282. DOI:10.1038/s41580-020-00324-8 |
| [5] |
Xu Z, Wang XM, Sun WB, et al. RelB-activated GPX4 inhibits ferroptosis and confers tamoxifen resistance in breast cancer[J]. Redox Biol, 2023, 68: 102952. DOI:10.1016/j.redox.2023.102952 |
| [6] |
Wang LY, Chen XG, Yan CH. Ferroptosis: an emerging therapeutic opportunity for cancer[J]. Genes Dis, 2020, 9(2): 334-346. |
| [7] |
Liu JM, Luo YW, Chen SM, et al. Deubiquitylase USP52 promotes bladder cancer progression by modulating ferroptosis through stabilizing SLC7A11/xCT[J]. Adv Sci, 2024, 11(45): e2403995. DOI:10.1002/advs.202403995 |
| [8] |
Ghaleb AM, Yang VW. Krüppel-like factor 4 (KLF4): what we currently know[J]. Gene, 2017, 611: 27-37. DOI:10.1016/j.gene.2017.02.025 |
| [9] |
Zhang Y, Yao C, Ju Z, et al. Krüppel-like factors in tumors: key regulators and therapeutic avenues[J]. Front Oncol, 2023, 13: 1080720. DOI:10.3389/fonc.2023.1080720 |
| [10] |
Cao Y. Potential roles of Krüppel-like factors in mediating adverse vascular effects of nanomaterials: a review[J]. J Appl Toxicol, 2022, 42(1): 4-16. DOI:10.1002/jat.4172 |
| [11] |
Jia YL, Ying XG, Zhou JC, et al. The novel KLF4/PLAC8 signaling pathway regulates lung cancer growth[J]. Cell Death Dis, 2018, 9(6): 603. DOI:10.1038/s41419-018-0580-3 |
| [12] |
Zhou Z, Song XX, Chi JJ, et al. Regulation of KLF4 by posttranslational modification circuitry in endocrine resistance[J]. Cell Signal, 2020, 70: 109574. DOI:10.1016/j.cellsig.2020.109574 |
| [13] |
Hu WX, Hofstetter WL, Li H, et al. Putative tumor-suppressive function of Krüppel-like factor 4 in primary lung carcinoma[J]. Clin Cancer Res, 2009, 15(18): 5688-5695. DOI:10.1158/1078-0432.CCR-09-0310 |
| [14] |
Wang XY, Xia SL, Li HC, et al. Correction: The deubiquitinase USP10 regulates KLF4 stability and suppresses lung tumorigenesis[J]. Cell Death Differ, 2023, 30(10): 2364. DOI:10.1038/s41418-023-01224-y |
| [15] |
Castro-Mondragon JA, Riudavets-Puig R, Rauluseviciute I, et al. JASPAR 2022: the 9th release of the open-access database of transcription factor binding profiles[J]. Nucleic Acids Res, 2022, 50(D1): D165-D173. DOI:10.1093/nar/gkab1113 |
| [16] |
Yao JW, Deng K, Huang JL, et al. Progress in the understanding of the mechanism of tamoxifen resistance in breast cancer[J]. Front Pharmacol, 2020, 11: 592912. DOI:10.3389/fphar.2020.592912 |
| [17] |
Suba Z. Amplified crosstalk between estrogen binding and GFR signaling mediated pathways of ER activation drives responses in tumors treated with endocrine disruptors[J]. Recent Pat Anticancer Drug Discov, 2018, 13(4): 428-444. DOI:10.2174/1574892813666180720123732 |
| [18] |
Mills JN, Rutkovsky AC, Giordano A. Mechanisms of resistance in estrogen receptor positive breast cancer: overcoming resistance to tamoxifen/aromatase inhibitors[J]. Curr Opin Pharmacol, 2018, 41: 59-65. DOI:10.1016/j.coph.2018.04.009 |
| [19] |
Yan YL, Teng HQ, Hang QL, et al. SLC7A11 expression level dictates differential responses to oxidative stress in cancer cells[J]. Nat Commun, 2023, 14(1): 3673. DOI:10.1038/s41467-023-39401-9 |
| [20] |
Yang JJ, Zhou YL, Xie SD, et al. Metformin induces Ferroptosis by inhibiting UFMylation of SLC7A11 in breast cancer[J]. J Exp Clin Cancer Res, 2021, 40(1): 206. DOI:10.1186/s13046-021-02012-7 |
| [21] |
Huang P, Zhao H, Dai H, et al. FXR deficiency induced ferroptosis via modulation of the CBP-dependent p53 acetylation to suppress breast cancer growth and metastasis[J]. Cell Death Dis, 2024, 15(11): 826. DOI:10.1038/s41419-024-07222-3 |
| [22] |
Ge C, Cao B, Feng D, et al. The down-regulation of SLC7A11 enhances ROS induced P-gp over-expression and drug resistance in MCF-7 breast cancer cells[J]. Sci Rep, 2017, 7(1): 3791. DOI:10.1038/s41598-017-03881-9 |
| [23] |
Dornier E, Rabas N, Mitchell L, et al. Glutaminolysis drives membrane trafficking to promote invasiveness of breast cancer cells[J]. Nat Commun, 2017, 8(1): 2255. DOI:10.1038/s41467-017-02101-2 |
| [24] |
Borrelli C, Roberts M, Eletto D, et al. In vivo interaction screening reveals liver-derived constraints to metastasis[J]. Nature, 2024, 632(8024): 411-418. DOI:10.1038/s41586-024-07715-3 |
| [25] |
Zang YC, Tian ZF, Wang DD, et al. METTL3-mediated N6-methyladenosine modification of STAT5A promotes gastric cancer progression by regulating KLF4[J]. Oncogene, 2024, 43(30): 2338-2354. DOI:10.1038/s41388-024-03085-2 |
| [26] |
Ou DL, Chen CW, Hsu CL, et al. Regorafenib enhances antitumor immunity via inhibition of p38 kinase/Creb1/Klf4 axis in tumor-associated macrophages[J]. J Immunother Cancer, 2021, 9(3): e001657. DOI:10.1136/jitc-2020-001657 |
| [27] |
Damaghi M, West J, Robertson-Tessi M, et al. The harsh microenvironment in early breast cancer selects for a Warburg phenotype[J]. Proc Natl Acad Sci USA, 2021, 118(3): e2011342118. DOI:10.1073/pnas.2011342118 |
| [28] |
Yu F, Li J, Chen H, et al. Krüppel-like factor 4 (KLF4) is required for maintenance of breast cancer stem cells and for cell migration and invasion[J]. Oncogene, 2011, 30(18): 2161-2172. DOI:10.1038/onc.2010.591 |
| [29] |
Zou HJ, Chen HY, Zhou Z, et al. ATXN3 promotes breast cancer metastasis by deubiquitinating KLF4[J]. Cancer Lett, 2019, 467: 19-28. DOI:10.1016/j.canlet.2019.09.012 |
| [30] |
Jia YL, Zhou JC, Luo X, et al. KLF4 overcomes tamoxifen resistance by suppressing MAPK signaling pathway and predicts good prognosis in breast cancer[J]. Cell Signal, 2018, 42: 165-175. DOI:10.1016/j.cellsig.2017.09.025 |
 2025, Vol. 40
2025, Vol. 40


