文章信息
- 王好甲, 苗格, 赵晓迪, 王新
- Wang Haojia, Miao Ge, Zhao Xiaodi, Wang Xin
- 神经肽FF通过调控RhoA/ROCK/YAP信号通路促进结直肠癌转移的分子机制研究
- Molecular mechanism of neuropeptide FF promoting metastasis in colorectal cancer by regulating RhoA/ROCK/YAP signaling pathway
- 实用肿瘤杂志, 2025, 40(3): 218-226
- Journal of Practical Oncology, 2025, 40(3): 218-226
基金项目
- 国家自然科学基金面上项目(82173256); 陕西省重点研发计划(2024SF-GJHX-04); 消化系肿瘤整合防治全国重点实验室课题(CBSKL2022ZZ55)
-
通信作者
- 王新, Email: wangx@fmmu.edu.cn
-
文章历史
- 收稿日期:2025-01-11
2. 空军军医大学,西京消化病医院,国家消化系统疾病临床研究中心,消化系肿瘤整合防治全国重点实验室,陕西 西安 710032
2. State Key Laboratory of Holistic Integrative Management of Gastrointestinal Cancers and National Clinical Research Center for Digestive Diseases, Xijing Hospital of Digestive Diseases, Fourth Military Medical University, Xi'an 710032, China
结直肠癌是全球高发的恶性肿瘤,发病率和死亡率在所有恶性肿瘤中分别位居第3位和第2位[1]。近年来,结直肠癌在我国的发病率和死亡率均呈上升趋势[2]。肿瘤转移是导致结直肠癌患者死亡的最主要原因[3]。近年来,结直肠癌以其高发病率和死亡率,严重危害我国国民的生命健康,由于人群早期筛查意识较为薄弱,多数患者初诊时已处于疾病中晚期[4]。据不完全统计,约有15%~25%的结直肠癌患者在确诊时即合并转移,而另有15%~25%的患者在结直肠癌原发灶根治术后发生转移,其中多数(80%~90%)转移灶无法获得根治性切除,未经治疗的肝转移患者的中位生存期仅为6.9个月,无法切除的患者5年生存率 < 5%[5]。因此,深入研究结直肠癌转移中的关键分子并阐明其调控机制具有重要的临床意义。
神经肽FF(neuropeptide FF, NPFF)是一种最初从牛脑中分离的哺乳动物酰胺化神经肽,是一种疼痛调节肽,在大鼠中具有抗阿片类药物活性[6],参与心血管调节、能量代谢、食物消耗、免疫、神经损伤修复和疼痛调节[7]。研究表明,NPFF通过其2个G蛋白偶联受体NPFF受体1(NPFF receptor 1, NPFFR1)即G蛋白偶联受体147(G-protein coupled receptor 147, GPR147)和NPFFR2即GPR74发挥作用[8]。NPFF通过细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2)信号传导上调基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9)刺激人卵巢癌细胞侵袭[9]。在细菌性肺炎中,NPFF可调控中性粒细胞在促炎和抗炎表型之间的平衡[10]。在视网膜母细胞瘤中,NPFF可能是参与其发生和发展的关键基因[11]。
然而,NPFF在结直肠癌中的作用及其分子机制尚不明确。本研究通过生物信息学方法和分子生物学实验探讨NPFF对结直肠癌转移的影响及其机制,为寻找结直肠癌转移中的关键分子和潜在治疗靶点提供实验依据。
1 材料与方法 1.1 细胞系和主要试剂人结直肠癌细胞系DLD-1、SW620、HT29、SW480和HCT8获取自美国模式菌种收集中心(American Type Culture Collection, ATCC)。人结直肠癌细胞系DiFi和永生化肠上皮细胞系NCM460获取自中国国家生物医学实验细胞资源库。人结直肠癌细胞系KM12C和KM12SM获取自美国范德堡大学Coffey实验室,保存于消化系肿瘤整合防治全国重点实验室细胞样本库。样本库细胞的保存和使用严格遵循《人类生物样本保藏伦理要求》伦理原则。
实验培养细胞所用DMEM培养液、胎牛血清、双抗(青霉素+链霉素)、胰蛋白酶和磷酸盐缓冲液均购自美国Gibco公司。聚合酶链式反应(polymerase chain reaction, PCR)引物购自北京擎科生物公司(表 1)。
| 基因 | 正向引物序列(5’-3’) | 反向引物序列(5’-3’) |
| GAPDH | AGAAGGCTGGGGCTCATTTG | AGGGGCCATCCACAGTCTTC |
| NPFF | GTGACTTACGTGTCCAGGGT | TGGGTATTTCTGCCAAACCTCT |
| AMOTL2 | GCTCGTTGAGTGAACGGCT | CATGAGCTAGTACAACATGAGGG |
| ANKRD1 | AGTAGAGGAACTGGTCACTGG | TGTTTCTCGCTTTTCCACTGTT |
| CTGF | CAGCATGGACGTTCGTCTG | AACCACGGTTTGGTCCTTGG |
| CYR61 | CTCGCCTTAGTCGTCACCC | CGCCGAAGTTGCATTCCAG |
| 注 GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase);NPFF:神经肽FF(neuropeptide FF);AMOTL2:血管生成素样蛋白2 (angiomotin like 2);ANKRD1:锚蛋白重复结构域1(ankyrin repeat domain 1);CTGF:结缔组织生长因子(connective tissue growth factor);CYR61:富含半胱氨酸蛋白61(cysteine rich angiogenic inducer 61) | ||
蛋白质印迹法(Western blotting)所用抗体购自美国CST公司。transwell迁移实验小室购自美国Gorning公司。翌圣RNA提取试剂盒和翌圣qPCR SYBR试剂盒购自上海翌圣公司。Takara逆转录试剂盒购自日本Takara公司。RhoA活性检测试剂盒购自美国Cytoskeleton公司。细胞核浆蛋白分离试剂盒购自上海碧云天生物技术有限公司。NPFF重组多肽购自美国MCE公司。
1.2 主要仪器细胞恒温培养箱购自德国Thermo公司。光学显微镜购自日本Olympus公司。台式低温高速和常温低速离心机购自美国Caliper公司。逆转录PCR(reverse transcription PCR, RT-PCR)仪和ChemiDocTM XRS+分子成像仪购自美国Bio-Rad公司。
1.3 细胞培养使用DMEM培养液培养细胞,并添加10%胎牛血清、1%双抗、1% L-谷氨酰胺和1%非必需氨基酸溶液,培养条件为5%CO2、37℃,定期换液和传代。
1.4 蛋白质提取和蛋白质印迹法使用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液裂解细胞15 min,12 000 r/min离心15 min,取上清。用BCA蛋白定量试剂盒测定浓度。采用SDS凝胶电泳后转印到硝酸纤维素膜。用5%脱脂牛奶封闭1 h后,将膜与一抗4℃孵育过夜,次日孵育辣根过氧化物酶(horseradish peroxidase, HRP)偶联抗体,使用ChemiDocTM XRS+成像系统,采用Bio-Rad图像实验室软件进行显影。
1.5 细胞RNA提取和实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)使用翌圣RNA提取试剂盒提取细胞RNA。使用紫外分光光度计检测样品浓度和260 nm与280 nm处吸光度值。使用Takara逆转录试剂盒获取cDNA,条件为37℃逆转录15 min,85℃灭活逆转录酶15 s。逆转录后模板使用翌圣qPCR SYBR试剂盒,用三步法程序进行扩增,扩增条件:95℃预变性5 min;95℃变性10 s,60℃退火20 s,72℃延伸20 s, 循环40次。使用Bio-Rad CFX软件进行分析,2-ΔΔCt方法计算每个样品的RNA相对表达水平。每个样品设置3次重复。
1.6 小干扰RNA(small interference RNA, si-RNA)和质粒瞬时转染设计合成针对NPFF的siRNA,包括siNPFF-1[正义链:5’-GUACAGAUGCCGUCUGUUA(dT)(dT)-3’,反义链:5’-UAACAGACGGCAUCUGUAC(dT)(dT)-3’]和siNPFF-2[正义链:5’-CAACGCUUUGGGAAGAAGU(dT)(dT)-3’,反义链:5’-ACUUCUUCCCAAAGCGUUG(dT)(dT)-3’],以及阴性对照siRNA[siNC正义链:5’-UUCUCCGAACGUGUCACGU(dT)(dT)-3’,反义链:5’-UUCUCCGAACGUGUCACGU(dT)(dT)-3’]。设计人源NPFF过表达质粒pCMV-NPFF(human)-3×FLAG-NEO及其空载对照VECTOR。使用Jetprime转染试剂进行siRNA和质粒转染。
1.7 体外迁移实验通过transwell实验评估细胞迁移能力。将2×105个转染后的细胞接种在transwell迁移小室中,下层使用添加20%胎牛血清的培养液诱导迁移。5%CO2、37℃孵育,24~48 h后(DLD-1和KM12C细胞为36 h,SW480细胞为48 h,DiFi细胞为24 h),使用无水乙醇固定细胞,用0.1%结晶紫溶液进行染色,并在光学显微镜下计数以确定其相对数量。每组设置3个复孔。
1.8 RhoA活性检测使用Cytoskeleton活性RhoA检测试剂盒检测RhoA活性。具体步骤为:使用裂解缓冲液裂解细胞15 min,10 000 r/min离心30 min,BCA蛋白定量后将浓度调整至0.25~2.0 mg/mL,向蛋白样品中加入50 μg磁珠,4℃旋转孵育1 h;离心和洗涤后收取上清,加入2×蛋白上样缓冲液后100℃煮样2 min;后续检测方法同蛋白质印迹法。
1.9 细胞免疫荧光和鬼笔环肽染色将细胞接种于免疫荧光四孔小室(Merck Millipore,美国),生长24 h后密度达到50%~60%。使用4%多聚甲醛溶液进行细胞固定。用0.5% Triton X-100溶液透化处理10 min。用5%牛血清白蛋白(bovine serum albumin, BSA)封闭1 h。4℃过夜孵育兔抗人Yes相关蛋白(Yes-associated protein, YAP)抗体(CST,美国),次日避光孵育异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的山羊抗兔抗体(武汉赛维尔生物),同时滴加罗丹明标记的鬼笔环肽工作液1 h。使用含4’,6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)染料的抗荧光淬灭封固剂进行封固。使用共聚焦显微镜进行荧光观察。
1.10 生物信息学分析2024年12月1日使用癌症基因组图谱(The Cancer Cenome Atlas, TCGA)数据库查询结直肠癌中NPFF的表达与预后相关情况。基于NPFF表达的中位transcripts per million(TPM)值将所有患者分为NPFF低表达(TPM值≤6.397 7)和高表达(TPM值> 6.397 7)患者。
1.11 统计学分析采用SPSS 27.0软件进行数据分析。定量资料符合正态分布的,以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD法。以P < 0.05为差异具有统计学意义。
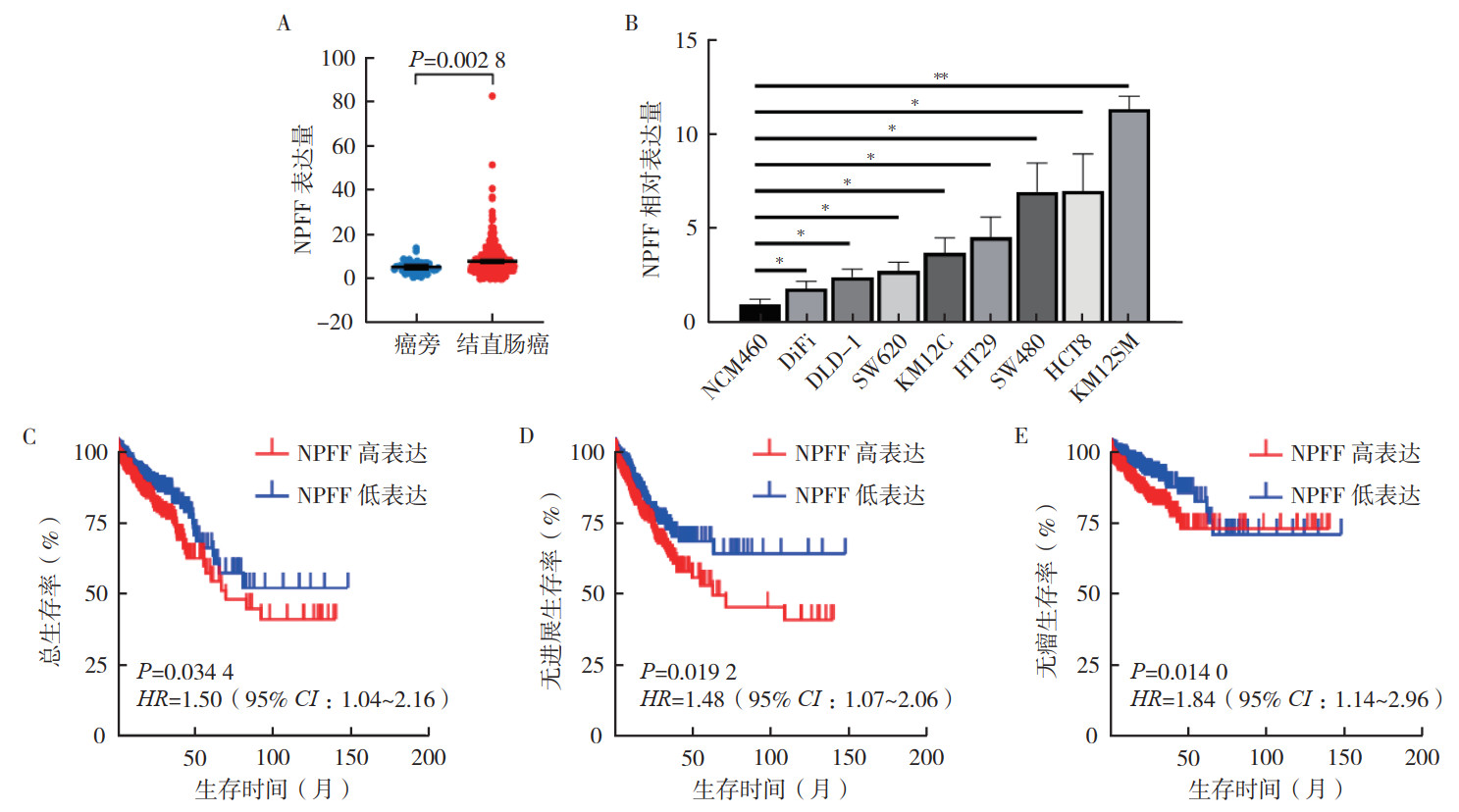
2 结果 2.1 NPFF与结直肠癌患者预后不良相关从TCGA数据库中提取NPFF在结直肠癌组织中的表达谱,共获取637例患者资料,其中男性332例,女性305例;年龄31~90岁,平均年龄66.34岁。结果显示,NPFF在结直肠癌组织中的表达高于癌旁正常组织(P < 0.01,图 1A)。RT-qPCR结果显示,NPFF在8种结直肠癌细胞系中的表达均高于肠上皮正常细胞NCM460(均P < 0.05,图 1B)。此外,TCGA数据库分析显示,NPFF低表达的结直肠癌患者的总生存期(overall survival, OS)、无进展生存期(progression free survival, PFS)和无瘤生存期(disease free survival, DFS)均优于NPFF高表达患者(均P < 0.05,图 1C~1E)。
|
| 注 A:TCGA数据库分析NPFF在结直肠癌组织与癌旁正常组织中的表达;B:RT-qPCR分析NPFF在8种结直肠癌细胞系和肠上皮正常细胞NCM460中的表达;C:TCGA数据库分析NPFF表达水平与结直肠癌患者总生存期的关系;D:TCGA数据库分析NPFF表达水平与结直肠癌患者无进展生存期的关系;E:TCGA数据库分析NPFF表达水平与结直肠癌患者无瘤生存期的关系;NPFF:神经肽FF(neuropeptide FF);*与NCM460比较,P < 0.05;**与NCM460比较,P < 0.01 图 1 NPFF在结直肠癌组织和细胞中的表达及其与患者预后的关系 Fig.1 Expression of NPFF in colorectal cancer tissues and cells and its correlation with the prognosis of patients |
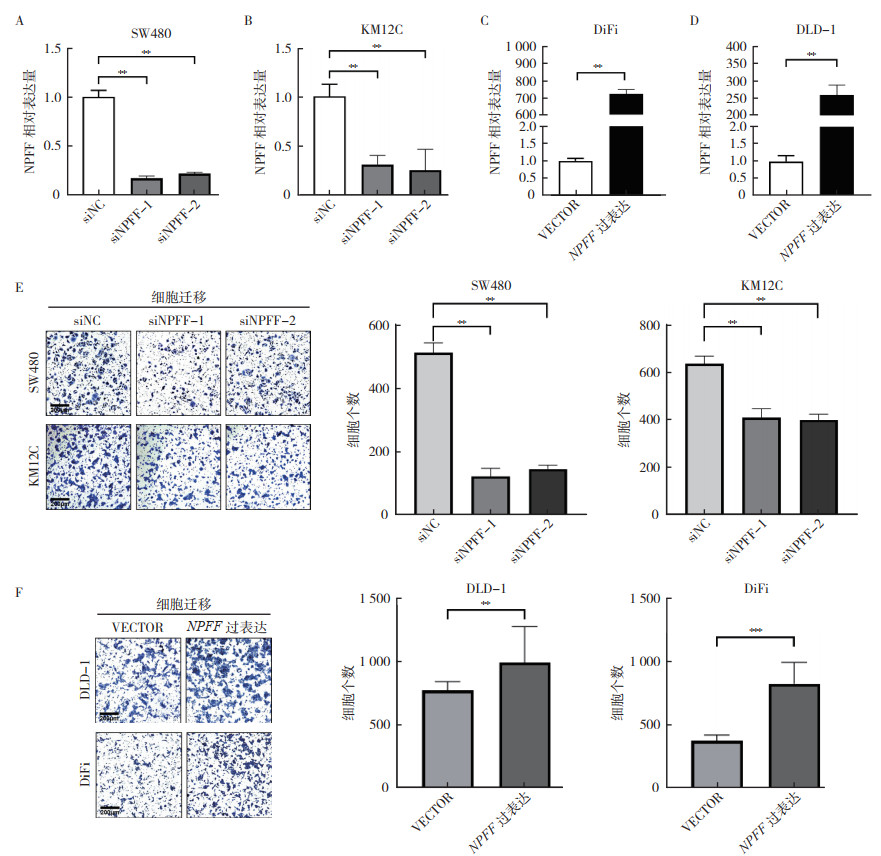
为研究NPFF对结直肠癌转移的影响,在SW480和KM12C细胞中转染靶向NPFF的siRNA(siNPFF-1和siNPFF-2)以敲减其中NPFF的mRNA表达量,对照组转染阴性对照siNC。在DiFi和DLD-1细胞中转染人源NPFF过表达质粒和空载对照VECTOR,以上调其中NPFF的mRNA表达量。通过RT-qPCR实验检测NPFF的表达变化情况以验证瞬时转染效率(均P < 0.01,图 2A~2D)。
|
| 注 A:使用siRNA在SW480细胞中敲减NPFF的效率;B:使用siRNA在KM12C细胞中敲减NPFF的效率;C:在DiFi细胞中过表达NPFF的效率;D:在DLD-1细胞中过表达NPFF的效率;E:在SW480和KM12C细胞中敲减NPFF的迁移实验结果(×10);F:在DLD-1和DiFi细胞中过表达NPFF的迁移实验结果(×10);NPFF:神经肽FF(neuropeptide FF);**P < 0.01 图 2 NPFF影响结直肠癌细胞体外迁移能力 Fig.2 NPFF affected the migration ability of colorectal cancer cells in vitro |
transwell迁移实验结果显示,SW480和KM12C细胞敲减NPFF后穿过transwell小孔的细胞数量较对照组细胞减少(均P < 0.01,图 2E);而过表达NPFF后的DiFi和DLD-1细胞透过transwell小孔的细胞数量较对照组增加(均P < 0.01,图 2F)。以上结果表明,NPFF表达可影响结直肠癌细胞的体外迁移能力。
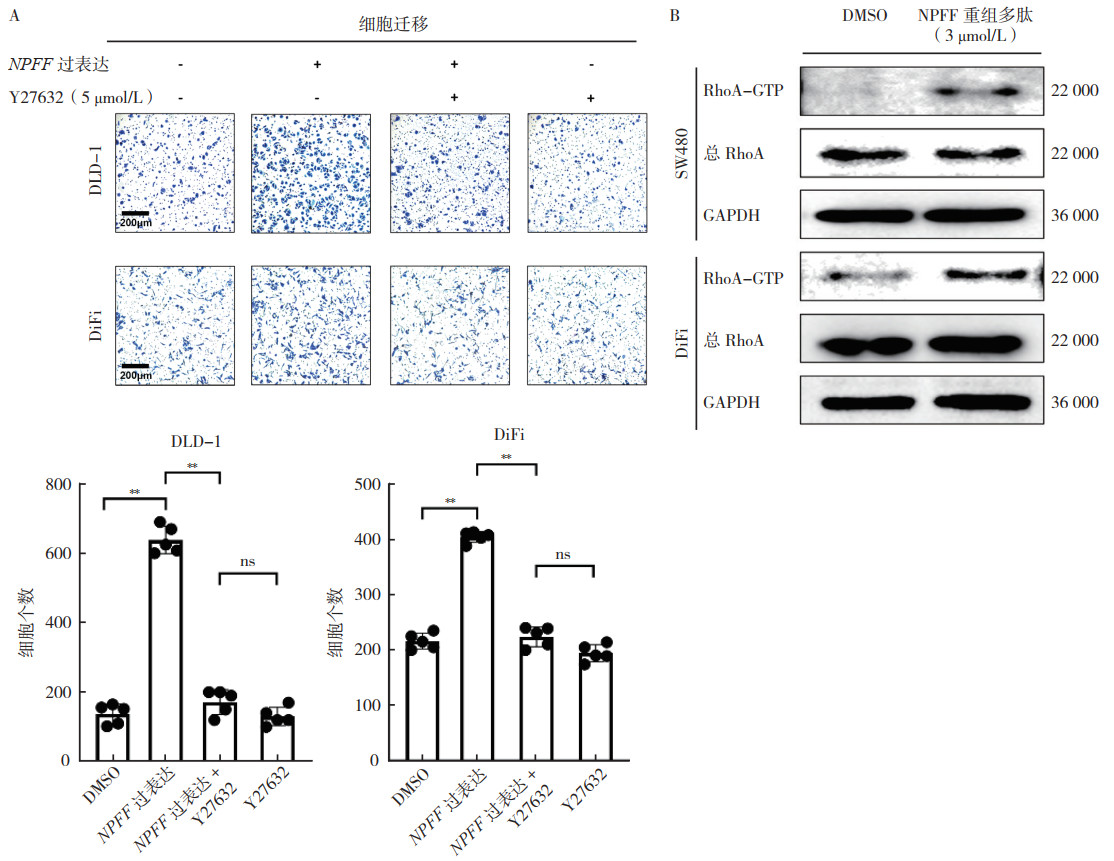
2.3 NPFF通过Ras同源家族成员A(Ras homolog family member A, RhoA)/Rho相关卷曲螺旋蛋白激酶(Rho associated coiled-coil containing protein kinase, ROCK)信号通路促进结直肠癌细胞迁移NPFF主要通过与G蛋白偶联受体NPFFR2结合来激活下游信号通路,而RhoA/ROCK信号介导许多G蛋白偶联受体的下游通路,因此探索ROCK是否参与NPFF诱导的细胞迁移。transwell迁移实验显示,在DLD-1和DiFi细胞培养液中添加ROCK 1/2抑制剂Y27632(5 μmol/L,24 h)可完全抵消NPFF过表达诱导的细胞迁移能力(均P < 0.01,图 3A)。
|
| 注 A:NPFF过表达和ROCK 1/2抑制剂Y27632(5 μmol/L,24 h)对DLD-1和DiFi细胞迁移能力的影响(×10);B:SW480和DiFi细胞中添加NPFF重组多肽(3 μmol/L,30 min)后活性RhoA的表达变化;NPFF:神经肽FF(neuropeptide FF);DMSO:二甲基亚砜(dimethyl sulfoxide);RhoA:RAS同源基因家族成员A(Ras homolog family member A);GTP:三磷酸鸟苷(guanosine triphosphate);GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase);**P < 0.01;ns:差异无统计学意义(not significant),P > 0.05 图 3 NPFF通过RhoA/ROCK信号通路促进结直肠癌细胞迁移 Fig.3 NPFF promoted the migration of colorectal cancer cells through the RhoA/ROCK signaling pathway |
使用RhoA活性检测试剂盒测定细胞中RhoA-GTP含量验证RhoA是否能被NPFF激活。结果显示,与添加二甲基亚砜(dimethyl sulfoxide, DMSO)的对照组比较,SW480和DiFi细胞在添加NPFF重组多肽(3 μmol/L,30 min)后RhoA的活化明显增加(图 3B),表明NPFF通过RhoA/ROCK信号通路对肿瘤细胞迁移能力进行调控。
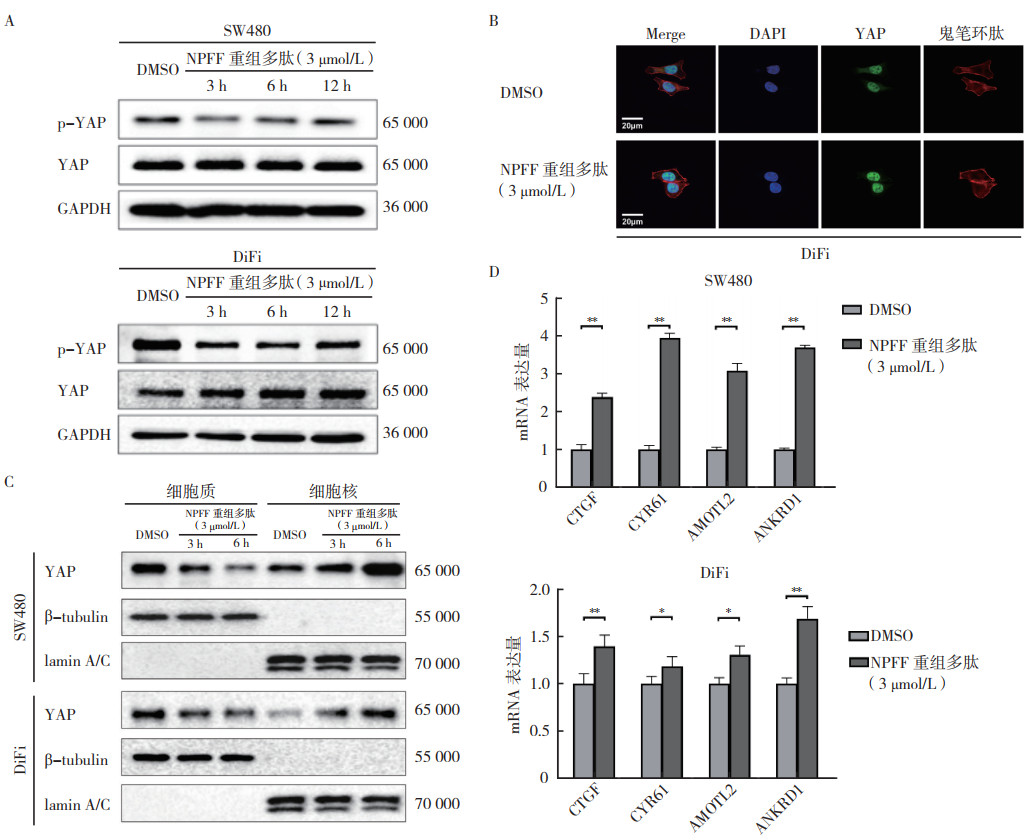
2.4 NPFF调控YAP的磷酸化水平和核转位通过蛋白质印迹法检测RhoA的下游分子YAP蛋白的磷酸化水平显示,SW480和DiFi细胞添加NPFF重组多肽(3 μmol/L)3、6和12 h后,YAP蛋白明显发生去磷酸化,提示其转录活性增加(图 4A)。
|
| 注 A:SW480和DiFi细胞在添加NPFF重组多肽(3 μmol/L)后YAP磷酸化水平的变化;B:DiFi细胞添加NPFF重组多肽(3 μmol/L,3 h)后鬼笔环肽和YAP免疫荧光染色(×60);C:SW480和DiFi细胞添加NPFF重组多肽(3 μmol/L)后YAP在细胞核和细胞质中的表达变化;D:SW480和DiFi细胞在添加NPFF重组多肽(3 μmol/L,24 h)后YAP下游分子的表达变化;DMSO:二甲基亚砜(dimethyl sulfoxide);NPFF:神经肽FF(neuropeptide FF);p-YAP:磷酸化的Yes相关蛋白(phospho-Yes-associated protein);GAPDH:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase);Merge:合并;DAPI:4’,6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole);CTGF:结缔组织生长因子(connective tissue growth factor);CYR61:富含半胱氨酸蛋白61(cysteine rich angiogenic inducer 61);AMOTL2:血管生成素样蛋白2(angiomotin like 2);ANKRD1:锚蛋白重复结构域1(ankyrin repeat domain 1);*P < 0.05;**P < 0.01 图 4 NPFF调控结直肠癌细胞中YAP的磷酸化水平和核转位 Fig.4 NPFF regulated the phosphorylation level and nuclear translocation of YAP in colorectal cancer cells |
RhoA可通过重塑细胞骨架激活YAP信号。使用免疫荧光染色分析添加NPFF重组多肽后肌动蛋白和YAP的表达和亚细胞定位。结果显示,NPFF重组多肽(3 μmol/L,3 h)增加DiFi细胞中鬼笔环肽的荧光强度和YAP的核定位(图 4B)。通过细胞核浆蛋白分离检测YAP在细胞核与细胞质中的表达情况显示,SW480和DiFi细胞中添加NPFF重组多肽(3 μmol/L,3和6 h)后YAP明显由细胞质转入细胞核内(图 4C)。RT-qPCR分析YAP的下游靶基因结缔组织生长因子(connective tissue growth factor, CTGF)、富含半胱氨酸蛋白61(cysteine rich angiogenic inducer 61, CYR61)、血管生成素样蛋白2 (angiomotin like 2, AMOTL2)和锚蛋白重复结构域1(ankyrin repeat domain 1, ANKRD1)的表达发现,NPFF重组多肽(3 μmol/L,24 h)可增加SW480和DiFi细胞中上述基因的表达(均P < 0.05,图 4D)。
3 讨论神经肽作为一种神经递质,可以通过自分泌或旁分泌发挥作用,以调节中枢神经和外周系统的多种生理功能。研究表明,神经肽可以通过自分泌或旁分泌方式参与刺激癌症进展[12]。结直肠癌与神经肽之间的关系已经被广泛研究。结直肠癌干细胞可以通过肠道神经元产生的神经递质5-羟色胺来促进肿瘤的生长和转移。这种过程涉及到5-羟色胺受体1B(5-hydroxytryptamine receptor 1B, HTR1B)、HTR1D和HTR1F。这些受体在结直肠癌干细胞中的表达水平较高,并且对5-羟色胺敏感[13]。但NPFF在结直肠癌中的作用及其机制未见报道。
本研究探索NPFF在结直肠癌中的功能和临床意义。结果表明,NPFF在结直肠癌细胞和组织中高表达,并与患者预后不良相关;NPFF可以促进结直肠癌细胞的体外迁移能力。
NPFF通过与细胞表面的G蛋白偶联受体结合来发挥作用[7],其中RhoA/ROCK信号介导许多G蛋白偶联受体的下游通路[14],因此,笔者探讨了NPFF是否能激活肿瘤细胞中的RhoA信号。结果表明,NPFF可上调细胞内RhoA活性,并通过功能回补实验证实,ROCK抑制剂完全抑制NPFF对细胞迁移的影响。这表明RhoA/ROCK在NPFF促转移功能中发挥关键作用。
YAP作为Hippo信号转导通路的关键信号转导分子,在组织生长和器官大小调节中发挥重要作用[15]。该激酶通路在进化过程中高度保守,可对多种细胞输入信号作出反应,包括对机械应激、代谢信号转导和细胞-细胞接触,并与许多经典的受体介导的信号转导通路[ERK/丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、Wnt/β-catenin、Notch和转化生长因子β(transforming growth factor beta, TGF-β)]有串扰[15-16]。本研究观察到NPFF通过RhoA激活ROCK进而促进YAP的去磷酸化和核转位,表明YAP入核调控转录。
综上所述,本研究证实,NPFF通过激活RhoA/ROCK/YAP信号通路来促进结直肠癌转移,而NPFF影响肿瘤进展的方式可能涉及神经和免疫浸润等多方面机制,需要进一步研究。
| [1] |
Siegel RL, Giaquinto AN, Jemal A. Cancer statistics, 2024[J]. CA A Cancer J Clin, 2024, 74(1): 12-49. DOI:10.3322/caac.21820 |
| [2] |
Han BF, Zheng RS, Zeng HM, et al. Cancer incidence and mortality in China, 2022[J]. J Natl Cancer Cent, 2024, 4(1): 47-53. DOI:10.1016/j.jncc.2024.01.006 |
| [3] |
Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis[J]. Science, 2011, 331(6024): 1559-1564. DOI:10.1126/science.1203543 |
| [4] |
吴琳珊, 王苏醒, 李军, 等. 结直肠癌患者一级亲属早期筛查依从率研究进展[J]. 实用肿瘤杂志, 2024, 39(4): 383-388. DOI:10.13267/j.cnki.syzlzz.2024.057 |
| [5] |
朱德祥, 任黎, 许剑民. 中国结直肠癌肝转移诊断和综合治疗指南(2023版)[J]. 消化肿瘤杂志: 电子版, 2023, 15(2): 86-99. |
| [6] |
Yang HY, Fratta W, Majane EA, et al. Isolation, sequencing, synthesis, and pharmacological characterization of two brain neuropeptides that modulate the action of morphine[J]. Proc Natl Acad Sci USA, 1985, 82(22): 7757-7761. DOI:10.1073/pnas.82.22.7757 |
| [7] |
Gouardères C, Puget A, Zajac JM. Detailed distribution of neuropeptide FF receptors (NPFF1 and NPFF2) in the rat, mouse, octodon, rabbit, guinea pig, and marmoset monkey brains: a comparative autoradiographic study[J]. Synapse, 2004, 51(4): 249-269. DOI:10.1002/syn.10305 |
| [8] |
Bonini JA, Jones KA, Adham N, et al. Identification and characterization of two G protein-coupled receptors for neuropeptide FF[J]. J Biol Chem, 2000, 275(50): 39324-39331. DOI:10.1074/jbc.M004385200 |
| [9] |
Wu Z, Jia QQ, Liu BQ, et al. NPFF stimulates human ovarian cancer cell invasion by upregulating MMP-9 via ERK1/2 signaling[J]. Exp Cell Res, 2023, 430(1): 113693. DOI:10.1016/j.yexcr.2023.113693 |
| [10] |
Gour N, Yong HM, Magesh A, et al. A GPCR-neuropeptide axis dampens hyperactive neutrophils by promoting an alternative-like polarization during bacterial infection[J]. Immunity, 2024, 57(2): 333-348. DOI:10.1016/j.immuni.2024.01.003 |
| [11] |
Zhao XM, Li YB, Sun P, et al. Bioinformatics analysis of key biomarkers for retinoblastoma[J]. J Int Med Res, 2021, 49(6): 3000605211022210. DOI:10.1177/03000605211022210 |
| [12] |
Wu Y, Berisha A, Borniger JC. Neuropeptides in cancer: friend and foe?[J]. Adv Biol, 2022, 6(9): 2200111. DOI:10.1002/adbi.202200111 |
| [13] |
Zhu PP, Lu TK, Chen ZZ, et al. 5-hydroxytryptamine produced by enteric serotonergic neurons initiates colorectal cancer stem cell self-renewal and tumorigenesis[J]. Neuron, 2022, 110(14): 2268-2282. DOI:10.1016/j.neuron.2022.04.024 |
| [14] |
Seasholtz TM, Majumdar M, Brown JH. Rho as a mediator of G protein-coupled receptor signaling[J]. Mol Pharmacol, 1999, 55(6): 949-956. DOI:10.1016/S0026-895X(24)23244-2 |
| [15] |
Crosby K, Wood AW, Simendinger J, et al. YAP vs. TAZ: differences in expression revealed through rigorous validation of target-specific monoclonal antibodies[J]. J Histotechnol, 2020, 43(4): 182-195. DOI:10.1080/01478885.2020.1847012 |
| [16] |
夏添明, 李朝辉, 王云帅, 等. miR-1273g-3p调控TGF-β/Smad4信号通路影响结直肠癌细胞的增殖、迁移和侵袭[J]. 实用肿瘤杂志, 2024, 39(3): 219-227. DOI:10.13267/j.cnki.syzlzz.2024.034 |
 2025, Vol. 40
2025, Vol. 40


