文章信息
- 吴雅君, 吴文俊, 郭杏, 赵多多, 高华, 蔡真, 韩晓雁
- 伴KMT2A-MLLT3的急性髓系白血病患者并发弥散性血管内凝血一例及文献复习
- 实用肿瘤杂志, 2025, 40(1): 82-85
-
通信作者
- 韩晓雁, Email: hanyx@zju.edu.cn
-
文章历史
- 收稿日期:2024-04-29
2. 义乌市中心医院血液科, 浙江 义乌 322000;
3. 成都市第三人民医院血液科, 四川 成都 610000
急性髓系白血病(acute myeloid leukemia, AML)合并赖氨酸甲基转移酶2A(lysine methyltransferase 2A, KMT2A)基因重排(rearrangement of KMT2A, KMT2Ar)是一种耐药和复发率高的白血病[1]。研究发现,KMT2Ar AML患者与二倍体AML比较,在早期死亡率和大出血事件方面存在差异,更易表现出明显的弥散性血管内凝血(disseminated intravascular coagulation,DIC)和发生大出血事件[2]。少部分KMT2Ar AML患者中可发现急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)样的免疫表型[3]。APL样表型的患者中,mixed lineage leukemia translocated to chromosome 3(MLLT3)作为融合伴侣的t(9;11)(p22;q23)是最常见的核型[4]。本文报道一例AML患者伴有KMT2A-MLLT3,同时为APL样的免疫表型,在临床上出现类似APL治疗过程中出现的DIC和脑出血的情况。
1 病例资料患者女性,36岁,因发热伴咳嗽3 d于2023年12月9日入住浙江大学医学院附属第一医院骨髓移植中心。一般体格检查无殊。血常规检查示,白细胞计数5.31×109/L,中性粒细胞计数0.80×109/L,血红蛋白101 g/L,血小板计数113×109/L,异常细胞55%。凝血功能+D-二聚体检查示,国际标准化比值1.26,纤维蛋白原2.35 g/L,活化部分凝血活酶时间34.8 s,凝血酶时间14.8 s,凝血酶原时间14.3 s,D-二聚体29 720 μg/L。超敏C反应蛋白209.52 mg/L。肺部CT平扫示,两肺感染性病变。支原体检测示,阳性。骨髓形态学检查示,有核细胞增多,原始细胞明显增生,占96%,该细胞胞体5~20 μm,外形圆形或椭圆形,细胞质量少,着色淡蓝色,核圆形或椭圆形,核染色质细致粒状,有核仁1到数个不等,部分不清晰,其余各系增生相对受抑制,骨髓象考虑急性白血病,AML-M0或急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)。免疫分型示,原始髓系细胞群约占非红系细胞的94.1%,表达分化抗原群117(cluster of differentiation 117, CD117)、CD33、CD13、CD64、CD123和CD15,不表达CD34、人类白细胞抗原(human leukocyte antigen, HLA)-DR、CD11b、CD14和CD16,提示AML(图 1)。白血病融合基因:KMT2A-MLLT3。基因突变:异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)、KMT2D、含SET结构域的蛋白2(SET domain containing 2, SETD2)和含锌指RNA结合蛋白富含丝氨酸结构域(zinc finger RNA-associated protein with serine-rich domain, ZRSR)阳性。染色体:核型结果47, XX, -9, +2mar[8]/46, XX[5]。初步诊断:(1)AML(M0 KMT2A-MLLT3);(2)肺部感染;(3)支原体感染。
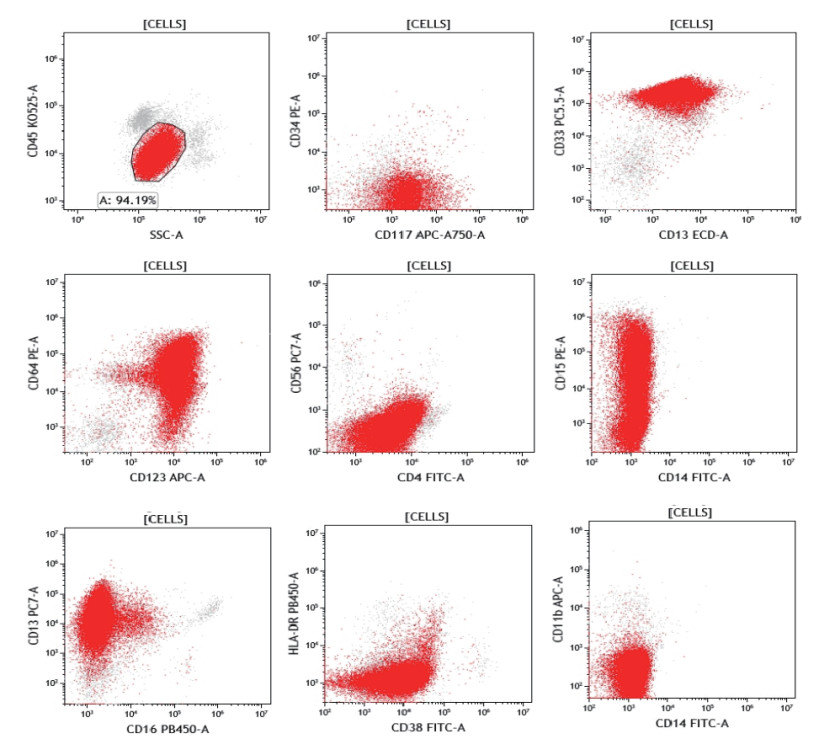
|
| 注 CELLS:细胞;CD:分化抗原群(cluster of differentiation);KO525-A:克罗姆橙色525-A(Krome orange 525-A);SSC-A:侧向散射光-A(side scatter-A);PE-A:藻红蛋白-A(phycoerythrin-A);APC-A:别藻蓝蛋白-A(allophycocyanin-A);PC-A:穿透型氰基染料(PerCP-cyanine);ECD-A:红细胞分化抗原(erythroid cell differentiation antigen);FITC-A:荧光素异硫氰酸酯标记的抗体-A(fluorescein isothiocyanate-A);HLA:人类白细胞抗原(human leukocyte antigen);PB450-A:Cell Proliferation Dye eFluorTM 450 图 1 AML患者的免疫分型检查结果 |
2023年12月9日患者入院后接受抗感染治疗:莫西沙星针0.4 g,1次/d,静脉注射1周。1周后患者体温下降,咳嗽好转,C反应蛋白(C-reactive protein, CRP)下降至39.21 mg/L。2023年12月19日予VA方案诱导治疗:阿扎胞苷(75 mg/m2 d1~5)+维奈克拉片(100 mg d1,200 mg d2,400 mg每天1次d3~28),28 d为1个周期,治疗1个周期。
患者诱导治疗期间凝血功能出现持续异常,主要表现为低纤维蛋白原血症,纤维蛋白原水平最低 < 0.5 g/L,活化部分凝血活酶时间延长至45.3 s,凝血酶原时间延长至25 s,血浆D-二聚体明显升高,维持在29 000~79 000 μg/L。2023年12月21日患者开始出现肉眼血尿,复查凝血功能示,纤维蛋白原0.76 g/L,活化部分凝血活酶时间37.7 s,凝血酶原时间15.5 s,D-二聚体32 650 μg/L。患者经中国DIC诊断积分系统(Chinese DIC Scoring System, CDSS)评分[5-6]达到7分,国际血栓与止血学会(International Society on Thrombosis and Haemostasis, ISTH)评分[7]≥5分,明确出现DIC。2023年12月24日患者突发持续性头痛和头晕,伴恶心和呕吐,呕吐出大量胃内容物,感四肢乏力。查体示,生命体征平稳,双侧瞳孔等大等圆,全身皮肤散在瘀斑,尤左上肢明显(图 2),四肢肌力4级,病理征阴性。复查凝血功能示,纤维蛋白原0.76 g/L,活化部分凝血活酶时间37.7 s,凝血酶原时间15.5 s,D-二聚体32 600 μg/L,血小板计数24×109/L。头颅CT检查示,蛛网膜下腔出血,左侧额颞顶枕部硬膜下出血并大脑镰下疝(图 3)。患者血三系减少,合并DIC和脑出血,手术风险大,予连续输注人纤维蛋白原2.0 g/d和新鲜冰冻血浆200~400 mL/d,积极输注血小板维持在20×109/L以上,予尼莫地平片和甘油果糖降颅压等内科对症治疗。2024年1月15日患者凝血功能开始恢复,复查凝血功能+D-二聚体示,纤维蛋白原1.96 g/L,活化部分凝血活酶时间34.0 s,凝血酶原时间14.9 s,D-二聚体11 960 μg/L,左上肢大片瘀斑逐渐消散。2024年1月22日复查头颅CT示,血肿基本吸收。
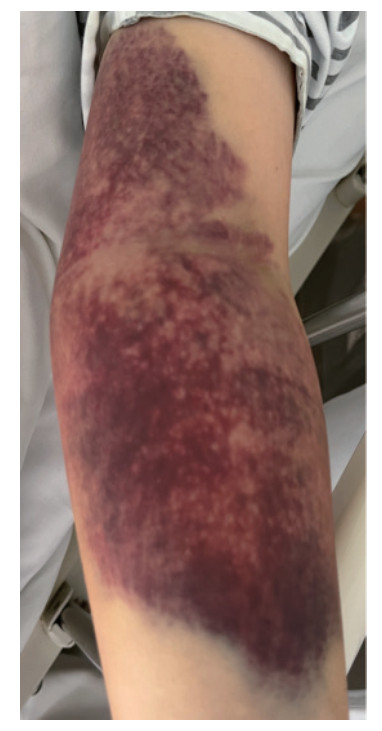
|
| 图 2 AML患者诱导治疗阶段出现的左上肢大片瘀斑 |
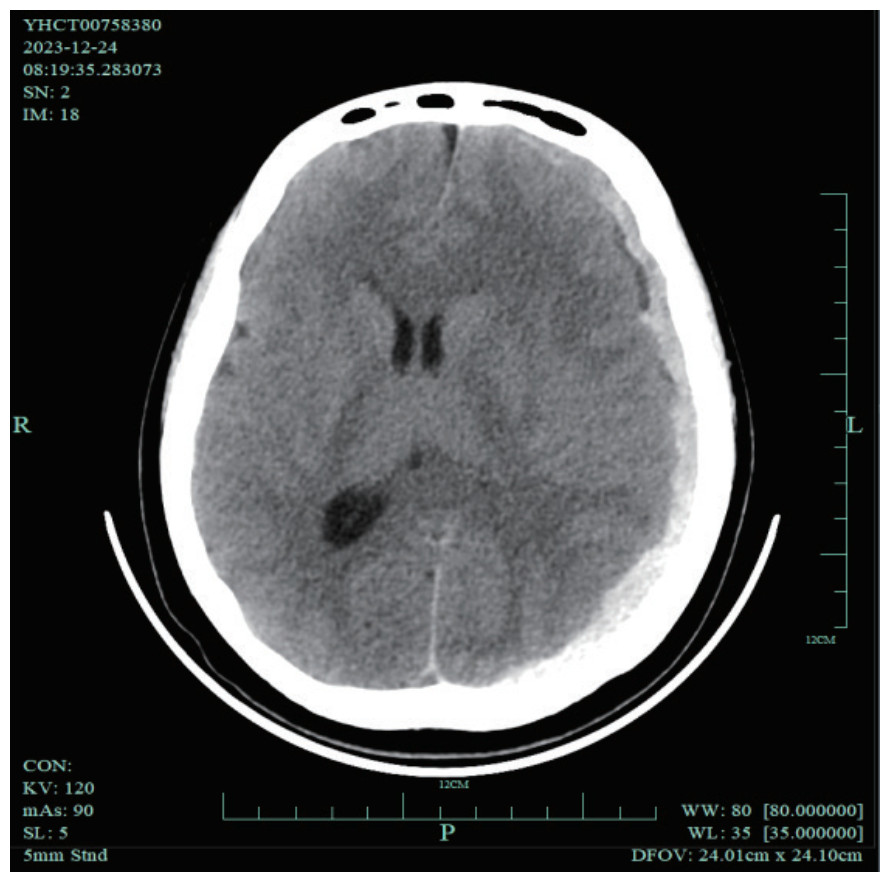
|
| 图 3 AML患者诱导治疗阶段发生脑出血的头颅CT影像 |
化疗结束第7天2024年1月24日复查骨髓,骨髓形态学:原始粒细胞1%。白血病残留检测:阴性。骨髓KMT2A-MLLT3示0.92%。2024年1月29日患者凝血功能和D-二聚体均恢复正常。患者于2024年2月6日再次行VA方案巩固治疗,2024年2月7日予腰椎穿刺+鞘内注射阿糖胞苷50 mg+地塞米松5 mg治疗,脑脊液检测微小残留病(minimum residual disease, MRD)阴性。2024年2月10日起予第2次VA方案巩固治疗:阿扎胞苷(75 mg/m2 d1~5)+维奈克拉片(400 mg每天1次d1~28),28 d为1个周期。期间未再观察到异常的凝血功能和出血情况的发生。目前随访患者处于缓解状态。
2 讨论KMT2Ar白血病亦被称为混合谱系白血病[8]。KMT2A基因位于11号染色体q23区域,由37个外显子构成,长度约为89 kb,并参与编码3 969个氨基酸[9-10]。这些氨基酸参与组成具有复杂结构域的核蛋白。染色体11q23易位会导致KMT2Ar,进而产生融合蛋白,破坏正常的转录调控机制[11]。KMT2Ar不仅可导致ALL和AML的发生,还影响患者的治疗反应和预后[1, 12]。KMT2Ar阳性的急性白血病患者通常表现出临床上的高度异质性,包括外周血白细胞计数增加、肝脾淋巴结肿大和易侵犯中枢神经系统等特征[13]。
此外,一项回顾性分析比较KMT2Ar AML成年患者队列(n=172)和年龄匹配的正常核型AML患者队列(n=522)诱导治疗后早期死亡的发生率和原因发现,KMT2Ar AML患者的60 d死亡率为15%,而核型正常AML患者为7%(P=0.04);与二倍体AML比较,KMT2Ar AML的主要出血事件发生率和总出血事件发生率均高于二倍体(均P < 0.01);在可评估的KMT2Ar AML患者中,93%的患者在死亡前表现出明显的DIC功能障碍,而正常核型患者这一比例为54%(P=0.03)[2]。该研究组采用ISTH评分[7]预测研究队列中的DIC显示,虽然在基线时,KMT2Ar AML成年患者队列和年龄匹配的正常核型AML患者队列之间的ISTH评分没有差异,但KMT2Ar AML患者在死亡时的评分高于二倍体核型患者,符合明显DIC的标准[14]。在多变量分析中,KMT2Ar和单核细胞表型是任何出血的唯一独立预测因子。
有学者总结认为,KMT2Ar AML具有类似于APL的出血和DIC倾向,早期识别和治疗可能降低这些患者DIC相关的发病率和死亡率[2, 4]。然而其并没有详细说明KMT2Ar AML患者的特定融合伴侣与出血的关系。而一项对102例KMT2Ar AML患者的研究检测到5种免疫表型:未成熟单核细胞(38%)、粒单核细胞(22%)、成髓细胞(22%)、成熟单核细胞(10%)和APL样(8%)[3]。在APL样表型患者中,t(9;11)(p22;q23)是最常见的核型,其以MLLT3为融合伴侣。8例(8%)病例显示缺乏CD34表达的APL样免疫表型和HLA-DR表达缺失/减弱,但表达其他骨髓标志物,如CD13、CD33和CD117[3]。与经典APL不同,这些病例在形态学上缺乏丰富的细胞质颗粒,并表现出较低的外周血的白血病细胞浸润。
本例伴有KMT2A-MLLT3(MLL-AF9)的AML患者同样缺乏CD34和HLA-DR的表达,并表达CD13、CD33和CD117,与APL免疫表型类似,并且在诱导治疗期间出现类似APL患者的异常的凝血功能[15-16]。本例患者通过CDSS评分[5-6]和ISTH评分[7],明确出现DIC,并且合并脑出血和皮肤大片的瘀斑出血的发生。经过积极治疗,患者DIC和脑出血情况得到明显改善。患者DIC考虑可能与KMT2Ar和APL样的免疫表型有关,但此类重排与异常出血相关的机制尚不明确,需要后续进一步研究。
综上所述,早期识别和积极管理DIC和大出血的发生对于降低KMT2Ar AML诱导治疗期间的死亡风险至关重要。目前,对KMT2Ar AML患者出血情况的关注度较低,我国尚未见相关病例报道。鉴于此,本文通过病例报道和文献学习,强调应对KMT2Ar AML患者进行凝血功能监测和及时关注出血情况,尤其是APL样免疫表型的AML患者,以类似治疗APL的方式,通过积极输注血小板、纤维蛋白原和血浆等,及时改善凝血功能、预防DIC和大出血的发生,从而降低患者死亡率。
| [1] |
Zotova OV, Lukianova AS, Valchuk MO, et al. 11q23/MLL rearrangements in adult acute leukemia[J]. Exp Oncol, 2021, 43(3): 229-233. |
| [2] |
Nguyen D, Kantarjian HM, Short NJ, et al. Early mortality in acute myeloid leukemia with KMT2A rearrangement is associated with high risk of bleeding and disseminated intravascular coagulation[J]. Cancer, 2023, 129(12): 1856-1865. DOI:10.1002/cncr.34728 |
| [3] |
Konoplev S, Wang XQ, Tang GL, et al. Comprehensive immunophenotypic study of acute myeloid leukemia with KMT2A (MLL) rearrangement in adults: a single-institution experience[J]. Cytometry B Clin Cytom, 2022, 102(2): 123-133. DOI:10.1002/cyto.b.22051 |
| [4] |
Venugopal S, Taylor J. Trying to outRun-DIC in KMT2Ar AML: it's tricky[J]. Cancer, 2023, 129(12): 1797-1799. DOI:10.1002/cncr.34727 |
| [5] |
冯悦, 王静, 李欣欣, 等. 弥散性血管内凝血的发病机制及药物治疗进展[J]. 药学进展, 2023, 47(5): 379-391. |
| [6] |
中华医学会血液学分会血栓与止血学组. 弥散性血管内凝血诊断中国专家共识(2017年版)[J]. 中华血液学杂志, 2017, 38(5): 361-363. |
| [7] |
Popescu NI, Lupu C, Lupu F. Disseminated intravascular coagulation and its immune mechanisms[J]. Blood, 2022, 139(13): 1973-1986. DOI:10.1182/blood.2020007208 |
| [8] |
Yokoyama A. Role of the MOZ/MLL-mediated transcriptional activation system for self-renewal in normal hematopoiesis and leukemogenesis[J]. FEBS J, 2022, 289(24): 7987-8002. DOI:10.1111/febs.16180 |
| [9] |
Casado P, Rio-Machin A, Miettinen JJ, et al. Integrative phosphoproteomics defines two biologically distinct groups of KMT2A rearranged acute myeloid leukaemia with different drug response phenotypes[J]. Signal Transduct Target Ther, 2023, 8(1): 80. DOI:10.1038/s41392-022-01288-1 |
| [10] |
El Chaer F, Keng M, Ballen KK. MLL-rearranged acute lymphoblastic leukemia[J]. Curr Hematol Malig Rep, 2020, 15(2): 83-89. DOI:10.1007/s11899-020-00582-5 |
| [11] |
Meyer C, Larghero P, Almeida Lopes B, et al. The KMT2A recombinome of acute leukemias in 2023[J]. Leukemia, 2023, 37(5): 988-1005. DOI:10.1038/s41375-023-01877-1 |
| [12] |
岑东, 裴仁治, 石兆玲, 等. 急性白血病的形态学、免疫学和细胞遗传学分型[J]. 实用肿瘤杂志, 1999, 14(3): 26-28. |
| [13] |
Issa GC, Zarka J, Sasaki K, et al. Predictors of outcomes in adults with acute myeloid leukemia and KMT2A rearrangements[J]. Blood Cancer J, 2021, 11(9): 162. DOI:10.1038/s41408-021-00557-6 |
| [14] |
Wang TF, Makar RS, Antic D, et al. Management of hemostatic complications in acute leukemia: Guidance from the SSC of the ISTH[J]. J Thromb Haemost, 2020, 18(12): 3174-3183. DOI:10.1111/jth.15074 |
| [15] |
Paterno G, Palmieri R, Tesei C, et al. The ISTH DIC-score predicts early mortality in patients with non-promyelocitic acute myeloid leukemia[J]. Thromb Res, 2024, 236: 30-36. DOI:10.1016/j.thromres.2024.02.017 |
| [16] |
葛琼, 郭鹏翔. 高白细胞急性髓系白血病白细胞增多机制的研究进展[J]. 实用肿瘤杂志, 2023, 38(1): 80-85. |
 2025, Vol. 40
2025, Vol. 40


